摘要
确定体外膜氧合(ECMO)治疗新生儿脑梗死(BI)的发生率和确定预测因素。我们在瑞典斯德哥尔摩卡罗林斯卡ECMO中心进行了一项回顾性队列研究。使用逻辑回归模型来识别BI预测因子。2010年至2018年期间接受静脉-动脉(VA)或静脉-静脉(VV) ECMO治疗的新生儿(0-28天)。主要结果是在ECMO治疗过程中CT证实BI。共纳入223例患者,102例患者(46%)至少进行了一次脑部CT, 27例患者(12%)被诊断为BI。BI诊断与30天死亡率增加相关(48% vs. 18%)。ECMO前较高的儿童死亡率指数评分、脓毒症作为ECMO治疗的指征、VA ECMO、ECMO模式之间的转换、持续肾替代治疗的使用和颅外血栓形成被认为是BI发展的独立预测因素。新生儿ECMO患者BI的发生率可能比以前了解的要高。在接受ECMO治疗的新生儿中,危险因素识别有助于采取措施降低风险或促进BI的早期诊断。
简介
体外膜氧合(ECMO)是治疗难治性严重肺和/或心力衰竭的一种维持生命的治疗方法,通常用于常规重症监护治疗失败的情况下。然而,除了患者病情危急外,ECMO治疗本身也与显著的发病率和死亡率相关。常见且严重的并发症是脑梗死(BI)。1,2.ecmo相关BI背后的病理生理学可能是ecmo前共病、相关炎症反应和ecmo诱导的止血中断的组合1,3.,4,5.在以往的研究中,BI的发病率为4-5%,与新生儿队列中较低的生存率相关6,7.然而,这些研究是基于注册的,我们假设BI的真实发病率实际上可能更高,这与我们之前在ECMO支持治疗的成年人中的发现一致8.
迄今为止,ECMO治疗新生儿的结局模型研究主要集中在与出血性中风或缺血性和出血性中风相关的危险因素9,10,11.先前的研究表明,早产、ECMO前的疾病严重程度、ECMO前心脏骤停和使用静脉-动脉(VA) ECMO可能与ECMO支持期间新生儿神经不良事件的增加有关,包括BI6,7.Anton-Martin等人和Reed等人都关注凝血参数,他们的研究结果显示缺血性卒中病例与对照组之间没有差异12,13.目前的数据是异构的,需要进一步的研究来评估BI的可能预测因素。我们旨在通过广泛的回顾性队列研究,探索经ct验证的ECMO新生儿BI的发生率并确定其预测因素。
方法
该研究根据赫尔辛基宣言进行,并获得瑞典斯德哥尔摩区域伦理审查委员会(DNR: 2018/830-31)批准,该委员会放弃了知情同意的需要。
2010年1月至2018年12月期间,在瑞典斯德哥尔摩卡罗林斯卡大学医院ECMO中心(一个治疗所有年龄组的大容量呼吸ECMO中心)接受VA或静脉-静脉ECMO治疗的所有新生儿(0-28天龄)均符合纳入条件。
主要结局是在ECMO治疗期间通过计算机断层扫描(CT)证实的任何类型的BI。ECMO开始前已知有脑血管畸形、BI或颅内出血(ICH)的患者,以及在另一个ECMO中心接受>治疗12小时的患者均被排除在研究之外。根据我们中心以前的研究,为了减少突发性事件的影响,患者还需要在拔管或发生BI之前接受ECMO支持至少12小时3.,8.
数据来自医院的数字医疗图表。记录可能的预测变量,直到出院或CT检测BI。由经验丰富的儿科放射科医生或神经放射科医生解读大脑ct。还收集了住院期间所有CT扫描的放射学数据和每日血液样本的数据。根据我们中心以前的研究,未进行CT检查的患者被归类为未发生BI8.记录变量,直到检测到BI或ECMO脱环,包括凝血变量。
新生儿患者采用13 French (Fr,外径= Fr/3 mm) OriGen (OriGen Biomedical, Burladingen, Germany)双管腔导管,经右颈内静脉(RJV)插管。VA ECMO采用颈动脉-颈动脉入路,并使用8-12 Fr Bio-Medicus (Medtronic, Tolochenaz, Switzerland)灯塔尖引流套管经RJV放置于右心房中部。动脉插管采用8-10 Fr Bio-Medicus(美敦力)置入右颈动脉。ECMO电路由Medos HILITE 800LT膜肺(Medos Medizintechnik, Stolberg, Germany/Xenios AG)组成。, Heilbronn,德国)和带粘结肝素的导管(Cortiva™,Medronic),以增加生物相容性。直到2011年秋季使用CAPS滚子泵(Stöckert,慕尼黑,德国)。从那时起,Pedivas/CentriMag (Levitronix, Zurich, Switzerland)离心泵控制台一直在使用。
抗凝是通过持续静脉输注未分离肝素达到活化部分凝血活酶时间(aPTT) 1.5-2倍的正常上限,每天至少监测三次。治疗期间,床边ECMO专科护士定期进行神经检查,包括脑干反射和瞳孔检查。当发生神经系统事件(如癫痫发作、瞳孔异常、意识混乱、意识下降)时,进行脑部CT扫描。每当患者被转诊进行胸部或腹部CT扫描时,通常也会进行额外的脑部CT扫描,即使在没有神经症状的情况下。在脑梗死事件中,抗凝靶没有常规改变。
采用Shapiro-Wilks检验检验分布的正态性。正态分布连续数据以均值(±SD)表示,非参数连续数据以中位数(IQR)表示,分类数据以数字和分数(%)表示。p < 0.05为差异有统计学意义。以BI为因变量,以可能的危险因素为解释变量,建立单变量logistic回归模型。在单变量回归中显示显著性趋势(p < 0.1)的解释变量随后被添加到降序多变量逻辑回归中,以确定BI的独立预测因素。在多变量分析之前,采用五次迭代的多重imputation来替换缺失的数据。采用马尔科夫链蒙特卡罗方法。有8个变量存在缺失数据,占所有值的2.9%。4项指标> %缺失:儿科死亡率指数(PIM)评分(31.4%)、乳酸水平(16.6%)、pO2(9%)和pCO2缺失(7.2%)。在多变量降序模型中,依次剔除最不显著的因素,直到只剩下显著变量。分析使用SPSS(27.0版,IBM公司,Armonk, NY, USA)和图。3.通过接口RStudio (RStudio, Boston, MA, USA)使用ggplot2包创建。
道德声明
该研究根据赫尔辛基宣言进行,并获得瑞典斯德哥尔摩区域伦理审查委员会(DNR: 2018/830-31)批准,该委员会放弃了知情同意的需要。
结果
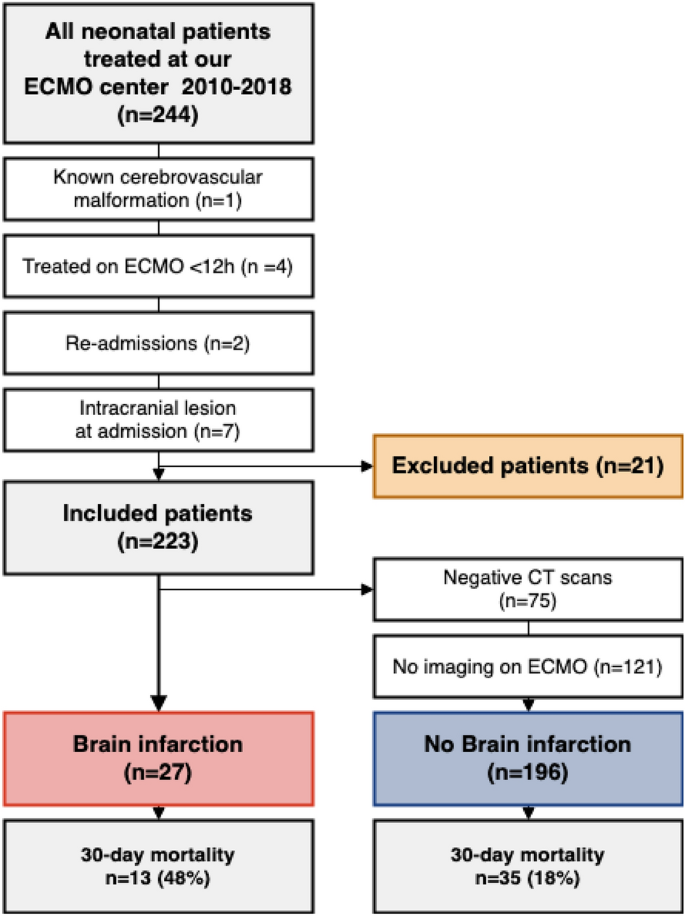
在研究期间,244名新生儿接受ECMO治疗。其中,21例患者被排除在外。1).ECMO最常见适应证为胎粪吸入综合征(MAS)(38%),最常见模式为VA ECMO(72%)。ECMO起始平均年龄为1天,平均治疗时间为6天(补充表)1).
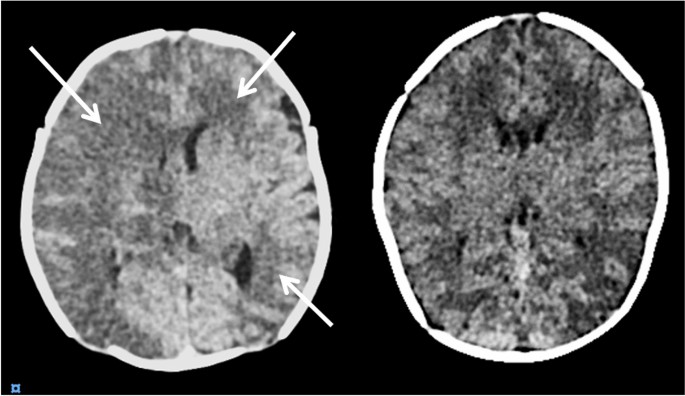
共有27例患者(12%)在ECMO治疗期间被诊断为BI。其中,16例被认为是由血栓栓塞引起的,10例是由脑灌注不足引起的,1例是由两者共同引起的。2).从ECMO开始到BI诊断的中位时间为4天(2-9天)。与非BI组相比,被诊断为BI的患者有更高的30天(48% vs. 18%, p < 0.01)和6个月的死亡率(48% vs. 20%, p < 0.01)(表2)1).值得注意的是,125例患者没有表现出神经系统症状,因此在治疗期间没有进行CT扫描,并被归类为没有发生BI。27例BI患者中有13例因神经系统症状进行了CT扫描,其余患者(52%)在没有任何神经系统指征的情况下进行了CT扫描。
在预测BI发展的单变量logistic回归中,ECMO前较高的PIM评分(p < 0.001)、ECMO前较高的动脉乳酸浓度(p = 0.007)、脓毒症(包括脓毒症休克)作为ECMO治疗的指证(p = 0.037)、VA ECMO (p = 0.021)、ECMO模式之间的转换(p = 0.040)、ECMO期间持续肾替代治疗(CRRT) (p = 0.021)、颅外血栓形成(p = 0.005)和颅外出血(p = 0.008)具有显著相关性(表3)2).其中,ECMO前PIM评分、脓毒症(包括感染性休克)、VA ECMO、ECMO模式之间的转换、ECMO期间CRRT和颅外血栓形成在降压多变量模型中均表现出独立的风险相关性(表2)3.).
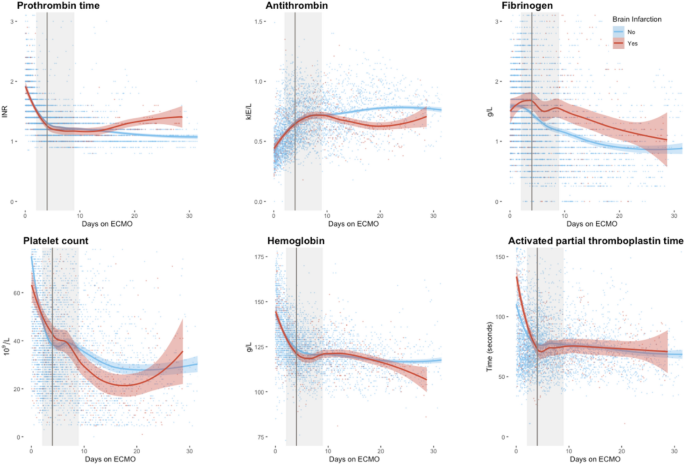
图中显示了ECMO启动后国际标准化比值(INR)、抗凝血酶、纤维蛋白原、血小板计数、血红蛋白和aPTT的时间变化,并按BI状态分层。3..从图像上看,ECMO起始时间和BI发生的整个中位或IQR时间的实验室数据没有明显差异。BI患者在治疗结束时表现出抗凝血酶降低、纤维蛋白原升高和血小板计数降低的趋势。
讨论
在这项观察性队列研究中,我们探讨了接受ECMO治疗的新生儿BI的可能预测因素。据我们所知,这是最大的单中心回顾性研究。223例患者中,27例(12%)发生BI。ECMO前高PIM评分、败血症、VA ECMO、ECMO模式间转换、CRRT和颅外血栓形成均被认为是BI的独立预测因素。BI患者的30天和6个月死亡率高于非BI患者。
我们报告新生儿ECMO BI发生率高于先前报道(4-5%)6,7.这可以用几个因素来解释。我们纳入了所有BI,没有基于大小或类型的区别,这可能在一定程度上解释了与大型注册表研究相比的差异14.此外,我们中心有一个慷慨的放射政策。头部CT扫描通常与颅外CT扫描同时进行,即使没有神经系统症状。这与我们中心之前的研究一致,该队列中52%的BIs是在没有症状的情况下通过CT扫描诊断出来的3.,8.一些已知BI的患者可能因未检测到的围产期BI而入院,这是合理的,这使得真实的发病率可能更高,因为亚临床BI可能在ECMO治疗期间未被检测到15.另一方面,我们努力使ECMO患者在任何可能的情况下保持清醒,这可能会降低患者发生未被发现的临床相关BI的风险,即使没有CT扫描。
PIM评分是一种用于预测儿科icu患者死亡率的风险分层系统。它包括与ICU入院和患者特征相关的参数16.先前对儿童人群的研究发现,动脉pH < 7.2、需要心肺复苏和ecmo前代谢性酸中毒是神经并发症的预测因素,所有这些都被考虑在PIM评分中7,17.虽然我们不能说明PIM评分的哪些方面导致了患者BI风险的增加,但我们的研究表明,它可以预测新生儿ECMO中BI的发展。
先前对新生儿的研究发现ECMO期间的神经并发症与低出生体重、早产、低胎龄、ECMO前心脏骤停和VA ECMO之间存在关联7,18.我们只能重现VA ECMO的意义。Wien等人对ECMO支持后的新生儿进行了MRI研究,发现VA患者比VV患者BI发生率更高(49%比29%)。19.这背后的一个可能原因可能是脉动血流的丧失,随后对内皮反应性和脑自调节产生负面影响,可见于VA ECMO患者20..
ECMO模式之间的转换与BI开发独立相关。这与最近的两项研究一致,这两项研究发现,从VV到VA ECMO的转换与新生儿和儿童并发症和/或死亡率增加有关21,22.在这项研究中,我们没有评估导致转换的原因,但我们中心之前对成人的一项研究表明,转换最常见的原因是右心室衰竭,可能是由于肺血管阻力增加23.与BI相关的一种解释可能是在转化过程中暴露于脑缺氧或血栓栓塞事件的长期风险。然而,如果转换是由于患者状态恶化而进行的,BI可能由疾病严重程度而不是转换本身来解释。值得注意的是,在单变量分析中,支持期间电路元件的变化不影响主要结果2).值得注意的是,本研究的转归数很低,bi组为3例(11%),非bi组为5例(3%)。因此,根据我们的发现得出任何有关ECMO转换的重大结论都应谨慎。
在研究的ECMO适应症中,只有败血症被证明是BI发展的独立预测因子,这是新的。然而,败血症是新生儿非ecmo人群BI发展的已知危险因素24,可能是因为它会导致止血障碍、内皮损伤和炎症介质的释放15.在ECMO回路中,血液暴露于人造表面本身所引起的炎症反应可能进一步加剧20..随着时间的推移,止血分析的图形显示较低的抗凝血酶、较高的纤维蛋白原和较低的血小板计数在发生BI的患者中更为普遍。在非ecmo人群中,抗凝血酶缺乏与过度凝血有关25.同样,纤维蛋白原水平升高与血栓形成有关,尽管因果关系尚不能确定26,27.纤维蛋白原是一种急性期蛋白,在我们的研究中可能仅仅反映了败血症和BI之间的关系。后者也可以解释BI与低血小板以及败血症中出现的抗凝血酶水平之间的关系28,29.值得注意的是,在我们的研究中,缺氧和血栓栓塞性中风都包括BI。因此,它们的病理生理存在显著差异,生物化学可能在ECMO患者BI的发展中具有不同的意义。
ECMO治疗期间CRRT的需求也是BI的独立预测因素。在我们的研究人群中,急性肾衰竭是CRRT的主要指征。这一发现与Cengiz等人的研究结果一致,他们发现ecmo治疗的急性肾损伤且需要CRRT的儿童患者发生神经系统并发症的风险增加17.CRRT和BI之间的关联也可以解释为ECMO期间与CRRT相关的溶血风险增加,其中血浆游离血红蛋白消除微循环中的一氧化氮,导致炎症增加、凝血激活和血管收缩30.,31,32.ECMO本身也可能导致溶血,已知中度至重度溶血可使ECMO患者的死亡风险增加约5倍33.
最后,颅外血栓形成与BI发展的独立风险相关。这一预测因子此前未在新生儿人群中进行过研究。颅外血栓形成可能提示ECMO回路内的止血中断、抗凝方案或ECMO适应证的严重程度。因此,它可能被视为一个替代标志的血栓倾向。此外,套管血栓不包括在颅外血栓中。被归类为颅外血栓形成的栓子可能源于套管本身,这是合理的。这可能会导致变量之间的一些重叠,进一步使对这些发现得出任何结论变得困难。值得注意的是,在研究期间临床观察到中心静脉血栓形成,今天我们在ECMO中不常规使用这些导管。
不幸的是,我们发现凝固参数的纵向观察(图。3.)很难从中得出任何结论。大多数情况下,不同参数的置信区间重叠,直到治疗结束。值得注意的是,这种分离发生在BI的中位数和75% IQR时间之后,这表明该图基于更少的观测数据。因此,对于所展示的图表,我们暂不作任何结论。
这项工作的主要局限性涉及BI的筛选和诊断。脑磁共振成像(MRI)对脑梗死的诊断比CT扫描更敏感、更特异34.然而,由于所使用的金属丝加强套管与MRI不兼容,通常不可能在ECMO期间进行。核磁共振成像通常在医疗保健链的后面进行。由于我们是专门的ECMO ICU,我们的患者在ECMO拔管后观察约24小时,然后转移到另一个PICU或转诊医院。在那里,患者将根据他们的标准接受治疗,并相应纳入他们的后续计划。由于这不是我们中心的标准临床实践,因此我们无法获得MRI数据。入院时未进行常规CT扫描,这表明一些患者可能在ECMO治疗开始前已出现亚临床BI。此外,未进行CT扫描的患者被归类为未发生BI,这可能导致我们队列中对BI发病率的低估。然而,这与以前的研究是一致的,可能只影响亚临床BI35,36,37.我们进行了亚组分析,排除了未进行CT扫描的患者(补充表)2,补充表3.).在这个亚组分析中,PIM评分(p = 0.014)、败血症(p = 0.045)和ecmo前乳酸水平(p = 0.004)仍然被发现具有统计学意义。然而,我们认为这并不能准确地反映临床环境和典型的ECMO人群。在这些患者中,至少有一个ct适应症——患者的情况不太好。亚组分析的结果可能报告了BI的虚假高发病率,26.5%。另一方面,我们认为我们的主要研究结果可能低估了新生儿ECMO患者BI的真实发生率可能更高。也许真正的发病率在我们的分析和亚组分析中报告的12-26.5%之间。我们纳入了VA和VV ECMO的数据,因为我们认为这更准确地描述了专用ECMO中心的临床设置,在考虑不同模式之间的转换时尤其重要。2013年之前入院患者的PIM评分数据缺失。然而,BI组和非BI组缺失数据的比例基本相同,因此我们认为使用多重imputation替换缺失值是合适的。 Moreover, we included all neonates regardless of gestational age and used gestational age as a continuous variable, rather than separating pre- and post-term neonates concerning risk factor for neurologic injury, as there may be inherent differences in complications. Some patients treated at our center are registered and reside outside Sweden. We were unable to access data regarding BI for patients transported back for continued ECMO support. Likewise, 23% (n = 52) were lost to follow up due to transfer to other regions or countries after decannulation from ECMO. The proportions were similar in the BI and non-BI groups (22 vs. 23%).
我们还进行了多次测试,这引入了I型错误的风险。我们选择不进行多重比较调整,因为本研究只是假设生成。因此,在得出明确的临床结论之前,所有确定的预测因素都需要进行外部验证。此外,大多数这些预测因素在进行ECMO期间是不可改变的。然而,对危险因素的认识增加了识别危险对象的机会,从而对抗凝和神经监测进行个体化管理。这可能会限制BI频率。神经监测手段可包括降低ct扫描阈值、强化生物化学评估(如脑损伤的凝血和生物标志物)、连续脑电图、脑近红外光谱、视神经鞘超声和经颅多普勒38,39,40.
结论
新生儿ECMO脑梗死可能比以前报道的更常见,并与死亡率增加有关。ECMO前PIM评分、脓毒症作为ECMO适应症、VA ECMO、ECMO模式之间的转换、CRRT和颅外血栓形成是ECMO治疗期间BI发展的独立预测因素。有必要进行前瞻性研究来证实这些结果。
数据可用性
在本研究期间和/或在本研究期间分析的患者图表中为保证质量而生成的数据集不公开,以确保专业保密,但可根据合理要求从通讯作者处获得。
缩写
- ABG:
-
动脉血气
- 行为:
-
活性凝血时间
- aPTT:
-
活化部分凝血活酶时间
- BI:
-
脑梗死
- 鼎晖:
-
先天性膈疝,
- 置信区间:
-
置信区间,
- 中枢神经系统:
-
中枢神经系统
- 一般:
-
持续肾脏替代疗法
- CT:
-
计算机断层扫描(CT)
- ECMO:
-
体外膜氧合
- ECPR:
-
体外心肺复苏,
- EMR %:
-
估计死亡率,以百分比计算
- 我:
-
颅内出血
- 印度卢比:
-
国际标准化比率
- MAS:
-
胎粪吸入综合征
- MVs:
-
缺失值
- PIM:
-
儿科死亡率指数
- PPHN:
-
新生儿持续肺动脉高压,
- 弗吉尼亚州:
-
Veno-arterial。
- VV:
-
透析滤
参考文献
Thomas, J., Kostousov, V. & Teruya, J.使用体外膜氧合出血和血栓并发症。Semin。Thromb。Hemost。44, 20-29(2018)。
杨丽娟,李志刚,李志刚。新生儿体外膜氧合的并发症。灌注9, 241-256(1994)。
Fletcher-Sandersjoo,。et al。体外膜氧合成人患者颅内出血的发生率、结局和预测因素:一项系统的叙述性综述。前面。神经。9, 548(2018)。
赵,H. J.,金,D. W.,金,G. S.和郑,I. S.儿科患者体外膜氧合器支持期间的抗凝治疗。全南医学院。53, 110(2017)。
米勒,范宁,J. P.,麦克唐纳,C. I.,麦考利,D. F. &弗雷泽,J. F.体外膜氧合(ECMO)的炎症反应:病理生理学综述。暴击。护理20., 1-10(2016)。
Van Heijst, A. F. J., De Mol, A. C. & IJsselstijn, H.新生儿ECMO:神经影像学发现和结果。Semin。Perinatol。38, 104-113(2014)。
Polito,。et al。体外膜氧合支持新生儿神经系统并发症。ELSO注册表数据分析。重症监护室。39, 1594-1601(2013)。
Iacobelli, R。et al。成人患者体外膜氧合的脑梗死预测因素:一项观察性队列研究。科学。代表。11, 3809(2021)。
Doymaz, S, Zinger, M. & Sweberg, T. ECMO上与持续性肺动脉高压新生儿颅内出血相关的危险因素。J.重症监护3., 6(2015)。
德拉·克鲁兹,电视节目。et al。体外膜氧合患者颅内出血的危险因素分析。j . Perinatol。17, 18-23(1997)。
Burgos, c.m., Frenckner, B. & Broman, l.m.早产儿和体外生命支持。ASAIO J。68, 633-645(2022)。
Anton-Martin, P。et al。在儿童体外膜充氧患者中,凝血特征不能作为急性脑血管事件的预测因子。ASAIO J。63, 793-801(2017)。
Reed, R. C. & Rutledge, J. C. 29例儿童体外膜氧合死亡患者血栓和出血的实验室和临床预测因素。Pediatr。Dev,病理学研究。13, 385-392(2010)。
Bowling, s.m., Gomes, J. & Firstenberg, m.s.接受体外膜氧合支持的患者的神经问题。在体外膜氧合:治疗进展InTech(的哲理,2016)。
纳尔逊,K. B. &林奇,J. K.新生儿中风。柳叶刀神经。3., 150-158(2004)。
Straney, L。et al。儿科死亡率指数3:预测儿科重症监护死亡率的更新模型。Pediatr。暴击。保健医疗。14, 673-681(2013)。
Cengiz, P., Seidel, K., Rycus, P. T., Brogan, T. V. & Roberts, J. S.小儿体外生命支持期间中枢神经系统并发症:发生率和危险因素。暴击。保健医疗。33, 2817-2824(2005)。
丘奇,j.t.。et al。推动ECLS的边界:< 34周EGA新生儿的结局。j . Pediatr。杂志。52, 1810-1815(2017)。
维恩文学硕士。et al。体外膜氧合治疗新生儿脑损伤的模式。点。j . Neuroradiol。38, 820-826(2017)。
简而言之,B. L.体外生命支持对大脑的影响:ECMO的重点。Semin。Perinatol。29, 45-50(2005)。
科夫勒,m.l.。et al。从静脉到静脉的体外膜氧合转换与儿童死亡率增加有关。外科医生。244, 389-394(2019)。
蔡柏宏。et al。胎粪吸入或持续性肺动脉高压新生儿ECMO由静脉转静脉的发病率。j . Pediatr。杂志。56, 459-464(2021)。
Falk, L., Fletcher-Sandersjöö, A., Hultman, J. & Broman, L. M.成人从静脉到静脉体外膜氧合的转换。膜(巴塞尔)11, 188(2021)。
费里罗博士。et al。新生儿和儿童中风的管理:来自美国心脏协会/美国中风协会的科学声明。中风50, e51-e96(2019)。
Croles, F. N., Borjas-Howard, J., Nasserinejad, K., Leebeek, F. W. G. & Meijer, K.抗凝血酶缺乏患者静脉血栓形成的风险:系统回顾和贝叶斯荟萃分析。Semin。Thromb。Hemost。44, 315-326(2018)。
纤维蛋白原及其降解产物作为血栓形成的危险因素。安。纽约大学科学学院936, 560-565(2001)。
范德邦,j.g.。et al。血浆纤维蛋白原升高:心血管疾病的原因或后果?Arterioscler。Thromb。Vasc。医学杂志。18, 621-625(1998)。
瑞,i.m.c.。et al。新生儿败血症中的血小板减少:发生率、严重程度和危险因素。《公共科学图书馆•综合》12, e185581(2017)。
老爷,R。et al。中性粒细胞减少症患者严重败血症和感染性休克时,因子VIIa和抗凝血酶III活性。血88, 881-886(1996)。
Donadee C。et al。红细胞微粒和无细胞血红蛋白清除一氧化氮是红细胞储存损伤的机制之一。循环124, 465-476(2011)。
Betrus C。et al。需要体外膜氧合和持续肾替代治疗的儿童患者溶血增强。安。Thorac。Cardiovasc。杂志。13, 378-383(2007)。
艾哈迈德,。et al。一氧化氮在心血管和肾脏系统中的作用。Int。理学。19, 2605(2018)。
Lou, S., MacLaren, G., Best, D., Delzoppo, C. & Butt, W.接受离心泵体外膜氧合的儿童患者的溶血:患病率、危险因素和结果。暴击。保健医疗。42, 1213-1220(2014)。
Vymazal, J., Rulseh, a.m, Keller, J. & Janouskova, L.缺血性中风CT和MR成像的比较。见解成像3., 619(2012)。
弗莱彻Sandersjöö, A。et al。成人患者体外膜氧合颅内出血的预测因素:一项观察性队列研究。J.重症监护5, 27-27(2017)。
吕伊特,c.e.et al。静脉-静脉体外膜氧合过程中的脑损伤。重症监护室。42, 897-907(2016)。
Omar, H. R, Mirsaeidi, M., Mangar, D. & Camporesi, E. M. ECMO持续时间是ECMO支持期间发生颅内出血的独立预测因子。ASAIO J。62, 634-636(2016)。
Lorusso, R。et al。成人和儿童ECMO患者的脑监测:早期和晚期评估的重要性。密涅瓦Anestesiol。83, 1061-1074(2017)。
塞林,e.p.。et al。用于监测人类创伤性脑损伤动态的血清蛋白生物标志物的连续采样:一项系统综述。前面。神经。8, 300(2017)。
阿本德,N. S., Dlugos, D. J. & Clancy, R. R.对缺氧缺血性脑病、先天性心脏病、ECMO和中风危重儿童长期脑电图监测的综述。j .中国。Neurophysiol。30., 134-142(2013)。
资金
由卡罗林斯卡学院提供的开放获取资金。AFS感谢瑞典大脑基金会(#FO2019-0006)和斯德哥尔摩地区(研究实习)的资助。EPT感谢来自战略研究领域神经科学(卡罗林斯卡研究所)、Erling-Persson家族基金会、斯德哥尔摩地区(临床研究任命)和瑞典大脑基金会(#FO2019-0006)的资金支持。资助者在这项研究的设计或实施中没有任何作用。
作者信息
作者及隶属关系
贡献
A.F.S.和L.M.B.构思并设计了这项研究,协调并监督数据收集,解释结果,并对重要的智力内容进行了批判性的审查。R.I.和S.K.作为共同第一作者贡献相同。S.K.收集数据,解释结果,准备图表,起草和修改手稿。r.i收集数据,进行数据分析,解释结果,制作图表,起草和修改手稿。S.W.收集数据并批准了手稿。E.P.T.和C.L.严格审查了手稿中重要的知识内容,并帮助修改了手稿。所有作者都同意提交的最终手稿,并同意对所有方面的工作负责。
相应的作者
道德声明
相互竞争的利益
LMB是Eurosets Srl医疗咨询委员会的成员。意大利梅多拉和德国海尔布隆的Xenios AG。这些承诺对这项工作没有影响。其他作者声明没有利益冲突。
额外的信息
出版商的注意
施普林格自然对出版的地图和机构从属关系中的管辖权主张保持中立。
权利和权限
开放获取本文遵循知识共享署名4.0国际许可协议,允许以任何媒介或格式使用、分享、改编、分发和复制,只要您对原作者和来源给予适当的署名,提供知识共享许可协议的链接,并注明是否有更改。本文中的图像或其他第三方材料包含在文章的创作共用许可协议中,除非在材料的信用额度中另有说明。如果材料未包含在文章的创作共用许可协议中,并且您的预期使用不被法定法规所允许或超出了允许的使用范围,您将需要直接获得版权所有者的许可。如欲查看本牌照的副本,请浏览http://creativecommons.org/licenses/by/4.0/.
关于本文
引用本文
科弗,S.,亚科贝利,R.,伍德,S.。et al。新生儿体外膜氧合脑梗死的发生率和预测因素:一项观察性队列研究。Sci代表12, 17932(2022)。https://doi.org/10.1038/s41598-022-21749-5
收到了:
接受:
发表:
DOI:https://doi.org/10.1038/s41598-022-21749-5