摘要
海洋温度变暖正在严重损害全球珊瑚礁的健康和恢复力。珊瑚白化会影响珊瑚的生理机能和珊瑚繁殖所需的能量。与珊瑚繁殖分配相关的机制尚不清楚,特别是在白化事件发生后。利用同位素标记技术,我们追踪了在先前漂白和未漂白的情况下,成体通过自养和异养向配子获取和分配碳的过程Montipora性而且Porites泥蜂珊瑚。实验结果表明:(1)两种植物均仅依靠自养将碳分配给配子,而异养作为碳源的依赖较少;(2)在提供配子时,特别是在先前漂白的情况下,经历了成体组织可用碳较少的权衡;(3)采用不同的策略将碳分配给配子。随着时间的推移,m .性尽管漂白,但通过限制碳分配给成年组织,将10%的碳分配给配子,与未漂白的菌落相比,分配给漂白菌落的碳少50-80%。在同一时期,p .泥蜂在将碳分配给配子之前,保持碳分配给成体组织。我们的研究强调了自养对从成年珊瑚到配子的碳分配的重要性,以及依赖于漂白易感性的物种碳分配的特定差异。
简介
了解资源分配的差异对于识别在压力环境条件下增强有机体生存的特征很重要1以及预测人口对全球气候变化的反应2.父母如何管理暴露于环境压力会对他们的后代在未来应对类似压力的能力产生重大影响3.,4,5,6,7.由于造礁珊瑚生活在其热耐受极限附近,它们对人为压力特别敏感,包括气候变化导致的海洋变暖8.在全球范围内,由于热胁迫导致的珊瑚白化或光合共生体损失预计将变得更加频繁和严重9,10预计到2050年,大多数珊瑚礁都会出现白化现象11.到本世纪末,预计超过80%的珊瑚礁将经历有害的频繁白化事件12,13据预测,白化频率和严重程度的增加会影响珊瑚的生理机能,影响成功的繁殖周期和物种适应的潜力。为了提高我们对珊瑚礁生态系统未来的预测能力,评估珊瑚在环境压力下的恢复策略和繁殖潜力是至关重要的6).
在珊瑚中,当海水表面温度升高导致珊瑚漂白时,可能会发生配子发生延迟、卵大小减小、繁殖力低和产卵可能性降低的情况14,15,16,17,18,19,20.,21,22.然而,一些物种可以继续有性繁殖尽管漂白15,18,19,23,24.白化后的成功繁殖可能是由于成年珊瑚从不同来源获取碳的混合营养能力。成年珊瑚从白化事件中恢复时依赖自养和异养两种途径25.众所周知,在成虫群中,珊瑚漂白会导致光合作用速率下降,而储存的脂质储备代谢增加26,27在某些物种中,这可能由异养率的增加来补充25,28,29.而珊瑚的营养策略各不相同,被认为会影响成年珊瑚的抗漂白性和热耐受性30.在美国,它们对配子发育的影响以及任何由此产生的亲代权衡在很大程度上仍未得到研究。父母获取碳和为后代提供碳可能导致珊瑚白化后繁殖的不同结果。
碳在鸡蛋中以脂质的形式储存31对卵磷脂营养发育的物种(包括珊瑚)特别重要,因为幼虫的营养仅限于卵中所含的资源32.迄今为止,尚不清楚转移到珊瑚卵中的碳是亲本自养碳还是异养碳获取的结果。鲍曼等人。33假设异养碳可能不成比例地分配给释放的珊瑚卵中的脂质,与亲本的漂白状态无关。在珊瑚中Pocillopora疣状,异质性似乎对配子发育有负面影响34而蛇发草则与之呈正相关Paramuricea clavata35.迄今为止,只有一项先前的研究追踪了成年珊瑚群落的光合产物Stylophora pistillata到它们释放的胚珠上(即幼虫)36.在这种受精和幼虫发育发生在亲本息肉内的育雏种中,自养碳从亲本转移到浮球的量比转移到卵的量大36这表明,在胚胎发生过程中,该物种可能会优先将固定碳转移给后代。目前还不清楚珊瑚是如何提供碳的,这些珊瑚是广播产卵者,在珊瑚虫释放卵子/精子后,在水柱中受精。此外,目前还不清楚在任何珊瑚繁殖策略的环境压力下,父母是如何将碳供应给后代的。
为了更好地理解父母获取碳的类型(自养vs.异养)与随后分配给后代之间的联系,我们进行了一系列实验,跟踪两种珊瑚从父母到卵的碳。我们比较了13C在先前漂白过的菌落中,与那些在热胁迫中没有漂白的菌落一起恢复(图2)。1).具体而言,我们:(1)追踪白化事件后成年珊瑚的碳分配;(2)追踪成年珊瑚的亲代碳供应到配子;(3)通过自养和异养途径评估配子供给;和(4)侧重于广播产卵与雌雄同体(Montipora性)和淋病(Porites泥蜂繁殖策略。
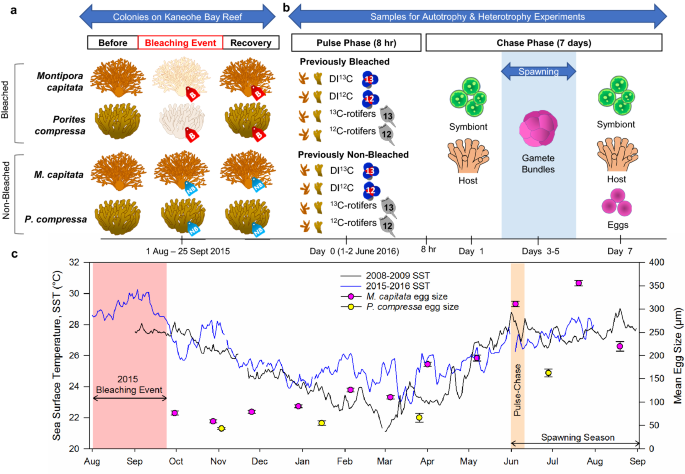
夏威夷珊瑚的实验设计和繁殖周期。(一个) 2015年8月至9月在Kāne'ohe湾的一次漂白活动中,漂白和未漂白的蜂群被标记41监测8个月,直至康复。(b2016年6月,从每个菌落中收集4个片段,进行8 h的脉冲阶段实验,以评估自养(DI)对碳的获取13C或DI12C)或异养(13C-rotifers或12C-rotifers)。分配13在共生细胞、宿主组织和卵子追逐阶段的7天内测量C。(c) NOAA MOKH1站(21°25′59”N 157°47′23”W) 2008-2009年的平均日海表温度(SST)Monitpora性之前报道过42以及发生白化的2015-2016年。将海表温度与鸡蛋大小(平均±标准误差)进行比较m .性42而且Porites泥蜂(Padilla-Gamiño,未发表数据)。
方法
珊瑚物种
我们研究了两种夏威夷造礁珊瑚的碳获取和分配情况,Montipora性而且Porites泥蜂.这两种珊瑚都是Kāne'ohe湾(美国夏威夷奥胡岛)的优势珊瑚,在那里进行了这项研究。Montipora性同时具有浮力配子(即卵-精子)束和地表水受精的雌雄同体吗37,38.Porites泥蜂是否有中性浮力卵和在水柱内受精的淋卵产卵39.为了评估这两个物种的亲代对卵子的供应,我们集中分析了雌性蜂群p .泥蜂在这项研究中。不过,这两个物种都在夏季产卵p .泥蜂是否有更长的(从夏天到秋天)和更少的同步产卵期m .性40.Montipora性结算率比p .泥蜂但早期移民的死亡率较高,生长速度较慢p .泥蜂40.
实验设计
我们的研究旨在跟踪热应激(一种自然发生的漂白事件)的时间41)和珊瑚的繁殖周期(配子的发育和产卵季节的释放)42).我们的研究地点为K4礁(21°26’36.6″N, 157°48’21.6″W),是位于Kāne’ohe湾中部的边缘礁,水停留时间为10-20天43.水流是海浪驱动的,并受到源自海湾南部的风驱动的长岸流的影响43,44,45.2015年8月1日至9月25日期间,Kāne'ohe湾海水温度在28.4至29.8°C之间发生漂白事件41.在此期间,Kāne'ohe湾多个珊瑚礁的珊瑚受到了影响41,包括位于K4礁的珊瑚。在整个Kāne'ohe湾,16.6%±4.7Montipora性19.7%±0.7Porites泥蜂菌落在2015年白化,大多数菌落在事件发生后3-4个月内明显恢复46.
2015年10月蛋开始发育的时候42大约在海水温度峰值后一个月41,我们在K4礁约2 m深处标记了两个物种明显漂白和未漂白的群落。每2-3个月对蜂群进行一次监测,并清洗标签,以确保在配子完全发育的产卵季节之前识别出蜂群,以便将来收集(图2-3)。1).这两个m .性而且p .泥蜂配子体周期长,可以持续9-10个月42并且与白化事件后成年珊瑚的其他生理参数的恢复相吻合26.
2016年5月27日(漂白事件大约8个月后),我们分别从四个先前漂白和四个先前未漂白的标记菌落中收集了碎片m .性而且p .泥蜂.菌落碎片约10厘米3.每个都有大小,至少有八个手指;两个物种的碎片大小相似。在收集的时候,这两个物种的所有菌落都明显没有漂白。1);叶绿素含量无显著差异一个(µg/g)浓度(方法描述在26的学生t检验m .性:df= 3, f = 0.88,p= 0.4477;p .泥蜂:df= 7, f = 1.51,p= 0.2656)。珊瑚碎片被运送到夏威夷海洋生物研究所的室外水流海水罐中;海水未经过滤,温度范围为25.2至26.4℃,光可用性范围为584至1249 μ mol光子/m2/ s。每个片段被进一步分为四个小块,用于以下四种处理的遗传复制:自养脉冲追踪标记;自养标记;异养脉冲跟踪标记;以及未标记的异养。
2016年6月1日,我们开始了自养脉冲追逐实验。自养的脉冲追逐标记和自养的未标记片段被分离在2 L充满0.2µm过滤和消毒海水的室中,以去除所有浮游生物并限制结节的异养性。在实验过程中,实验室被放置在流经海水的容器中,以保持恒定的环境温度。日出后1小时,自养试验以0.117 M、98 at.%的引种开始13C NaHCO3.添加到每个处理室中,最终溶解的无机碳浓度约为26 μ mol/l25.在每个控制室中加入相同体积的未经标记的0.2µm过滤和消毒的海水。9小时后,用未标记的0.2µm过滤海水冲洗隔离室,开始追逐阶段。在追逐阶段的第1天(2016年6月2日)和第7天(2016年6月8日),我们从每个标记和未标记的菌落中收集了小块用于同位素分析。在追逐期间,每6小时在每个室内交换一次水。
准备13c标记轮虫为异养脉冲追逐实验,我们获得了夏威夷原生浮游植物的培养物(Nannochloropsis oculata)和轮虫(Brachionus plicatilis).培养维持在0.2µm过滤和消毒的海水中。浮游植物以0.117 M、98% at.%的浓度培养13C NaHCO3.25在异养实验前,每天三次,连续三天喂给轮虫培养。产生的δ13标记浮游植物C值为75.82‰,未标记浮游植物C值为−15.87‰;δ13标记轮虫C值为19.32‰,未标记轮虫C值为−16.98‰。2016年6月2日,将异养脉冲追逐标记和异养未标记的片段分离到2 L充满0.2µm过滤和消毒海水的室中,以去除室中任何非标记的浮游生物。日落后1小时,异质性实验的脉冲期开始,引入150 ml13c标记轮虫,浓度为每毫升2-4轮虫到每个处理室25.在每个控制室中加入相同体积和浓度的未标记轮虫。珊瑚虫很活跃,并显示出延伸的触须。8小时后,隔离室被未经标记的未经过滤的海水冲洗,开始追逐阶段。在追逐阶段的第1天(2016年6月3日)和第7天(2016年6月9日),我们从每个标记和未标记的菌落中收集了小块用于同位素分析。从两次脉冲追逐实验中采集的珊瑚样本被立即在-80°C下冷冻,然后被运送到维拉诺瓦大学进行进一步处理。
用去离子水和喷枪从骨骼上去除珊瑚组织。用组织研磨机和离心分离共生体细胞和宿主组织47.分离的细胞和组织移液到不同的锡胶囊中(EA Consumables, LLC, Marlton, NJ),在60°C下干燥至少24小时。我们在显微镜下检查了共生细胞和宿主组织的所有样本,以确保胶囊中没有骨骼碎片。然后,所有胶囊被折叠成小而均匀的小球,为同位素分析做准备。
在2016年6月5日和6日晚上,一些m .性蜂群在自然产卵期间(新月后1-2天)释放配子束。这些日期与异养实验中蜂群追逐阶段的第3-4天和自养实验中蜂群追逐阶段的第4-5天相吻合。1).用移液管从隔离室表面收集配子束m .性18.我们无法从p .泥蜂.这个物种在满月期间和之后被零星地观察到产卵38,48配子释放的时间也不像它们那样可预测m .性.为了评估两个物种的原位发育卵的同位素特征,我们在追逐的第7天在1.85%甲醛中保存了每个菌落的额外片段。使用Cal-Ex II固定剂/脱钙剂对这些碎片进行脱钙,用70%乙醇冲洗,并从珊瑚组织中分离出发育中的卵。在产卵过程中释放的配子束的同位素值与同一群体中解剖的卵的同位素值无显著差异(配对t检验:df= 8, t = 0.25,p= 0.8090)。无论是释放还是解剖,配子束/卵移液到锡胶囊中,在60°C下干燥至少24小时,并折叠成小而均匀的颗粒,为同位素分析做准备。
稳定同位素分析
所有的锡胶囊在Elementar Pyrocube和产生的CO中燃烧2气体是用德雷克塞尔大学自然科学院的Elementar Isoprime100同位素比质谱仪分析的。δ13C值相对于维也纳Peedee Belemnite石灰岩标准(vPDB) (δ13C =每密尔偏差的稳定碳比13C:12C相对vPDB)。样品分析为两份。标准,B2150 (EA Consumables, LLC, Marlton, NJ),内部麋鹿组织,DORM(鱼肌肉)和鸟类羽毛标准,δ的精度为±0.14‰13C。
统计分析
δ差异有统计学意义13C值分别为每个物种和营养脉冲追逐实验,采用混合效应模型(补充表1).这些结果比较了先前漂白状态(漂白,未漂白),脉冲周期处理(13c标记的,未标记的),组织类型(共生体,宿主,卵/束),以及追逐期(第1天,第7天)的时间重复效应。每个模型都包括基因型和组织类型(共生体细胞,宿主组织和卵/束)的随机效应嵌套在先前的漂白状态中。随机和重复效应比较协方差参数估计和拟合统计量,-2res对数似然。事后Tukey-Kramer检验确定了在主要模型效应的显著相互作用中彼此显著不同的因素(补充表)2- - - - - -5).p≤0.05为有统计学意义。我们计算百分比富集值,将每个脉冲追逐实验和物种的平均标记值与各自的对照进行比较(补充表)6).所有统计分析均使用SAS System for Windows的SAS统计软件Version 9.4生成。
结果与讨论
碳自养获取途径
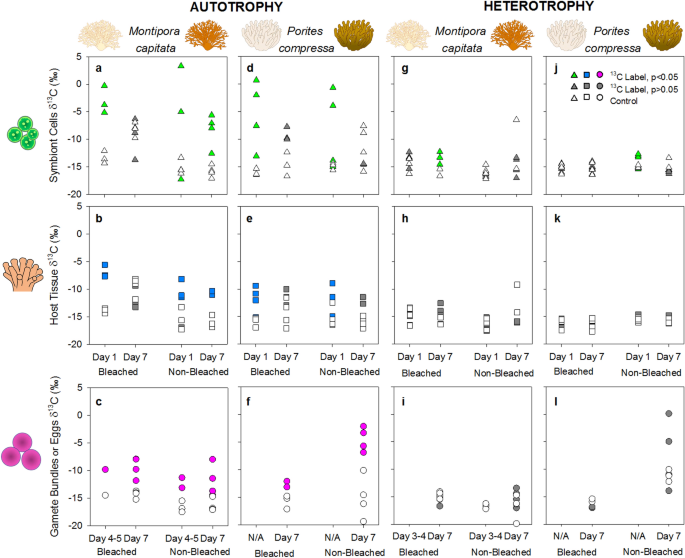
我们的结果提供了第一个直接证据,证明碳资源从成年珊瑚群落分配到它们的卵(图2)。2).这两个物种都依赖于自养来为卵分配碳。在第一天的追捕中Montipora性,有显著的合并13C来自共生细胞的自养(图。2a)和宿主组织(图;2B)与对照珊瑚相比,白化和未白化的成年群落的标记。同样,到第4-5天,有显著性差异13与对照相比,从漂白和未漂白的成年菌落中释放的配子束在标记的配子束中C的富集(图2)。2c)。m .性的地址。13在追逐阶段,C在成虫体内的分配和保留时间因先前漂白状态的不同而不同。在漂白的殖民地,这个比例明显更高13C被分配到共生细胞而不是宿主组织,而且明显更多13在追逐的第1天开始,C被分配到宿主组织而不是配子束。2得了;补充表2).到了第七天,13C被耗尽(即δ降低13C)在白化珊瑚的共生细胞和宿主组织中均存在,标记菌落和对照菌落之间无显著差异(图2)。2a, b).然而,漂白菌落的卵仍然是一个重要的储存地点(即较高的δ13C)13C在第7天的分配(图;2c).相反,未漂白的菌落保留了下来13c标签在共生细胞、宿主组织和卵子中持续到第7天(图2)。2a - c)。尽管如此,还有更多13C在第7天转移到漂白剂的卵中,而非漂白剂的卵中。2c;补充表2).总的来说,这些模式表明配子发育显著优先于成体组织维持m .性当碳自养获得时,特别是发生漂白时。
配子发育的碳获取主要是自养的。(一个- - - - - -l)植物中自养或异养获得碳Montipora性(一个- - - - - -c、g- - - - - -我),Porites泥蜂(d- - - - - -f, j- - - - - -l)殖民地。分配发生在追逐阶段到共生细胞(A d g j),宿主组织(B e h k)和鸡蛋(C f i l)。所有稳定的碳同位素值(δ13C)显示;对照菌落(DI12C或12c轮虫),白色符号;标记菌落13C或13c轮虫)中的有色共生体。绿色、蓝色或粉色符号表示与对照菌落相比有统计学上的显著差异;用灰色符号标记的菌落表明与对照菌落相比没有显著差异。完整的统计分析可在补充表格中找到1- - - - - -5.
无论是漂白还是非漂白Porites泥蜂的自养分配模式13C与漂白的相似m .性.在p .泥蜂在追逐的第一天,有更大的合并13C在共生细胞中(图;2d)和宿主组织(图;2e)与对照珊瑚相比,白化和未白化的成年群落的标记数量(补充表)3.).还有更多13C分配给共生体而不是宿主,不管之前的漂白状态如何。到了第七天,13在漂白和未漂白的成年菌落中,共生体细胞和宿主组织中的c标签显著减少(图2)。2d、e;补充表3.).虽然我们无法评估配子p .泥蜂在追逐的第7天之前,从漂白和未漂白的菌落中解剖出来的卵明显更丰富13与对照珊瑚相比,C在标记的珊瑚中(图。2f).相对于m .性,有更大的分配13C对未漂白的卵比漂白的菌落中p .泥蜂(无花果。2f;补充表3.).没有漂白剂的成虫能够比漂白剂的成虫分配更多自养获得的碳到卵中。
异养碳获取途径
而先前对成年珊瑚群落的生化研究假设,异养对珊瑚卵的发育至关重要m .性尤其是在漂白之后,在漂白中就更少了p .泥蜂26,28,我们发现这两个物种都没有严重依赖异养。在一次自然漂白事件发生大约8个月后,两个物种对卵的资源分配主要依赖于自养获得的碳(图2)。2).在m .性,几乎没有异养习得13C通过共生细胞(图;2g)和宿主组织(图;2h)成虫群体和正在发育的卵或释放的配子束(图;2i),除了来自漂白菌落的共生细胞在第7天(图。2g;补充表4).虽然m .性在漂白和漂白后恢复的最初几个月里,是否显示出更多的异养性47,49,50,当未漂白时,它比其他同种生物更依赖自养28.最近,δ13C分析表明,异养性对其影响有限m .性在漂白后恢复期间51.我们的数据表明,来自异养的碳没有被配子吸收m .性这表明,这个来源对配子生的影响不如之前假设的那么重要。
相反,异养碳被纳入一些未漂白的菌落的发育卵p .泥蜂,但在统计学上无统计学意义(图2)。2l)。同样的,p .泥蜂成人表现出很少或没有获得异养性13C,除第1天显著富集13C由来自未漂白菌落的共生细胞(图;2j;补充表5).这表明,如果在实验期间发生了进食,任何相关的碳都会在追逐后迅速代谢掉(几小时内)。到第7天,未漂白的发育卵标记p .泥蜂平均增加了40%13C高于未漂白对照菌落(图;2l).像自养习得一样,有更大的13C使鸡蛋从未漂白到漂白的菌落p .泥蜂紧接着异养(图;2l;补充表5).异养碳的积累p .泥蜂部分菌落第7天的卵(图;2l),虽然不具有统计学意义,但可能在不到24小时内通过宿主组织进行了转运。已知碳转移发生在24小时内的成人组织的细胞器之间52在幼虫的组织层中53,因此,从亲本到配子的易位也可能发生在类似的时间段内。卵对碳的异养获取可能发生在p .泥蜂值得进一步调查。
低富集值表明异养性碳分配的证据有限。这可能是由于珊瑚全息生物通过呼吸失去碳25和/或粘液产生54以及随后珊瑚粘液中的微生物对碳的吸收55.相对于每个物种产卵期的实验时间,可能进一步影响了异养性的碳吸收。为m .性,产卵发生在实验中间,而对于p .泥蜂产卵大约在两周后发生38,48.值得注意的是,一些殖民地p .泥蜂含有异养获得碳的卵,表明珊瑚喂养可以促进该物种的卵发育。到目前为止,我们对珊瑚的摄食行为如何或是否会随着卵的生长而改变,并在胃维管腔中占据更多的空间,以及珊瑚的摄食如何受到束形成和配子释放准备过程的影响知之甚少。需要进一步的研究来更好地了解异养在珊瑚繁殖中的作用34,35.
亲代碳供应
在配子体发生和/或胚胎发生过程中,不同繁殖策略(育雏vs产卵)的珊瑚的亲代供应可能以不同的速率和阶段发生。在我们的研究中,我们发现在放生前的几天内,播散产卵者将碳大部分自养地转移到卵中。类似地,配子m .性56而且p .泥蜂48两者在释放前都从父母那里获得共生体(即垂直传播),而不是从环境(即水平传播)。在珊瑚中,Stylophora pistillata碳的转运优先发生在planula期(受精后)36,而球状美国pistillata是否通过垂直和水平传输接收共生体57.无论营养来源如何,从亲本到配子的碳分配可能与共生体的垂直传递相一致,从而更有效地为后代提供释放后立即所需的资源。
在平面上进行的脉冲追踪实验支持了这一假设。例如,球状物Pocillopora damicornis在释放后至少24小时内依赖亲本提供的碳,然后在48小时内转向从自己的共生体获得碳53.逐渐长大的幼虫更多地依靠自养来获得碳供应,而不是依靠亲本储备。Pocillopora damicornis小于5天的Planulae从其共生体中获得了16-27%的固定碳58而将近一个月大的planulae从共生体中获得了大约70-85%的碳59,60.同龄Montipora digitata幼虫从其共生体的光合产物中获得高达90%的固定碳60.虽然还不知道亲代供给发生在什么时候或通过什么营养途径p . damicornis(具有垂直传播的育苗种)或m . digitata(一种垂直传播的产卵物种),一旦后代到达水柱,就立即依赖于亲代的碳源,并在随后的几天中持续使用。在这些物种的配子/幼虫中,共生体最初缺乏光合产物的生产,可能会在释放后的头24小时内防止氧化损伤,因为它们漂浮在水面附近,可能会面临更大的热应激风险61.因此,进一步强调了父母为后代提供碳的重要性。
父母的权衡
权衡理论表明,繁殖通常会干扰亲本的维持和/或生长,当涉及共生关系时,代谢权衡变得更加复杂62.例如,在受损或迁移的珊瑚群落中,与再生相关的代谢成本导致繁殖下降63,64.在我们的研究中,我们发现珊瑚亲本在释放碳资源之前将碳资源转移到配子中,但这不利于成体组织中的碳存储。这两个物种的成年群体在为它们的卵提供碳时经历了一种生理上的权衡,尤其是在那些之前已经漂白的群体中。富集的配子13C与消耗一致13共生体细胞和宿主组织中都有C,这是亲本资源交换的证据。由于繁殖,母体组织的碳损失是预期的,并已作为碳预算的一部分计算36,65或从现场观测和能源储备分析中得到启示15.这是第一个直接测量代谢性权衡作为碳消耗在亲代组织。
在我们的研究中,我们不能评估有多少13C,如果有的话,是通过呼吸由成人组织流失的。然而,没有变化13C在未漂白共生细胞的第1天至第7天之间(图。2a)或宿主组织(图;2b)的m .性(补充表2),表明新获得的碳的呼吸作用很小。在我们的研究中,在获得碳的7天内就发生了碳分配的权衡,这表明共生细胞和宿主组织的维持在相对较短的时间内受到配子发育所需碳的影响。在这种情况下m .性这种权衡只发生在先前漂白的菌落自养获得碳时,而发生在先前漂白的菌落自养获得碳时p .泥蜂经过漂白和未漂白的菌落将自养获得的碳从成虫转移到发育中的虫卵。在这两个物种中,碳都发生了重新分配,远离成虫和卵子发育。
其他研究显示了成年蜂群繁殖的长期权衡。例如,繁殖蜂群p . damicornis有一半的非繁殖菌落的年线性扩展率65.长期的权衡也与白化事件后的繁殖有关。在Orbicella annularis(以前Montastraea annularis),在明显恢复的群体中,配子体发生在漂白后,而仍然明显漂白的群体则消耗自己的结构物质来维持,并且不繁殖15,17.在疣种的繁殖产量与白化敏感性成正比,但生长速率与白化严重程度无关66.而漂白可以减少一些夏威夷物种的钙化9,47尽管出现了漂白现象,但繁殖仍在继续18.到目前为止,白化事件后与生长和繁殖相关的长期权衡仍不清楚67并进行进一步调查。
营养动力学与珊瑚代谢
白化珊瑚的异养性被假设为表明一个群体在压力下和/或在白化中生存的恢复机制50,68.成人依赖异养习得13在我们的研究中(即自然漂白后的8个月),同一物种的C比实验漂白后的11个月要低50.成人反应的差异可能是由于温度严重程度的差异,因为实验漂白比我们研究的2015年自然漂白事件高出约3°C25,69.此外,在一些自然白化事件中,遮阳、云层覆盖、降雨事件和水流都可能缓和珊瑚礁的条件,使受影响的珊瑚恢复得更快69在实验漂白过程中,温度控制较好。我们的研究结果表明,漂白后异养依赖的持续时间取决于压力的严重程度。
而碳的异养获取似乎表明某些珊瑚物种的白化严重程度50,70自养的获取和分配可能更能反映成虫群体的生理应激。在先前漂白的殖民地m .性所有的殖民地p .泥蜂, autotrophically-acquired13C被分解,而不是储存,因为它在追逐的第1天到第7天下降(图。2f)。相反,新获得的碳被储存和维持在菌落中m .性在2015年的活动中,这一点并没有消失。我们的结果表明,即使漂白m .性菌落恢复(即获得共生体和发育配子),8个月后,漂白和未漂白的菌落之间的碳需要量仍然存在根本差异。
白化后碳分配方式的物种特异性差异可能反映了它们配子体周期和产卵期的时间差异。在夏威夷,白化季节(9月至10月)和产卵季节(5月至6月)之间的时间至少是7个月41,71.漂白菌落的恢复和配子的发育可以发生在这个时间范围内。在m .性在美国,卵在8 - 9月开始发育,大约需要8 - 10个月,产卵发生在5 - 8月,新月后2 - 4天18,42.配子体周期:配子体周期的长度p .泥蜂未知,但零星的观察表明,这个物种在夏季满月期间和之后释放配子38,48.在我们的实验中,m .性在追捕的第3-5天就已经产生了,而p .泥蜂可能在我们研究结束后的11-12天内产生。显著的易位13C从成虫到原位虫卵可能表明p .泥蜂是分配资源给卵和准备产卵(图。2f, l).虽然我们无法观察产卵p .泥蜂我们的数据清楚地表明,这个物种在漂白事件后有能力产生配子,并且碳被供应给先前漂白和未漂白的菌落中的卵子。对于这两个物种来说,漂白菌落的长期恢复与配子的发育同时发生42.随着热应激事件变得更加频繁、强烈和持续时间更长,恢复和发育配子的窗口可能会缩短,从而影响生殖生活史策略。
珊瑚白化后的繁殖策略
对先前漂白和未漂白的菌落进行的比较提供了证据,证明了在成人和正在发育的配子中发生自然漂白事件8个月后发生的生理影响。以前漂白m .性与未漂白的菌落相比,共生体细胞(减少80%)和宿主组织(减少50%)中的碳储量减少(图2)。2然而,对漂白和未漂白的菌落来说,将碳转移到卵中都是一个精力充沛的优先事项(图2)。2c).碳向卵的转移损害了漂白的成虫群体,而未漂白的成虫群体保持了碳的储存。此外,先前漂白的菌落提供了更多13与未漂白的菌落相比,第7天C对鸡蛋的影响(增加10%)。2c、补充表2).这些发现表明m .性优先配子发育,亲本为这一生理过程提供的能量量不受先前漂白的限制。以前漂白的菌落能够通过消耗成虫体内储存的碳储备来满足卵的能量需求。这些结果支持了考克斯的研究结果18并提供了一种持续配子体发生的机制m .性尽管漂白。此外,尽管漂白易感性不同,但相似数量的碳被转移到发育中的卵子(补充表)2).这支持了先前的发现,确定低表型和生化变异的鸡蛋在m .性父母的形态,生理和环境压力都不同72.
在p .泥蜂在漂白后,配子体继续发生,在先前漂白和未漂白的菌落中,发育中的卵子被提供新获得的碳。虽然13C自养结合到卵中p .泥蜂(无花果。2f, l),与未漂白菌落相比,漂白菌落中共生细胞或宿主组织通过营养途径吸收碳的情况没有差异(补充表)3.,5).这表明p .泥蜂成年企鹅已经从白化事件中恢复过来26.然而,我们观察到漂白事件对它们发育中的卵至少有一个剩余的影响,因为与未漂白的菌落相比,45-80%的碳被转移到先前漂白的卵中(图。2f、l)。Porites泥蜂只有当有多余的碳供应时,才能在成虫恢复后供应给蛋。而漂白p .泥蜂产生的卵可能在漂白事件后产卵,未漂白的菌落可能比漂白的菌落更早产卵或产生更多或更大的卵。
我们的研究强调了珊瑚亲代供应的两种不同策略,在未来和重复的白化事件的背景下,对成虫和后代的生存产生重要影响。通过增加分配给鸡蛋的碳,漂白m .性以牺牲成虫群体为代价优先配子发生。在繁殖方面的更高投资可能有助于弥补该物种早期新兵的低存活率40.为p .泥蜂,经过漂白处理和未经过漂白处理的成虫群落在寄主组织中的碳分配没有差异。然而,更少的碳被转移到漂白群体的卵中,这可能导致漂白群体中更小和/或更少的卵。自p .泥蜂产生大量配子的进化压力更小吗40这种碳分配策略可能会在漂白事件后保持繁殖潜力。
数据可用性
所有数据都在主要手稿和补充材料中提供。
参考文献
《权衡》。在生命历史的演变72-90(牛津大学出版社,1992)。
麦丁,j.s.。et al。一种基于特征的方法来推进珊瑚礁科学。生态发展趋势。另一个星球。31, 419-428(2016)。
莫索,T. A. &福克斯,C. W.母体效应的适应性意义。生态发展趋势。另一个星球。13, 403-407(1998)。
海洋中的跨代可塑性:生命历史中依赖环境的母性影响。生态89, 418-427(2008)。
Torda G。et al。珊瑚对气候变化的快速适应。Nat,爬。改变7, 627-636(2017)。
Calosi, P., Putnam, H. M., Twitchett, R. J. & Vermandele, F.海洋后生动物现代大灭绝:通过整合化石、现代和生理数据来改进预测。安。3月科学牧师11, 369-390(2019)。
蒂博,C。et al。两种海洋环节动物对全球综合变化的代内和代外反应差异很大。3月的杂志。167, 1-17(2020)。
豪厄格-古尔伯格,O。et al。快速气候变化和海洋酸化下的珊瑚礁。科学(80 -)。318, 1737-1742(2007)。
科尔斯,s.l.。et al。夏威夷珊瑚适应或适应较高海洋温度的证据。PeerJ2018, 1-24(2018)。
气候变化、珊瑚白化和世界珊瑚礁的未来。3月Freshw。Res。50, 839-866(1999)。
van Hooidonk, R., Maynard, J. & Planes, S.在变暖的世界中珊瑚礁的临时避难所。Nat,爬。改变3., 508-511(2013)。
Donner, S., Heron, S. F. & Skirving, W. J.未来情景:气候变化时代预测珊瑚礁未来的建模工作综述。在珊瑚白化。生态学研究(分析与综合)(范·奥彭,M. & J.洛)https://doi.org/10.1007/978-3-319-75393-5_13(施普林格Cham, 2018)。
应对承诺:不同未来情景下对珊瑚礁的预估热应力。《公共科学图书馆•综合》4, e5712(2009)。
礁珊瑚中浮浪释放的月周期性Pocillopora damicornis与各种环境因素有关。在第五届国际珊瑚礁大会论文集,第4卷307-312(1985)。
Szmant, A. M. & Gassman, N. J.长时间“漂白”对珊瑚礁珊瑚的组织生物量和繁殖的影响Montastrea annularis.珊瑚礁8, 217-224(1990)。
Ward, S, Harrison, P. & Hoegh-Guldberg, O.珊瑚白化降低了硬壳珊瑚的繁殖,增加了对未来压力的易感性。在第九届国际珊瑚礁大会论文集, Vol. 2 1123-1128(2000)。
门德斯,J. M. &伍德利,J. D. 1995-1996年漂白事件对息肉组织深度、生长、繁殖和骨骼带形成的影响Montastraea annularis.3月生态。掠夺。爵士。235, 93-102(2002)。
考克斯,e。f。有性生殖的延续Montipora性漂白。珊瑚礁26, 721-724(2007)。
奈格里,A. P.马歇尔,P. A. &海沃德,A. J.热胁迫对珊瑚受精和早期胚胎发生的不同影响。珊瑚礁26, 759-763(2007)。
Sudek, M, Aeby, G. S. & Davy, S. K.夏威夷的局部漂白导致组织损失和配子数量的减少Porites泥蜂.珊瑚礁31, 351-355(2012)。
Airi, V。et al。地中海特有虫黄藻珊瑚的繁殖效率随着温度的升高而降低,沿宽的纬度梯度。《公共科学图书馆•综合》9, 1-8(2014)。
莱维坦,D. R.,布德罗,W.,哈拉,J. &诺尔顿,N.长期减少产卵Orbicella珊瑚种类因温度压力。3月生态。掠夺。爵士。515, 1-10(2014)。
Padilla-Gamiño, J. L. &盖茨,R. D.夏威夷造礁珊瑚的产卵动力学Montipora性.3月生态。掠夺。爵士。449, 145-160(2012)。
Armoza-Zvuloni, R., Segal, R., Kramarsky-Winter, E. & Loya, Y.反复的白化事件可能导致石珊瑚的高耐受性和显著的配子体发生:Oculina patagonica作为一个模特。3月生态。掠夺。爵士。426, 149-159(2011)。
Hughes, a.d., Grottoli, a.g., Pease, t.k.和Matsui, Y.非漂白和漂白珊瑚中碳的获取和同化。3月生态。掠夺。爵士。420, 91-101(2010)。
罗德里格斯,L. J. & Grottoli, A. G.能量储备和代谢作为珊瑚从白化恢复的指标。Limnol。Oceanogr。52, 1874-1882(2007)。
郭志伟,陈志伟,陈志伟。亚喀巴北部海湾超级珊瑚对热胁迫的生理和生物地球化学响应。前面。3月科学。4, 1-12(2017)。
罗德里格斯,L. J. & Palardy, J. E.漂白珊瑚的异养可塑性和恢复力。自然440, 1186-1189(2006)。
Sangmanee, K。et al。热胁迫和漂白对两种硬壳珊瑚异养取食对微纳米浮游生物的影响。3月Pollut。公牛。158, 111405(2020)。
康蒂-杰佩,即。et al。造礁珊瑚的营养策略和抗漂白性。科学。睡觉。6, eaaz5443(2020)。
Arai, T., Kato, M., Heyward, A. J.,池田,Y. & Maruyama, T.正浮力造礁珊瑚卵的脂质组成。珊瑚礁12, 71-75(1993)。
Figueiredo, J。et al。硬壳珊瑚幼虫脂质和脂肪酸组成的个体发生变化。珊瑚礁31, 613-619(2012)。
鲍曼,J.,格罗托利,a.g.,休斯,a.d.和松井,Y.光自养和异养碳在漂白和非漂白珊瑚脂质的获取和储存。J. Exp. Mar. Biol。生态。461, 469-478(2014)。
Séré,王志刚,Massé,李志刚,李志刚。异养性饲养对江豚有性繁殖的影响Pocillopora疣状在水族缸。J. Exp. Mar. Biol。生态。395, 63-71(2010)。
戈里,。et al。食物供应对地中海蛇怪有性繁殖和生化组成的影响Paramuricea clavata.J. Exp. Mar. Biol。生态。444, 38-45(2013)。
光合产物对珊瑚繁殖的贡献。3月的杂志。101, 259-263(1989)。
海沃德,A. J.五种珊瑚的有性繁殖Montipora.夏威夷三月生物学研究所。技术代表。37, 170-178(1986)。
Kolinski, S. P. & Cox, E. F.夏威夷硬壳珊瑚配子和平台释放模式和时间的更新,对保护和管理的影响。Pac。科学。57, 17-27(2003)。
亨特,c.l.。夏威夷礁珊瑚(Porites compressa)的基因型多样性与种群结构(夏威夷大学,1988)。
科林斯基,s.p.。夏威夷瓦胡岛卡内奥赫湾的capitata的有性繁殖和早期生活史(夏威夷大学,2004)。
Bahr, K. D., Rodgers, K. S. & Jokiel, P. L.三次白化事件对夏威夷Kāne 'ohe湾珊瑚礁弹性的影响。前面。3月科学。4, 398(2017)。
Padilla-Gamiño, j.l。et al。夏威夷造礁珊瑚的沉积和繁殖生物学Montipora性.医学杂志。公牛。226, 8-18(2014)。
罗瑞杰,傅立文,李志强,李志强。沿海礁湖系统环流的数值研究。j .地球物理学。研究海洋。114, 1-18(2009)。
夏威夷瓦胡岛卡内奥赫湾物理海洋学的描述性研究。檀香山(HI):夏威夷海洋生物研究所,夏威夷大学.14(1968)。
史密斯,S. V.,基默尔,W. J.,劳斯,E. A.,布洛克,R. E. &沃尔什,T. W.卡内奥赫湾污水分流实验:生态系统对营养扰动响应的展望。Pac。科学。35, 279-396(1981)。
Ritson-Williams, R. & Gates, R. D.珊瑚群落对夏威夷Kāne 'ohe湾连续多年白化的恢复力。珊瑚礁39, 757-769(2020)。
Rodrigues, L. J. & Grottoli, A. G.漂白和恢复的夏威夷珊瑚骨骼、宿主组织和虫黄藻中的钙化率和稳定的碳、氧和氮同位素。Geochim。Cosmochim。学报70, 2781-2789(2006)。
Neves, eg . G.繁殖趋势的组织学分析Porites夏威夷凯恩奥湾的物种。Pac。科学。54, 195-200(2000)。
Palardy, J. E., Rodrigues, L. J. & Grottoli, A. G.浮游动物对健康和漂白珊瑚在两个深度的日常代谢碳需求的重要性。J. Exp. Mar. Biol。生态。367, 180-188(2008)。
休斯,A. D. &格罗托利,A. G.异养补偿:珊瑚礁对全球变暖的恢复力或长期压力的迹象的可能机制?《公共科学图书馆•综合》8, 1-10(2013)。
沃尔,C. B., Ritson-Williams, R.,波普,B. N. &盖茨,R. D.珊瑚在漂白和恢复过程中生化和同位素组成的空间变异。Limnol。Oceanogr。64, 2011-2028(2019)。
科普,C。et al。共生礁珊瑚光合作用驱动碳同化的亚细胞研究Pocillopora damicornis.MBio6, 1-9(2015)。
Kopp, C., Domart-Coulon, I., Barthelemy, D. & Meibom, A.在造礁珊瑚幼虫生命阶段,来自鞭毛藻共生体的营养输入是最小的。科学。睡觉。2, e1500681(2016)。
Wild, C., Naumann, M., Niggl, W. & Haas, A.由硬壳珊瑚释放的温水和冷水珊瑚礁粘液的碳水化合物组成。Aquat。医学杂志。10, 41-45(2010)。
西尔维拉,c.b.。et al。微生物过程驱动珊瑚礁有机碳流动。《。牧师。41, 575-595(2017)。
Padilla-Gamiño, J. L., Weatherby, t.m., Waller, R. G. & Gates, R. D.硬壳珊瑚卵-精子束的形成和结构组织Montipora性.珊瑚礁30., 371-380(2011)。
拜勒,K. A.卡米-维尔,M., Fine, M. & Goulet, T. L.珊瑚中多重共生体获取策略的自适应机制Stylophora pistillata.《公共科学图书馆•综合》8, 1-7(2013)。
散布的能量考虑Pocillopora damicornis(林奈)浮浪幼体。在第四届国际珊瑚礁研讨会论文集,第2卷153-156(1981)。
盖瑟,M. R. & Rowan, R.珊瑚虫黄虫共生于平浪幼虫Pocillopora damicornis.J. Exp. Mar. Biol。生态。386, 45-53(2010)。
Harii, S., Yamamoto, M. & Hoegh-Guldberg, O.甲藻光合作用和储存脂质对造礁珊瑚共生幼虫生存的相对贡献。3月的杂志。157, 1215-1224(2010)。
我是雅科夫列娃。et al。藻类共生体在高温下增加珊瑚幼虫的氧化损伤和死亡。3月生态。掠夺。爵士。378, 105-112(2009)。
van Woesik, R. & Jordán-Garza, a . G.珊瑚种群在快速变化的环境。J. Exp. Mar. Biol。生态。408, 11-20(2011)。
破坏对硬壳珊瑚生长、繁殖和脂质储存的影响Pocillopora damicornis(林奈)。J. Exp. Mar. Biol。生态。187, 193-206(1995)。
受损珊瑚的繁殖和再生会争夺能量分配吗?3月生态。掠夺。爵士。143, 297-302(1996)。
珊瑚浮叶幼虫的能量学、能力和长距离扩散Pocillopora damicornis.3月的杂志。93, 527-533(1987)。
贝尔德,A. H. &马歇尔,P. A.大堡礁白化后硬壳珊瑚的死亡率、生长和繁殖。3月生态。掠夺。爵士。237, 133-141(2002)。
普雷科达,K.,哈特,M. J.,贝尔德,A. H. &马丁,J. S.珊瑚组织生物量与生长而不是繁殖相权衡。珊瑚礁39, 1027-1037(2020)。
安东尼,K. R. N.,胡根布姆,M. O.,梅纳德,J. A.,格罗托利,A. G. &米德尔布鲁克,R.预测环境压力死亡风险的能量学方法:珊瑚白化的案例研究。功能。生态。23, 539-550(2009)。
Bahr, K. D. Jokiel, P. L. & Rodgers, K. S.夏威夷礁珊瑚的季节性和年度钙化率,Montipora性,在当前和未来气候变化情景下。ICES, 3月科学。74, 1083-1091(2017)。
陈志伟,陈志伟。不同浊度下珊瑚异养性和自养性的变化。J. Exp. Mar. Biol。生态。252, 221-253(2000)。
夏威夷和埃尼威塔克岛一些常见的雌雄同体珊瑚的繁殖模式和时间。3月的杂志。48, 173-184(1978)。
Padilla-Gamiño, j.l。et al。所有的鸡蛋都生而平等吗?夏威夷造礁珊瑚的案例研究Montipora性.珊瑚礁32, 137-152(2013)。
确认
我们感谢夏威夷海洋生物研究所(HIMB)的教职员工,尤其是Ruth Gates博士;E. Lenz、M. McMahon、J. Lopez、A. Trujillo、M. Jaffe和J. Axworthy在现场和实验室提供了协助;德雷塞尔大学自然科学院D. Velinsky和P. Zelanko的同位素分析;P. Bernhardt提供统计援助。这项研究是根据夏威夷土地和自然资源部2017-13年的科学许可证进行的。这项研究得到了维拉诺瓦大学文理学院教师发展基金和国家科学基金会综合有机系统部门的支持,综合生态生理学计划(NSF IOS-IEP) 1655888到LJR, NSF IOS-IEP 1655682和斯隆研究奖学金到JPG。这是HIMB的贡献#1906和海洋与地球科学技术学院(SOEST)的贡献#11579。
作者信息
作者及隶属关系
贡献
L.J.R.和J.L.P.G.设计、执行研究并撰写论文;L.J.R.分析了数据。
相应的作者
道德声明
相互竞争的利益
作者声明没有利益竞争。
额外的信息
出版商的注意
施普林格自然对出版的地图和机构从属关系中的管辖权主张保持中立。
补充信息
权利和权限
开放获取本文遵循知识共享署名4.0国际许可协议,允许以任何媒介或格式使用、分享、改编、分发和复制,只要您对原作者和来源给予适当的署名,提供知识共享许可协议的链接,并注明是否有更改。本文中的图像或其他第三方材料包含在文章的创作共用许可协议中,除非在材料的信用额度中另有说明。如果材料未包含在文章的创作共用许可协议中,并且您的预期使用不被法定法规所允许或超出了允许的使用范围,您将需要直接获得版权所有者的许可。如欲查看本牌照的副本,请浏览http://creativecommons.org/licenses/by/4.0/.
关于本文
引用本文
罗德里格斯,l.j., Padilla-Gamiño, J.L.营养供应和父母的权衡导致珊瑚在漂白事件后成功的繁殖性能。Sci代表12, 18702(2022)。https://doi.org/10.1038/s41598-022-21998-4
收到了:
接受:
发表:
DOI:https://doi.org/10.1038/s41598-022-21998-4