摘要gydF4y2Ba
小鼠单克隆抗体M4M最近被设计用于阻断人TRPM4通道。生成M4M的多肽由跨膜段5 (S5)和孔之间的肽A1和孔与跨膜段6 (S6)之间的肽A2组成。利用肽芯片,在A2中的一个4氨基酸序列EPGF被鉴定为M4M的结合表位。EPGF与其他氨基酸的取代大大降低了结合亲和力。人体TRPM4结构分析表明,EPGF位于通道孔的外部。A1在空间上接近EPGF结合表位,尽管由37个氨基酸肽分开。电生理学研究表明,M4M可以阻断人TRPM4,但对啮齿动物TRPM4没有影响,因为它们具有不同的氨基酸序列ERGS作为结合基序。我们的研究结果表明M4M是人TRPM4的特异性抑制剂。gydF4y2Ba
简介gydF4y2Ba
瞬时受体潜在褪黑素成员4 (TRPM4)是一种电压依赖性、非选择性的单价阳离子通道gydF4y2Ba1gydF4y2Ba.近年来,人们发现TRPM4在许多疾病中起着关键作用。已知TRPM4突变可引起心脏传导问题,如右束支传导阻滞、心动过速和Brugada综合征gydF4y2Ba2gydF4y2Ba.在前列腺癌、肝癌、膀胱癌、宫颈癌、结肠癌和大B细胞癌中,异常的TRPM4活性会影响癌细胞的生长和迁移gydF4y2Ba3.gydF4y2Ba.在神经系统中,TRPM4在多发性硬化症等疾病的神经血管细胞死亡中起重要作用gydF4y2Ba4gydF4y2Ba、中风gydF4y2Ba5gydF4y2Ba,头部损伤gydF4y2Ba6gydF4y2Ba以及脊髓损伤gydF4y2Ba7gydF4y2Ba.缺血时,胞质钙含量升高gydF4y2Ba2 +gydF4y2BaTRPM4活性显著增强。TRPM4在低氧损伤神经系统疾病中表达上调。在通道活性增加的同时,钠含量过高gydF4y2Ba+gydF4y2BaTRPM4通道内流可引起神经元和血管内皮细胞的肿瘤细胞死亡gydF4y2Ba7gydF4y2Ba,gydF4y2Ba8gydF4y2Ba.gydF4y2Ba
据报道,抗糖尿病药物格列本脲可抑制TRPM4的功能,目前正在中风的临床试验中进行研究gydF4y2Ba9gydF4y2Ba.格列本脲是一种广泛用于治疗2型糖尿病的抗糖尿病药物。它通过抑制钾来调节血糖水平gydF4y2Ba三磷酸腺苷gydF4y2Ba通过与胰腺β细胞的SUR1亚基相互作用gydF4y2Ba10gydF4y2Ba.由于TRPM4与SUR1形成通道复合物,当SUR1和TRPM4以一定比例共表达时,格列本脲对TRPM4具有抑制作用gydF4y2Ba11gydF4y2Ba.在没有SUR1的情况下,格列本脲对TRPM4活性没有影响gydF4y2Ba12gydF4y2Ba.在过去的几年里,我们试图通过直接靶向TRPM4来抑制TRPM4的功能。在体外和体内研究中,siRNA首次用于抑制TRPM4的表达。脑卒中诱导后,应用TRPM4 siRNA可保护神经元和血管内皮细胞。因此,在永久性和短暂性脑卒中模型中都发现了功能改善gydF4y2Ba13gydF4y2Ba,gydF4y2Ba14gydF4y2Ba.由于siRNA在转录水平上起作用,TRPM4 siRNA需要在TRPM4蛋白上调之前,在疾病发病的非常早期应用。考虑到siRNA的局限性,我们试图开发一种特异性的阻断剂,直接作用于TRPM4蛋白。gydF4y2Ba
大约12年前,我们开始生成针对大鼠TRPM4通道跨膜段5 (S5)和6 (S6)之间的28个氨基酸多肽的多克隆抗体M4PgydF4y2Ba15gydF4y2Ba.在常氧和缺氧条件下,M4P均可降低TRPM4电流,保护血管内皮细胞和神经元免受缺氧后的嗜瘤细胞死亡gydF4y2Ba16gydF4y2Ba.应用M4P改善脑卒中动物模型再灌注损伤gydF4y2Ba15gydF4y2Ba.在M4P成功的基础上,我们进一步开发了抗人TRPM4的单克隆抗体M4MgydF4y2Ba17gydF4y2Ba.M4M靶向的多肽是人TRPM4通道S5和S6之间的21个氨基酸序列。该多肽由疏水通道孔隔开的两个小多肽组成gydF4y2Ba18gydF4y2Ba.目前尚不清楚什么是结合表位,以及单个氨基酸的位置如何影响M4M作用。在本研究中,我们通过表位定位、氨基酸替代、结构分析和电生理研究来检测M4M的结合表位,以及M4M对人TRPM4通道的特异性。gydF4y2Ba
结果gydF4y2Ba
M4M结合表位的鉴定gydF4y2Ba
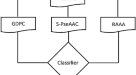
小鼠单克隆抗体M4M被设计用于靶向人TRPM4的细胞外多肽(图4)。gydF4y2Ba1gydF4y2Baa).该多肽由通道成孔表位P-loop分隔的两个抗原序列A1和A2组成。A1含有4种氨基酸,A2含有17种氨基酸(图2)。gydF4y2Ba1gydF4y2Bab).为了鉴定M4M的结合表位,对抗原多肽RDSDSNCSSEPGFWAHPPGAQ进行了肽微阵列(图4)。gydF4y2Ba1gydF4y2Bac).肽与连接体一起被转化为7、10和13个氨基酸的肽,并有6、9和12个氨基酸的重叠。在0.1至100 μ g/ml的不同浓度下,M4M孵育显示出类似的染色模式(图2)。gydF4y2Ba1gydF4y2BaC)高信噪比。对照组IgG未与抗原多肽结合。在所有7、10和13个氨基酸多肽中观察到的强抗体反应表明,4个氨基酸序列的EPGF是M4M的结合表位(图4)。gydF4y2Ba1gydF4y2Bad)。gydF4y2Ba
M4M结合表位的鉴定。(gydF4y2Ba一个gydF4y2Ba)人体TRPM4通道的跨膜段5和6的示意图。M4P的抗原表位标记为A1和A2。P: pore-loop。(gydF4y2BabgydF4y2BaA1和A2的氨基酸序列,由通道孔(p-loop)分开。(gydF4y2BacgydF4y2Ba)构象肽芯片与对照小鼠IgG(1µg/ml)或M4M(0.1和1µg/ml)孵育,然后用二抗染色(红色:样品染色;绿色:对照染色)。对于每个读出的图片,最上面一行:7个氨基酸片段;中排:10个氨基酸片段;最下面一行:13个氨基酸片段。(gydF4y2BadgydF4y2Ba)在长度为7、10和13个氨基酸的肽段上,抗体对具有一致motif的相邻肽段形成的表位样斑点模式有很强的应答。gydF4y2Ba
EPGF是M4M结合的关键gydF4y2Ba
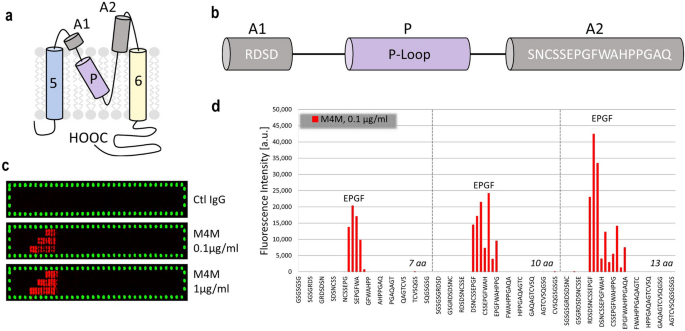
结合表位EPGF和邻近氨基酸gydF4y2Ba1gydF4y2BaSNCSSEPGFWAHPgydF4y2Ba13gydF4y2Ba通过对20种标准氨基酸进行单氨基酸替代进一步检验。热图,取代矩阵和氨基酸图(图。gydF4y2Ba2gydF4y2Baa - c)强调保守的核心主题gydF4y2Ba6gydF4y2BaEPGFgydF4y2Ba9gydF4y2Ba由N端和c端可变拉伸构成gydF4y2Ba1gydF4y2BaSNCSSgydF4y2Ba5gydF4y2Ba而且gydF4y2Ba10gydF4y2BaWAHPgydF4y2Ba13gydF4y2Ba.gydF4y2Ba
氨基酸位置gydF4y2Ba8gydF4y2BaG和FgydF4y2Ba9gydF4y2Ba表现出一个基本的特征,交换任何其他氨基酸导致完全失去抗体结合(图。gydF4y2Ba2gydF4y2Bac).氨基酸位置gydF4y2Ba6gydF4y2BaE具有很强的保守性,交换其他氨基酸后信号强度至少降低72%。氨基酸位置gydF4y2Ba7gydF4y2BaP也表现出强烈的保守性,交换a使信号强度降低了57%,而与野生型氨基酸相比,任何其他替代都使信号强度降低了至少81%。gydF4y2Ba
N端和c端变量的所有其他氨基酸位置都延伸gydF4y2Ba1gydF4y2BaSNCSSgydF4y2Ba5gydF4y2Ba而且gydF4y2Ba10gydF4y2BaWAHPgydF4y2Ba13gydF4y2Ba表现出对野生型氨基酸无偏好的可变特性。尽管其主要可变的性质,氨基酸位置gydF4y2Ba10gydF4y2BaW对芳香氨基酸F、W和Y表现出轻微的偏好。gydF4y2Ba
M4M是人类TRPM4的特异性gydF4y2Ba
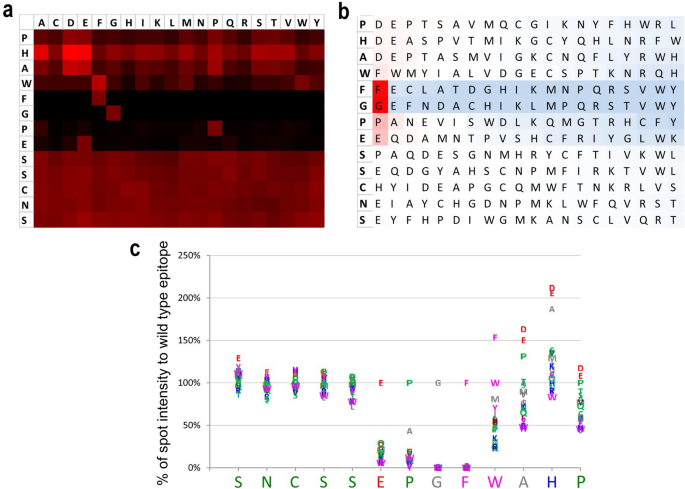
为了在功能上表征M4M,人或小鼠TRPM4在HEK293细胞中瞬时表达。TRPM4通道在缺氧孵育7分钟后被激活。在对照组未转染的HEK293细胞中,基线电流通过斜坡协议从−80 mV到+ 80 mV观察(图2)。gydF4y2Ba3.gydF4y2Baa).转染小鼠TRPM4后,与未转染的细胞相比,在IgG和M4M处理的细胞中观察到更大的电流(图。gydF4y2Ba3.gydF4y2Bab). IgG和M4M处理之间无差异。接下来我们通过7分钟低氧诱导激活小鼠TRPM4。与图中常氧条件比较。gydF4y2Ba3.gydF4y2Bab,缺氧诱导IgG和M4M处理的电流更大(图4)。gydF4y2Ba3.gydF4y2Bac).同样,两组之间没有发现差异。当人TRPM4被引入HEK293细胞,在常氧条件下,IgG处理产生的电流大于M4M处理(图4)。gydF4y2Ba3.gydF4y2Bad).在低氧诱导7min后,M4M处理下观察到的电流仍小于IgG处理(图。gydF4y2Ba3.gydF4y2Bae)。gydF4y2Ba
M4M的电生理特性。(gydF4y2Ba一个gydF4y2Ba)未转染HEK293细胞在常氧和7 min缺氧条件下的电流电压关系。斜坡协议应用于−80到+ 80 mV,保持电位为0 mV。N = 8单元格。(gydF4y2BabgydF4y2Ba)小鼠TRPM4转染HEK293细胞在常氧环境下的电流电压关系。分别用20.8 μg/ml浓度的对照IgG (n = 8个细胞)或M4M (n = 11个细胞)预处理30min后夹片。(gydF4y2BacgydF4y2Ba比较IgG (n = 8细胞)和M4M (n = 10细胞)在小鼠TRPM4过表达条件下对缺氧HEK293细胞的电流电压关系。(gydF4y2BadgydF4y2Ba)人TRPM4过表达HEK293细胞在常氧条件下IgG与M4M的电流电压关系比较。N = 6单元格。(gydF4y2BaegydF4y2Ba)人TRPM4过表达下缺氧HEK293细胞IgG与M4M的电流电压关系比较。N = 6单元格。(gydF4y2BafgydF4y2Ba)常氧下+ 80 mV TRPM4电流密度总结。背景电流来自(gydF4y2Ba一个gydF4y2Ba)被减去。hTRPM4:转染人TRPM4;mTRPM4:转染小鼠TRPM4。(gydF4y2BaggydF4y2Ba)缺氧+ 80 mV时减电流密度总结。*p < 0.05,学生的gydF4y2BatgydF4y2Ba测试。gydF4y2Ba
我们进一步分析了减去基线电流后+ 80 mV时的电流密度。在常氧条件下,M4M能抑制人TRPM4电流。相比之下,IgG和M4M处理具有相似的小鼠TRPM4电流(图4)。gydF4y2Ba3.gydF4y2Baf).低氧诱导7min后,M4M再次抑制人TRPM4电流,在小鼠TRPM4表达细胞中,IgG和M4M处理没有发现差异(图4)。gydF4y2Ba3.gydF4y2Bag).这些结果表明,在常氧和低氧条件下,M4M都能有效抑制人TRPM4电流,而M4M对小鼠TRPM4电流没有影响。gydF4y2Ba
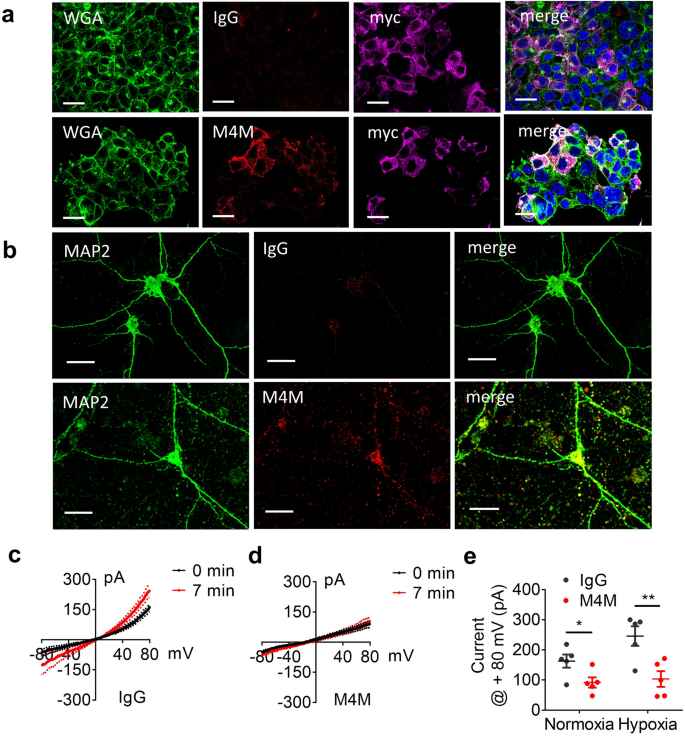
为了检验M4M是否能结合活细胞表面的TRPM4通道,我们培养转染hTRPM4的HEK 293细胞,然后固定细胞,使用人IgG或M4M(图4)。gydF4y2Ba4gydF4y2Baa),细胞表面标记物WGA可在HEK 293细胞表面识别M4M。用对照IgG培养的细胞表面未见染色。M4M还在携带人TRPM4序列的转基因大鼠原代培养神经元上检测到hTRPM4。对照组IgG未检测到信号。gydF4y2Ba4gydF4y2Bab).电生理学研究发现,在对照组IgG处理的神经元中,缺氧诱导电流增加。而M4M孵育成功阻断了缺氧诱导的电流增加(图4)。gydF4y2Ba4gydF4y2Ba一部)。这些结果表明,用人TRPM4序列取代结合位点后,大鼠TRPM4对M4M阻断敏感。gydF4y2Ba
M4M检测hTRPM4及其对人TRPM4基因转基因大鼠神经元的影响(gydF4y2Ba一个gydF4y2Ba)用IgG(上)或M4M(下)检测myc - ddk标记人TRPM4转染HEK的免疫荧光染色。WGA,细胞表面标记物(绿色)和人IgG或M4M染色(红色),hTRPM4的Myc染色(粉红色)。比例尺:20µm。(gydF4y2BabgydF4y2Ba) OGD 24 h后,对携带人TRPM4序列的转基因大鼠神经元进行人IgG(上图)或M4M染色(下图,红色)。MAP2,神经元标记(绿色)。比例尺:20µm。(gydF4y2BacgydF4y2Ba) IgG处理常氧和缺氧神经元电流电压关系的比较,n = 5个细胞。(gydF4y2BadgydF4y2Ba) M4M处理常氧和缺氧神经元电流电压关系的比较,n = 5个细胞。(gydF4y2BaegydF4y2BaIgG或M4M在常氧和缺氧条件下TRPM4电流+ 80 mV的总结(右)。*p < 0.05, **p < 0.01,学生t检验。gydF4y2Ba
结构分析gydF4y2Ba
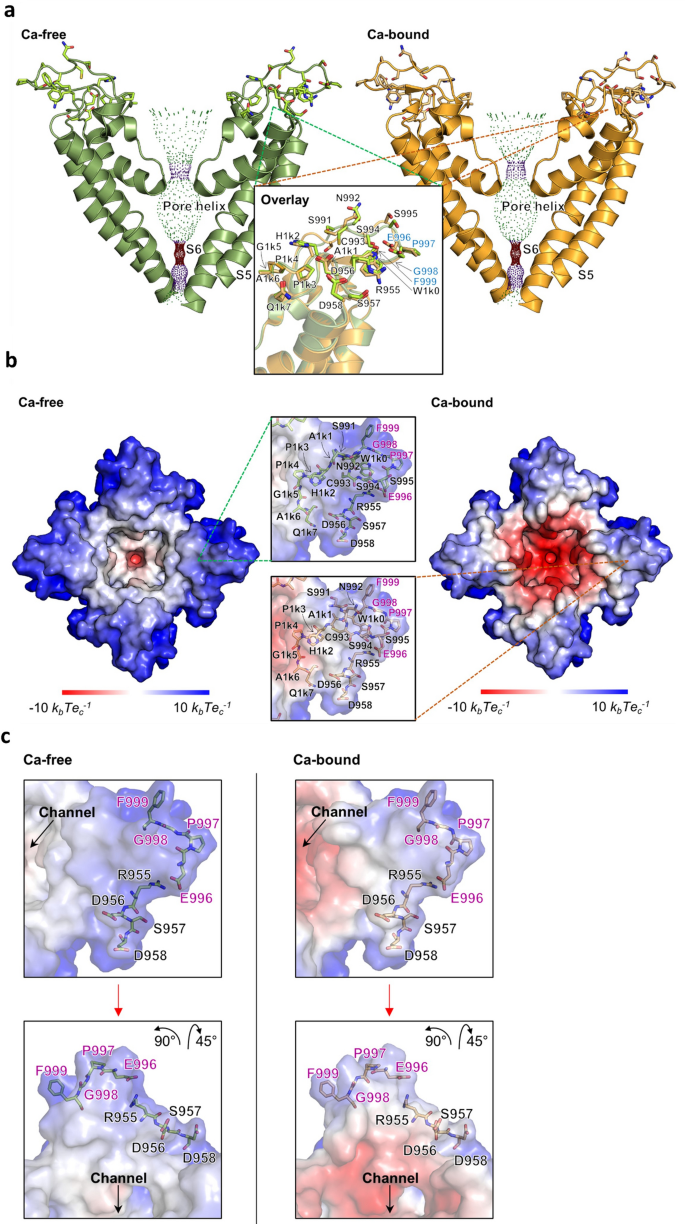
TRPM4是一个钙激活通道;基于最近发表的人类TRPM4结构gydF4y2Ba19gydF4y2Ba,在无钙和钙结合条件下,研究了人TRPM4中心孔区域内抗原序列的位置(图。gydF4y2Ba5gydF4y2Baa).该区域包含S5、S6和孔隙环,形成离子渗透通路。A1和A2序列都位于细胞外,环绕通道外部入口的前庭。A2构成了过滤器和S6之间的超长循环的一部分。无钙结构和钙结合结构的叠加表明A1和A2的位置没有发生重大变化。gydF4y2Ba
人体TRPM4通道的孔隙结构。(gydF4y2Ba一个gydF4y2Ba人类TRPM4通道的无钙(左边为绿色)和钙结合(右边为橙色)封闭状态下的孔隙结构,在没有前后四聚体单元的s5孔螺旋- s6区域可见。21个氨基酸肽序列残基以棒状表示。特写窗口描述了肽结合区域与标记残基的叠加。提出的EPGF结合基序残基以蓝色突出显示。通道孔以圆点表示。为清晰起见,剩余标签X100n (n = 0,1,…,9)缩写为X1kn。使用程序HOLE (HOLE发布2.2.005,2016年8月7日)计算圆点可视化的通道孔隙半径。gydF4y2Bahttp://www.holeprogram.org/gydF4y2Ba).gydF4y2Ba(b)gydF4y2Ba人类TRPM4四聚体在2种状态下的通道入口视图。由静电势着色的溶剂排除表面显示为无钙(左)和钙结合(右)封闭状态,为s5孔螺旋- s6区域可视化。近距离窗口显示了无钙(绿色条)和钙结合(橙色条)封闭状态下的21个氨基酸肽序列残基。残基被标记,建议的EPGF结合基序残基以洋红色突出显示。彩色比例尺表示表面静电势。为清晰起见,剩余标签X100n (n = 0,1,…,9)缩写为X1kn。静电表面电位用APBS (Version 3.0,gydF4y2Bahttps://www.poissonboltzmann.org/gydF4y2Ba).(gydF4y2BacgydF4y2Ba)从2个不同角度的特写窗口显示了所提出的EPGF结合基序残基,以及无钙(左边,绿色棒)和钙结合(右边,橙色棒)人类TRPM4闭合状态的残基R955-D958,从通道入口角度可见于s5孔螺旋- s6区域。残基被标记,建议的EPGF结合基序残基以洋红色突出显示。通道孔、静电表面和蛋白质结构使用PyMOL(分子图形系统,1.8版)进行可视化。2015.薛定谔,有限责任公司gydF4y2Bahttps://pymol.org/gydF4y2Ba).gydF4y2Ba
在钙结合条件下,在前庭内表面测量高负的静电表面电位(图。gydF4y2Ba5gydF4y2BaB、通道入口视图)。同样,无钙结构和钙结合结构都表现出相似的胞外形成。结合表位EPGF位于通道的最外层,无论钙是否存在,都形成细胞外炮塔的尖端。A1肽RDSD虽然与A2被孔隔开,但与EPGF表位接近(图2)。gydF4y2Ba5gydF4y2Bac). n链糖基化位点N992位于EPGF的另一侧,靠近通道入口(图。gydF4y2Ba5gydF4y2Baa、b)。gydF4y2Ba
讨论gydF4y2Ba
20多年前,通过靶向细胞外结构域来抑制通道活性的TRPC1抗体已经开发出来gydF4y2Ba20.gydF4y2Ba.随后有更多的抗体被报道阻断了其他色氨酸通道gydF4y2Ba21gydF4y2Ba.这些抗体靶向跨膜段5 (S5)和通道孔之间的第三细胞外结构域(E3)。当我们开始开发TRPM4阻断抗体时gydF4y2Ba22gydF4y2Ba,我们发现TRPM4的E3结构域较短,且主要含有疏水氨基酸。因此,在设计抗原时,我们考虑了覆盖整个连接S5和S6的序列的较长序列。我们开发的第一个TRPM4阻断抗体是针对大鼠TRPM4通道的多克隆抗体gydF4y2Ba15gydF4y2Ba.最近,我们生产了一种针对人TRPM4类似肽的单克隆抗体M4MgydF4y2Ba17gydF4y2Ba.M4M在细胞膜表面与人TRPM4结合。电生理研究进一步证明M4M可抑制人TRPM4活性。gydF4y2Ba
产生M4M的抗原序列包含一个来自人TRPM4通道的4氨基酸序列RDSD A1肽段和一个17氨基酸序列SNCSSEPGFWAHPPGAQ A2肽段(图4)。gydF4y2Ba1gydF4y2Ba).A1表位RDSD的选择基于疏水性分析。剩下的E3区域的大多数序列是疏水的,与抗体结合的可及性较低。相比之下,连接孔和A2所在的S6的序列很长,主要含有亲水氨基酸。将A1和A2连接到一个多肽中产生M4M是一个前所未有的尝试,因为这两个区域被一个相当长的跨越孔隙的32个氨基酸多肽隔开。我们的假设是,A1和A2虽然被p环分开,但在空间上很接近,有助于抗体识别。当M4M成功生成时,一个问题出现了:结合位点在哪里?是传统的E3区域(A1序列),还是孔隙后的新A2区域?gydF4y2Ba
在本研究中,来自表位定位和后续替代试验的有力证据清楚地表明,A2区域内的4个氨基酸表位EPGF是M4M的结合表位。EPGF位于A2的中间,距离通道孔5个氨基酸。基于已发表的人类TRPM4结构gydF4y2Ba19gydF4y2Ba,对人TRPM4的结构分析表明,EPGF表位位于最外层,突出到细胞外空间,使其成为抗体结合的理想选择。A1序列RDSD也位于通道外,但更靠近孔隙(图2)。gydF4y2Ba5gydF4y2Bac).正如假设的那样,A1和EPGF虽然被一个长长的37个氨基酸的肽分开,但在空间上是物理上接近的。虽然A1不是结合表位的一部分,但它可能为稳定抗体结合提供支持。A1在M4M功能中的确切作用还需要进一步研究。值得注意的是,A2含有一个糖基化位点Asn992,所附着的聚糖指向细胞外空间gydF4y2Ba19gydF4y2Ba.Asn992靠近通道孔,似乎不干扰M4M结合。gydF4y2Ba
作为CagydF4y2Ba2 +gydF4y2Ba活化的阳离子通道,结合CagydF4y2Ba2 +gydF4y2Ba假设到TRPM4先于电压依赖性打开gydF4y2Ba23gydF4y2Ba.CagydF4y2Ba2 +gydF4y2Ba结合位点位于S1-S4结构域细胞质侧的亲水口袋中gydF4y2Ba19gydF4y2Ba.在这里,我们发现钙的存在不会改变TRPM4结构的位置,包括EPGF结合表位。因此M4M可以与Ca和Ca结合gydF4y2Ba2 +gydF4y2Ba游离和钙gydF4y2Ba2 +gydF4y2BaTRPM4通道。M4M结合如何影响CagydF4y2Ba2 +gydF4y2Ba敏感性仍然未知。由于M4M结合位点位于通道的胞外侧,而CagydF4y2Ba2 +gydF4y2Ba结合位点在细胞质侧,M4M不太可能影响CagydF4y2Ba2 +gydF4y2Ba直接绑定。M4M的阻断作用主要来自于直接阻断通道孔或通过抑制通道激活时的构象变化。已知缺氧会增加细胞内钙水平,从而激活TRPM4通道gydF4y2Ba24gydF4y2Ba.我们的结果表明,M4M在静息和激活状态下都可以与人TRPM4结合。这与我们之前的研究一致,即M4M在常氧和低氧条件下都能抑制人类TRPM4gydF4y2Ba17gydF4y2Ba.M4M的这种特性具有临床意义,因为受到疾病侵袭的组织通常包含健康细胞和受缺氧影响的细胞的混合物。在缺氧的细胞中,抑制TRPM4电流可以缓解肿瘤细胞的死亡,而在常氧的细胞中,当缺氧扩散到这些细胞时,结合M4M可以防止潜在的肿瘤发生。gydF4y2Ba
替代试验表明,EPGF表位的每个氨基酸都对结合至关重要。与其他氨基酸的交换大大降低了结合亲和力。与人类EPGF的TRPM4序列相比,小鼠的TRPM4通道在相应位置含有ers。我们的电生理研究显示M4M对小鼠TRPM4无影响,证实了M4M对人TRPM4的特异性。gydF4y2Ba
基于肽的表位定位是线性和相对简单构象表位的理想方法。具有三级和/或四级结构的复杂表位可能不能很好地表征gydF4y2Ba25gydF4y2Ba.对于TRPM4,需要四个亚基才能形成一个功能通道gydF4y2Ba24gydF4y2Ba.为了说明人类TRPM4的细胞外结构域对M4M结合至关重要,将大鼠TRPM4的S5和6之间的细胞外结构域替换为相应的人类序列。免疫染色和膜片钳研究证实该突变大鼠TRPM4具有功能,并对M4M阻断敏感。这一结果进一步证明了M4M对人TRPM4具有特异性。gydF4y2Ba
目前的TRPM4阻滞剂9-菲诺尔和格列本脲存在各种非特异性、毒性或需要额外亚基存在的挑战gydF4y2Ba13gydF4y2Ba.TRPM4阻断抗体具有特异性强的优点。我们之前对多克隆抗体M4P的研究表明,TRPM4阻断抗体能够抑制TRPM4的功能,无论在体外还是体内gydF4y2Ba15gydF4y2Ba,gydF4y2Ba16gydF4y2Ba.单克隆抗体M4M的产生标志着我们开发与TRPM4功能异常相关的神经系统疾病的新疗法的尝试取得了进展gydF4y2Ba26gydF4y2Ba.细胞外结合表位的鉴定表明,TRPM4阻断抗体可以很容易地从细胞外进入通道。值得注意的是,M4M是一种小鼠单克隆抗体,如果用于患者,可能会产生异体免疫反应。M4M的人性化是减少免疫排斥反应的下一步。gydF4y2Ba
材料与方法gydF4y2Ba
单克隆抗体M4M的制备gydF4y2Ba
小鼠单克隆抗体M4M的生产已在前面描述gydF4y2Ba17gydF4y2Ba.利用接近人TRPM4通道孔的KLH偶联21氨基酸抗原多肽(RDSDSNCSSEPGFWAHPPGAQ)制备抗体。在获得的几个克隆中,M4M被选为具有最好的结合亲和力和对TRPM4通道活性的抑制作用。gydF4y2Ba
抗原决定基映射gydF4y2Ba
肽微阵列由PEPperPRINT (Heidelberg, Germany)完成。在C端和n端用中性的GSGSGSG连接子延长了RDSDSNCSSEPGFWAHPPGAQ肽段的序列,以避免肽段被截断。延长的肽序列转化为7、10和13个氨基酸的肽段,肽段-肽段重叠为6、9和12个氨基酸。在片上合成多肽后,所有的多肽都通过一个c端半胱氨酸和一个适当修饰的n端硫醚连接环化。由此产生的构象肽微阵列包含99个不同的肽,打印在重复的198个肽点上,并由额外的HA (YPYDVPDYAG, 74个位点)控制肽框起。相应的肽芯片用浓度为0.1 μg/ml的M4M孵育,然后用山羊抗小鼠IgG (H+L)二次抗体DyLight680(0.2µg/ml, Thermo Fisher)染色。对照抗体为小鼠单克隆抗ha (12CA5) DyLight800(0.2µg/ml)。读出使用Innopsys InnoScan 710-IR微阵列扫描仪,扫描增益为50/10(红/绿)。随后用对照抗体对构成肽微阵列的额外HA对照肽进行染色,作为内部质量控制,以确认测定性能和肽微阵列的完整性。微阵列图像分析使用PepSlide分析仪(Sicasys GmbH)完成。gydF4y2Ba
携带人TRPM4序列的转基因大鼠的产生gydF4y2Ba
利用CRISPR/Cas9技术,我们构建了一个携带人TRPM4序列的转基因大鼠模型。将位于外显子19和20之间的结合基序替换为相应的人TRPM4序列(突变序列从大鼠QDRSLPSILRRVFYRPYLQIFGQIPQEEMDVALMNPSNCSAERGSWAHPEGPV到人RDSDFPSILRRVFYRPYLQIFGQIPQEDMDVALMEHSNCSSEPGFWAHPPGAQ)。TRPM4的其余序列仍然来自大鼠。基因分型和DNA测序证实了人TRPM4序列的存在。所有动物实验均按照美国国家神经科学研究所动物护理与使用委员会的指导方针和国际arrival指导方针(gydF4y2Bahttps://arriveguidelines.orggydF4y2Ba).实验方案由机构动物护理和使用委员会(IACUC No. 1)批准。A19107)。大鼠饲养于南洋理工大学李光前医学院动物研究中心。gydF4y2Ba
转基因大鼠皮层神经元的原代培养gydF4y2Ba
简而言之,获得胚胎第18天(E18)怀孕转基因大鼠的胎脑,并在含有20 U/ml木瓜蛋白酶(Worthington, Lakewood, NJ, USA)的Earle平衡盐溶液(EBSS, Thermo Fisher Scientific, MA, USA)中消化40分钟。分离的细胞被接种在涂有聚l -赖氨酸和层粘连蛋白的12毫米圆形玻璃盖上,细胞培养液中含有Neurobasal medium、2% B27补剂、1% GlutaMAX补剂(Thermo Fisher Scientific, MA, USA)。电镀后1天更换培养基,每3天更换一半培养基。用4µM胞嘧啶阿拉伯糖苷处理细胞,从体外培养(DIV) 3-6天开始,以限制有丝分裂细胞的增殖,并在37°C的神经元培养基中维持10-21天。gydF4y2Ba
体外缺氧诱导gydF4y2Ba
对于膜片钳记录期间的急性氧葡萄糖剥夺(OGD),细胞灌注含5 mM NaN的缺氧人工脑脊液(aCSF)gydF4y2Ba3.gydF4y2Ba和10 mm2 -脱氧葡萄糖降低糖酵解能力,干扰能量代谢中的细胞呼吸。gydF4y2Ba
24小时OGD,细胞在低葡萄糖培养基中生长(2份EBSS和1份低葡萄糖DMEM, Invitrogen, Life Technologies Corporation, USA),并置于聚碳酸酯缺氧诱导室(模块化培养室,#27310,STEMCELL Technologies Inc.)。温哥华,BC,加拿大)。首先用含1% O的混合气体冲洗腔室gydF4y2Ba2gydF4y2Ba, 5% cogydF4y2Ba2gydF4y2Ba94% NgydF4y2Ba2gydF4y2Ba5分钟,以清除室内的环境空气。随后,将缺氧室严密密封,置于37°C培养箱中24 h。gydF4y2Ba
免疫荧光染色gydF4y2Ba
用4%多聚甲醛固定后,细胞在阻断血清(10%胎牛血清,0.2% PBST)中孵育1小时。主要抗体包括M4M(0.4µg/ml)、抗myc (C3956,西格玛-奥尔德里奇,MI, USA)、抗wga (Cat#W11261,赛默飞世尔科学,MA, USA)、人血清IgG (I4506,西格玛-奥尔德里奇,MI, USA)、抗map2 (M4403,西格玛-奥尔德里奇,MI, USA)。二抗与FITC或Alexa Fluor 594, Alexa Fluor 647结合。gydF4y2Ba
电生理学gydF4y2Ba
采用全细胞膜片钳比较M4M对人和小鼠TRPM4的影响。总之,用1 μg人TRPM4转染HEK293细胞gydF4y2Ba17gydF4y2Ba或小鼠TRPM4gydF4y2Ba15gydF4y2Ba使用脂质体2000转染试剂(Cat#11668019,赛默飞世尔科技,MA,美国)。转染24小时后,在室温下使用膜片钳放大器记录全细胞电流(Multiclamp 700B,配备Digidata 1440A, Molecular Devices, CA, USA)。贴片电极使用flame /Brown微吸拔器(P-1000, Sutter Instrument, CA, USA)进行拉拔,并使用microforge (MF200, World Precision Instruments Inc.)进行抛光。FL,美国)。浴液中含有(毫摩尔/升)NaCl 140, CaClgydF4y2Ba2gydF4y2Ba2, KCl 2, MgClgydF4y2Ba2gydF4y2Ba1,葡萄糖20,HEPES 20, pH 7.4。内部溶液含有(毫升/升)CsCl 156, MgClgydF4y2Ba2gydF4y2Ba1, EGTA 10和HEPES 10在pH 7.2用CsOH调整。额外的钙gydF4y2Ba2 +gydF4y2Ba加入移液液中,得到7.4 μM游离CagydF4y2Ba2 +gydF4y2Ba,使用WEBMAXC v2.10计算。记录前30 min,在浴液中加入单克隆抗体M4M或小鼠对照IgG(亚类IgG1),浓度为20.8 μg/ml。电流-电压关系通过施加250 ms的电压斜坡从−80到+ 80 mV,保持电位为0 mV来测量。采样率为20 kHz,滤波器设置为1 kHz。数据分析使用pClamp10, version10.2 (Molecular Devices, CA, USA)。记录未转染HEK293细胞的基线电流。用含5 mM NaN的浴液诱导缺氧gydF4y2Ba3.gydF4y2Ba和10毫米2-脱氧葡萄糖(2-DG)连续通过MicroFil (34 Gauge, World Precision Instruments Inc.)。(美国),距离记录单元约10 μm。流速设置为200 μL/min。在0分钟记录常氧电流,并与缺氧培养后7分钟记录的低氧电流进行比较。人和小鼠TRPM4电流可以通过从未转染的细胞中减去基线电流来获得。在10 μM picrotoxin、10 μM CNQX (6-cyano-7-nitoquinoxaline-2,3-dione)、50 μM D- apv (D(-)-2-氨基-5-磷酸卵黄酸)、1 μM TTX(河豚毒素)、60 μM镉和100 μM 4AP(4-氨基吡啶)的拮抗作用下进行神经元记录。gydF4y2Ba
表位替代试验gydF4y2Ba
为了研究所提出的表位和M4M的靶向特异性,由PEPperPrint GmbH公司进行了表位替换扫描。野生型肽的取代扫描gydF4y2Ba1gydF4y2BaSNCSSEPGFWAHPgydF4y2Ba13gydF4y2Ba是基于所有氨基酸位置与20个主要氨基酸的交换。由于该试验的肽段长度限制,远离结合表位EPGF的肽段未被包括在内。在片上合成多肽后,所有的多肽都通过一个c端半胱氨酸和一个适当修饰的n端硫醚连接环化。相应的肽微阵列包含260个不同的肽变体,并由额外的HA (YPYDVPDYAG)控制肽框定。微阵列与M4M抗体在浓度为1 μg/ml的条件下孵育16小时,温度为4℃,转速为140 rpm。随后用山羊抗小鼠(H+L)二次DyLight680抗体(赛默飞雪)染色,然后用Innopsys InnoScan 710-IR微阵列扫描仪读出,定量斑点强度,以及用PepSlide分析仪(Sicasys GmbH)注释肽。gydF4y2Ba
人体TRPM4结构分析gydF4y2Ba
无钙(PDB ID: 6BQR)和钙结合的人TRPM4四聚体(PDB ID: 6BQV)的坐标文件gydF4y2Ba19gydF4y2Ba已从蛋白质资料库(PDB) (gydF4y2Bahttp://www.rcsb.org/gydF4y2Ba)gydF4y2Ba27gydF4y2Ba.利用HOLE程序计算了圆点可视化通道孔隙半径gydF4y2Ba28gydF4y2Ba样本容量为0.225 Å。用APBS web套件计算静电表面电位gydF4y2Ba29gydF4y2Ba使用默认参数。使用PyMOL分子图形系统(1.8版)对通道孔、静电表面和蛋白质结构进行可视化。2015.薛定谔,LLC。gydF4y2Ba
统计分析gydF4y2Ba
数据以均数±s.e.m表示。使用GraphPad Prism 6.0版本进行统计分析。学生t检验用于比较两种均值。gydF4y2BaPgydF4y2Ba< 0.05被认为是显著的。gydF4y2Ba
数据可用性gydF4y2Ba
所有资源均可在合理要求下从通讯作者处获得。在当前研究中生成和分析的多肽可在Uniprot存储库(gydF4y2Bahttps://www.ebi.ac.uk/swissprot/gydF4y2Ba, SPIN ID编号SPIN200024323)。gydF4y2Ba
参考文献gydF4y2Ba
Nilius B。gydF4y2Baet al。gydF4y2Baca2+激活的阳离子通道trpm4的电压依赖性。gydF4y2Ba生物。化学。gydF4y2Ba278gydF4y2Ba, 30813-30820(2003)。gydF4y2Ba
王C, Naruse, K.,高桥,K. trpm4通道在心血管生理学和病理生理学中的作用。gydF4y2Ba细胞gydF4y2Ba7gydF4y2Ba, 62(2018)。gydF4y2Ba
高勇,廖平。Trpm4通道与癌症。gydF4y2Ba癌症。gydF4y2Ba454gydF4y2Ba, 66-69(2019)。gydF4y2Ba
Schattling B。gydF4y2Baet al。gydF4y2BaTrpm4阳离子通道介导实验性自身免疫性脑脊髓炎和多发性硬化症中的轴突和神经元变性gydF4y2BaNat,地中海。gydF4y2Ba18gydF4y2Ba, 1805-1811(2012)。gydF4y2Ba
张娥,廖平。脑瞬时受体电位通道与脑卒中。gydF4y2Baj . >。Res。gydF4y2Ba93gydF4y2Ba, 1165-1183(2015)。gydF4y2Ba
葛斯,K. M., Lantzy, M. K., Lee, E. D. & Lafrenaye, A. D.瞬态受体潜在褪黑素4诱导弥漫性创伤性脑损伤后星形胶质细胞肿胀而非死亡。gydF4y2Baj .创伤gydF4y2Ba35gydF4y2Ba, 1694-1704(2018)。gydF4y2Ba
Gerzanich, V。gydF4y2Baet al。gydF4y2Batrpm4的重新表达引发脊髓损伤继发性出血。gydF4y2BaNat,地中海。gydF4y2Ba15gydF4y2Ba, 185-191(2009)。gydF4y2Ba
陆桂英,王志强,廖平。脑卒中中肿瘤细胞死亡的研究。gydF4y2Ba启杂志。物化学。杂志。gydF4y2Ba176gydF4y2Ba, 37-64(2019)。gydF4y2Ba
杰哈,r.m.gydF4y2Baet al。gydF4y2Ba磺脲受体1和格列本脲在创伤性脑损伤中的作用:证据综述。gydF4y2BaInt。理学。gydF4y2Ba21gydF4y2Ba, 409(2020)。gydF4y2Ba
Nichols, C. G. Katp通道作为细胞代谢的分子传感器。gydF4y2Ba自然gydF4y2Ba440gydF4y2Ba, 470-476(2006)。gydF4y2Ba
Woo s.k, Kwon m.s, Ivanov, A, Gerzanich, V. & Simard, J. M.磺酰脲受体1 (sur1)-瞬时受体潜在褪黑素4 (trpm4)通道。gydF4y2Ba生物。化学。gydF4y2Ba288gydF4y2Ba, 3655-3667(2013)。gydF4y2Ba
王晓燕,王晓燕,王晓燕。非选择性阳离子通道trpm4与磺酰脲受体sur1相互作用的研究。gydF4y2Ba生物。化学。gydF4y2Ba287gydF4y2Ba, 8746-8756(2012)。gydF4y2Ba
陈,B。gydF4y2Baet al。gydF4y2Ba无创多模态成像直接显示trpm4抑制改善脑卒中再灌注损伤。gydF4y2BaTransl。中风Res。gydF4y2Ba10gydF4y2Ba, 91-103(2019)。gydF4y2Ba
Loh, K. P。gydF4y2Baet al。gydF4y2BaTrpm4抑制促进缺血性卒中后血管生成。gydF4y2Ba弗鲁格拱门。gydF4y2Ba466gydF4y2Ba, 563-576(2014)。gydF4y2Ba
陈,B。gydF4y2Baet al。gydF4y2Batrpm4特异性阻断抗体可减轻脑卒中大鼠模型再灌注损伤。gydF4y2Ba弗鲁格拱门。gydF4y2Ba471gydF4y2Ba, 1455-1466(2019)。gydF4y2Ba
魏,S。gydF4y2Baet al。gydF4y2Ba缺氧条件下trpm4阻断抗体对神经元、星形胶质细胞和血管内皮细胞抗肿瘤作用的比较。gydF4y2Ba前面。细胞发育生物学。gydF4y2Ba8gydF4y2Ba, 562584(2020)。gydF4y2Ba
低,s.w。gydF4y2Baet al。gydF4y2Ba阻断人trpm4通道的单克隆抗体的研制与鉴定。gydF4y2Ba科学。代表。gydF4y2Ba11gydF4y2Ba, 10411(2021)。gydF4y2Ba
Nilius B。gydF4y2Baet al。gydF4y2Ba阳离子通道trpm4的选择性滤波器。gydF4y2Ba生物。化学。gydF4y2Ba280gydF4y2Ba, 22899-22906(2005)。gydF4y2Ba
Autzen, H. E。gydF4y2Baet al。gydF4y2Ba脂质纳米圆盘中trpm4离子通道的结构。gydF4y2Ba科学gydF4y2Ba359gydF4y2Ba, 228-232(2018)。gydF4y2Ba
徐淑贞,Beech, d.j. Trpc1是天然血管平滑肌细胞中储存操作ca(2+)通道的跨膜亚基。gydF4y2Ba中国保监会,Res。gydF4y2Ba88gydF4y2Ba, 84-87(2001)。gydF4y2Ba
奈勒,J. & Beech, D. J.细胞外离子通道抑制剂抗体。gydF4y2Ba打开药物发现。J。gydF4y2Ba1gydF4y2Ba, 36-42(2009)。gydF4y2Ba
廖,P. & Loh, K. P. Trpm4通道抑制剂治疗中风。gydF4y2Ba美国专利gydF4y2Ba10221239(2019)。gydF4y2Ba
Nilius B。gydF4y2Baet al。gydF4y2Ba非选择性阳离子通道trpm4 ca2+敏感性的调控。gydF4y2Ba生物。化学。gydF4y2Ba280gydF4y2Ba, 6423-6433(2005)。gydF4y2Ba
Mathar,我。gydF4y2Baet al。gydF4y2BaTrpm4。gydF4y2BaHandb。Exp。杂志。gydF4y2Ba222gydF4y2Ba, 461-487(2014)。gydF4y2Ba
阿伯特,W. M.,丹施罗德,M. M.和洛,D. C.目前的方法对抗原-抗体相互作用的精细映射。gydF4y2Ba免疫学gydF4y2Ba142gydF4y2Ba, 526-535(2014)。gydF4y2Ba
Simard, j.m, Kahle, K. T. & Gerzanich, V.中枢神经系统损伤中微血管衰竭的分子机制- nkcc1和sur1/trpm4的协同作用。gydF4y2Baj . Neurosurg。gydF4y2Ba113gydF4y2Ba, 622-629(2010)。gydF4y2Ba
伯曼,h.m.。gydF4y2Baet al。gydF4y2Ba蛋白质数据库。gydF4y2Ba核酸测定。gydF4y2Ba28gydF4y2Ba, 235-242(2000)。gydF4y2Ba
史玛特,史玛特,史玛特,郭菲罗,J. M. Wallace, B. a。gydF4y2BaBiophys J。gydF4y2Ba65gydF4y2Ba, 2455-2460(1993)。gydF4y2Ba
Jurrus E。gydF4y2Baet al。gydF4y2Baapbs生物分子溶剂化软件套件的改进。gydF4y2Ba蛋白质科学。gydF4y2Ba27gydF4y2Ba, 112-128(2018)。gydF4y2Ba
确认gydF4y2Ba
我们感谢Dr. R.N.V. Krishna Deepak关于人类TRPM4结构分析的建设性讨论。这项工作得到了新加坡卫生部国家医学研究委员会授予的NMRC/OFIRG/0070/2018, MOH-000859-01和MOH-000522-00的资助。HF由新加坡科学、技术和研究局(A*STAR)生物医学研究理事会支持。JB由新加坡国际研究生奖(SINGA), A*STAR,新加坡支持。gydF4y2Ba
作者信息gydF4y2Ba
作者及隶属关系gydF4y2Ba
贡献gydF4y2Ba
p.l.、H.F.和B.N.构想并指导了这个项目;P.L.构思、分析数据并撰写论文;s.w., j.b., C.P.P.和S.W.L.进行了实验和数据分析。所有作者都审阅了手稿。gydF4y2Ba
相应的作者gydF4y2Ba
道德声明gydF4y2Ba
相互竞争的利益gydF4y2Ba
作者声明没有利益竞争。gydF4y2Ba
额外的信息gydF4y2Ba
出版商的注意gydF4y2Ba
施普林格自然对出版的地图和机构从属关系中的管辖权主张保持中立。gydF4y2Ba
权利和权限gydF4y2Ba
开放获取gydF4y2Ba本文遵循知识共享署名4.0国际许可协议,允许以任何媒介或格式使用、分享、改编、分发和复制,只要您对原作者和来源给予适当的署名,提供知识共享许可协议的链接,并注明是否有更改。本文中的图像或其他第三方材料包含在文章的创作共用许可协议中,除非在材料的信用额度中另有说明。如果材料未包含在文章的创作共用许可协议中,并且您的预期使用不被法定法规所允许或超出了允许的使用范围,您将需要直接获得版权所有者的许可。如欲查看本牌照的副本,请浏览gydF4y2Bahttp://creativecommons.org/licenses/by/4.0/gydF4y2Ba.gydF4y2Ba
关于本文gydF4y2Ba
引用本文gydF4y2Ba
魏,S.,本恩,J.,普尔,C.P.gydF4y2Baet al。gydF4y2Ba单克隆抗体M4M结合表位识别人TRPM4通道。gydF4y2BaSci代表gydF4y2Ba12gydF4y2Ba, 19562(2022)。https://doi.org/10.1038/s41598-022-22077-4gydF4y2Ba
收到了gydF4y2Ba:gydF4y2Ba
接受gydF4y2Ba:gydF4y2Ba
发表gydF4y2Ba:gydF4y2Ba
DOIgydF4y2Ba:gydF4y2Bahttps://doi.org/10.1038/s41598-022-22077-4gydF4y2Ba
评论gydF4y2Ba
通过提交评论,您同意遵守我们的gydF4y2Ba条款gydF4y2Ba而且gydF4y2Ba社区指导原则gydF4y2Ba.如果您发现一些滥用或不符合我们的条款或指导方针,请标记为不适当。gydF4y2Ba