摘要
患有短肠综合征(SBS)的儿童患肠衰竭相关肝病(IFALD)的风险很高。这项回顾性随访研究的目的是比较停用肠外营养(PN)和IFALD在坏死性小肠结肠炎(NEC)和非NEC诱导的SBS之间的差异。我们共纳入77例经多学科肠衰竭治疗的新生儿SBS患者(NEC患者38例,非NEC患者39例),随访至少2年,直到中位年龄10岁(四分位数范围6.0-16)。通过中位年龄3.2(1.0-6.7)岁(n = 62)的肝脏活检和血清肝脏生化评估IFALD的发生和特征。总体而言,与非NEC患者相比,NEC患者的空肠末端造口术和自体肠重建手术较少(< 0.05),而其余小肠解剖结构在组间具有可比性。NEC患者累计断PN频率更高,PN持续时间更短(P < 0.05)。在整个随访期间(P = 0.052)和10年(P = 0.024), NEC患者组织学IFALD的总体累积概率较低。NEC患者末次随访时ALT和GGT水平较低(P均< 0.05)。在单因素Cox回归分析中,无空肠末端造口术、NEC诊断、剩余小肠长度较长、多学科治疗和早产是断奶PN的预测因素,而NEC诊断和低出生体重以及多学科护理可以避免组织学IFALD。NEC诱发SBS的新生儿比非NEC SBS的新生儿更早达到肠内自主,这与长期幸存者中组织学IFALD的更有效解决有关。
简介
在短肠综合征(SBS)中,功能性肠道质量的广泛损失导致肠衰竭(IF)和长期肠外营养(PN)依赖1.小儿SBS多由坏死性小肠结肠炎(NEC)引起,主要影响早产儿和低出生体重儿,其次为中肠扭转、胃裂、肠闭锁和扩展型巨结肠1.患有SBS的早产儿,特别是患有NEC的早产儿,患胆汁淤积和肠衰竭相关肝病(IFALD)的风险增加。2,3..在最近的一项研究中,超过20%的生化胆汁淤积性NEC手术患者死亡4在中位年龄为5岁的约50%的儿科SBS患者中存在显著的组织病理学IFALD5.
早产不仅会损害肝功能,还会损害其对SBS新生儿所暴露的许多IFALD危险因素的反应能力6.这些危险因素包括PN延长,中线和肠脓毒症发作率高,缺乏肠内饲料和肠肝循环中断1,5.未成熟的肝脏降低了管状运输和胆汁酸解毒能力,加上对脂质过氧化和全身感染的易感性增加,易使早产儿肝损伤6,7,8.肠道炎症、肠道屏障功能受损、细菌易位和门脉血流量受损可能进一步增加NEC患者发生肝脏疾病的风险9.另一方面,早期实现肠内自主可能保护NEC患者避免进展性IFALD10.
NEC诱导的新生儿SBS的长期肝脏结局仍有待研究。这项回顾性比较随访研究的目的是评估NEC引起的儿童SBS的长期生化和肝脏组织病理学结果。我们假设,与儿童SBS的其他病因相比,NEC引起的SBS由于不成熟肝脏的脆弱性,与组织病理学IFALD恢复较慢有关。
方法
道德
本研究已获得赫尔辛基大学医院(芬兰赫尔辛基)伦理委员会的伦理批准。所有实验均按照相关指南和规定进行。获得所有患者和/或其法定监护人的知情同意。
患者与研究设计
研究回顾了赫尔辛基大学医院儿童医院治疗的所有儿童IF患者,并确定了1988年至2018年出生的SBS患者。SBS定义为连续60天以上需要PN和/或手术切除50%年龄调整后的小肠11.所有患者均接受了肠切除术,未接受手术治疗的NEC患者不包括在研究中。总体而言,确定了78例SBS患者,其中77例纳入了可用的随访数据(表2)1).其中62例患者进行了肝活检。以NEC为基础病因的患者(NEC-SBS n = 38)与其他原因的SBS患者(非NEC-SBS n = 39)进行比较。SBS的其他原因包括中肠扭转(n = 13)、小肠闭锁(n = 9)、扩张性巨结肠病(n = 8)、闭锁合并胃裂(n = 6)和孤立性胃裂(n = 3)。
数据从2010年开始前瞻性收集,并在2010年之前回顾性收集(最后随访日期为2010年之前的4例患者)。自2009年以来,我中心开展了包括现代含脂乳剂鱼油、抗菌导管锁、自体重建(AIR)手术(系列横肠成形术,STEP,纵向肠延长和定制,LILT)、肠移植在内的规范化多学科管理和随访项目11,12.如前所述,在我们的IF康复计划中,肝活检通常用于评估IFALD5.
从患者记录中收集临床数据,包括胎龄和体重、剩余肠的解剖结构、手术步骤和PN持续时间(从开始到断奶)。记录出生至随访期间血培养阳性脓毒症发作次数。年龄调整小肠和结肠长度百分比根据公布的年龄特定正常值计算13,14.随访持续到2020年底,允许在2018年研究纳入期结束后对每位患者进行至少两年的随访。随访数据收集于最近一次随访(n = 70)或肠移植前最后一次随访(n = 2)或死亡前(n = 5)。
血清生化
在一夜禁食后抽取血样。采用标准医院实验室方法分析丙氨酸转氨酶(ALT)、天门冬氨酸转氨酶(AST)、谷氨酰转移酶(GGT)、总胆红素和结合胆红素、血小板计数和胆汁酸。计算APRI指数[(AST/正常上限)× 100 /血小板计数(109/ L)]15.血清瓜氨酸是肠肠细胞质量的标志,使用自动氨基酸分析仪(Biochromon 30 Physiological and Midas Autosampler, Biochromon Limited, Cambridge, England)进行测量,如前所述16.
肝脏活检和组织病理学
核心肝穿刺活检在全身麻醉下超声引导下进行诊断或在监测肠内窥镜或计划开腹期间进行随访5,17.如前所述,当先前的活检显示异常和可能进展的组织病理学时,进行随访肝活检5.两名经验丰富的儿童肝脏病理学家根据标准化的组织病理学方案对肝活检进行了分析5,17.由于肝活检中位有15(5-22)个门静脉区,因此被认为具有代表性。活检对胆汁淤积进行评分(0 - 3级;无,轻微,有标记,明显),门脉炎症(0 ~ 4级;如前所述,不存在,轻微,轻度,中度,显著),脂肪变性(0至3级;< 25%,25-50%,> 50%的肝细胞受累)和纤维化(Metavir阶段从0到4)5.IFALD定义为肝活检发现的任何异常,包括胆汁淤积、门脉炎症、纤维化或脂肪变性。活动性IFALD定义为存在组织学胆汁淤积和/或门静脉炎症,慢性IFALD定义为存在Metavir纤维化≥2期和/或脂肪变性≥2级,无胆汁淤积或炎症5.
统计分析
采用IBM SPSS统计,版本25进行数据分析。除非另有说明,所有结果均以四分位差(IQR)的中位数表示。采用Mann-Whitney u检验和Fisher精确检验比较两组间的统计学差异。使用Kaplan-Meier对数秩生存分析来评估IFALD的累积发生和PN脱机。用单因素和多因素Cox回归分析了断PN和存在组织病理学IFALD的预测因素。p值< 0.05为有统计学意义。
结果
患者特征与生存
患者特征见表1.如预期的那样,NEC患者的胎龄和出生体重明显较低。总的来说,23例患者接受了AIR手术,非nec组的手术频率明显更高,2例非nec的扩张性巨结肠患者接受了肠移植。总生存率为94%,组间具有可比性(表1).死亡原因为脓毒症(1例NEC患者,2例非NEC患者)和IFALD(2例非NEC患者),均发生在2008年之前。从出生到随访,两组间血培养阳性脓毒症发作数无明显差异,而非nec患者在2009年之前开始治疗的比例较高(表2)1).
剩余肠解剖
如表所示1,非nec组以空肠-结肠吻合术为代价进行空肠末端吻合术的比例显著高于非nec组(23% vs. 2.6%, P = 0.014),而空肠-回肠-结肠吻合术的比例具有可比性(51% vs. 50%, P = 1.000)。其余绝对长度和年龄调整后的小肠长度、剩余结肠的比例、回盲瓣的存在和第一次可用的血清瓜氨酸水平在两组间无显著差异。
PN的依赖
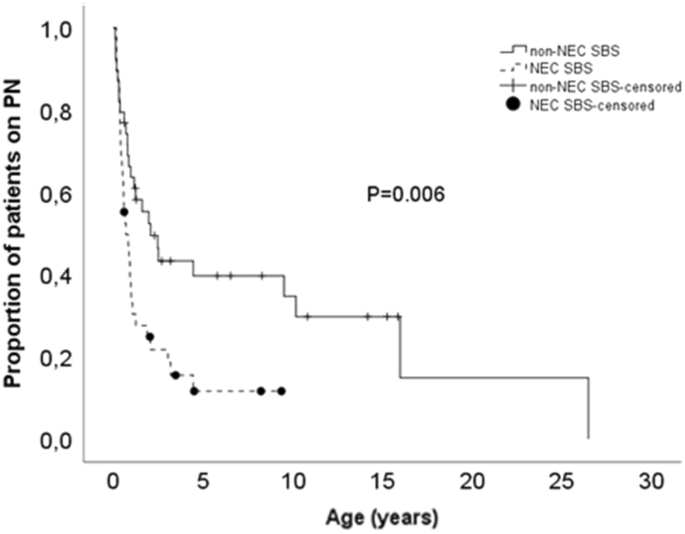
与非NEC患者相比,NEC患者更有效地戒断PN,如图Kaplan Meier分析所示。1.最少随访2年后,74%的NEC患者(95%CI 0.747-1.186)和49%的非NEC患者(95%CI 1.120-1.591)停用了PN (P = 0.021)。PN开始后5年和10年的数据分别为84% (95%CI 0.280-1.112)和59% (95%CI 0.352-3.789;P = 0.009)和84% (95%CI 0.280-1.112)和67% (95%CI 0.352-3.785;P = 0.012)。NEC组停用PN的中位时间为0.7年(95%CI 0.3-1.1),而非NEC- sbs组为2.1年(95%CI 0.9-3.3) (P = 0.006)。
在PN开始后5年停用PN的单因素Cox回归分析中,NEC的诊断、较长的剩余年龄调整小肠长度、无空肠末端造瘘、2009年实施标准化多学科管理和随访计划后开始IF治疗以及较低的胎龄都是停用PN的预测因素(表2)2).在多因素Cox回归模型中,存在空肠末端造口术和较短的小肠长度仍然是延长PN依赖的显著危险因素(表2)2).
肝脏疾病
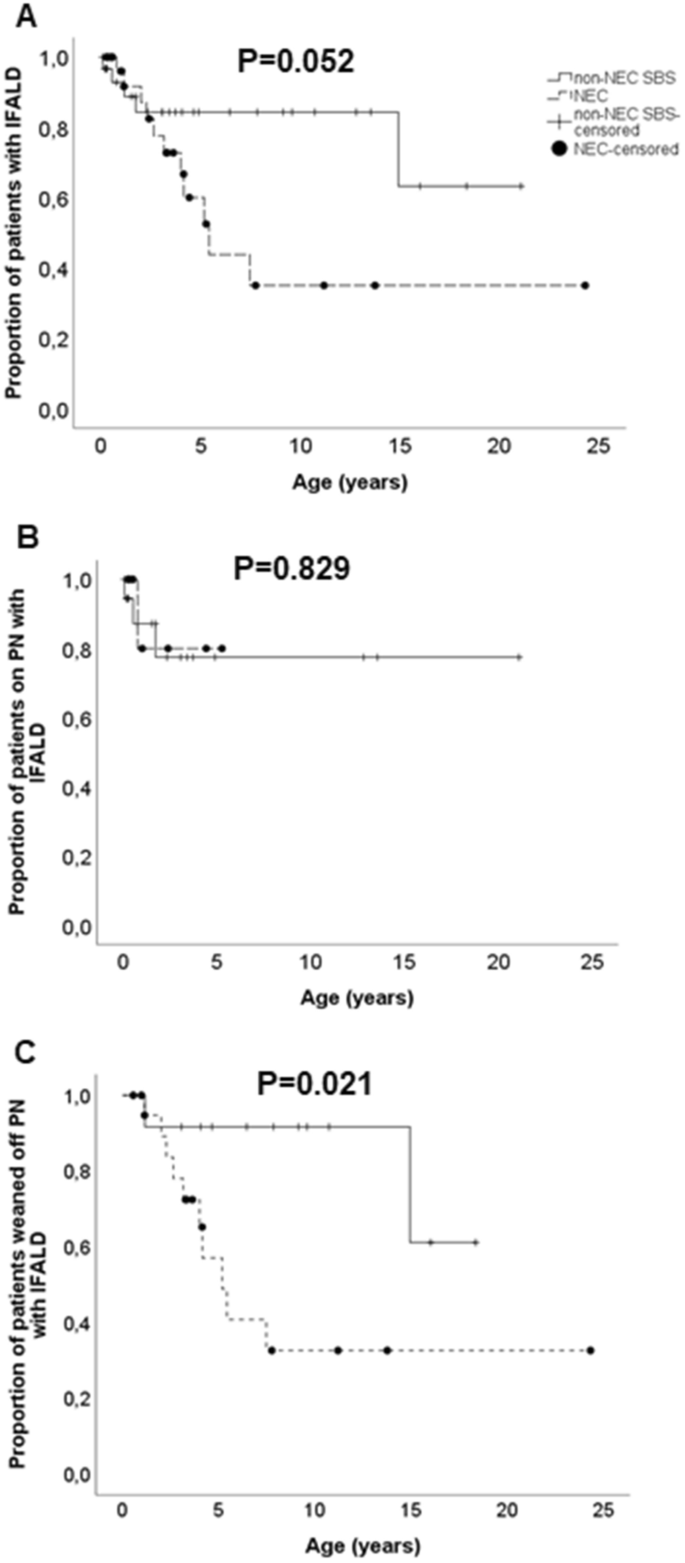
共有62例患者进行了肝活检3.).NEC组肝活检年龄中位数为3.2(1.0 ~ 5.2)岁,非NEC组为3.7(0.8 ~ 9.6)岁(P = 0.578)。在65%的NEC患者和84%的非NEC患者中发现了IFALD的任何组织病理学征象,其定义为肝活检中存在胆汁淤积、门脉炎症、纤维化或脂肪变性(P = 0.146)3.).虽然非nec患者门静脉炎症、纤维化和脂肪变性的发生率和分级较高,但差异无统计学意义(表2)3.).
与非NEC SBS患者相比,NEC患者在随访期间组织学IFALD的累积发生率较低,因此组织学IFALD在NEC患者中较早解决(图2)。2).10年时,组织学IFALD的NEC患者和非NEC患者的比例分别为37% (95%CI 4.259-7.384)和87% (7.297-9.865,P = 0.024)。在PN依赖的患者中,组织学上的IFALD的发生在两组之间是相当的,NEC组早期停用PN可以更快地实现肝脏组织学的正常化(图2)。2).在单因素Cox回归分析中,包括当前PN依赖、PN持续时间、胎龄、出生体重、剩余年龄调整小肠长度、是否存在空肠末端造口、2009年实施标准化多学科管理和随访计划前开始IF治疗和基础诊断,非nec诊断、出生体重高和2009年之前开始IF治疗预测10年出现组织学IFALD(表2)4).在多变量模型中,只有2009年之前开始治疗仍有显著性(表4).
在随访结束时测定肝脏生物化学值1).尽管25-29%的患者转氨酶水平升高,16%的患者GGT水平升高,12%的患者胆红素水平升高,但两组患者转氨酶水平的中位数均在正常范围内1).与NEC患者相比,非NEC患者的中位ALT和GGT水平显著高于NEC患者(表2)1).PN依赖患者的ALT [62 (33-145) vs. 31 (21-44), P = 0.005]、AST [51 (37-237) vs. 40 (33-48), P = 0.010)和GGT [52 (29-101) vs. 15 (11-46), P = 0.001]高于停用PN的患者。
讨论
据我们所知,这是首批评估新生儿SBS中组织病理学IFALD与肠内自主恢复之间长期发生关系的研究之一。我们的研究结果表明,与其他潜在病因导致的SBS新生儿相比,NEC诱导的SBS新生儿更早地放弃PN。在NEC诱导的SBS中,肠内自主的有效恢复与随访结束时组织学肝损伤的更快解决和较低的ALT和GGT水平相关。
根据我们的研究结果,NEC先前已被证明可以预测SBS患儿早期实现肠内自主18,19.在我们的研究中,74%和84%的NEC-SBS患者停止PN 2年和5年,而非nec患者则分别为49%和59%。Sparks等人报道,在中位随访4.3年后,65%的NEC SBS患儿达到肠内自主,而非NEC患儿为29%10.与SBS的其他基础诊断相反,NEC患者即使在36个月后也继续以与前12个月相似的速度戒掉PN10,18.
在目前的研究中,NEC诊断、无空肠末端造口术、剩余小肠较长、2009年后多学科治疗和早产(低胎龄和低体重)独立预测了断奶PN。与其他SBS患者相比,NEC患者早产发生率更高,结肠造口末端发生率更低,而血清瓜氨酸浓度以及小肠长度、剩余结肠比例和有无ICV等肠道解剖结构的其他关键特征在两组间具有相似性。总的来说,这些发现表明,早产儿和肠连续性几乎一致的建立基本上有助于NEC患者较其他患者更早地实现肠内自主。在NEC患者中,AIR手术和肠道移植也较少,表明他们其余肠道的功能状态更好。患有SBS的早产儿被认为具有更强的适应能力,因为与足月婴儿相比,剩余肠道的生长潜力更大13.这有助于肠内耐受和吸收,促进肠内自主的早期实现18,20.,21.重建肠道连续性对于达到肠内自主的重要性是公认的1,22.双肠造瘘SBS患者食糜回输至剩余回肠和结肠可促进粘膜健康,改善营养吸收,缩短PN时间,缓解胆汁淤积,恢复胆汁酸代谢22,23,24.
与我们最初的假设相反,我们的主要新发现是,在NEC诱导的SBS患者的最新随访中,组织学IFALD的消退发生得更早,并与较低的血清ALT和GGT水平相关。血清GGT水平升高与肝内胆汁淤积和/或炎症有关5.在Cox回归分析中,SBS的NEC病因、低出生体重和2009年后的多学科治疗预测了随访期间组织学IFALD的解决。尽管NEC患者在SBS早期出现胆汁淤积和生化肝功能障碍的风险增加2,3.,25早期停用PN可使肝损伤恢复更快,而在PN分娩期间,两组发生组织学IFALD的频率相似。我们的研究结果证实,实现肠内自主是预防和管理IFALD的有效方法20.,25.在随访结束时,约30%的患者血清肝脏生化水平升高,最常见的是ALT值,但两组中肝脏组织正常化的比例要小得多,包括胆汁淤积、门静脉炎症、纤维化或脂肪变性。因此,在先前的一项关于SBS患儿的研究中,超过三分之一的患者血清ALT水平仍然升高,其中包括那些在中位随访3.8年后停用PN的患者26.这些发现强调了进一步研究的必要性,以揭示断PN后IFALD的意义和发病机制。
以前已经认识到多学科IF护理的好处12,27.因此,自2009年以来,我们的多学科IF康复计划的实施与SBS新生儿实现肠内自主和IFALD解决的改善结果相关。从这项回顾性研究中,很难确定我们重新定义的管理方案的哪些具体组成部分主要有助于这些结果的改善,但引入含肠外脂类的鱼油,有效预防败血症发作以及专用的多学科方法可能是最重要的因素之一27,28,29,30..在本研究中,非NEC SBS患者在2009年之前开始治疗的频率更高,这可能对这些患者相对于NEC患者的长期预后产生了负面影响。我们的研究也受到回顾性设计和患者数量相对较少的限制。尽管广泛的纳入期可能改变了我们的结果,但两组患者的肝活检年龄相似,其中绝大多数是在2009年治疗标准化后进行的。由于缺乏成对的肝活检,我们无法处理个别患者的纵向变化,而不得不依赖于组织学IFALD解决的生存曲线估计。
总之,我们的研究表明NEC诱导的SBS新生儿比非NEC SBS新生儿更早达到肠内自主。较早实现肠内自主和标准化多学科护理与较早解决组织学IFALD相关。
数据可用性
数据可由Annika Mutanen博士索取,annika.mutanen@hus.fi,儿童外科,儿童肝脏和肠道研究小组,儿童研究中心,赫尔辛基大学新儿童医院和赫尔辛基大学医院,Stenbackinkatu 9, PO Box 34700029 HUS,芬兰赫尔辛基。
缩写
- 空气:
-
自体重建(AIR)手术
- ALT:
-
丙氨酸转氨酶
- AST:
-
天冬氨酸转氨酶
- GGT:
-
谷氨酰转移酶
- 如果:
-
肠衰竭
- IFALD:
-
肠道衰竭相关的肝病
- 轻快的动作:
-
纵肠加长剪裁
- NEC公司:
-
坏死性小肠结肠炎
- SBS:
-
短肠综合症
- 步骤:
-
连续横肠成形术
参考文献
Duggan, C. P. & Jaksic, T.小儿肠衰竭。心血管病。j .地中海。377, 666年。https://doi.org/10.1056/NEJMra1602650(2017)。
杜罗,D。et al。坏死性小肠结肠炎婴儿肠衰竭的危险因素:Glaser儿科研究网络研究。j . Pediatr。157, 203年。https://doi.org/10.1016/j.jpeds.2010.02.023(2010)。
杜罗,D。et al。坏死性小肠结肠炎手术治疗后肠外营养相关肝病的危险因素:Glaser儿科研究网络研究[更正]。j . Pediatr。杂志。减轻。52, 595 - 600。https://doi.org/10.1097/MPG.0b013e31820e8396(2011)。
Karila, K., Anttila, A., Iber, T., Pakarinen, M. & Koivusalo, A.手术坏死性小肠结肠炎和自发性肠穿孔中肠衰竭相关胆汁淤滞。j . Pediatr。杂志。54, 460-464(2019)。
Mutanen, A., Lohi, J., Merras-Salmio, L., Koivusalo, A. & Pakarinen, M. P.儿童肠衰竭组织病理学肝病活动性的预测、识别和进展。j .乙醇。74, 593 - 602。https://doi.org/10.1016/j.jhep.2020.09.023(2021)。
早产儿胆汁淤积症。中国。Perinatol。47, 341 - 354。https://doi.org/10.1016/j.clp.2020.02.009(2020)。
陈海林。et al。人肝脏小管转运蛋白基因的发育表达。j .乙醇。43, 472-477(2005)。
七弦琴,J。et al。由于半胱氨酸酶缺乏,早产儿的l -半胱氨酸和谷胱甘肽代谢受损。点。j .中国。减轻。61, 1067 - 1069。https://doi.org/10.1093/ajcn/61.4.1067(1995)。
Eaton, S, Rees, C. M. & Hall, N. J.目前关于坏死性小肠结肠炎流行病学、发病机制和治疗的研究。新生儿学111, 423 - 430。https://doi.org/10.1159/000458462(2017)。
斯帕克斯,e。et al。坏死性小肠结肠炎与短肠综合征患儿早期实现肠内自主有关。j . Pediatr。杂志。51, 92 - 95。https://doi.org/10.1016/j.jpedsurg.2015.10.023(2016)。
Merras-Salmio, L。et al。小儿肠衰竭- 1984-2017年在国家三级转诊中心治疗的前100名患者的关键结果。j .父母。肠内减轻。在新闻(2018)。
meras - salmio, L. & Pakarinen, M. P.改良的基于多学科方案的短肠综合征治疗方法改善了预后。j . Pediatr。杂志。减轻。61, 24岁。https://doi.org/10.1097/mpg.0000000000000775(2015)。
Struijs, m.c., Diamond, i.r., de Silva, N. & Wales, P. W.建立儿童肠道长度标准。j . Pediatr。杂志。44, 933年。https://doi.org/10.1016/j.jpedsurg.2009.01.031(2009)。
米切尔,j.e.。et al。结肠影响回肠切除腹泻。挖。说,科学。25, 33-41。https://doi.org/10.1007/bf01312730(1980)。
Wai, c.t。et al。一个简单的非侵入性指标可以预测慢性丙型肝炎患者明显的纤维化和肝硬化。肝脏病学38, 518(2003)。
Mutanen,。et al。小儿原发性肠衰竭患者血清FGF21随肝脏脂肪积累而增加。j .乙醇。60, 183 - 190。https://doi.org/10.1016/j.jhep.2013.09.003(2014)。
Mutanen,。et al。小儿肠衰竭断肠外营养后持续异常肝纤维化。肝脏病学58, 729 - 738。https://doi.org/10.1002/hep.26360(2013)。
Demehri, F. R。et al。小儿短肠综合征的肠内自主:诊断后一年的预测因素。j . Pediatr。杂志。50, 131 - 135。https://doi.org/10.1016/j.jpedsurg.2014.10.011(2015)。
可汗,f.a。et al。肠衰竭患儿肠内自主的预测因素:一项多中心队列研究。j . Pediatr。167, 29岁。https://doi.org/10.1016/j.jpeds.2015.03.040(2015)。
贾维德,p。J。et al。肠内营养在逆转婴儿肠外营养相关肝功能障碍中的作用。j . Pediatr。杂志。40, 1015 - 1018。https://doi.org/10.1016/j.jpedsurg.2005.03.019(2005)。
富勒顿b.s.。et al。小儿肠衰竭患者的肠内自主、肝硬化和长期无移植生存。j . Pediatr。杂志。51, 96 - 100。https://doi.org/10.1016/j.jpedsurg.2015.10.027(2016)。
刘爱琴,冯爱琴,黄佳琪,谭柏琪。粘膜瘘再喂食对坏死性小肠结肠炎新生儿小肠造口术的有益影响。j . Pediatr。杂志。51, 1914 - 1916。https://doi.org/10.1016/j.jpedsurg.2016.09.010(2016)。
Picot, D., Layec, S., Dussaulx, L., Trivin, F. & Thibault, R.因临时双肠造瘘导致肠衰竭患者食糜回输:转诊中心15年前瞻性队列研究中国。减轻。36, 593 - 600。https://doi.org/10.1016/j.clnu.2016.04.020(2017)。
科尔法特,k.v.k。et al。食糜回输恢复肠衰竭患者的调节胆盐- fgf19轴。肝脏病学74, 2670 - 2683。https://doi.org/10.1002/hep.32017(2021)。
蒂尔曼,E. M.,诺曼,J. L.,黄,E. Y.,拉扎尔,L. F. & Crill, C. M.坏死性小肠结肠炎患儿在实施喂养指南前后肠外营养相关肝病的评估。减轻。中国。Pract。29, 234 - 237。https://doi.org/10.1177/0884533614522834(2014)。
Keefe, G。et al。保肝性肠外营养时代小儿肠衰竭患者胆红素和转氨酶趋势的长期评估。j . Pediatr。杂志。57, 122 - 126。https://doi.org/10.1016/j.jpedsurg.2021.09.018(2022)。
梅里特,r.j.。et al。肠道康复计划在小儿肠衰竭和短肠综合征治疗中的应用。j . Pediatr。杂志。减轻。65, 588 - 596。https://doi.org/10.1097/mpg.0000000000001722(2017)。
Melendez, M. & Yeh, D. D.探索儿童和成人患者肠衰竭相关肝病的长期危险因素:脂质注射乳剂在肝病发展中的作用减轻。中国。Pract。https://doi.org/10.1002/ncp.10824(2022)。
Khalaf, R. T. & Sokol, R. J.对儿童肠衰竭相关肝病的新见解。肝脏病学https://doi.org/10.1002/hep.31152(2020)。
Vernon-Roberts, A., Lopez, R. N., Frampton, C. M. & Day, A. S.对牛磺酸在减少接受肠外营养患者导管相关血流感染疗效的meta分析。帕尔特。肠内减轻。https://doi.org/10.1002/jpen.2363(2022)。
资金
这项工作由Sigrid Jusélius基金会(MPP)和芬兰儿科研究基金会(MPP)资助。资金来源没有参与研究、研究设计、收集、分析或解释数据、准备文章或决定提交文章发表。
作者信息
作者及隶属关系
贡献
概念化,学院;设计,A.M.和M.P.P.;采办和分析,副总裁和mpp;起草了第一份手稿,A.M.;修改了手稿,a.m., r.g., l.m.s., M.P.P.所有审阅过的作者都批准了提交的手稿版本。
相应的作者
道德声明
相互竞争的利益
作者声明没有利益竞争。
额外的信息
出版商的注意
施普林格自然对出版的地图和机构从属关系中的管辖权主张保持中立。
补充信息
权利和权限
开放获取本文遵循知识共享署名4.0国际许可协议,允许以任何媒介或格式使用、分享、改编、分发和复制,只要您对原作者和来源给予适当的署名,提供知识共享许可协议的链接,并注明是否有更改。本文中的图像或其他第三方材料包含在文章的创作共用许可协议中,除非在材料的信用额度中另有说明。如果材料未包含在文章的创作共用许可协议中,并且您的预期使用不被法定法规所允许或超出了允许的使用范围,您将需要直接获得版权所有者的许可。如欲查看本牌照的副本,请浏览http://creativecommons.org/licenses/by/4.0/.
关于本文
引用本文
穆塔宁,A., Pöntinen, V.,加纳,R.。et al。在坏死性小肠结肠炎诱导的短肠综合征中,有效实现肠内自主有助于肝损伤的解决。Sci代表12, 17516(2022)。https://doi.org/10.1038/s41598-022-22414-7
收到了:
接受:
发表:
DOI:https://doi.org/10.1038/s41598-022-22414-7