摘要gydF4y2Ba
炎症性肠病(IBD)发病率呈上升趋势;因此,有效的治疗是有必要的。人碳酸酐酶I (hCA I)在IBD中的治疗作用仍然未知。因此,我们研究了口服耐受hCA I是否会在体内诱导抗肠道炎症的抗原特异性保护。重度联合免疫缺陷小鼠口服hCA I, keyhole limpet hemocyanin (KLH)或磷酸盐缓冲盐水(PBS) 7天。在细胞转移后4周收集结肠和肠系膜淋巴结(mln)。此外,还研究了治疗效果的机制。比较成熟药物与hCA I口服给药的疗效。口服hCA I明显改善结肠炎。hCA I到达盲肠,比美沙拉嗪和强的松龙更有效地改善结肠炎。 Compared with PBS treatment, hCA I treatment reduced interleukin (IL)-17a, IL-6, and retinoic acid-related orphan receptor gamma t (RORγt) expression in the colon or MLNs; moreover, hCA I markedly reduced IL-6, IL-17, and interferon-gamma (IFN-γ) levels in the MLN. Oral administration of hCA I induced immune tolerance and suppressed colitis in vivo. Thus, hCA I administration could be proposed as a new treatment option for IBD.
简介gydF4y2Ba
炎症性肠病(IBD),包括溃疡性结肠炎(UC)和克罗恩病(CD),是胃肠道的慢性炎症性疾病,通常发生在暴露于某些危险因素的遗传易感人群中gydF4y2Ba1gydF4y2Ba.这些与环境因素共同发展的疾病病例每年都在增加,正成为一项社会挑战gydF4y2Ba2gydF4y2Ba,gydF4y2Ba3.gydF4y2Ba.然而,IBD的发病机制尚不完全清楚。gydF4y2Ba
近年来,无论是抗tnf -α、JAK抑制剂、α4β7整合素抑制剂、白介素(IL)-12和IL-23 p40亚单位抑制剂等生物治疗方法,还是疾病控制率均有整体提高。然而,现有的药物仍然会引起一些副作用gydF4y2Ba4gydF4y2Ba,gydF4y2Ba5gydF4y2Ba.据报道,IBD,特别是CD和UC的靶向治疗对改善长期预后很重要。此外,这种方法对于更好地了解病情并允许基于个体和发病时间进行治疗是必要的gydF4y2Ba6gydF4y2Ba,gydF4y2Ba7gydF4y2Ba.从这个角度来看,迫切需要副作用小的治疗方案。gydF4y2Ba
对共生细菌、自身抗原以及各种微生物产品和食品的不受控制的先天和适应性免疫反应是IBD的病因因素gydF4y2Ba8gydF4y2Ba.既往研究证实,粪便提取物盲肠细菌抗原(CBA)与其病因有关gydF4y2Ba9gydF4y2Ba,gydF4y2Ba10gydF4y2Ba.我们之前已经确定碳酸酐酶I (CA I;261个氨基酸,AA;29千道尔顿)是CBA的主要蛋白质,也是参与诱导免疫反应的抗原gydF4y2Ba11gydF4y2Ba.在胃肠道内,CA I仅在结肠中表达,并在酸碱平衡、pH调节和CO中发挥核心作用gydF4y2Ba2gydF4y2Ba运输gydF4y2Ba12gydF4y2Ba.此外,CA I在小鼠模型和UC患者的实验性结肠炎活动期表达降低,而在缓解期表达升高gydF4y2Ba13gydF4y2Ba.因此,我们认为CA I表达的降低可能与疾病活动有关。我们之前报道过口服小鼠CA I (mCA I)通过抗原特异性免疫耐受改善小鼠模型中的IBDgydF4y2Ba14gydF4y2Ba.此外,我们提供了mCA I表位可以驱动免疫耐受的证据,并证明了在IBD小鼠模型中,调节树突状细胞与mCA I肽(DCregsCA I肽)脉冲诱导抗原特异性保护以对抗结肠炎gydF4y2Ba15gydF4y2Ba.口腔耐受性在各种疾病中都有报道gydF4y2Ba16gydF4y2Ba.然而,由于人类和小鼠具有不同的AA序列,确定人源化蛋白的治疗效果对于临床应用至关重要。在本研究中,我们研究了使用人CA I (hCA I)作为免疫治疗方法的口服免疫,并评估了其在小鼠结肠炎模型中的疗效。此外,我们还比较了hCA I与现有药物的治疗效果。gydF4y2Ba
结果gydF4y2Ba
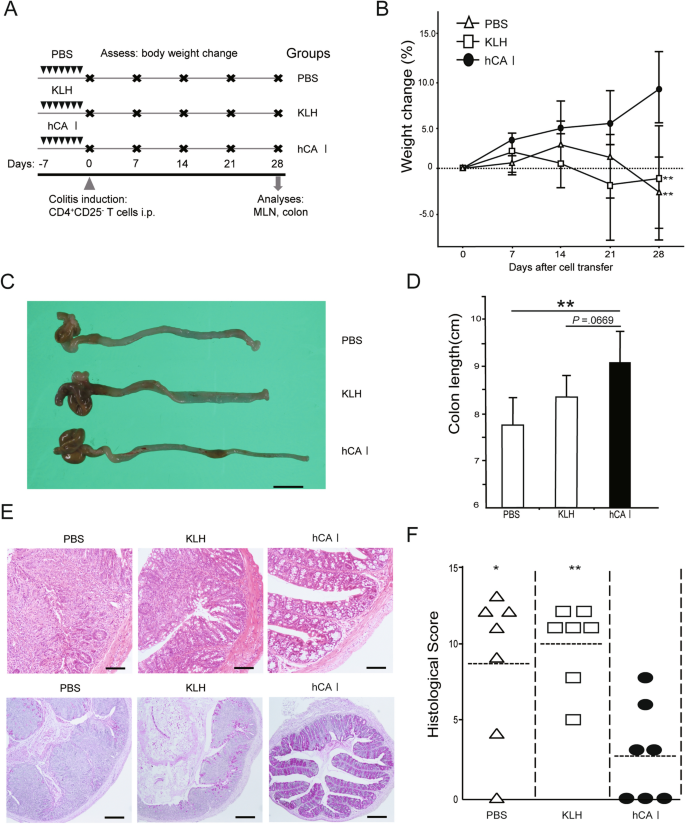
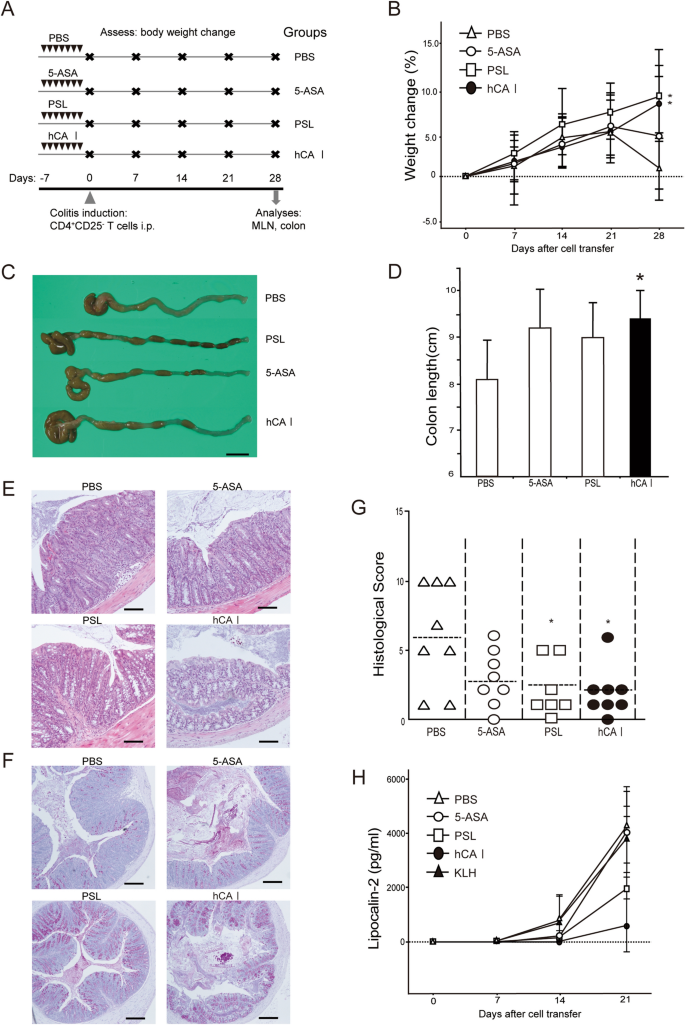
使用hCA I口服增敏可改善小鼠模型实验性结肠炎gydF4y2Ba
我们之前提供的证据表明,口服mCA I抗原对右旋糖酐硫酸钠(DSS)模型肠炎和CD4有抑制作用gydF4y2Ba+gydF4y2BaCD25gydF4y2Ba−gydF4y2BaT细胞转移模型小鼠gydF4y2Ba14gydF4y2Ba.为了评估口服CA I在免疫治疗中的临床应用,制备了hCA I,并进行了进一步的实验(补充图。gydF4y2BaS1gydF4y2Ba).我们分析了使用hCA I的口服增敏是否可以改善CD4的炎症水平gydF4y2Ba+gydF4y2BaCD25gydF4y2Ba−gydF4y2Ba结肠炎T细胞转移模型。小鼠给予hCA I,如“gydF4y2Ba方法gydF4y2Ba”(无花果。gydF4y2Ba1gydF4y2BaA). KLH是一种长期以来备受关注的口服免疫耐受诱导蛋白gydF4y2Ba17gydF4y2Ba;然而,它在IBD患者(CD和UC)中尚未临床有效。gydF4y2Ba18gydF4y2Ba.因此,将KLH作为对照蛋白用于评估免疫耐受。小鼠的日常饮食包括含有蛋白质的正常饮食。我们评估了体重变化,并证明与PBS和klh治疗组相比,hCA i治疗组在结肠炎诱导4周后体重减轻最小(gydF4y2BaPgydF4y2Ba< 0.01;无花果。gydF4y2Ba1gydF4y2BaB).细胞转移四周后,hCA I处理小鼠的结肠长度明显大于pbs处理小鼠(gydF4y2BaPgydF4y2Ba< 0.01;无花果。gydF4y2Ba1gydF4y2BaC和D)。组织学检查显示,结肠炎的特征是炎症细胞大量浸润,隐窝延伸和变性,上皮细胞增生,杯状细胞耗损,这些在hCA I组中均被抑制,甚至在细胞转移后4周。KLH-和pbs治疗小鼠注射CD4gydF4y2Ba+gydF4y2BaCD25gydF4y2Ba−gydF4y2BaT细胞经历了严重的结肠炎。hCA I治疗小鼠的组织学评分明显低于KLH或pbs治疗小鼠(gydF4y2BaPgydF4y2Ba< 0.05;无花果。gydF4y2Ba1gydF4y2BaE、F)。gydF4y2Ba
使用hCA I口服耐受性保护小鼠实验性结肠炎。(gydF4y2Ba一个gydF4y2Ba)实验方案(见“gydF4y2Ba方法gydF4y2Ba”)。(gydF4y2BaBgydF4y2Ba) 0、7、14、21、28天体重随时间的相对变化(%)。CD4gydF4y2Ba+gydF4y2BaCD25gydF4y2Ba−gydF4y2BaT细胞(3 × 10gydF4y2Ba5gydF4y2Ba)转移模型小鼠(n = 7只/组)分别用PBS、KLH和hCA I处理,分别用三角形、正方形和黑圈表示。误差条表示SD。(gydF4y2BaCgydF4y2Ba)第28天结肠肉眼见。比例:10毫米(gydF4y2BaDgydF4y2Ba结肠炎小鼠第28天的结肠长度(n = 7)。(gydF4y2BaEgydF4y2Ba)第28天结肠组织学分析。PBS和klh处理的小鼠表现出炎症细胞浸润,粘膜高度显著增加,杯状细胞严重损失。口服hCA I改善了这些发现。高(H&E染色;原始刻度:100 μm)和低(周期性酸性席夫染色;原标度:200 μm)放大图。(gydF4y2BaFgydF4y2Ba)第28天组织学评分。横条:中位数。*gydF4y2BaPgydF4y2Ba< 0.05;**gydF4y2BaPgydF4y2Ba< 0.01(相对于hCA i处理的小鼠)。所示数据是两个独立实验的代表性数据。gydF4y2Ba
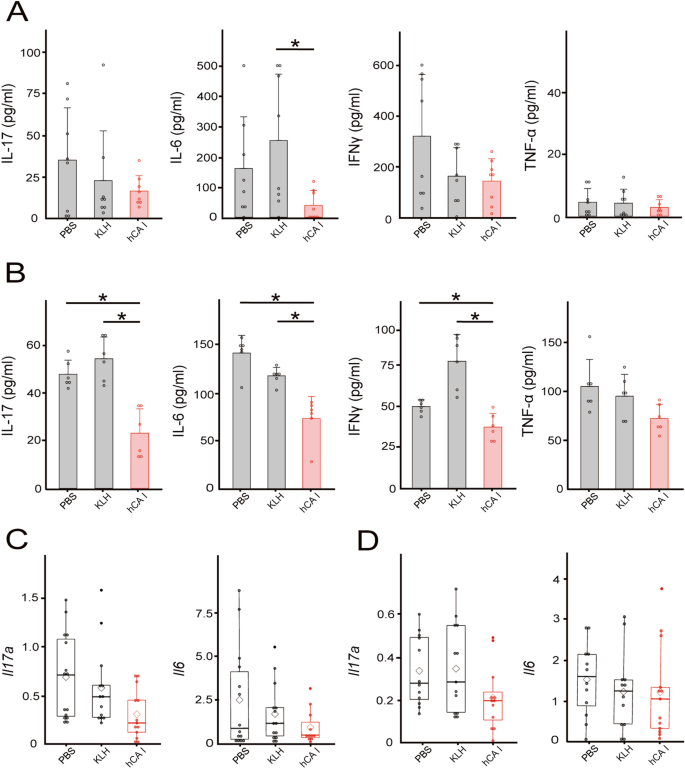
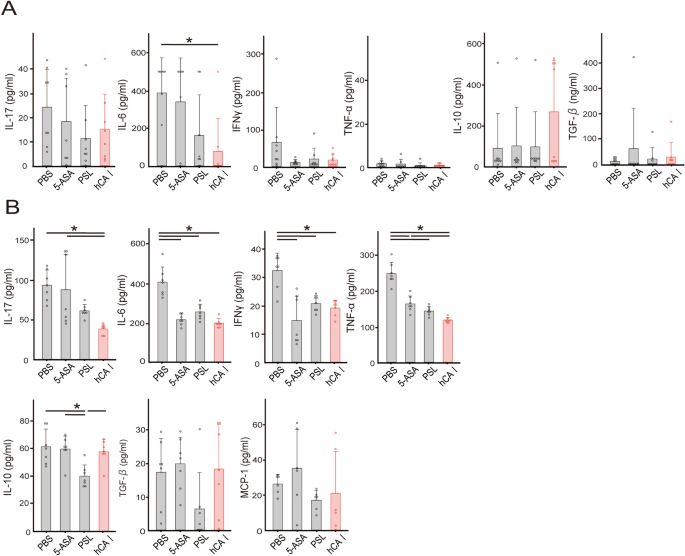
口服hCA I可降低炎症细胞因子反应gydF4y2Ba
我们之前已经澄清,口服mCA I可诱导炎症细胞因子(如IL-17、IL-6和TNF-α)的抗原特异性保护gydF4y2Ba14gydF4y2Ba.因此,我们决定研究人源化蛋白是否会表现出类似的反应。通过测量细胞因子在结肠和mln中的表达,研究口服hCA I改善T细胞转移模型中结肠炎的机制。结肠中IL-6的产生显著降低(图。gydF4y2Ba2gydF4y2BaA), IL-6、IL-17和IFN-γ的产生在mln中显著降低(gydF4y2BaPgydF4y2Ba< 0.05)。gydF4y2Ba2gydF4y2BaB)之后,成绩单也被评估。在hCA i处理的小鼠结肠中,IL-17A的表达呈下降趋势(gydF4y2BaPgydF4y2Ba= 0.0528)与pbs处理小鼠相比(图;gydF4y2Ba2gydF4y2BaC)。在mln水平上也有类似的趋势,但不显著(图。gydF4y2Ba2gydF4y2BaD)。gydF4y2Ba
在实验性结肠炎模型小鼠中,口服hCA I可抑制结肠和mln的炎症反应。CD4后四周gydF4y2Ba+gydF4y2BaCD25gydF4y2Ba−gydF4y2Ba转移T细胞和dc,收集结肠和mln。(gydF4y2Ba一个gydF4y2Ba)体外培养72h, ELISA法检测结肠;平均±SD 8只/组。(gydF4y2BaBgydF4y2BaMLN细胞分泌细胞因子浓度(1 × 10gydF4y2Ba6gydF4y2Ba),用PMA和离子霉素培养72 h, ELISA法测定;均数±SD 6只/组;*gydF4y2BaPgydF4y2Ba< 0.05。(gydF4y2BaCgydF4y2BaCD4后四周gydF4y2Ba+gydF4y2BaCD25gydF4y2Ba−gydF4y2Ba转移T细胞,实时RT-PCR检测结肠转录因子或细胞因子mRNA表达水平;平均±SD 14-15只/组。(gydF4y2BaDgydF4y2Ba)采用实时RT-PCR检测MLN细胞中转录因子或细胞因子mRNA的表达水平;白色菱形表示平均值,水平线表示中位数,直线表示12-13只/组小鼠的±SD。*gydF4y2BaPgydF4y2Ba< 0.05。gydF4y2Ba
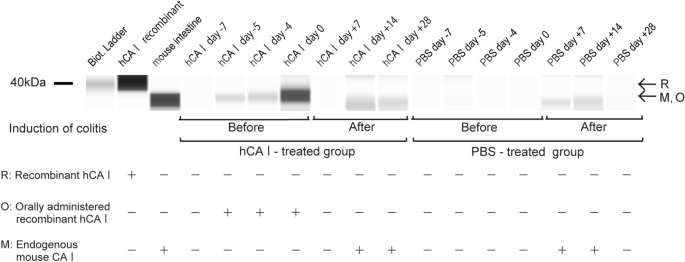
口服hCA I到达大肠gydF4y2Ba
为了阐明口服hCA I蛋白在体内的行为,首先,每天从hCA I组和PBS组的三只小鼠中收集粪便。随后,利用多克隆抗体从小鼠粪便中收集因结肠炎脱落的内源性mCA I或口服的hCA I蛋白。最后,用免疫印迹法测定各组粪便样本中CA I的含量(见“gydF4y2Ba方法gydF4y2Ba”)。在结肠炎诱导前,从口服hCA I组收集的粪便样本显示,与重组hCA I组相比,被肠激酶识别单元切割的蛋白带缩短了(图2)。gydF4y2Ba3.gydF4y2Ba;在产生含有肠激酶识别序列的重组蛋白后,我们能够证明粪便中含有的CA I没有被小鼠引起的溢出污染(补充图。gydF4y2BaS1gydF4y2Ba).相反,在阴性对照组(口服PBS前),蛋白带为阴性。在诱导结肠炎后,出现了一条从大肠上皮细胞脱落的mCA I蛋白带(图。gydF4y2Ba3.gydF4y2Ba;第7天,hCA I给药组小鼠的粪便中没有检测到mCA I,而PBS组小鼠的粪便中已经出现了mCA I条带。此外,在第28天,pbs处理组的链消失了,但hCA i处理小鼠的粪便中继续出现。这一结果表明,在PBS组结肠炎发展较早。此外,在结肠炎进展的第28天,PBS组肠道和粪便中的CA I含量均有所下降。通过分析免疫印迹结果,我们发现在hCA I和pbs处理的小鼠中都有许多非特异性条带和涂片。gydF4y2BaS2gydF4y2Ba为了确定这些条带是否代表本研究的粪便hCA I浓度,我们对同型对照和其他CA I抗体免疫沉淀的对照组进行了类似的实验,并证实检测到的CA I条带是特异性的(补充图。gydF4y2BaS2gydF4y2BaB, C)。gydF4y2Ba
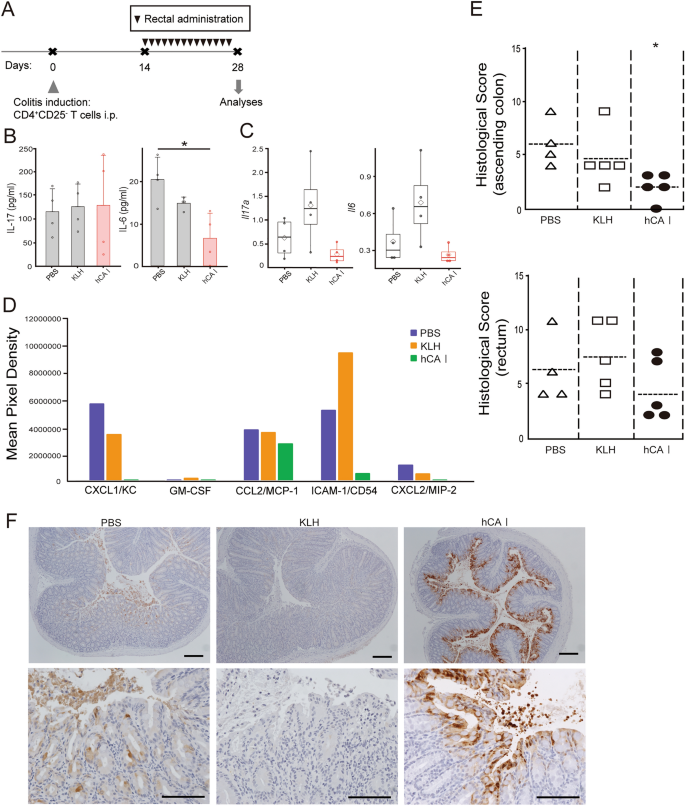
在慢性炎症期,hCA I直肠致敏抑制实验性结肠炎小鼠模型的结肠炎症gydF4y2Ba
由于大肠被上皮和粘液覆盖,我们进行了直肠给药实验,以阐明口服hCA I是在小肠还是在大肠中起作用。我们发现,在结肠炎症进展过程中,粪便中的CA I减少;因此,我们决定进一步研究在CA I减少期间直肠hCA I致敏是否能抑制结肠炎症。当用直肠给药管给小鼠注射200 μL靛靛胺染色的药物时,证实药物到达了升结肠(补充图。gydF4y2BaS3gydF4y2BaA)。根据口服给药,在诱导结肠炎前,每天给予hCA I、KLH和PBS,连续7天,结肠炎未见抑制(补充图。gydF4y2BaS3gydF4y2BaB, C)。接下来,我们进行了一项实验,在14-27天,当结肠炎症导致粪便中的CA I减少时,我们给直肠注射了hCA I(图2)。gydF4y2Ba4gydF4y2BaA)。在mln中,我们观察到促炎细胞因子的产生减少,与pbs处理的小鼠相比,IL-6有相当大的差异(图。gydF4y2Ba4gydF4y2BaB).因此,对成绩单进行评估。在hCA i处理小鼠的mln中,IL-17A和IL-6的表达呈下降趋势(gydF4y2BaPgydF4y2Ba分别为0.0741和0.0578)。gydF4y2Ba4gydF4y2BaC)。此外,细胞因子阵列用于研究直肠给药的hCA I是否作用于任何其他重要靶点以影响肠道。与其他组相比,hCA I组中参与结肠先天免疫和适应性免疫的细胞因子和趋化因子的表达趋于较低(图2)。gydF4y2Ba4gydF4y2BaD和补充图gydF4y2BaS4gydF4y2Ba).用hCA I治疗的小鼠结肠上升部分的组织学评分明显低于PBS治疗的小鼠(gydF4y2BaPgydF4y2Ba< 0.05;无花果。gydF4y2Ba4gydF4y2BaE)。结肠组织上升部分的免疫染色显示,在hCA I处理组中,上皮性CA I被保留(图。gydF4y2Ba4gydF4y2BaF)。gydF4y2Ba
在结肠炎诱导后直肠给药hCA I可抑制结肠炎的发展。(gydF4y2Ba一个gydF4y2Ba)实验方案(见“gydF4y2Ba方法gydF4y2Ba”)。CD4后四周gydF4y2Ba+gydF4y2BaCD25gydF4y2Ba−gydF4y2Ba转移T细胞,收集mln。(gydF4y2BaBgydF4y2BaMLN细胞分泌细胞因子浓度(1 × 10gydF4y2Ba6gydF4y2Ba),用PMA和离子霉素培养72 h, ELISA法测定;平均±SD 4只/组。*gydF4y2BaPgydF4y2Ba< 0.05。(gydF4y2BaCgydF4y2Ba)采用实时RT-PCR检测MLN细胞中转录因子或细胞因子mRNA的表达水平;白色菱形为平均值,横线为中位数,直线为±SD 4只/组。*gydF4y2BaPgydF4y2Ba< 0.05。(gydF4y2BaDgydF4y2Ba)使用小鼠细胞因子阵列测量结肠分泌的细胞因子浓度;将每组收集的上清液(n = 3)混合。(gydF4y2BaEgydF4y2Ba)第28天组织学评分。横杆:中位数;*gydF4y2BaPgydF4y2Ba< 0.05(相对于pbs处理的小鼠)。离开;升号,右;直肠。CD4gydF4y2Ba+gydF4y2BaCD25gydF4y2Ba−gydF4y2BaT细胞(3 × 10gydF4y2Ba5gydF4y2Ba)转移模型小鼠(n = 4-5只/组)分别用PBS、KLH和hCA I处理,分别用三角形、正方形和黑圈表示。PBS组中有一只小鼠在腹腔注射CD4时死亡gydF4y2Ba+gydF4y2BaCD25gydF4y2Ba−gydF4y2BaT细胞。(gydF4y2BaFgydF4y2Ba免疫组化法检测CA I的表达。给出了高倍率(原始比例尺,200 μm)和低倍率(原始比例尺,100 μm)下的代表性图像。所示数据均来自单个实验。gydF4y2Ba
与现有的IBD药物相比,使用hCA I口服增敏在实验性结肠炎小鼠模型中表现出非劣效性抑制作用gydF4y2Ba
尽管CD4gydF4y2Ba+gydF4y2BaCD25gydF4y2Ba−gydF4y2BaT细胞转移模型小鼠经常被用作IBD的临床前模型,我们的研究有一个额外的优势,我们使用这个慢性结肠炎模型来比较现有的药物治疗,即5-ASA和PSL与hCA I的疗效,给小鼠服用hCA I或现有的药物(5-ASA和PSL),并诱导结肠炎(图。gydF4y2Ba5gydF4y2BaA)。我们评估了体重变化,并确定在结肠炎诱导4周后,与PBS组相比,hCA I和psl治疗组的体重减轻最小(gydF4y2BaPgydF4y2Ba< 0.05;无花果。gydF4y2Ba5gydF4y2BaB).细胞转移四周后,hCA I处理小鼠的结肠长度明显大于pbs处理小鼠(gydF4y2BaPgydF4y2Ba< 0.05;无花果。gydF4y2Ba5gydF4y2BaC, D)。组织学检查显示,在细胞转移后4周,hCA I组和PSL组的结肠炎被抑制,但pbs处理的小鼠出现了严重的结肠炎。此外,与pbs治疗小鼠相比,hCA I或PSL治疗小鼠的组织学评分显著降低(gydF4y2BaPgydF4y2Ba< 0.05;无花果。gydF4y2Ba5gydF4y2Baeg)。对粪便生物标志物脂脂素2随时间的分析显示,与其他组相比,hCA I的结肠炎有抑制趋势(图2)。gydF4y2Ba5gydF4y2BaH)。gydF4y2Ba
hCA I与先导药物治疗效果的实验比较。(gydF4y2Ba一个gydF4y2Ba)实验方案。各组:PBS,美沙拉嗪(5-ASA) 100mg /kg / os (p.o o),泼尼松龙(PSL) 2mg /kg p.o,人CA I (hCA I) 0.3 mg/d p.o(见“gydF4y2Ba方法gydF4y2Ba”)。(gydF4y2BaBgydF4y2Ba) 0、7、14、21、28天体重随时间的相对变化(%)。CD4gydF4y2Ba+gydF4y2BaCD25gydF4y2Ba−gydF4y2BaT细胞(3 × 10gydF4y2Ba5gydF4y2Ba)转移模型小鼠(n = 8只/组)分别用PBS、5-ASA(美沙拉嗪)、PSL(泼尼松龙)和hCA I(三角形、白圈、正方形和黑圈表示)进行治疗。误差条表示SD。(gydF4y2BaCgydF4y2Ba)第28天结肠肉眼见。比例:10毫米(gydF4y2BaDgydF4y2Ba结肠炎小鼠第28天的结肠长度(n = 8)。(gydF4y2BaEgydF4y2Ba,gydF4y2BaFgydF4y2Ba)第28天结肠组织学分析。PBS-和5- asa处理小鼠可见炎性细胞浸润,黏膜高度明显升高(H&E染色;原始尺度:100 μm),杯状细胞严重缺失(周期性酸性席夫染色;原标度:200 μm)放大图。口服hCA I和PSL改善了这些发现。(gydF4y2BaGgydF4y2Ba)第28天组织学评分。横杆:中位数;*gydF4y2BaPgydF4y2Ba< 0.05(相对于pbs处理的小鼠)。所示数据是两个独立实验的代表性数据。(gydF4y2BaHgydF4y2Ba)粪便生物标志物脂蛋白素-2分析。CD4gydF4y2Ba+gydF4y2BaCD25gydF4y2Ba−gydF4y2BaT细胞(3 × 10gydF4y2Ba5gydF4y2Ba)转移模型小鼠(n = 3只/组)分别用PBS、5-ASA(美沙拉嗪)、PSL(泼尼松龙)、hCA I或KLH(用三角形、白圈、正方形、黑圈和黑三角形表示)进行治疗。gydF4y2Ba
与现有药物相比,hCA I口服耐受性对炎症细胞因子的抑制效果不差gydF4y2Ba
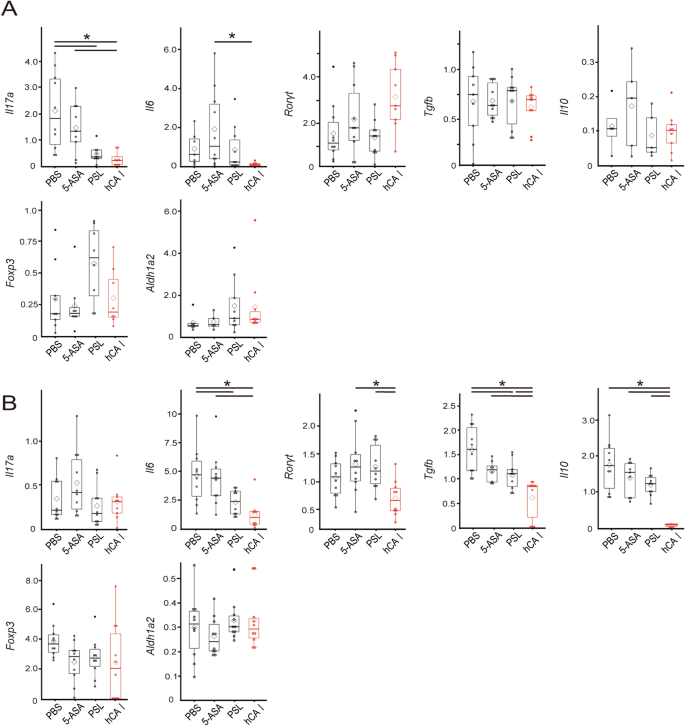
我们之前澄清了使用小鼠CA I的口服致敏诱导CD103gydF4y2Ba+gydF4y2BaCD11cgydF4y2Ba+gydF4y2Badc和叉头盒蛋白3 (Foxp3)gydF4y2Ba+gydF4y2BaCD4gydF4y2Ba+gydF4y2BaCD25gydF4y2Ba+gydF4y2Ba在mln中抑制Th17细胞的反应gydF4y2Ba14gydF4y2Ba.此外,我们发现mCA I 58-73表位可以与主要组织相容性复合体(MHC) II类分子相互作用,并在小鼠IBD模型中通过类似机制证明DCregsCA I肽诱导的抗原特异性保护抗结肠炎gydF4y2Ba15gydF4y2Ba.在这项研究中,我们调查了口服hCA I对结肠炎相关转录物和细胞因子的影响。与5-ASA和PSL组相比,hCA i给药小鼠结肠中IL-6的产生显著降低(gydF4y2BaPgydF4y2Ba< 0.05)(图gydF4y2Ba6gydF4y2Ba在mln中,hCA I比5-ASA更有效地抑制炎症细胞因子的产生,包括IL-6、IL-17、IFN-γ和TNF-α (gydF4y2BaPgydF4y2Ba< 0.05;无花果。gydF4y2Ba6gydF4y2BaB)。随后,我们评估了转录本的表达,如ALDH1A2(通过CD103参与Treg诱导gydF4y2Ba+gydF4y2Badc)、TGF-β和IL-10在mln中的表达,并评估它们在口服耐受性诱导中的作用。IL-17A表达明显降低(gydF4y2BaPgydF4y2Ba< 0.05),而ALDH1A2和Foxp3在hCA i处理小鼠结肠中的表达高于pbs处理小鼠结肠中的表达。此外,与5- asa处理小鼠相比,hCA i处理小鼠结肠中IL-6的表达显著降低(gydF4y2BaPgydF4y2Ba< 0.05;无花果。gydF4y2Ba7gydF4y2Ba此外,与pbs处理的小鼠相比,hCA I和PSL处理的小鼠mln中IL-6的表达水平显著降低(gydF4y2BaPgydF4y2Ba< 0.05)。此外,与5- asa处理的小鼠相比,hCA i处理小鼠的mln中IL-6和视黄酸相关孤儿受体γ t (RORγT)表达水平显著降低(gydF4y2BaPgydF4y2Ba< 0.05)。ALDH1A2在mln中的表达水平无统计学意义,但与其他组相比,hCA i处理小鼠的ALDH1A2表达水平较高。gydF4y2Ba7gydF4y2BaB).另一方面,如既往研究所示,口服mCA I可诱导treggydF4y2Ba14gydF4y2Ba在第28天,流式细胞术在mln和脾脏中未观察到。gydF4y2BaS5gydF4y2Ba).为了明确hCA I与肠道细菌之间的关系,我们在第0天检测了粪便中肠道细菌的变化。在hCA I组,增加的百分比gydF4y2Ba拟杆菌门gydF4y2Ba在门观察(补充图。gydF4y2BaS6gydF4y2BaA).从alpha多样性分析来看,PBS组的多样性倾向于较低,各组之间没有明显变化(补充图。gydF4y2BaS6gydF4y2BaB).在β多样性主成分分析中,各组表现出不同特征(补充图;gydF4y2BaS6gydF4y2BaC)。gydF4y2Ba
讨论gydF4y2Ba
我们之前已经确定主要的盲肠细菌抗原CA I是IBD的靶抗原gydF4y2Ba11gydF4y2Ba.此外,使用DCregs和口服mCA I的免疫治疗可改善小鼠IBD模型的抗原特异性免疫耐受gydF4y2Ba11gydF4y2Ba,gydF4y2Ba14gydF4y2Ba.此外,我们鉴定了mCA I表位,并证明DCregsCA I肽在IBD小鼠模型中诱导了抗结肠炎的抗原特异性保护gydF4y2Ba15gydF4y2Ba.本研究的三个主要发现如下:(1)在IBD小鼠模型中诱导hCA i特异性口服耐受性,并通过抑制mln中的炎症细胞因子抑制小鼠实验性结肠炎的进展;(2)结肠炎恶化时,粪便CA I含量减少,直肠补充hCA I可减轻结肠炎的严重程度;(3)与现有药物(5-ASA或PSL)相比,hCA I在IBD小鼠模型中对结肠炎的抑制作用不差。gydF4y2Ba
KLH是一种长期以来在小鼠模型中作为口服免疫耐受诱导物引起兴趣的蛋白质。然而,KLH在IBD患者(CD和UC)中的临床疗效较差。gydF4y2Ba17gydF4y2Ba,gydF4y2Ba18gydF4y2Ba.Margalit等人。gydF4y2Ba19gydF4y2Ba将这种差异归因于KLH给药时间短,其他抗原可能的影响,以及KLH被用作免疫耐受和T细胞增殖的参数,但尚不清楚哪些T细胞和treg对KLH刺激有反应。我们之前报道过,与KLH或pbs治疗的小鼠相比,口服mCA I在CA I治疗小鼠的mln和结肠中上调了Foxp3 + Tregs从Foxp3- cd4 + CD25- T细胞的分化gydF4y2Ba14gydF4y2Ba.这些结果表明,CA i特异性口服耐受性在IBD中被诱导,并通过诱导抗原特异性Foxp3 + CD4 + CD25 + T细胞来防止结肠炎的进展。本研究使用KLH作为对照蛋白,与我们之前的研究一致。hCA I已经积累了比KLH更强的证据,证明了其抑制结肠炎的疗效,可用于临床应用。此外,我们考虑了与hCA I或打乱序列相同质量的不同蛋白质作为对照。然而,当蛋白质被降解为氨基酸时,出现抗原活性位点的可能性占主导地位。gydF4y2Ba
在T细胞转移模型小鼠中,口服hCA I与口服mCA I具有相同的抑制作用(图2)。gydF4y2Ba1gydF4y2Ba).口服hCA I可重复抑制体内结肠炎和体重减轻(图2)。gydF4y2Ba1gydF4y2Ba而且gydF4y2Ba5gydF4y2Ba),以及炎症细胞因子的产生和体外炎症相关转录的抑制(图2。gydF4y2Ba2gydF4y2Ba,gydF4y2Ba6gydF4y2Ba,gydF4y2Ba7gydF4y2Ba).gydF4y2Ba
先前的报道表明,在胸腺外分化的调节性T细胞(treg)通过抗炎细胞因子IL-10抑制炎症细胞的功能和增殖,从而维持肠道稳态gydF4y2Ba20.gydF4y2Ba,gydF4y2Ba21gydF4y2Ba.Tregs的胸腺外分化也影响微生物群的组成,并抑制Th2炎症,包括粘膜界面的过敏性炎症gydF4y2Ba22gydF4y2Ba.此外,在体内扩大dc可增强口服耐受性的诱导gydF4y2Ba23gydF4y2Ba而肠粘膜CD103gydF4y2Ba+gydF4y2BaDCs诱导Foxp3gydF4y2Ba+gydF4y2Ba通过TGF-β和维甲酸依赖机制调节T细胞gydF4y2Ba24gydF4y2Ba,gydF4y2Ba25gydF4y2Ba,gydF4y2Ba26gydF4y2Ba.我们已经证明,使用DCregs的免疫治疗和口服mCA I增加了IL-10的产生和转录本的表达,如FOXP3和AlDH1A2,主要发生在mln中。我们还使用流式细胞仪证明了mCA I诱导抗原特异性treg和CD103的能力gydF4y2Ba+gydF4y2BaCD11cgydF4y2Ba+gydF4y2BaIBD小鼠模型结肠炎诱导后第7天的DCs (DSS和T细胞转移模型小鼠)gydF4y2Ba11gydF4y2Ba,gydF4y2Ba14gydF4y2Ba,gydF4y2Ba15gydF4y2Ba.在本实验中,通过树突状细胞参与Treg诱导的ALDH1A2表达增加(图2)。gydF4y2Ba7gydF4y2BaA,B),但mCA I给药后无显著差异gydF4y2Ba14gydF4y2Ba.此外,我们在第28天用流式细胞仪测量了treg的诱导,发现没有显著变化(补充图。gydF4y2BaS5gydF4y2Ba).由于小鼠和人CA I之间氨基酸序列的差异,口服hCA I可能削弱了抗原特异性耐受的作用(补充表gydF4y2BaS1gydF4y2Ba).然而,结肠炎症被重复性地抑制(图。gydF4y2Ba1gydF4y2Ba,gydF4y2Ba4gydF4y2Ba,gydF4y2Ba5gydF4y2Ba).事实上,与对照组相比,hCA i处理小鼠的mln中炎症细胞因子IL-6、IL-17和IFN-γ主要减少(图2)。gydF4y2Ba2gydF4y2BaB和gydF4y2Ba6gydF4y2Ba).此外,IL-6和IL-17A的转录物也发生了类似的变化(图2)。gydF4y2Ba2gydF4y2BaC, D,gydF4y2Ba7gydF4y2Ba).gydF4y2Ba
IFN-γ诱导的趋化因子CXCL9或CXCL10及其共同受体CXCR3在IBD患者的肠道中上调gydF4y2Ba27gydF4y2Ba最近的一项研究表明,骨髓细胞特异性适配器蛋白MyD88信号通路以及细胞因子IL-12、IL-23和IFN-γ密切参与了美国结肠炎症的发病机制gydF4y2Ba尼莫gydF4y2BatamIEC-KOgydF4y2Ba老鼠gydF4y2Ba28gydF4y2Ba.在临床实践中,已证明ustekinumab对CD和UC具有治疗作用,并且对Th1反应中参与的细胞因子如IL12和IFN-γ的控制意义日益显著gydF4y2Ba29gydF4y2Ba.我们的数据表明,在hCA i处理组的mln中,IL-6、IL-17和INF-γ的产生显著降低(图2)。gydF4y2Ba2gydF4y2BaB和gydF4y2Ba6gydF4y2Ba).我们之前的研究报告了类似的结果gydF4y2Ba11gydF4y2Ba,gydF4y2Ba14gydF4y2Ba,gydF4y2Ba15gydF4y2Ba.在本实验中,我们主要检查了调节免疫相关的细胞因子,这是我们在之前的mCA I实验系统中确定的;然而,Th1反应在T细胞转移模型小鼠中的作用仍有必要进一步研究,因为它可能与结肠炎的发生有很大的关系。gydF4y2Ba
口服蛋白质和氨基酸调节肠道免疫。例如,在喂食蛋白质缺乏饮食的小鼠中,小肠中的treg数量显著减少。在无菌小鼠中也观察到这种反应gydF4y2Ba30.gydF4y2Ba.在无菌小鼠实验中发现,食物中含有的氨基酸色氨酸被肠道细菌代谢形成犬尿氨酸,诱导Treg活性gydF4y2Ba31gydF4y2Ba.此外,有报道称,蛋白质摄入影响小肠黏膜Treg的分化,但不影响大肠粘膜gydF4y2Ba30.gydF4y2Ba.相反,饮食中的大多数蛋白质加重了C56BL/6J特异性无病原体小鼠dss诱导的结肠炎gydF4y2Ba32gydF4y2Ba.对结肠炎有保护作用的蛋白质很少见。之前,我们确定CB-17 SCID小鼠,注射CD4gydF4y2Ba+gydF4y2BaCD25gydF4y2Ba−gydF4y2Ba含有DCregsCA I的细胞经历了被抑制的结肠炎,而那些接受了调节性树突状细胞的细胞则与缺失CA I的盲肠细菌抗原(DCregsgydF4y2BaCBA-CA我gydF4y2Ba)没有出现结肠炎抑制gydF4y2Ba11gydF4y2Ba.因此,CA I是一种罕见的诱导大肠免疫耐受的蛋白。在本研究中,hCA I通过免疫印迹检测,在粪便中比小鼠CA I含量更高,后者因结肠炎从结肠脱落(图2)。gydF4y2Ba3.gydF4y2Ba和补充图。gydF4y2BaS2gydF4y2Ba).因此,我们认为在该小鼠模型中给予了足够量的hCA I蛋白。先前的一项研究表明,树突状细胞通过延伸其突起穿过上皮细胞而不破坏紧密连接,从而对腔内内容物进行采样gydF4y2Ba33gydF4y2Ba.由此看来,口服hCA I可直接控制小肠粘膜或大肠的免疫诱导。然而,在结肠炎诱导前直接给药hCA I并不能抑制结肠炎症。我们之前的报道表明,口服mCA I可诱导mln中的Tregs和DCregsgydF4y2Ba14gydF4y2Ba.此外,我们证明了源自CA I的t细胞表位肽可以与MHC II类分子相互作用;更具体地说,mCA I 58-73肽脉冲DCregs保护实验性结肠炎小鼠gydF4y2Ba15gydF4y2Ba.这些结果表明,hCA I蛋白或部分降解的氨基酸诱导了小肠免疫。此外,当比较PBS和hCA I处理组粪便中CA I蛋白的含量时,在hCA I处理的小鼠粪便中没有发现CA I,而在PBS处理的小鼠粪便中,CA I在第7天就已经存在了。PBS组CA I在第28天减少。这些结果表明,hCA i治疗组的结肠炎发作受到抑制;因此,即使在第28天,也能清晰地观察到蛋白带(图2)。gydF4y2Ba3.gydF4y2Ba).尽管有报道称UC患者组织中CA I表达降低,并加重结肠炎gydF4y2Ba13gydF4y2Ba在美国,还没有关于结肠炎早期粪便CA I一次性增加或疾病加重时消耗的报道。这些结果提示肠道内稳态无法维持的可能性,由于缺乏CA I,在结肠炎加重期间诱导免疫耐受。事实上,在结肠炎症加重期间补充CA I可以抑制结肠炎的发展(图。gydF4y2Ba4gydF4y2Ba).gydF4y2Ba
通过比较hCA I与现有药物的效果,我们发现hCA I比美沙拉嗪更有效地改善结肠炎,与PSL相似(图2)。gydF4y2Ba5gydF4y2Ba).粘膜愈合对控制IBD至关重要gydF4y2Ba34gydF4y2Ba,gydF4y2Ba35gydF4y2Ba,gydF4y2Ba36gydF4y2Ba.各种生物制剂已经被开发出来,IBD的治疗方法也有所改进。然而,轻中度病例主要使用5-ASA制剂治疗,其他治疗方案很少。此外,现有药物具有各种副作用,如继发感染,因此改进治疗方案是必不可少的。生物制剂的使用会增加感染、恶性肿瘤、免疫问题以及代谢和血液并发症的风险gydF4y2Ba4gydF4y2Ba.相反,CA I是一种自我抗原,被认为是一种治疗药物,使用安全,引起过敏反应的可能性低。此外,它具有与现有药物完全不同的作用机制,因此,当联合使用时,可以增强治疗效果。gydF4y2Ba
如前所述,通过免疫沉淀和免疫印迹,我们发现结肠炎早期粪便CA I水平短暂性升高,随后在加重期粪便CA I水平下降。我们还观察到hCA I影响肠道细菌的组成(补充图。gydF4y2BaS6gydF4y2Ba).这表明,即使在结肠炎期间,CA I给药也会影响肠道微生物群的含量。我们假设,在结肠炎期间,肠道菌群组成发生了类似的变化,尽管需要更多的研究,包括肠道细菌和代谢物的分析,来验证我们的假设。在本研究中,我们能够明确CA I在多种因素交织的肠道环境中的作用。此外,CA I也有可能作为评估结肠炎活性的生物标志物。尽管如此,我们认为使用KO小鼠结肠特异性CA I进行额外的实验是必要的,以研究宿主CA I的影响。虽然已经有来自结肠特异性cre表达小鼠的CA I被使用的报道,但目前还没有来自KO小鼠的CA I的报道。gydF4y2Ba
结论gydF4y2Ba
我们发现CA I只存在于胃肠道内的大肠中gydF4y2Ba12gydF4y2Ba是一种可以诱导口服耐受性的抗原,因此可能成为IBD患者的一种新的治疗方式。gydF4y2Ba
方法gydF4y2Ba
老鼠gydF4y2Ba
CB-17同基因严重联合免疫缺陷(SCID)和BALB/c (H-2d, IA-IE)雌性小鼠,在经过认证的动物设施中特定的无病原体条件下饲养,购自CLEA Japan, Inc.(东京,日本)。本研究中使用的所有小鼠都是8-12周龄,喂食标准实验室饲料,并在受控条件下(22°C, 55%湿度,12小时昼夜循环)饲养在爱媛大学医学研究生院(爱媛,日本)的动物中心。将动物随机分为实验组,每个笼子里装着所有组的动物。gydF4y2Ba
抗原和喂养方案gydF4y2Ba
动物口服hCA I (0.3 mg/天)或锁眼帽贝血青蛋白(KLH) (0.3 mg/天;77600;赛默飞世尔科学公司,罗克福德,伊利诺伊州,美国)在磷酸盐缓冲盐水(PBS)中放置7天。以平均消耗量(5 mL/day)计算连续喂养方案给药的hCA I或KLH的日总剂量。PBS中含有hCA I或KLH的瓶子每天更换两次以避免污染。蛋白质的剂量是根据现有的报道和我们的疗效分析结果来设定的gydF4y2Ba37gydF4y2Ba.对照组连续7天接受PBS治疗。直肠给药实验中,hCA I和KLH在PBS中稀释纯化至0.3 mg / 200 μL,用直肠给药管(C30PU-MRE1711;Instech, PA,美国)一天一次。对照组通过直肠注射200 μ L PBS,每天1次。gydF4y2Ba
结肠炎诱导gydF4y2Ba
致敏后7天,根据先前描述的方法诱导结肠炎gydF4y2Ba38gydF4y2Ba,做了一些修改。简单地说,CD4gydF4y2Ba+gydF4y2BaCD25gydF4y2Ba−gydF4y2Ba利用CD4从BALB/c小鼠脾脏中分离T细胞gydF4y2Ba+gydF4y2BaCD25gydF4y2Ba+gydF4y2Ba调节性T细胞分离试剂盒和AutoMACS (Miltenyi Biotec, Bergisch Gladbach, Germany)。CD4gydF4y2Ba+gydF4y2BaCD25gydF4y2Ba−gydF4y2BaT细胞(3 × 10gydF4y2Ba5gydF4y2Ba细胞/小鼠)悬浮在0.2 mL PBS中,腹腔注射到SCID小鼠。对照组SCID小鼠单独注射0.2 mL PBS。转账的那天被指定为第0天。gydF4y2Ba
粪便和结肠组织中CA I的制备及免疫沉淀gydF4y2Ba
每天收集SCID小鼠粪便,用于口服给药实验,定量粪便CA I蛋白含量。简单地说,每天收集每组3只动物的粪便,其中400毫克用于进一步实验。取正常BALB/c小鼠近盲肠处1厘米的大肠切片,取mCA I作为对照。结肠组织和粪便样本用无菌PBS清洗三次,分别置于10 mL带有1.0 mm二氧化硅球的PBS中(6912;裂解基质C;MP Biomedicals, Solon, OH,美国)。涡旋5min后,用5000×离心去除二氧化硅球和残留粪便或结肠组织gydF4y2BaggydF4y2Ba在4°C下加热5分钟。将500 μL回收的上清液加入1000 μL PBS中,18000 ×离心gydF4y2BaggydF4y2Ba在4°C下放置30分钟。CA I蛋白使用Dynabeads™protein G免疫沉淀试剂盒(DB10007;赛默飞世尔科学公司)。2 μg CA I多克隆抗体(13198-2-AP;Proteintech Group Inc., Rosemont, IL,美国)稀释在200 μ L Ab结合和洗涤缓冲液中添加到磁珠中。抗体与珠粒结合后,每个样品加250 μL上清。最后,进行非变性洗脱,仅回收目标蛋白。同型对照确认实验,小鼠(G3A1) mAb IgG 1同型对照(5415;细胞信号,马萨诸塞州,美国)。另一种碳酸酐酶1抗体(GTX83196; Gene Tex, CA, USA). Coomassie Brilliant Blue (CBB) staining was performed using 4–12% Bolt® Bis–Tris plus gel (Thermo Fisher) and NuPAGE™ MES SDS running buffer (Invitrogen) to confirm the uniformity of the samples after immunoprecipitation.
免疫印迹分析gydF4y2Ba
通过免疫沉淀从粪便中回收目标蛋白,使用Jess系统(自动化简单western blot系统;ProteinSimple, San Jose, CA, United States),采用12-230千daltons分离模块(#SM-W-004),并使用CA I多克隆抗体(13198-2-AP;Proteintech Group Inc.)和抗兔子检测模块(#DM-001),根据制造商的说明。采用RePlex特征和总蛋白测定法测定同一毛细管内的总蛋白量,并将其用于归一化(RP-001和DM-TP1;Protein Simple, Bio-Techne, CA, USA)。数据分析使用Compass软件进行Simple Western(版本:4.1.0)。gydF4y2Ba
用于治疗IBD的试验药物gydF4y2Ba
强的松(PSL;PubChem CID: 5755)和5-氨基水杨酸(5-ASA;也被称为美沙拉嗪;PubChem CID: 4075)。5-ASA (100 mg kggydF4y2Ba1gydF4y2Ba一天gydF4y2Ba1gydF4y2Ba)和PSL(2毫克公斤gydF4y2Ba1gydF4y2Ba一天gydF4y2Ba1gydF4y2Ba)用于hCA I组和PBS组之间的比较。这些剂量是根据以往文献设定的有效浓度gydF4y2Ba39gydF4y2Ba,gydF4y2Ba40gydF4y2Ba.这些药物被溶解在PBS中,并通过自由选择的饮酒方式给药。每天更换瓶子,以防止污染和药物变性。gydF4y2Ba
微生物区系处理与分析gydF4y2Ba
每天收集SCID小鼠的新鲜粪便,用于评估现有药物治疗的疗效,以量化肠道菌群含量。对照组的老鼠只喝水。为了避免笼子效应,每组小鼠都被关在一个笼子里,并收集粪便样本。简单地说,每天收集每组3只动物的粪便,用于进一步的实验。各组的粪便菌群样本悬浮在Genefind 2.0 (A41499;Beckman Coulter, CA,美国)裂解缓冲液。暂停被转移到MORA (46211;AMR Inc., Tokyo, Japan)珠管并粉碎3分钟。离心后,根据制造商的方案使用Genefind 2.0 (Beckman Coulter)自动纯化上清液,并用80µL无菌水洗脱DNA。使用KAPA HiFi HotStart PCR试剂盒和条形码索引引物341F (CCTACGGGNGGCWGCAG)和806R (GACTACHVGGGTATCTAATCC)扩增细菌16S核糖体RNA基因V3-V4区。扩增子用amprexp (A63880; Beckman Coulter) and quantified using Qubit (Q33238; Thermo Fisher Scientific). 16S rRNA sequencing was performed using the MiSeq™ system (SY-410–1003; Illumina, San Diego, CA, United States). The 16S rRNA sequence analysis was performed using the QIIME2 suite of software tools (v3.5.3)41gydF4y2Ba.选择序列相似度为97%的操作分类单元,并将序列与Silva数据库(v138.1)进行比对。gydF4y2Ba42gydF4y2Ba.为了比较beta多样性,计算了加权和非加权UniFrac距离gydF4y2Ba43gydF4y2Ba.附原始资料(补充文件)gydF4y2Ba1gydF4y2Ba).gydF4y2Ba
结肠炎的组织学评估gydF4y2Ba
细胞移植4周后对小鼠实施安乐死;随后,他们的升结肠被切除,用10%的中性缓冲福尔马林固定,并用石蜡包埋。薄组织切片进行H&E染色或周期性酸性希夫染色。结肠炎的组织学评估评分如前所述(补充表gydF4y2BaS2gydF4y2Ba)gydF4y2Ba38gydF4y2Ba.gydF4y2Ba
体外mln培养及mln细胞因子水平测定gydF4y2Ba
肠系膜淋巴结(MLN)细胞(1 × 10gydF4y2Ba6gydF4y2Ba)在完整的罗斯威尔公园纪念研究所(RPMI) 1640培养基中培养(含10%胎牛血清(FBS)、20 mM HEPES、2-巯基乙醇(2-ME)、青霉素和链霉素;生命技术日本有限公司,东京,日本)72小时后,25 ng/mL 12-肉豆蔻酸佛波13-乙酸酯(PMA;P88139;Sigma-Aldrich, St Louis, MO, United States)和1 μg/mL ionomycin (10,634;(Sigma-Aldrich)。培养完成后,使用ELISA试剂盒检测上清液中IL-6 (M6000B)、IL-17 (M1700)、IFN-γ (MIF00)、TNF-α (MTA00B)、转化生长因子-β1 (TGF-β1) (DB100C)、IL-10 (M1000B)和MCP-1 (DY479-05) (R&D Systems, Inc., Minneapolis, MN, usa)。gydF4y2Ba
体外结肠培养与结肠细胞因子水平gydF4y2Ba
如前所述,评估结肠培养的细胞因子浓度gydF4y2Ba14gydF4y2Ba,gydF4y2Ba15gydF4y2Ba.简单地说,在清除粪便后,从横结肠中切除1厘米的切片,并用无菌PBS冲洗三次。结肠组织切片置于完整的RPMI 1640培养基中培养72 h。随后,使用ELISA试剂盒(R&D Systems)检测上清液中的细胞因子,即IL-6、IL-17、IFN-γ、TNF-α、TGF-β1和IL-10。为了进行综合分析,将从每组收集的上清液(n = 3)混合,使用小鼠细胞因子阵列面板A (ARY006;研发系统)。使用Image Quant TL (Cytiva, Tokyo, Japan)进行分析。gydF4y2Ba
从结肠和mln中提取RNA,定量实时聚合酶链反应gydF4y2Ba
横结肠标本和mln用TissueLyser (QIAGEN, Tokyo, Japan)均质。使用RNeasy Plus Mini Kit (74134;QIAGEN,日本东京)。随后,利用高容量cDNA逆转录试剂盒(4368,814;赛默飞世尔科学公司)。采用实时定量PCR (Quantitative real-time PCR, qPCR)对结肠炎小鼠mln和结肠的mRNA进行IL-6、IL-10、IL-17A、TGF-β、FOXP3、rorr γt和ALDH1A2的检测。以次黄嘌呤磷酸核糖转移酶1 (HPRT1)表达为对照。qPCR使用LightCycler 96实时PCR系统(Roche, Basel, Switzerland)和LightCycler FastStart DNA Master SYBR Green I (Roche, Basel, Switzerland)进行。这些分析中使用的引物序列见补充表gydF4y2BaS3gydF4y2Ba.gydF4y2Ba
免疫组织化学gydF4y2Ba
所有切片都脱蜡再水化。CA I检测切片在10 mM柠檬酸缓冲溶液(pH为6.0)中在110°C下蒸压1 min。0.03%双氧水阻断内源性过氧化物酶后,用兔抗ca I多克隆抗体(1:500稀释;NNP188191;Novus Biologicals, CO,美国)在4°C过夜。随后将切片与山羊抗小鼠免疫球蛋白结合到过氧化物酶标记的氨基酸聚合物中,在25°C下孵育40分钟,如MAX-PO (R) Kit (424142;日雷株式会社,东京,日本)。然后用简单染色DAB溶液(415172;Nichirei),用苏木精反染色。gydF4y2Ba
流式细胞分析及细胞内细胞因子合成分析gydF4y2Ba
收集MLN细胞或脾脏细胞(n = 3)。用纯化的大鼠抗鼠CD16/CD32 (93;表达载体。,Tokyo, Japan), frequencies of forkhead box protein 3 (Foxp3) + CD4 + CD25 + Tregs were determined using the Anti-Mouse/Rat Foxp3 Staining Set (77-5775-4-; eBioscience, San Diego, CA), allophycocyanin-conjugated anti-Foxp3 mAb (FJK-16s), PE-conjugated anti-CD25 mAb (PC61.5), and FITC-conjugated anti-CD4 mAb (RM4-5). The stained cells were analyzed using a flow cytometer (FACSCalibur; BD Bioscience). Data were processed using CellQuest software (BD Bioscience). Fluorescence staining was analyzed by fluorescence-activated cell sorting using FlowJo software version 10.0 (FLOWJO, LLC, Ashland, OR).
Lipocaline-2 ELISAgydF4y2Ba
采用小鼠lipocalin-2/NGAL检测试剂盒(MLCN20;研发)根据制造商的说明。gydF4y2Ba
统计分析gydF4y2Ba
所有单独实验的数据均以平均值±标准差(SD)表示。在合适的地方,学生的gydF4y2BatgydF4y2Ba-test被使用。对于多重比较,采用单向方差分析(ANOVA),然后进行Tukey诚实显著性差异检验。所有统计分析均使用JMP软件计算(SAS Institute Inc., Cary, NC,美国)。差异被认为有统计学意义时gydF4y2BaPgydF4y2Ba< 0.05。gydF4y2Ba
道德的考虑gydF4y2Ba
实验方案由爱媛大学医学研究生院(日本爱媛)动物实验委员会批准,并根据实验室实践指南进行(机构审查委员会批准05-TI-67-1)。所有研究均遵循arrival指南进行。gydF4y2Ba
数据可用性gydF4y2Ba
在当前研究期间生成和/或分析的数据集可根据合理要求从通信作者处获得。gydF4y2Ba
缩写gydF4y2Ba
- AA:gydF4y2Ba
-
氨基酸gydF4y2Ba
- ALDH1A2:gydF4y2Ba
-
乙醛脱氢酶家族成员A2gydF4y2Ba
- 方差分析:gydF4y2Ba
-
方差分析gydF4y2Ba
- APC:gydF4y2Ba
-
抗原呈递细胞gydF4y2Ba
- APCgydF4y2BaCa I 58gydF4y2Ba- - - - - -gydF4y2Ba73gydF4y2Ba:gydF4y2Ba
-
APC脉冲碳酸酐酶I 58-73gydF4y2Ba
- BIC:gydF4y2Ba
-
BrevibacillusgydF4y2Ba体内克隆gydF4y2Ba
- CA I:gydF4y2Ba
-
碳酸酐酶IgydF4y2Ba
- CBA:gydF4y2Ba
-
盲肠细菌抗原gydF4y2Ba
- CBB:gydF4y2Ba
-
考马斯亮蓝gydF4y2Ba
- CD:gydF4y2Ba
-
克罗恩氏病gydF4y2Ba
- 互补脱氧核糖核酸:gydF4y2Ba
-
互补脱氧核糖核酸gydF4y2Ba
- CXCL9:gydF4y2Ba
-
C-X-C基序趋化因子配体gydF4y2Ba
- CXCL10:gydF4y2Ba
-
C-X-C基序趋化因子配体gydF4y2Ba
- CXCR3:gydF4y2Ba
-
C-X-C motif趋化因子受体3gydF4y2Ba
- DCregs:gydF4y2Ba
-
调节性树突细胞gydF4y2Ba
- DCs:gydF4y2Ba
-
树突细胞gydF4y2Ba
- 决策支持系统:gydF4y2Ba
-
右旋糖酐硫酸钠gydF4y2Ba
- ELISA:gydF4y2Ba
-
酶联免疫吸附试验gydF4y2Ba
- 的边后卫:gydF4y2Ba
-
胎牛血清gydF4y2Ba
- FITC:gydF4y2Ba
-
异硫氰酸荧光素gydF4y2Ba
- 具体:gydF4y2Ba
-
叉头盒蛋白3gydF4y2Ba
- gm - csf:gydF4y2Ba
-
粒细胞巨噬细胞集落刺激因子gydF4y2Ba
- hCA我:gydF4y2Ba
-
人体碳酸酐酶IgydF4y2Ba
- HPRT1:gydF4y2Ba
-
次黄嘌呤磷酸核糖转移酶1gydF4y2Ba
- IEC:gydF4y2Ba
-
肠上皮细胞gydF4y2Ba
- 干扰素-γ:gydF4y2Ba
-
移行细胞gydF4y2Ba
- IL:gydF4y2Ba
-
白介素gydF4y2Ba
- KLH:gydF4y2Ba
-
锁眼帽贝血色素gydF4y2Ba
- 有限合伙人:gydF4y2Ba
-
脂多糖gydF4y2Ba
- MHC:gydF4y2Ba
-
主要组织相容性复合体gydF4y2Ba
- MLN:gydF4y2Ba
-
肠系膜淋巴结gydF4y2Ba
- 信使rna:gydF4y2Ba
-
信使核糖核酸gydF4y2Ba
- 尼莫gydF4y2BatamIEC-KOgydF4y2Ba:gydF4y2Ba
-
他莫昔芬诱导的iec特异性抑制NF-κB通过条件消融IKK亚基gydF4y2Ba
- 不是:gydF4y2Ba
-
周期酸席夫gydF4y2Ba
- PBS:gydF4y2Ba
-
磷酸盐gydF4y2Ba
- 聚合酶链反应:gydF4y2Ba
-
聚合酶链反应gydF4y2Ba
- 体育:gydF4y2Ba
-
藻红蛋白gydF4y2Ba
- PerCP:gydF4y2Ba
-
周围素叶绿素蛋白gydF4y2Ba
- PMA:gydF4y2Ba
-
12-肉豆蔻酸酯,13-乙酸gydF4y2Ba
- PSL:gydF4y2Ba
-
强的松gydF4y2Ba
- pTregs:gydF4y2Ba
-
外周调节性T细胞gydF4y2Ba
- qPCR:gydF4y2Ba
-
实时定量PCRgydF4y2Ba
- RORγ老师:gydF4y2Ba
-
维甲酸相关孤儿受体tgydF4y2Ba
- RPMI:gydF4y2Ba
-
罗斯威尔公园纪念研究所gydF4y2Ba
- SCID:gydF4y2Ba
-
严重联合免疫缺陷gydF4y2Ba
- SD:gydF4y2Ba
-
标准偏差gydF4y2Ba
- sds - page:gydF4y2Ba
-
十二烷基硫酸钠-聚丙烯酰胺凝胶电泳gydF4y2Ba
- 防晒系数:gydF4y2Ba
-
特定的无菌gydF4y2Ba
- TGF -β:gydF4y2Ba
-
转化生长因子-βgydF4y2Ba
- Th0:gydF4y2Ba
-
抗原CD4gydF4y2Ba+gydF4y2Ba辅助性T细胞gydF4y2Ba
- Th1:gydF4y2Ba
-
CD4gydF4y2Ba+gydF4y2BaT细胞产生IFN-γgydF4y2Ba
- Th17:gydF4y2Ba
-
CD4gydF4y2Ba+gydF4y2BaT细胞产生白细胞介素-17gydF4y2Ba
- 肿瘤坏死因子:gydF4y2Ba
-
肿瘤坏死因子gydF4y2Ba
- 亚群:gydF4y2Ba
-
调节性T细胞gydF4y2Ba
- 加州大学:gydF4y2Ba
-
溃疡性结肠炎gydF4y2Ba
- 我:gydF4y2Ba
-
2-MercaptoethanolgydF4y2Ba
- 5-ASA:gydF4y2Ba
-
5-Aminosalicylic酸gydF4y2Ba
参考文献gydF4y2Ba
纽约州,莫洛德基。gydF4y2Baet al。gydF4y2Ba基于系统回顾,炎症性肠病的发病率和患病率随着时间的推移而增加。gydF4y2Ba胃肠病学gydF4y2Ba142gydF4y2Ba, 46-54(2012)。gydF4y2Ba
卡普兰,g.g.全球IBD负担:从2015年到2025年。gydF4y2Ba胃肠醇。乙醇。gydF4y2Ba12gydF4y2Ba, 720-727(2015)。gydF4y2Ba
吴世昌。gydF4y2Baet al。gydF4y2Ba21世纪炎症性肠病的全球发病率和患病率:基于人群的研究的系统综述gydF4y2Ba《柳叶刀》gydF4y2Ba390gydF4y2Ba, 2769-2778(2018)。gydF4y2Ba
Click, B. & Regueiro, M.新的IBD疗法的安全性和监测的实用指南。gydF4y2BaInflamm。肠道说。gydF4y2Ba25gydF4y2Ba, 831-842(2019)。gydF4y2Ba
在改变,N。gydF4y2Baet al。gydF4y2Ba传统药物在炎症性肠病中的新应用:cochrane综述告诉我们什么?gydF4y2BaInflamm。肠道说。gydF4y2Ba21gydF4y2Ba, 2948-2957(2015)。gydF4y2Ba
科伦贝尔,j.f.。gydF4y2Baet al。gydF4y2Ba严格控制管理对克罗恩病(CALM)的影响:一项多中心、随机、对照3期试验gydF4y2Ba《柳叶刀》gydF4y2Ba390gydF4y2Ba, 2779-2789(2018)。gydF4y2Ba
Ungaro, R。gydF4y2Baet al。gydF4y2Ba溃疡性结肠炎的治疗目标更新:一项系统综述。gydF4y2Ba点。j .杂志。gydF4y2Ba114gydF4y2Ba, 874-883(2019)。gydF4y2Ba
鲍姆加特,d.c. &卡丁,s.r.炎症性肠病:病因和免疫生物学。gydF4y2Ba《柳叶刀》gydF4y2Ba369gydF4y2Ba, 1627-1640(2007)。gydF4y2Ba
琮、Y。gydF4y2Baet al。gydF4y2Ba自发性结肠炎C3H/HeJBir小鼠中CD4+ T细胞对肠道细菌抗原的反应:增加T辅助细胞1型反应和转移疾病的能力。gydF4y2Ba实验,医学。gydF4y2Ba187gydF4y2Ba, 855-864(1998)。gydF4y2Ba
琮、Y。gydF4y2Baet al。gydF4y2Ba细菌反应性T调节细胞抑制肠道菌群的致病免疫反应。gydF4y2Baj . Immunol。gydF4y2Ba169gydF4y2Ba, 6112-6119(2002)。gydF4y2Ba
Yamanishi, H。gydF4y2Baet al。gydF4y2Ba碳酸酐酶I脉冲的调节性树突状细胞对CD4+CD25- T细胞诱导的小鼠结肠炎具有保护作用。gydF4y2Baj . Immunol。gydF4y2Ba188gydF4y2Ba, 2164-2172(2012)。gydF4y2Ba
Parkkila, S。gydF4y2Baet al。gydF4y2Ba碳酸酐酶同工酶I, II,和VI在人类消化道的分布。gydF4y2Ba肠道gydF4y2Ba35gydF4y2Ba, 646-650(1994)。gydF4y2Ba
乔瓦尼,r.f.。gydF4y2Baet al。gydF4y2Ba活动性溃疡性结肠炎患者结肠黏膜碳酸酐酶I的降低。gydF4y2Ba挖。说,科学。gydF4y2Ba43gydF4y2Ba, 2086-2092(1998)。gydF4y2Ba
森K。gydF4y2Baet al。gydF4y2Ba口服碳酸酐酶I可改善Foxp3-CD4+CD25- T细胞诱导的小鼠实验性结肠炎。gydF4y2Baj . Leukoc。医学杂志。gydF4y2Ba93gydF4y2Ba, 963-972(2013)。gydF4y2Ba
八木天线,S。gydF4y2Baet al。gydF4y2Ba碳水化合物I表位肽改善炎症性肠病小鼠模型的炎症。gydF4y2BaInflamm。肠道说。gydF4y2Ba22gydF4y2Ba, 1835-1846(2016)。gydF4y2Ba
韦纳,h.l.。gydF4y2Baet al。gydF4y2Ba口服耐受。gydF4y2BaImmunol。牧师。gydF4y2Ba206gydF4y2Ba, 232-259(2005)。gydF4y2Ba
赫斯比,S.,梅斯特基,J., Moldoveanu, Z., Holland, S. & Elson, c.o.人类口腔耐受性。T细胞耐受,B细胞不耐受。gydF4y2Baj . Immunol。gydF4y2Ba152gydF4y2Ba, 46-63(1994)。gydF4y2Ba
Kraus, T. A., Toy, L., Chan, L., Childs, J. & Mayer, L.炎症性肠病患者口服可溶性蛋白耐受性失败。gydF4y2Ba胃肠病学gydF4y2Ba126gydF4y2Ba, 1771-1778(2004)。gydF4y2Ba
玛,M。gydF4y2Baet al。gydF4y2Ba口服Alequel(一种自体结肠提取蛋白的混合物)治疗克罗恩病的双盲临床试验:患者量身定制的方法。gydF4y2Ba点。j .杂志。gydF4y2Ba101gydF4y2Ba, 561-568(2006)。gydF4y2Ba
坂口,S.,宫原,M.,科斯坦蒂诺,C. M. &哈夫勒,D. A. FOXP3gydF4y2Ba+gydF4y2Ba人类免疫系统中的调节性T细胞。gydF4y2BaNat. Rev. Immunol。gydF4y2Ba10gydF4y2Ba, 490-500(2010)。gydF4y2Ba
Hori, S, Nomura, T. & Sakaguchi, S.转录因子Foxp3对调节性T细胞发育的控制。gydF4y2Ba科学gydF4y2Ba299gydF4y2Ba, 1057-1061(2003)。gydF4y2Ba
Josefowicz, s.z。gydF4y2Baet al。gydF4y2Ba胸腺外产生的调节性T细胞控制黏膜TH2炎症。gydF4y2Ba自然gydF4y2Ba482gydF4y2Ba, 395-399(2012)。gydF4y2Ba
Viney, J. L., Mowat, A. M., O 'Malley, J. M., Williamson, E. & Fanger, N. A.体内扩展树突细胞增强口服耐受性的诱导。gydF4y2Baj . Immunol。gydF4y2Ba160gydF4y2Ba, 5815-5825(1998)。gydF4y2Ba
库姆斯,j.l.。gydF4y2Baet al。gydF4y2Ba功能性特异性的粘膜CD103+ DCs通过TGF-β和维甲酸依赖机制诱导Foxp3+调节性T细胞。gydF4y2Ba实验,医学。gydF4y2Ba204gydF4y2Ba, 1757-1764(2007)。gydF4y2Ba
Mucida D。gydF4y2Baet al。gydF4y2Ba维甲酸介导的相互TH17和调节性T细胞分化。gydF4y2Ba科学gydF4y2Ba317gydF4y2Ba, 256-260(2007)。gydF4y2Ba
Ihara, S., Hirata, Y. & Koike, K.炎症性肠病中的TGF-β:免疫细胞、上皮细胞和肠道菌群的关键调节因子。gydF4y2Baj .杂志。gydF4y2Ba52gydF4y2Ba, 777-787(2017)。gydF4y2Ba
Singh, U. P., Venkataraman, C., Singh, R. & Lillard, J. W. Jr. CXCR3轴:在炎症性肠病中的作用及其治疗意义。gydF4y2BaEndocr。金属底座。免疫Disord。药物靶点。gydF4y2Ba7gydF4y2Ba, 111-112(2007)。gydF4y2Ba
Eftychi C。gydF4y2Baet al。gydF4y2Ba细胞因子IL-12和IL-23在时间上的不同功能驱动慢性结肠炎症,以应对肠屏障损伤。gydF4y2Ba免疫力gydF4y2Ba51gydF4y2Ba, 367-380(2019)。gydF4y2Ba
桑兹,b.e.。gydF4y2Baet al。gydF4y2BaUstekinumab用于溃疡性结肠炎的诱导和维持治疗。gydF4y2Ba心血管病。j .地中海。gydF4y2Ba381gydF4y2Ba, 1201-1214(2019)。gydF4y2Ba
金,k。S。gydF4y2Baet al。gydF4y2Ba膳食抗原通过诱导小肠中的调节性T细胞来限制粘膜免疫。gydF4y2Ba科学gydF4y2Ba351gydF4y2Ba, 858-863(2016)。gydF4y2Ba
Zelante, T。gydF4y2Baet al。gydF4y2Ba来自微生物群的色氨酸分解代谢产物通过白介素-22参与芳基烃受体并平衡粘膜反应性。gydF4y2Ba免疫力gydF4y2Ba39gydF4y2Ba, 372-385(2013)。gydF4y2Ba
卢埃林,s.r.。gydF4y2Baet al。gydF4y2Ba饮食和肠道菌群之间的相互作用改变了小鼠肠道的通透性和结肠炎的严重程度。gydF4y2Ba胃肠病学gydF4y2Ba154gydF4y2Ba, 1037-1046(2018)。gydF4y2Ba
肠树突细胞。gydF4y2Ba放置Immunol。gydF4y2Ba107gydF4y2Ba, 109-138(2010)。gydF4y2Ba
弗ø斯莱,K. F.,杨森,J.,莫姆,B. A., Vatn, M. H.,易卜生集团。炎症性肠病的粘膜愈合:来自挪威人群队列研究的结果gydF4y2Ba胃肠病学gydF4y2Ba133gydF4y2Ba, 412-422(2007)。gydF4y2Ba
炎症性肠病中的粘膜愈合:一项系统综述。gydF4y2Ba肠道gydF4y2Ba61gydF4y2Ba, 1619-1635(2012)。gydF4y2Ba
特纳,D。gydF4y2Baet al。gydF4y2BaSTRIDE- ii:国际IBD研究组织(IOIBD)炎症性肠病选择治疗靶点(STRIDE)倡议的最新进展:确定IBD治疗靶点策略的治疗目标。gydF4y2Ba胃肠病学gydF4y2Ba160gydF4y2Ba, 1570-1583(2021)。gydF4y2Ba
法里亚,a.m.。gydF4y2Baet al。gydF4y2Ba连续喂养诱导口服耐受性:增强转化生长因子- β /白介素-10的上调和实验性自身免疫性脑脊髓炎的抑制gydF4y2Baj . Autoimmun。gydF4y2Ba20.gydF4y2Ba, 134-145(2003)。gydF4y2Ba
Kjellev, S., Lundsgaard, D., Poulsen, s.s. & Markholst, H.用CD4+CD25- T细胞重建Scid小鼠导致快速结肠炎:一种改进的药理学测试模型。gydF4y2BaInt。Immunopharmacol。gydF4y2Ba6gydF4y2Ba, 1341-1354(2006)。gydF4y2Ba
古普塔,R. A., Motiwala, M. N., Mahajan, un . N. & Sabre, S. G.田菁通过抑制TNF-α和IL-6对乙酸诱导小鼠溃疡性结肠炎的保护作用。gydF4y2Baj . Ethnopharmacol。gydF4y2Ba219gydF4y2Ba, 222-232(2018)。gydF4y2Ba
Sann, H., von Erichsen, J., Hessmann, M., Pahl, A. & Hoffmeyer, A.用于治疗IBD的药物及其组合在小鼠急性dss诱导的结肠炎中的疗效。gydF4y2Ba生命科学。gydF4y2Ba92gydF4y2Ba, 708-718(2013)。gydF4y2Ba
Bolyen E。gydF4y2Baet al。gydF4y2Ba利用QIIME 2可重复、交互式、可扩展和可扩展的微生物组数据科学。gydF4y2Ba生物科技Nat。》。gydF4y2Ba37gydF4y2Ba, 852-857(2019)。gydF4y2Ba
Quast C。gydF4y2Baet al。gydF4y2BaSILVA核糖体RNA基因数据库项目:改进的数据处理和基于网络的工具。gydF4y2Ba核酸测定。gydF4y2Ba41gydF4y2Ba, 590-596(2013)。gydF4y2Ba
Lozupone, C. & Knight, R. UniFrac:比较微生物群落的一种新的系统发育方法。gydF4y2Ba达成。环绕。Microbiol。gydF4y2Ba71gydF4y2Ba, 8228-8235(2005)。gydF4y2Ba
确认gydF4y2Ba
我们要感谢谷本健二和藤野高楠提供的技术援助。gydF4y2Ba
资金gydF4y2Ba
这项工作得到了爱媛大学综合科学中心生物资源系的支持,并得到了JSPS(日本科学促进协会)KAKENHI资助号:JP19K17495至S.Y.和JSPS KAKENHI资助号:JP18K08007至Y.H.的部分支持gydF4y2Ba
作者信息gydF4y2Ba
作者及隶属关系gydF4y2Ba
贡献gydF4y2Ba
k.t.,研究概念和设计,数据的获取,分析和解释,统计分析,获得资金,和手稿的起草。s.y., e.t., Y.I.和y.h.,研究概念和设计,数据的获取,数据的分析和解释,统计分析,获得资金,起草手稿,对手稿的关键修订和批准最终版本的手稿。m.a., y.y., h.t., t.k., m.h.和b.m.,起草,重要修订,并批准最终版本的手稿。gydF4y2Ba
相应的作者gydF4y2Ba
道德声明gydF4y2Ba
相互竞争的利益gydF4y2Ba
作者声明没有利益竞争。gydF4y2Ba
额外的信息gydF4y2Ba
出版商的注意gydF4y2Ba
施普林格自然对出版的地图和机构从属关系中的管辖权主张保持中立。gydF4y2Ba
权利和权限gydF4y2Ba
开放获取gydF4y2Ba本文遵循知识共享署名4.0国际许可协议,允许以任何媒介或格式使用、分享、改编、分发和复制,只要您对原作者和来源给予适当的署名,提供知识共享许可协议的链接,并注明是否有更改。本文中的图像或其他第三方材料包含在文章的创作共用许可协议中,除非在材料的信用额度中另有说明。如果材料未包含在文章的创作共用许可协议中,并且您的预期使用不被法定法规所允许或超出了允许的使用范围,您将需要直接获得版权所有者的许可。如欲查看本牌照的副本,请浏览gydF4y2Bahttp://creativecommons.org/licenses/by/4.0/gydF4y2Ba.gydF4y2Ba
关于本文gydF4y2Ba
引用本文gydF4y2Ba
丹姬,K,八木,S,竹下,E。gydF4y2Baet al。gydF4y2Ba口服人碳酸酐酶I抑制小鼠炎症性肠病模型中的结肠炎。gydF4y2BaSci代表gydF4y2Ba12gydF4y2Ba, 17983(2022)。https://doi.org/10.1038/s41598-022-22455-ygydF4y2Ba
收到了gydF4y2Ba:gydF4y2Ba
接受gydF4y2Ba:gydF4y2Ba
发表gydF4y2Ba:gydF4y2Ba
DOIgydF4y2Ba:gydF4y2Bahttps://doi.org/10.1038/s41598-022-22455-ygydF4y2Ba
评论gydF4y2Ba
通过提交评论,您同意遵守我们的gydF4y2Ba条款gydF4y2Ba而且gydF4y2Ba社区指导原则gydF4y2Ba.如果您发现一些滥用或不符合我们的条款或指导方针,请标记为不适当。gydF4y2Ba