摘要
高尿酸血症(high uricemia, HUA)是指体内血清尿酸(SUA)水平高的一种生理状态,可引起多种慢性疾病风险的增加。肾脏尿酸(UA)代谢受损是引起HUA的重要原因。在本研究中,我们验证了运动过程中产生的循环因子调节正常大鼠肾脏和正常大鼠肾脏细胞(NRK-52E)中ABCC4、ABCG2、URAT1和GLUT9的表达及其与NF-κB和NRF-2的关系。10只健康SD大鼠不运动(CON)和10只健康SD大鼠进行有氧跑步机运动6周,分别用血清培养NRK-52E细胞。采用无NRF-2抑制剂(EXE)和有NRF-2抑制剂(EXE + ML)的大鼠有氧运动6周血清培养细胞。干化学法检测大鼠SUA水平,酶比色法检测血清和肝脏黄嘌呤氧化酶(XOD)活性,Western-blot法检测肾脏和NRK-52E细胞蛋白表达,比色法检测上、下腔UA水平。有氧运动降低了大鼠的SUA水平,但对肝脏黄嘌呤氧化酶没有显著影响。增加肾脏和NRK-52E细胞中部分UA转运蛋白的表达,提高细胞排泄UA的能力。当NRF-2被抑制时,NF-κB和ABCG2表达增加,ABCC4、URAT1和GLUT9表达减少。综上所述,本研究提示6周的有氧跑步机运动干预可能有助于改善肾细胞尿酸的排泄,提示长期有氧运动可能是预防高尿酸血症的一种手段。
介绍
UA在肾脏疾病中起着重要作用1.HUA是一种与SUA水平直接相关的生理状态。体内长期高水平的SUA会引起各种组织损伤和功能下降,可能诱发痛风2,肾脏损伤3.,代谢综合征4,5,以及其他严重影响身体健康的疾病。肾脏在体内各种物质的代谢中起着至关重要的作用,也是体内尿酸排泄的主要途径。肾脏尿酸的排泄有四个步骤:过滤、分泌前重吸收、分泌和分泌后重吸收6.ABCC4, ABCG27,8, GLUT99、URAT110在肾小管上皮细胞中有重要的作用,其功能障碍可能影响UA的排泄。
运动对身体的所有生理系统都有多重影响11.由于组织和器官的适应,定期的体育活动和运动训练可增强功能能力和改善身体健康。近年来,已有研究证明,骨骼肌的收缩可以释放出多种代谢产物,如生物活性蛋白,这些代谢产物可能在有规律的运动中,对增强人体各种组织器官的功能起着重要作用12,13.此前的研究表明,运动后血液中代谢产物的增加可以改善海马功能14增加人脂肪细胞中GLUT4的表达15.另一项研究表明,长期运动经历的人的血清也增加了海马神经元细胞的脑源性神经营养因子(BDNF)和原肌球蛋白相关激酶B (TrkB)的蛋白表达(HT-22)。16这表明运动导致循环生物活性分子的增加。
运动可以降低HUA患者的SUA水平,在健康人群中也有类似的效果17.已有研究表明,NF-κB和NRF-2可能在调节这些UA转运蛋白在人体各组织中的表达中起着重要作用,而运动对NF-κB和NRF-2的影响也得到了证实12,13.然而,运动减少SUA的原因还不清楚。本研究旨在探讨运动大鼠血清是否影响正常大鼠肾细胞通过ABCC4、ABCG2、URAT1、GLUT9转运UA的能力及生理机制。
材料与方法
动物和细胞
该研究获得了北京体育大学体育科学实验伦理委员会(ID 2020175A)的批准。据报道,该研究遵循了arrival指南。所有有关实验动物处理和使用的程序都是按照欧盟(UE)关于保护用于科学研究的动物的指令2010/63/EU的规定执行的。实验是按照所谓的3Rs原则进行的(替换,还原,提纯动物)。
选用健康雄性SD大鼠20只(8周龄,体重229.788±16.609 g),购自思培福(北京)生物技术有限公司(SCXK2019-0010)。所有大鼠按Excel生成的随机数表编号,随机分为对照组(CON, n = 10)和运动组(EXE, n = 10),体重分别为230.742±13.836和228.834±19.727 g(平均±SD)。NRK-52E细胞购自武汉Procell生命科学技术有限公司(Procell, CL-0174)。
大鼠运动计划
运动干预前,EXE组大鼠适应跑步机运动3 d。适应跑步机后,每只大鼠在坡度和VO为5°的跑步机上进行分级运动测试2max使用哥伦布Oxymax系统(哥伦布仪器,美国)进行测试。当大鼠被电击后不奔跑时,或当结果为VO时2连续两次下降,则认为该鼠已达到VO2最大强度。在这6周内,VO2max每两周检测一次,根据VO调整运动强度2最大的结果。EXE组在跑步机上以50% VO热身10分钟2运动前最大强度。热身后,EXE组以70% VO进行50分钟的有氧运动2最大强度(坡度:5°)。运动干预为期6周,每周6天。
样品收集
末次运动后24h,大鼠腹腔注射20%氨基甲酸乙酯溶液(5 ml/kg)麻醉。从大鼠腹主动脉取血置于真空血管中,离心取血清。采集大鼠的肾脏和肝脏,所有样本保存在- 80°C备用。
细胞培养
细胞培养前,将同组大鼠血清充分混合。NRK-52E细胞分为对照组(CON)、运动血清组(EXE)和运动血清与ML385组(EXE + ML)在DMEM + 10%FBS + 1%(青霉素-链霉素溶液)的6孔板中培养。待细胞生长至约80%融合后,无血清暴露24小时,然后在不同的新培养基中暴露24小时(37°C, 5% CO2饱和湿度)进行进一步测试。CON组的培养液含有10%的CON大鼠血清,EXE组的培养液含有10%的EXE大鼠血清,EXE + ML组的培养液含有10%的EXE大鼠血清,并添加高效NRF-2抑制剂ML385 (5 μmol/L)18.
细胞尿酸转运能力
细胞按上述方法培养24 h后,将细胞置于跨孔板上腔。上室和下室分别代表肾细胞的顶端侧和基底侧。因此,对每组细胞设置两种不同的处理方法,以验证不同处理方法对NRK-52E细胞UA排泄和UA重吸收能力的影响。1只在上腔以300 μmol/L的UA处理24 h,测定下腔UA水平,以反映不同干预方式对NRK-52E细胞UA重吸收能力的影响。另一组仅在下腔中添加300 μmol/L的UA,通过测定上腔中UA的水平来反映不同干预方法对NRK-52E细胞UA排泄能力的影响。用UA试剂盒(南京建成生物工程研究所,C-012-2)比色法测定上、下腔UA水平,以反映细胞对UA的重吸收或排泄能力。
血清尿酸
在6周运动干预前后,从所有大鼠的眶后丛中抽取血液。在3500 rpm离心15 min后获得血清。在试验条上加入血清滴液,用旺德福DC-101(广州旺德福生物科技有限公司,CHN)干化学法测定SUA。
血清和肝脏XOD
采用大鼠XOD试剂盒(武汉斯普比奥股份有限公司),酶比色法测定血清(末次运动后24 h)和肝脏XOD水平。
总蛋白提取和Western Blot
收集肾脏和NRK-52E细胞。肝脏在预冷EP管中低温均质20 s 2 ~ 3次。冰浴30分钟后,在4℃离心30分钟(13000 rpm)提取上清。用BCA试剂盒(P0010;Beyotime)。提取的蛋白上清与5 ×蛋白负载缓冲液(按4:1体积混合)放入沸水中浸泡10分钟。变性后冷却至室温,−20℃保存。蛋白(每个通道20 μL)装入预先制备的凝胶(5%浓缩凝胶,12%分离凝胶)上,用DYY-7C电泳仪(北京六一仪器,CHN)电泳。使用CZ-40转移箱(北京六一仪器,CHN)将凝胶转移到PVDF膜上,然后用ponceau染色,然后切割印迹,然后与抗体杂交。用不同稀释比例的特异性抗体对蛋白进行免疫印迹处理(见表1)中含有5%脱脂奶粉(SMP)的TBST。然后用TBST中的第二抗体对蛋白进行处理。每个膜上只检测到一种蛋白和GAPDH。使用BandScan分析灰度值。
统计分析
所有大鼠SUA及NRK-52E细胞中UA转运体蛋白表达均以Mean±SD表示。采用SPSS19.0对所得数据进行Kolmogorov-Smirnov检验,所有数据均符合正态分布。组间比较采用SPSS 19.0独立样本t检验,组内比较采用配对样本t检验,p< 0.05,p< 0.01为统计学差异。
结果
XOD和SUA水平
运动6周后,CON和EXE之间血清和肝脏XOD水平无显著差异(表2)2和无花果。1B). EXE组的SUA低于CON组(p< 0.05;表格3.和无花果。1一个)。
NRK-52E细胞的尿酸排泄和重吸收能力
细胞的上腔UA水平在EXE组高于CON组(p< 0.05;表格4和无花果。1C), EXE + ML组细胞上腔UA水平低于EXE组(p< 0.05;表格4和无花果。1C). EXE + ML组细胞下腔UA水平低于EXE组(p< 0.01;表格4和无花果。1D)。
NF-κB和NRF-2蛋白表达
运动6周后,EXE组大鼠的NRF-2表达高于CON组,但CON组和EXE组大鼠的NRF-2表达无明显差异(表2)5和无花果。2A1, B1)。EXE组肾脏NF-κB表达明显低于CON组(p< 0.01;表格5和无花果。2A1, C1)。
将NRK-52E细胞暴露于6周运动24小时后获得的10%血清中,平均增加了21.0%的NRF-2蛋白表达(p< 0.01;表格6和无花果。2A2, B2),与暴露于10%血清的不运动大鼠相比。将NRK-52E细胞暴露于含有ML385的运动6周24小时后获得的10%血清中,NRF-2蛋白表达降低(p< 0.01;表格6和无花果。2A2, B2),与暴露于运动后获得的10%血清但没有ML385相比。
将NRK-52E细胞暴露于运动6周24小时后获得的10%血清中,NF-κB蛋白表达平均降低44.2% (p< 0.01;表格6和无花果。2A2, C2),与未运动获得的10%血清暴露相比。将NRK-52E细胞暴露于含有ML385的6周运动24小时后获得的10%血清中,NF-κB蛋白表达增加(p< 0.05;表格6和无花果。2A2, C2),与暴露于运动后但无ML385的10%血清相比。
ABCC4和ABCG2蛋白表达
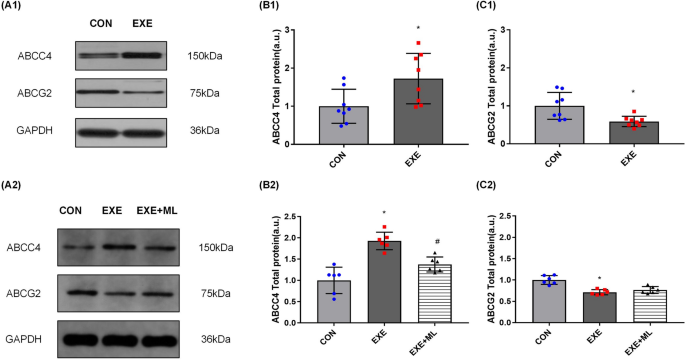
运动6周后,EXE组肾脏中ABCC4的表达明显高于CON组(p< 0.05;表格7和无花果。3.A1, B1)。EXE组肾脏中ABCG2的表达明显低于CON组(p< 0.05;表格7和无花果。3.A1, C1)。
将NRK-52E细胞暴露于运动6周24小时后获得的10%血清中,ABCC4蛋白表达平均增加92.7% (p< 0.01;表格8和无花果。3.A2, B2), ABCG2蛋白表达平均降低28.9% (p< 0.01;表格8和无花果。3.A2、C2)。将NRK-52E细胞暴露于含ML385运动6周24小时后获得的10%血清中,ABCC4蛋白表达降低(p< 0.01;表格8和无花果。3.A2, B2)与运动后获得的10%血清相比,但没有ML385。
URAT1和GLUT9蛋白表达
运动6周后,EXE组肾脏中URAT1的表达明显高于CON组(1.691±0.614 vs. 1.000±0.442 a.u。p< 0.05;表格9和无花果。4A1, B1)。EXE组肾脏中GLUT9的表达明显高于CON组(1.338±0.242 vs. 1.000±0.173 a.u.);p< 0.05;表格9和无花果。4A1, C1)。
将NRK-5he2E细胞暴露于运动6周24小时后获得的10%血清中,URAT1蛋白表达平均增加了126.2%(2.262±0.441 vs. 1.000±0.531 a.u)。p< 0.01;表格10和无花果。4A2, B2),与未运动获得的10%血清暴露相比。将NRK-52E细胞暴露于含有ML385的6周运动24小时后获得的10%血清中,URAT1蛋白表达降低(1.337±0.494 vs. 2.262±0.441 a.u。p< 0.01;表格10和无花果。4A2, B2),与暴露于运动后获得的10%血清但没有ML385相比。
NRK-52E细胞暴露于运动6周24小时后获得的10%血清中,GLUT9蛋白表达平均增加了126.0%(2.260±0.409 vs 1.000±0.550 a.u)。p< 0.01;表格10和无花果。4A2, C2),与未运动获得的10%血清暴露相比。将NRK-52E细胞暴露于含有ML385的6周运动24小时后获得的10%血清中,GLUT9蛋白表达降低(1.212±0.595 vs. 2.260±0.409 a.u)。p< 0.01;表格10和无花果。4A2, C2),与暴露于运动后但无ML385的10%血清相比。
讨论
在嘌呤代谢的下游途径中,XOD不仅催化了次黄嘌呤从中间体到黄嘌呤再到UA的代谢,而且直接催化了黄嘌呤从中间体到UA的合成,是生成UA的关键限速酶。XOD活性增加是HUA发生的主要原因之一19.我们的研究显示,有氧运动6周后,大鼠肝脏XOD活性无显著差异,说明有氧运动6周对大鼠UA的产生没有影响。有氧运动6周后,大鼠SUA水平明显低于对照组。
细胞在transwell板中培养时,上室和下室分别代表肾脏细胞的顶端侧和基底侧。因此,下腔的UA转运到上腔取决于细胞的UA排泄功能。相比之下,上腔的尿酸向下腔的转运依赖于细胞的尿酸重吸收功能。长期运动后的血液循环因子在血清暴露24小时后增加了NRK-52E细胞上腔UA水平。当抑制NRF-2时,上腔UA水平降低。这些结果提示,大鼠SUA的减少与肾脏UA排泄量的增加有关,细胞中UA转运体的功能可能与NRF-2的功能有关。
NF-κB和NRF-2在调节炎症反应中发挥重要作用20.,21还有氧化应激22.另外,一些UA转运蛋白的功能受NF-κB和NRF-2的调控23,24,25.提示NF-κB和NRF-2在HUA的发病机制和临床病理表型中发挥重要作用。长期规律的有氧运动还可以通过调节肾脏中NF-κB和NRF-2的表达来提高机体的抗氧化能力26,减弱氧化应激损伤,减少炎症反应,减轻肾脏损伤,改善肾功能27,28.在本研究中,有氧运动6周后,EXE组大鼠NF-κB表达明显低于CON组,虽然在EXE组和CON组大鼠之间NRF-2表达无显著差异,但EXE组大部分个体的NRF-2表达水平高于CON组。长期运动后,血清暴露24 h后,NRK-52E细胞中循环因子表达增加,NF-κB表达降低。以上结果提示,6周的有氧运动可以提高肾脏和细胞的抗氧化能力,抑制炎症反应,保护肾脏。
ABCC4 (MRP4)是肾细胞排泄UA的重要途径29.它通过上皮细胞消耗ATP将UA排入小管,使UA随尿液排出30..当ABCC4的表达被抑制时,肾脏对UA的排泄减少,这是HUA和痛风的风险31.ABCG2通过消耗ATP调节肾小管上皮细胞前膜UA的分泌32,33.当ABCG2蛋白表达增加时,UA的排泄量增加34,35证实了ABCG2在肾脏UA排泄中起着至关重要的作用,而ABCG2的功能变化也与HUA发生的风险密切相关36.
ABCC4和ABCG2在肾脏中具有排泄UA的功能,是各种抗癌药物和环境致癌物在各器官运输的底物37,38.因此,目前的研究主要集中在不同药物或环境对ABCC4和ABCG2功能的影响,相关研究表明具有抗氧化作用的药物可能通过调节NRF-2和NF-κB的表达来提高ABCC4和ABCG2的表达24.有氧运动也具有抗氧化作用,已证实其对人体各组织器官NRF-2表达的积极作用,提示长期有氧运动后血清循环因子可能通过NRF-2途径对ABCC4和ABCG2表达有积极作用39,40.然而,很少有研究关注运动对ABCC4和ABCG2表达的影响。只有一篇论文报道了在一段时间的跑步机运动后,大鼠海马中ABCG2的表达增加41,运动对肾脏中ABCC4和ABCG2表达的影响尚未见报道。
我们的结果表明,有氧运动增加了健康大鼠肾脏中ABCC4的表达,长期运动后的血液循环因子增加了血清暴露24 h后NRK-52E细胞中ABCC4的表达。这一结果提示运动后肾脏中UA转运体的表达变化与血液循环因子有关。而当NRF-2在细胞内被抑制时,ABCC4的表达下降。以上结果提示,长期运动后血清循环因子可显著提高肾小管上皮通过ABCC4排泄UA的能力,且ABCC4的表达与NRF-2的表达呈正相关。这一现象与以往研究中其他组织中蛋白质的变化趋势相同39,42,这与我们研究的假设相同。但在本研究中,有氧运动6周后,大鼠肾脏中ABCG2的表达下降,血清暴露24 h后,NRK-52E细胞中ABCG2的表达下降。当NRF-2被抑制时,NF-κB和ABCG2的表达增加,提示长期运动可能削弱肾小管上皮通过ABCG2排泄UA的能力。虽然ABCG2和NF-κB的相同趋势与我们的假设和之前的研究一致,但运动后血清暴露细胞中ABCG2的下降与我们的假设完全相反。我们的研究发现,NF-κB和NRF-2的变化相反。以上结果提示,有氧运动不能同时激活NF-κB和NRF-2的表达。ABCG2抑制的主要原因可能与运动后NF-κB表达降低有关。ML385抑制NRF-2后,NRK-52E细胞(EXE + ML组)NF-κB和ABCG2表达增加,也证实了上述观点。
有研究表明,ABCG2的表达取决于细胞内UA的水平43,因此推测血清暴露后ABCG2表达降低可能与培养基中低浓度的UA有关。因此,需要进一步研究这些现象的原因。
URAT1是一种表达于肾皮质近曲小管刷缘的UA转运蛋白,可在近曲小管约一半处重吸收UA44.一项相关研究表明,敲除URAT1可降低小鼠肾脏UA的重吸收功能,证实了URAT1对UA的重吸收作用10.我们的结果表明,有氧运动增加了健康大鼠肾脏中URAT1的表达,长期运动后的血液循环因子增加了血清暴露24 h后NRK-52E细胞中URAT1的表达。当NRF-2被抑制时,URAT1的表达下降。这一结果表明,URAT1的表达与NRF2呈正相关,长期运动后血清循环因子可能显著提高肾小管上皮通过URAT1吸收UA的能力。然而,URAT1的表达增加与我们的研究假设不一致,长期有氧运动通过增加UA的排泄和减少UA通过肾小管上皮的重吸收来减少SUA。相关研究表明,UA在体内是一种抗氧化剂,SUA水平的平衡对维持机体的抗氧化能力至关重要45.在本研究中,有氧运动6周后,血液循环因子导致肾脏和细胞中URAT1表达升高,可能是一种保护机制,以防止其他UA转运蛋白的升高导致UA过量排出。研究表明,HUA个体的URAT1表达高于健康个体46,47.健康大鼠运动后URAT1蛋白活性增加6该研究提出,运动诱导的URAT1表达和活性的变化与血尿酸水平升高有关。然而,我们的研究结果表明,运动后URAT1表达的变化并不仅仅与SUA水平有关。此外,除了HUA外,URAT1的表达也与低尿酸血症相关48.本研究中细胞URAT1表达的增加可能与低UA环境有关,因此推测本研究中血清暴露后URAT1表达的增加可能与培养基中低UA浓度有关。然而,这一现象的原因还需要进一步的实验来探索。
GLUT9主要在肝脏和肾脏中表达49,50,51,52.虽然被命名为葡萄糖转运蛋白9,但GLUT9的主要转运能力体现在UA的转运上,而不是葡萄糖9.一项相关研究表明,当GLUT9表达减少时,体内SUA水平降低46证实了GLUT9对UA的重吸收作用48.我们的结果表明,有氧运动增加了健康大鼠肾脏中GLUT9的表达,长期运动后的血液循环因子增加了血清暴露24 h后NRK-52E细胞中GLUT9的表达。当NRF-2被抑制时,GLUT9的表达下降。这一结果表明,GLUT9的表达也与NRF2呈正相关,长期运动后血清中循环因子可能大大提高肾小管上皮通过GLUT9重新吸收UA的能力。
综上所述,长期有氧运动后血液循环因子在调节肾脏UA转运蛋白表达中起重要作用,血液循环因子通过调节NRF-2调节ABCC4、URAT1、GLUT9,通过调节NF-κB调节ABCG2。目前尚不清楚运动后血清中哪种循环因子的变化最终会影响NRF-2和NF-κB。我们的研究结果表明,长期有氧运动可以促进肾脏UA的排泄能力,降低健康机体SUA水平,提示有氧运动可能是预防HUA的一种手段。为今后研究运动预防HUA的生理机制提供了理论依据。
数据可用性
支持本文结论的原始数据将由作者提供,没有任何保留。如果您需要本文提供的数据,可以通过电子邮件联系江忠业(1210962636@qq.com)或曹建民教授(BB45_Colorado@foxmail.com)。
参考文献
paalic, D., Marinkovic, N. & Feher-Turkovic, L.尿酸作为多因素疾病的重要因素之一——事实与争议。物化学。地中海。22, 63 - 75。https://doi.org/10.11613/bm.2012.007(2012)。
Saladini F。et al。有规律的体育活动可以防止高尿酸血症的年轻人发生高血压。j . Hypertens。35, 994 - 1001。https://doi.org/10.1097/hjh.0000000000001271(2017)。
Geraci G。et al。尿酸与肾脏血流动力学之间的关系:高血压患者肾损伤的病理生理学意义。j .中国。Hypertens。18, 1007 - 1014。https://doi.org/10.1111/jch.12812(2016)。
Kanbay, M。et al。代谢综合征中的尿酸:从一个无辜的旁观者到一个核心参与者。欧元。j .实习生。地中海。29, 3 - 8。https://doi.org/10.1016/j.ejim.2015.11.026(2016)。
高尿酸血症患者代谢综合征的患病率。点。j .地中海。120, 442 - 447。https://doi.org/10.1016/j.amjmed.2006.06.040(2007)。
大鼠肾脏URAT1活性和表达的变化。任。失败。32, 855 - 862。https://doi.org/10.3109/0886022x.2010.494805(2010)。
Takada, T, Suzuki, H. & Sugiyama, Y. LLC-PK1细胞中点突变或缺失突变的人BCRP/ABCG2极化表达的表征。制药。Res。22, 458 - 464。https://doi.org/10.1007/s11095-004-1884-9(2005)。
Van Aubel, R. A, Smeets, P. H, Van den Heuvel, J. J. & Russel, f.g.人有机阴离子转运蛋白MRP4 (ABCC4)是嘌呤末端代谢物尿酸盐的外排泵,具有多个变构底物结合位点。点。j .杂志。肾杂志。288, f327 - 333。https://doi.org/10.1152/ajprenal.00133.2004(2005)。
考尔菲尔德。et al。SLC2A9是人体高容量尿酸盐转运蛋白。科学硕士。5, e197。https://doi.org/10.1371/journal.pmed.0050197(2008)。
早,s.a。et al。多种有机阴离子转运蛋白促进尿酸的肾脏净排泄。杂志。染色体组。33, 180 - 192。https://doi.org/10.1152/physiolgenomics.00207.2007(2008)。
霍利,哈格里夫斯,乔伊纳,M. J. J.和齐拉斯,J. R.运动的综合生物学。细胞159, 738 - 749。https://doi.org/10.1016/j.cell.2014.10.029(2014)。
Safdar, A., Saleem, A. & Tarnopolsky, M. A.耐力运动衍生的外泌体治疗代谢性疾病的潜力。内分泌内分泌素。12, 504 - 517。https://doi.org/10.1038/nrendo.2016.76(2016)。
Whitham, M. & Febbraio, M. A.不断扩大的肌纤维组织:发现、挑战和治疗意义。Nat. Rev.药物发现。15, 719 - 729。https://doi.org/10.1038/nrd.2016.153(2016)。
霍洛维茨。et al。血液因子将运动对神经发生和认知的有益作用转移到老年大脑。科学369, 167 - 173。https://doi.org/10.1126/science.aaw2622(2020)。
Flores-Opazo, M, Raajendiran, A, Watt, M. J. & Hargreaves, M.运动血清增加人脂肪细胞中的GLUT4。Exp。杂志。104, 630 - 634。https://doi.org/10.1113/ep087495(2019)。
宁,W。et al。运动血清对海马HT-22细胞突触形成及BDNF和TrkB蛋白表达的影响辽宁体育科学抛光工艺。42, 52-56。https://doi.org/10.13940/j.cnki.lntykj.2020.06.012(2020)。
G.里皮,Brocco, G. Franchini, M. Schena, F. & G. Guidi, G.男性职业耐力运动员血清肌酐、尿酸、白蛋白和葡萄糖与健康对照的比较。中国。化学。实验室。地中海。42, 644 - 647。https://doi.org/10.1515/cclm.2004.110(2004)。
辛格。et al。NRF2小分子抑制剂选择性干预keap1缺失NSCLC肿瘤的耐药。ACS化学。医学杂志。11, 3214 - 3225。https://doi.org/10.1021/acschembio.6b00651(2016)。
罗氏公司,。et al。rasburicase治疗Lesch-Nyhan综合征继发高尿酸血症的疗效。点。J.肾病。53, 677 - 680。https://doi.org/10.1053/j.ajkd.2008.09.011(2009)。
Chin J. P,陈昌明,Lee T. H, Chou C. w, Lu C. y广州管圆线虫条件下的培养基通过激活Erk1/2和NF-κB诱导大鼠RSC96雪旺氏细胞中髓鞘碱性蛋白的改变。下巴。j .杂志。61, 137 - 143。https://doi.org/10.4077/cjp.2018.Bag544(2018)。
程,L。et al。异丙酚通过抑制ERK1/2/NF-κB通路,部分减弱弗氏佐剂诱导的完全神经炎症。j .细胞。物化学。120, 9400 - 9408。https://doi.org/10.1002/jcb.28215(2019)。
何晓明,王丽娟,王晓明,王晓明,白藜芦醇通过激活核因子红系2相关因子2通路抑制百草枯诱导的氧化应激和纤维化反应。j .杂志。其他实验。342, 81 - 90。https://doi.org/10.1124/jpet.112.194142(2012)。
王,Z。et al。白藜芦醇通过抑制NF-κB信号通路的激活和抑制camp响应元件的转录活性,诱导大肠癌HCT116/L-OHP细胞ampk依赖性MDR1抑制。肿瘤医学杂志。36, 9499 - 9510。https://doi.org/10.1007/s13277-015-3636-3(2015)。
隋,H。et al。evo二胺通过抑制结直肠癌p50/p65 NF-κB通路抑制ABCG2介导的耐药j .细胞。物化学。117, 1471 - 1481。https://doi.org/10.1002/jcb.25451(2016)。
南卡罗来纳州拉什沃斯。et al。人急性髓系白血病中Nrf2的高表达是由NF-κB驱动的,是其耐药的基础。血120, 5188 - 5198。https://doi.org/10.1182/blood-2012-04-422121(2012)。
雷纳,s.m。et al。短期运动训练可以提高胰岛素敏感性,但不能抑制胰岛素抵抗受试者免疫细胞中的炎症途径。J. Diabetes Res;2013, 107805年。https://doi.org/10.1155/2013/107805(2013)。
预防:在1型糖尿病患者中,高强度运动与降低糖尿病肾病风险相关。奈特。Rev.尼弗罗尔。11, 198年。https://doi.org/10.1038/nrneph.2015.17(2015)。
格尔比迪,梅斯达奇尼亚,A. &拉赫尔,I.代谢综合征中的运动。氧化物。地中海。细胞。Longev。2012, 349710年。https://doi.org/10.1155/2012/349710(2012)。
Masereeuw, R. & Russel, f.g.肾脏阴离子药物转运体的治疗意义。杂志。其他。126, 200 - 216。https://doi.org/10.1016/j.pharmthera.2010.02.007(2010)。
杨,Z。et al。尿酸通过上调大鼠肾小管上皮细胞赖氨酸氧化酶的表达增加纤维连接蛋白的合成。点。j .杂志。肾杂志。299, f336 - 346。https://doi.org/10.1152/ajprenal.00053.2010(2010)。
小黄瓜,Du。et al。獐牙菜醇提物对大鼠肝胆汁酸转运蛋白Mrp4和转录因子Nrf2表达的影响第三军医大学;37, 957 - 961。https://doi.org/10.16016/j.1000-5404.201501038(2015)。
倪振华,毛青青,张晓燕,张晓燕,张晓燕。人乳腺癌抵抗蛋白(BCRP/ABCG2)的结构与功能研究。咕咕叫。药物金属底座。11, 603 - 617。https://doi.org/10.2174/138920010792927325(2010)。
Haslam, i.s。et al。肠道环丙沙星外排:乳腺癌抵抗蛋白(ABCG2)的作用。药物金属底座。Dispos。39, 2321 - 2328。https://doi.org/10.1124/dmd.111.038323(2011)。
Ichida, K。et al。肾外尿酸排泄减少是高尿酸血症的常见原因。Commun Nat。3., 764年。https://doi.org/10.1038/ncomms1756(2012)。
Kottgen,。et al。全基因组关联分析确定了18个与血清尿酸盐浓度相关的新位点。Nat,麝猫。45, 145 - 154。https://doi.org/10.1038/ng.2500(2013)。
Kostalova, E., Pavelka, K., Vlaskova, H., Musalkova, D. & Stiburkova, B.女性携带者缺乏低黄嘌呤-鸟嘌呤磷酸核糖转移酶所致的高尿酸血症和痛风:鉴别诊断的新见解。中国。詹。Acta Int。j .中国。化学。440, 214 - 217。https://doi.org/10.1016/j.cca.2014.11.026(2015)。
毛青,王晓燕。乳腺癌耐药蛋白(BCRP/ABCG2)在药物转运中的作用研究进展。aap J。17, 65 - 82。https://doi.org/10.1208/s12248-014-9668-6(2015)。
Belleville-Rolland, T。et al。MRP4 (ABCC4)是心血管疾病的潜在药理靶点。杂志。Res。107, 381 - 389。https://doi.org/10.1016/j.phrs.2016.04.002(2016)。
Xu, S, Weerachayaphorn, J., Cai, S. Y, Soroka, C. J.和Boyer, J. L.芳基烃受体和nf - e2相关因子2是人类MRP4表达的关键调控因子。点。j .杂志。Gastrointest。肝脏杂志。299, g126 - 135。https://doi.org/10.1152/ajpgi.00522.2010(2010)。
金,e。J。et al。NRF2敲低通过抑制HO-1和ABCG2的表达使5-氟尿嘧啶耐药胰腺癌细胞再敏。Int。分子科学。https://doi.org/10.3390/ijms21134646(2020)。
跑步机运动对TgAPP/PS1小鼠血脑屏障Aβ运输和清除的影响。华东师范大学博士学位论文(2017)。
贾勇,陈娟,朱辉,贾振华,崔敏华,异常升高的氧化还原敏感因子Nrf2通过增强ABCG2和Bcl-2/Bmi-1基因的转录调控促进癌症干细胞存活。肿瘤防治杂志。代表。34, 2296 - 2304。https://doi.org/10.3892/or.2015.4214(2015)。
尿酸盐转运体基因在代谢障碍发展中的潜在作用。Cureus10, e2382。https://doi.org/10.7759/cureus.2382(2018)。
榎本失败,。et al。调节血液尿酸水平的肾尿酸阴离子交换剂的分子鉴定。自然417, 447 - 452。https://doi.org/10.1038/nature742(2002)。
Roumeliotis, S, Roumeliotis, A., Dounousi, E., Eleftheriadis, T. & Liakopoulos, V.膳食抗氧化补充剂与慢性肾脏疾病尿酸:一项综述。营养物质https://doi.org/10.3390/nu11081911(2019)。
勇,T。et al。蜜环菌对通过OAT1和CNT2调节的高尿酸血症小鼠的低尿酸血症作用。点。j .下巴。地中海。46, 585 - 599。https://doi.org/10.1142/s0192415x18500301(2018)。
Abramowicz, M., Zuccotti, G. & Pflomm, J. M. J. J. Lesinurad/别嘌醇(Duzallo)用于痛风相关高尿酸血症。《美国医学会杂志》319, 188 - 189。https://doi.org/10.1001/jama.2017.20189(2018)。
Windpessl, M. Ritelli, M. Wallner, M. & Colombi, M.与肾诱导低尿酸血症相关的一种新的纯合子SLC2A9突变。点。j . Nephrol。43, 245 - 250。https://doi.org/10.1159/000445845(2016)。
刘,S。et al。根皮素通过共同抑制炎症和glut9介导的尿酸摄取来减弱高尿酸血症诱导的内皮功能障碍。J.细胞分子医学。21, 2553 - 2562。https://doi.org/10.1111/jcmm.13176(2017)。
奥古斯汀,R。et al。人葡萄糖转运蛋白样蛋白-9 (GLUT9)的鉴定和鉴定:选择性剪接改变转运。生物。化学。279, 16229 - 16236。https://doi.org/10.1074/jbc.M312226200(2004)。
Keembiyehetty C。et al。小鼠葡萄糖转运蛋白9剪接变异体在成人肝脏和肾脏中表达,并在糖尿病中上调。摩尔。性。20., 686 - 697。https://doi.org/10.1210/me.2005-0010(2006)。
H. B.和Moley J. F.葡萄糖促进转运蛋白家族新成员SLC2A9 (GLUT9)的克隆和表达分析。基因组学66, 217 - 220。https://doi.org/10.1006/geno.2000.6195(2000).
确认
感谢北京体育大学动物实验室在动物饲养训练、NRK-52E细胞培养和血清暴露实验等方面的帮助。
资金
本研究得到中央高校基本科研业务费专项基金(2020033和20211016)的资助。
作者信息
作者和隶属关系
贡献
Z.Jiang。,J.Cao. and H.S. designed the experiment. H.Jiang. and Y.Fan. trained rats for 6 weeks. Z.Sun. collected the plasma samples after exercise. Z.Jiang. undertook the NRK-52E cell culture experiments, Z.Sun. completed all biochemical and molecular analyses, H.Cao. completed all data statistics. Z.Jiang. wrote the initial draft of the manuscript, and all authors contributed to, reviewed and approved the final version of the submitted manuscript. All authors agree to be accountable for all aspects of the work in ensuring that questions related to the accuracy or integrity of any part of the work are appropriately investigated and resolved. All persons designated as authors qualify for authorship, and all those who qualify for authorship are listed.
相应的作者
道德声明
相互竞争的利益
作者声明没有竞争利益。
额外的信息
出版商的注意
施普林格自然对出版的地图和机构附属的管辖权要求保持中立。
补充信息
权利与权限
开放获取本文遵循创作共用署名4.0国际许可协议(Creative Commons Attribution 4.0 International License),该协议允许在任何媒体或格式中使用、分享、改编、分发和复制,只要您给予原作者和来源适当的署名,提供创作共用许可协议的链接,并说明是否有更改。本文中的图片或其他第三方材料包含在文章的创作共用许可中,除非在材料的信用额度中另有说明。如果材料不包含在文章的创作共用许可中,并且您的预期用途不被法律法规允许或超出了允许的用途,您将需要直接从版权所有者那里获得许可。欲查看此许可证的副本,请访问http://creativecommons.org/licenses/by/4.0/.
关于本文
引用本文
蒋铮,曹军,苏慧华,曹军。et al。运动血清调节正常大鼠肾细胞的尿酸转运蛋白。Sci代表12, 18086(2022)。https://doi.org/10.1038/s41598-022-22570-w
收到了:
接受:
发表:
DOI:https://doi.org/10.1038/s41598-022-22570-w