摘要
α粒子发射体(αRPT)靶向放射药物治疗在癌症治疗中具有优势,因为α粒子的距离短、局部能量沉积高,可以实现精确的辐射传递和高效的肿瘤细胞杀伤。然而,这些特性产生的亚器官剂量沉积效应不容易被直接伽马射线成像(PET或SPECT)表征。我们提出了一种计算程序,利用来自电离辐射量子成像探测器(iQID)的数字自放射活度图像来确定组织中α发射放射性核素吸收剂量的空间分布。数据从211在犬模型中进行同种异体造血细胞移植的at -放射免疫治疗研究,以开发这些方法。9只健康犬接受16.9-30.9 MBq的治疗211At/mg单克隆抗体(mAb)从早期(2-5小时)和晚期(19-20小时)的时间点(共16个)获得淋巴结活检,从每个时间点提取10-20个连续的12µm冷冻切片,用iid设备成像。iQID空间活动图像在三维体积内进行剂量点-核卷积,生成剂量率图。从剂量率曲线看,高速率区和低速率区的累积吸收剂量分别为9±4 Gy和1.2±0.8 Gy。我们进一步评估了摄取的均匀性、与组织病理的协同配准,以及改善αRPT吸收剂量不均匀性微观表征所需的切片数量。
简介
尽管近几十年来癌症治疗取得了进展,但难治性或转移性癌症患者在化疗、放疗和生物疗法治疗后仍然面临着具有挑战性的结果1.α粒子发射体(αRPT)的放射药物治疗利用α粒子的短范围(10-100 μ m)和高局部能量沉积(高达200 keV/ μ m线性能量转移或LET)来发挥治疗优势。当α粒子发射放射性同位素连接到能够靶向肿瘤细胞上特定抗原的载体上时,辐射可以有效地传递到病变组织,而对邻近健康细胞的辐射剂量最小。试验已经证明了在患者中显著的治疗效果,并导致美国食品和药物管理局(FDA)批准阿尔法释放223二氯Ra (Xofigo)治疗前列腺癌2,3.,4.
RPT领域正在越来越多地研究患者、肿瘤和器官特异性放射性核素分布的定量成像和剂量测定,以充分利用该模式的潜力,为患者提供知情处方5.亚器官空间剂量表征对于理解αRPT的作用尤为重要,因为治疗α粒子(~ 2-10 MeV)在组织中只能传播几个细胞直径,而标准化的小规模剂量测定方法已被确定为临床转化未满足的先决条件6,7.由于远距离光子信号的缺乏或极小,伽马射线成像技术对αRPT验证的适应具有挑战性。在体内评估组织中的α -发射器必须与这些程序的极低的管理活动相抗衡,这对图像质量构成了挑战8,9.使用替代示踪剂的技术在放射性药物动力学中引入了系统的不确定性,这可能主导被检测的子器官效应6,8.
在没有可靠的体内成像方法的情况下,亚器官α -粒子效应可能通过体外生物分布和使用放射自显像的剂量学研究来了解8,10.几种生物成像放射自显像具有高分辨率和大动态范围的特点——目前在体内方法无法达到的程度——已经被开发用于临床前和临床放射药物表征,包括α-相机11α相机12, Timepix探测器13、iQID(电离辐射量子成像探测器)相机14.该iQID具有近细胞分辨率(约20 μ m全宽半最大值或半宽半宽)、高检测效率(98%±1%)和实时逐个事件定量成像,因此已被用于αRPT研究中获得定量活性图15,16,17,18,19,20.,21.然而,由于对图像处理的要求很高,很少有研究从放射自显像中得到相关空间尺度的定量吸收剂量图。使用α-相机进行剂量测定的研究数量有限15,22,但这些方法还没有完全阐明。我们试图编纂一个健壮的数字放射自显影剂量测量框架,可以有效地处理许多组织切片,用于广泛的αRPT研究。
在这项工作中,我们提出了在α粒子药代动力学研究中使用iQID相机的辐射剂量测量方法。快速成像伴随着一套半自动Python脚本,用于定量活性估计、图像配准、吸收剂量和剂量率估计、摄取均匀性分析以及与苏木精和伊红(H&E)染色的共配准。数据来自16个犬淋巴结后给药211评估at标记的抗cd45单克隆抗体(mAb)用于异基因造血细胞移植条件下的演示和验证脚本。我们表明,在靶蛋白表达不均匀的组织中,平均剂量指标不能准确表征剂量分布,因此也不能准确表征治疗效果。为了提高数据收集吞吐量,我们评估了使用1-3片组织切片来评估剂量率的定量准确性,而不是使用10-20片。
我们遵循别处使用的RPT命名规范5,其中的项剂量描述的是辐射剂量(即吸收剂量,单位为J/kg或Gy),而不是药物的质量(如在非放射性治疗中使用)。这个物理量与所施的活性是可区分的,在适用的情况下,可在单位时间的放射性崩解(Bq或Ci)中讨论。
方法
Alpha-RIT成像实验
砹- 211 (211在造血细胞移植(HCT)准备方案中,抗cd45单抗放射免疫治疗(RIT)是一种有前途的替代外束全身照射(TBI)的血液恶性肿瘤,包括白血病和非霍奇金淋巴瘤15,23.这项研究使用了来自211At-RIT研究犬模型的HCT,以开发广泛适用于组织切片研究的算法。由于犬科淋巴瘤在解剖形态、临床表现、细胞表面标记物和治疗反应方面与人类淋巴瘤相似,因此在治疗研究中,犬科淋巴瘤是一种实用的和临床相关的模型24,25.
数据收集如前所述15: 9只健康犬接受16.9 ~ 30.9 MBq的治疗211At/mg mAb(补充表S1).在早期(2-5小时)和晚期(19-20小时)时间点进行淋巴结活检(n = 16)。受试者体重在7.9-13公斤之间,服用0.5或0.75毫克/公斤的211at标记的抗cd45单抗CA12.10C12-B10 (8.44-23.2 MBq/kg注射活性,IA)。iid成像和活度、剂量率和吸收剂量计算如下所述。
伦理批准
所有的程序都得到了Fred Hutchinson癌症中心机构动物护理和使用委员会(IACUC)的批准。26.Fred Hutchinson在美国农业部注册为研究机构(91-R-0081),在PHS/OLAW (D16-00142)文件中有保证书,并获得AAALAC国际的完全认证。研究设计和方法之前报道过15结合当前手稿中的报告,遵循arrival指南中的建议。
连续切片
的211在衰变系列中包含两个阿尔法粒子发射211在和子代放射性核素211Po的能量分别为5.87和7.45 MeV,对应于水中48和70 μ m的范围27.从每个活检组织中提取10-20个连续的12 μ m冷冻切片,这些切片跨越范围,每个都允许α粒子逃逸,以估计中心切片中α粒子的吸收剂量率。使用ivid设备同时测量系列中每个切片的活度。我们在下一次活检前尽可能长时间地收集数据,以减少统计上的不确定性,并利用可用的成像时间(约15小时,或7.2小时半衰期的两倍211在)。我们丢弃了后处理分析中有重大撕裂或褶皱的样品,用相邻切片的副本替换。由于丢弃的样本数量超过了可接受的样本,因此没有对一只犬的两份完整的活组织切片进行分析。与样本收集相关的挑战将在片最小化一节中进一步讨论。
iQID相机
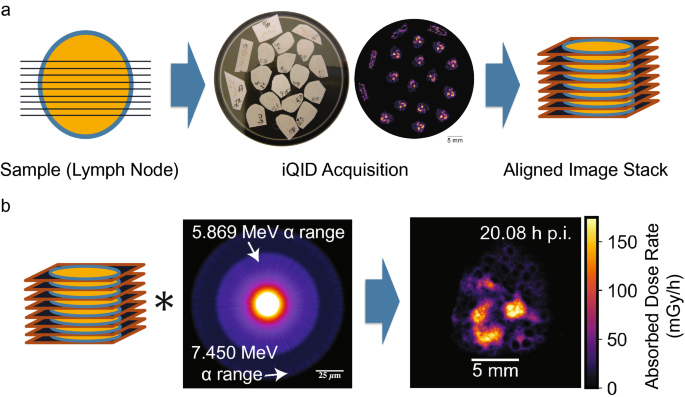
在之前的工作中详细描述了iQID的工作机制、闪烁器选项和特性、器件原理图和事件读出系统14,28.在这些实验中使用了相同的设置。简而言之,该设备包括一个与微通道板像增强器直接接触的闪烁体和一个透镜,该透镜将闪烁光投射到一个带有CMOSIS CMV4000 CMOS传感器的400万像素(2048 × 2048)点灰研究蚱蜢®3相机上28.α粒子在ZnS:Ag闪烁屏(ejb -440;Eljen Technology),选择它是因为它的商业可用性和极高的光产率(~ 95000光子/MeV)29.闪烁光被空间信息保存图像增强器放大,并使用闭路电视摄像机镜头成像到CMOS传感器上。每一个α -粒子相互作用事件在图像帧中显示为CMOS相机上的一个相邻像素的小簇。多个阿尔法粒子事件可能出现在单一的图像帧中,并使用质心估计处理为单事件在具有空间和时间信息的列表模式数据。因此,iQID是一个逐个事件的测量设备,其中每检测到一个阿尔法衰减记录一个计数。使用ZnS:Ag对3.70 - 7.95 MeV之间的α粒子的iQID效率之前在4π几何中测量为98%±1%14,或者是实验中使用的2π几何的一半。图像测量速度为每秒20-30帧(33-50毫秒曝光时间)。一个校准刻度确定了测量的有效像素大小(10-30 μ m)。之前的工作14表征了本征检测器分辨率可达20 μ m (FWHM)。实时iQID图像和采集设置在定制开发的LabVIEW™采集软件中查看。在iid设备上的组织样本的自上而下视图,以及随后的iid事件图像,可以在图中看到。1(中心)。
图像配准
我们使用开源Python库的组合,包括scikit-image(0.18.1),将iid放射自显像处理成剂量率图像。30.OpenCV (4.0.1)31,和PyStackReg (0.2.5)32,33.数字1概述了数字放射自显影剂量学的概念。2详细说明所需处理步骤的顺序。这些方法的脚本可以在Github上以开发中的Python包的形式获得https://github.com/robin-peter/iqid-alphas(https://doi.org/10.5281/zenodo.7117835).
多层放射自显像被分割成相应于离散组织切片的感兴趣区域(roi)。对每个ROI中检测到的事件进行时间分组和指数校正211在衰减时,最小二乘残差优化指数拟合到时间直方图的计数在成像过程中。这个过程产生了活检时每个组织切片的空间活动快照。
我们通过将每个薄片(12 μ m)近似为其相邻薄片的最小畸变二维变换,在一个3D体积内对连续切片的活动图像进行了配准。1a).通过旋转角度使图像强度之间的均方误差(MSE)最小化,粗略获得方向。然后应用打包的刚体转换(平移和旋转)进行精确对齐(PyStackReg)。记录由旋转引起的累积活度的小误差,并用标量补偿因子(平均误差2.2%)进行校正。
剂量率估计
我们使用剂量点核(DPK)卷积法和蒙特卡罗(MC)核来估计组织中的空间剂量率。DPK卷积已经用解析和mc生成的核进行了研究,特别是用于γ和β发射体的内部剂量测定6,22,34,35.我们生成了三维能量沉积核(图。3.)使用1- μ m体素,使用GEANT4蒙特卡罗框架36,模拟107阿尔法粒子从211在水中的衰变链。211在和211假设Po处于长期平衡状态,只有α粒子作为初生粒子产生。核径向平均,分装到iQID图像堆栈的体素大小(XY: 10-30µm;Z: 12µm)。在径向平均和图像特定分档之前,与任何非零1- m体素相关的平均统计不确定度为1.1%。
蒙特卡罗能量沉积核211在水中的粒子[10]7事件,GEANT436].(一个) 1- μ m体素核(151 × 151 × 151 μ m),表现为两个α衰变路径211在。(b)核,体素中能量沉积百分比为12 μ m。能量沉积迅速超过相邻的12 μ m组织切片。(c的半测井径向剖面一个)归一化为一个阿尔法粒子,显示随距离下降。
三维活动图像栈的卷积左(r \ \ (\) \)能量沉积核左(r \ \ (K \) \),以及通过体素密度包含质量\(\rho \左(r \右)\)和体积左(r \ \ (V \) \),生成了三维瞬时剂量率快照\点(\ D{} \左(r \) \)活检时(图5)1b):
在这里,我们使用了ICRU第96号报告的命名法6,在那里\ (r \)表示源位置和\ (r ^ {\ '} \)表示目标位置。(离散)卷积积分是用快速傅立叶变换(FFT)的打包Python方法计算的。我们使用来自图像堆栈中央切片的数据进行分析,因为精确的计算可能需要跨越整个的测量数据211在α -粒子范围内的切片,这是不保证外围切片。
组织学融合
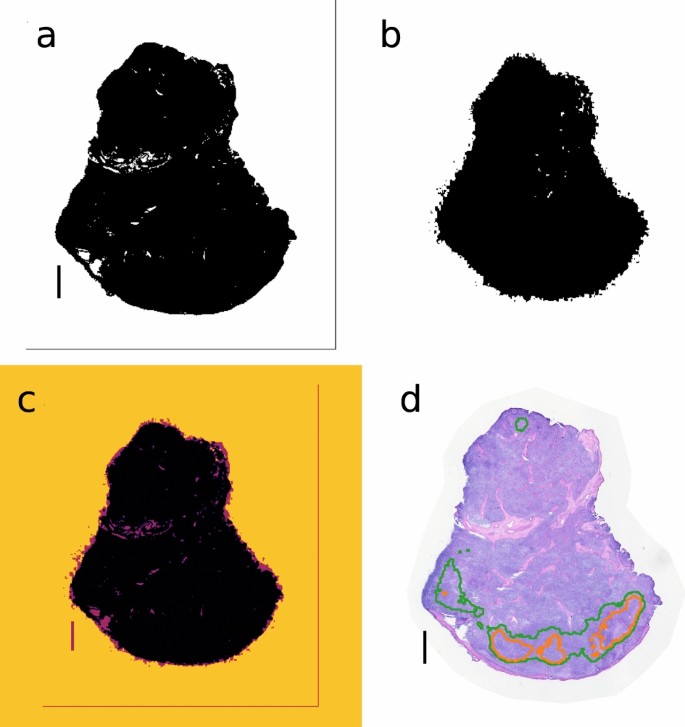
组织切片连续与每个样本系列染色苏木精和伊红(H&E)使用标准方案。我们将H&E图像与iQID剂量率图进行数字联合注册,以比较病理信息和药物摄取。我们的方法是将高分辨率的H&E图像(50-200 MB)按20倍采样,以计算iid图像的适当转换,然后将转换后的iid图像映射到全分辨率的H&E污渍上。
我们首先将所有图像转换为二进制进行对齐。使用Otsu的方法(scikit-image)获得下采样的H&E图像的粗略阈值。37,一种基于方差的程序,通过聚类强度直方图来分离图像。对稀疏的iQID图像使用较小的阈值(Otsu阈值的十分之一),以获得覆盖整个淋巴结空间范围的二值值。我们从比例尺(H&E)和视场测量(iid)中获得像素大小,然后使用scikit-image的缩放功能按相应的因子缩放iid图像。使用描述的切片对齐方法(包括MSE强度比较和二维变换)对同维图像进行共配准。由于H&E切片与iqid测量的中心切片在空间上相隔50-100 μ m,我们允许在共配准过程中发生一些错位和剪切转变。阈值检测、缩放因子和2D转换都是自动计算和应用的,并对反射进行手动校正(面朝上和面朝下的切片)。
片最小化
研究多个时间点和组织类型的剂量学研究可能会被所需的10-20 μ m组织切片所阻碍。采集无撕裂或褶皱的连续样品系列需要相当高的技术,可能会限制我们剂量测定方法的可及性。此外,设备视场(使用40和115毫米直径的ivid配置)可能限制成像吞吐量。成像通量对于使用短寿命放射性核素的实验很重要,在实验中,来自同一个活检组织或牺牲时间的几个组织在广泛的信号衰减之前应该成像,而长寿命放射性核素的成像时间很长,以获得统计上显著的计数。预计到这些吞吐量挑战,我们通过模拟DPK卷积过程的变化,研究了是否可以使用更少的切片获得剂量率估计。
我们假设,我们的剂量测定程序将产生类似的结果,无论是使用周围的几个切片(共1-3片)或全套(中心切片两侧最多10片)来计算中心切片剂量率图。数字3.说明了我们的推理,显示了冰冻切片切片厚度(12 μ m)的平均每α粒子能量沉积核。3.a),能量在选定体素中的分布(图。3.b)和核的径向轮廓,随着距离的增加,径向轮廓迅速下降(图5)。3.c).核的初始衰减是由于α粒子通量在3D介质中的分散,导致a\ (1 / r ^ {2} \)能量沉积减少,随两者211在阿尔法粒子上可以看到布拉格峰。在70 μ m处的急剧截止表明在7.45 mev以上沉积的能量最小211阿宝α粒子。因此,超过6片(72 μ m)的衰减事件不会对被测切片产生显著的剂量贡献,并且与靠近中心的切片相比,到达该点的切片所产生的剂量减少。
片贡献方法
我们通过模拟有限数据试验来验证我们的假设,在这些试验中,只从中心获得一个或几个连续的切片。这些空间剂量率计算方法与上述方法相同,只是有一点不同N=1, 3, 5,马克斯中心切片用于三维iQID活动图像堆栈,而N马克斯切片用于原始分析。中央切片中所有体素的总和剂量率,\点(\ D {} _ {N} \)记录下来,与所有可用切片的剂量率进行比较,\点(\ D {} _ {0} \).为了保持中央切片测量的对称性,我们通过在每边增加一个额外切片来模拟奇数切片数的试验N.
为了使用该方法获得准确的剂量率,通过经验拟合得到了有限切片数据的校正因子\点(\ D {} _ {N} /{维}_{0}\ \点)关于N.然而,校正因子的确定需要完整的数据集(10-20片)。尽管这种方法可以减少使用相同数据集的后续过程的切片需求,但我们寻求了一种不受此约束的替代方法。
克隆方法
我们研究了一种不需要初始切片的替代有限数据方法,其中有限切片模拟中未测量的组织被最外层测量切片的副本或克隆数字替代。有限数据的试验N=1, 3, 5,马克斯中间的切片,剩下的N马克斯1, N马克斯3、N马克斯5、0…切片是两侧外部切片的复制品。然后进行DPK卷积,如上所述。两种方法的图解如图所示。7一个。
结果
吸收不均匀
我们的研究证实了低活性组织背景下的局部高活性区域。利用自动生成的轮廓遮罩将组织从非组织背景中数字分割出来。活检时瞬时剂量率的体素值被归类为剂量率-面积直方图(图1)。4A),我们将其划分为三个区域,由均值的标准差定义。与这些区域相对应的区域在相应的剂量率图像上被突出显示(图1)。4b)。
在对一只代表性犬的两次活检研究中,各自的平均剂量率分别为46±45 mGy/h (2.15 h p.i.)和19±20 mGy/h (19.45 h p.i.)。不确定性代表一个标准偏差(σ),反映了剂量率-面积直方图的长高剂量尾(图。4a).因此,在各自的活检中,14%和13%的组织面积(> 1σ来自平均值)的剂量率值超过全器官平均值的两倍,5%和6%的组织面积(> 2σ)超过全器官平均值的3倍。数字4C显示了这些差异,在两个活检的早期和晚期时间点,每个子区域(< 1σ, > 1σ, > 2σ,以及整个淋巴结)的平均剂量率。
吸收剂量估算
在早期和晚期时间点使用16个活检的批次脚本估计剂量率,其中两个活检因样本缺陷而丢弃(见方法;n = 14)。我们假设犬类受试者的吸收和衰减运动学相似,以比较不同研究间ia归一化剂量率。由于均匀性分析表明,平均剂量率可能不是样本中所有区域的代表性度量,因此测量数据被分为每个淋巴结切片的高剂量率(> 2σ,“热”)和低剂量率(< 1σ,“冷”)区域。图中每个子集内的平均剂量率随时间绘制。5.
为了估计剂量,使用最小二乘残差优化将数据拟合为双指数函数(图2)。5).在每个活检数据子集内计算标准差,并将其作为误差,得到热区和冷区减少后的卡方值为19.5和2.2。在定量分析中,这些拟合质量值比通常预期的更偏离统一,特别是在高活动区域。然而,考虑到有限的样本点(6参数拟合的n = 14)和数据集中的可变性,这个结果并不令人惊讶。该研究没有针对淋巴结内的特定区域进行控制,导致样本有各种切割(冠状、矢状、横向)和体积(半淋巴结、全淋巴结)。因此,通过剂量率对区域进行分割可能导致高摄取的不同淋巴结结构区域之间的比较。
把冷热剂量率曲线积分到六211在半衰期给出了在淋巴结组织切片中接受的吸收剂量的上下限。通过将假设的剂量率曲线缩放到穿过数据集中的最大值来计算剂量,粗略估计了不确定性。平均IA为150±60 MBq(4.1±1.6 mCi),热地区和冷地区的辐射剂量分别为9±4 Gy和1.2±0.8 Gy。
组织学融合
数字6显示了ivid剂量率图像和H&E病理图像的配准过程,该图像在方法部分中描述。高剂量率区域的等高线覆盖在H&E图像上进行病理比较(图。6d)。
iid剂量率图像和h&e染色图像之间的配准程序。(一个) H&E阈值二值图像。(b) iQID剂量速率映射阈值二值图像。(c)共同注册(一个)和(b)使用比例因子和二维变换。(d图中高活性区域的等高线。4b覆盖在H&E图像上。比例尺显示1毫米。
片最小化
数字7A说明了使用有限数量的组织切片估计剂量率的两种后处理方法。在切片贡献法中,研究仅限于N切片有切片贡献\点(\ D {} _ {N} \),表示为全切片(对照研究)总剂量率的分数\点(\ D {} _ {0} \)(无花果。7b,左)。该数据的指数拟合(χ2/ν=1.73)提供了一个经验标量修正因子\ (C_ {N} \)以得出一个正确的剂量率估计\(\点{D}_{e} = C_{N} \点{D}_{N} .\)对拟合尺度法的疗效进行了评估(图。7B,右)通过比较e \点(\ D {} _ {} \)来\点(\ D {} _ {0} \).失去过去的准确性N=11(130µm)反映了用渐近模型拟合在充分时达到统一的数据N.在8只犬模型的14个活检中,平均偏差为e \点(\ D {} _ {} \)从\点(\ D {} _ {0} \)一片为9.5%,三片为2.4%。
片最小化分析。(一个)卡通示意图,显示使用有限数据逼近剂量率的切片贡献和克隆方法。(b)(左)累计贡献N片,\点(\ D {} _ {N} \),趋向中央切片剂量率\点(\ D {} _ {0} \).指数拟合(黑线,χ2/ν= 1.73)提供了一种放大低片剂量率图像的方法。(右)比较切片贡献法的评价e \点(\ D {} _ {} \)来\点(\ D {} _ {0} \).的平均偏差e \点(\ D {} _ {} \)从\点(\ D {} _ {0} \)(14例活检)一次切片为9.5%(灰色虚线)。(c)(左)克隆方法在冷热数据子集中的评价。(右)淋巴结切片马赛克突出显示评估区域。单片平均偏差e \点(\ D {} _ {} \)从\点(\ D {} _ {0} \)(14例活检)为4.8%,但不需要其他全切片数据。上面密集的热数据点,下面密集的冷数据点\(\点{D}_{e} /\点{D}_{0} = 1\)线条反映了被测量的切片对特征的过度强调。
切片贡献法需要完全对照研究(10-20片)才能计算α -粒子剂量率。我们提出了一种替代的“克隆”后处理方法,将有限片试验的外部片向外复制,以跨越DPK卷积前的α -粒子范围。
在8只犬模型的14个活组织切片中,单层切片的平均偏差e \点(\ D {} _ {} \)从\点(\ D {} _ {0} \)单片克隆法为4.8%,三片克隆法为1.8%。克隆方法试图在不具有多个切片的空间信息的情况下获得定量准确的剂量率,并假设周围组织在相同的空间位置包含相同的特征。我们通过在每个数据子集(热区、冷区和整个淋巴结均值)中评估相同的剂量率比较指标来验证这一假设。7c).的平均偏差e \点(\ D {} _ {} \)从\点(\ D {} _ {0} \)炎热和寒冷地区分别为7.9%/3.9%和6.5%/4.3%(单片/三片)。这个偏差,随着N,表明剂量率高估(在\(\点{D}_{e} /\点{D}_{0} = 1\)线)在热点地区和低估(以下\(\点{D}_{e} /\点{D}_{0} = 1\)线)在寒冷地区。
讨论
这项工作为Bäck、Jacobsen和Miller开发的数字放射自显影工具添加了一套小规模剂量测定的定量方法11,14,22.在临床前αRPT研究中,数字放射自显像已被用于量化活性分布,但除了少数例外,αRPT药代动力学研究中的吸收剂量估计来自器官内空间不敏感的生物分布研究17,18,19,20.,21.
我们的工作是对先前基于数字放射自显像的αRPT剂量测定的改进15,22在三个方面:
- (一)
计算和图像处理方法,包括ROI分割、活动校正、切片配准、MC DPK卷积等,在我们之前的工作中没有得到充分的描述;
- (b)
iQID相机是一个自给自足的系统,它直接测量活动(逐个事件),而不是像α-相机那样使用二级伽玛计数测量。因此,与剂量测量相关的不确定度降低了;
- (c)
我们引入了自动化元素来提高数据收集和处理的效率,将直方图分割用于评估非均匀性,并提出了减少这些研究中令人禁止性切片要求的方法。脚本可以在Github上以开发中的Python包的形式获得https://github.com/robin-peter/iqid-alphas(https://doi.org/10.5281/zenodo.7117835).
我们的程序不追踪单个α粒子的轨迹或它们在特定细胞中的随机效应,而是用平均蒙特卡罗(MC)能量沉积核计算吸收剂量。因此,我们将我们的方法归类为小规模(子器官和细胞水平),而不是真正的随机微剂量测定方法,使用名义上的惯例21.使用DPK核可以将此方法扩展到其他放射性核素38或者是非水组织,如骨骼和肺39通过生成一个新的内核。作者目前正在进行治疗结合的研究225交流和227用这些方法建立了小鼠模型。
直接MC、DPK卷积和MIRD s -系数(或s -值)是ICRU第96号报告确定的与RPT吸收剂量计算相关的三种当前剂量测量方法6.s系数法通常被认为是最实用和最接近临床标准的方法,但它通常假定剂量在一个器官内分布均匀,这在αRPT中往往是不准确的。我们的程序在程序工作流中使用MC和DPK卷积,大部分包含在一个非专有软件(Python)中,可以复制该软件,通过调整少数特定的组件,在其他放射性核素和组织的系统中获得剂量测定结果。未来的工作应该比较使用iQID的DPK方法与积极研究的s系数方法,模型剂量不均匀性,如体素级或细胞级的s值(即MIRDcell模拟)。6,40,41.然而,体素级s值通常在比iQID大得多的尺度上进行评估(PET和SPECT分辨率,> 0.5 mm), MIRDcell模拟结果可能难以映射到非细胞iQID设备。因此,DPK和iQID的微尺度s值方法之间的比较是一项重要的任务。
α -粒子剂量在细胞水平上差异很大,因为粒子范围短导致剂量分布在靶抗原表达周围。我们证实,像生物分布研究中常见的那样,只报告平均剂量可能不足以表征放射性药物摄取不均匀的亚器官组织的治疗效果。研究这种微剂量不均匀性与生物效应之间的关系已被确定为αRPT进展的关键途径6.我们的数字剂量分割和与病理信息的共配方法允许在不均匀尺度上进行剂量估计,并促进生物效应的共同研究。本工作中提出的方法也可以推广到报告rbe加权剂量分布的端点,如DNA双链断裂诱导42和生殖细胞存活43进一步评估αRPT的临床效果。
我们描述了两种后处理方法,以显著减少所需的冷冻切片数量,只使用1-3个12µm切片来获得中心切片的剂量率估计,而不是使用10-20片来获得该数据点。两种方法在较高的切片数下都表现出相似的收敛性,但克隆方法在我们的试验中有略高于单层切片的准确性(4.8% vs 9.5%).克隆方法不需要一个完整的数据集来开发经验校正因子——不像切片贡献方法——因此可以应用于没有先前经验的有限数据研究。克隆方法的主要局限性是假设放射性热点的空间分布不随组织深度发生显著变化,这导致测量切片上的特征被系统性地过度强调。因此,从一个切片到下一个切片在形态结构和生理上的差异将影响克隆方法的准确性。观察到的差异是小的犬淋巴结数据,但其他组织类型可能显示更大的结构不均匀性。解剖学上不同的组织可能需要使用切片贡献或全序列方法来精确计算剂量。然而,所有的DPK方法都不适用于测量具有小规模、异质材料结构的样本(如骨髓小梁),因为除非在DPK中专门模拟,否则组织和非组织(如空气或骨)之间的界面将不能准确反映。
相反,12 μ m切片的剂量计算可能不能表征α -颗粒范围以外的活检组织的其他部分。要评估整个器官的三维剂量分布,可能需要多个稀疏样本。冰冻切片应在一致的位置切割,以尽量减少几何效应(例如,外部组织层吸收增加)或结构效应(例如,与横断面相比,皮质滤泡在纵向上的存在增加)。今后评估器官内样品变化的工作对于提高剂量估计的准确性和一致性是有价值的。
在非正式的术语中,这里提出的方法应该被认为是使用数字放射自显影αRPT剂量测定的建议配方,而不是固定处方。后续研究应旨在优化各组件,包括配准程序、微剂量测定模型(DPK或其他)和实验参数。剂量的贡献211在剂量核中未定量电子捕获分支,应在今后的工作中进一步研究。在这项研究中,一个简单的算法足以对齐犬类淋巴结,但对于复杂的组织可能需要更强大的程序。采用刚性二维变换,假设每个切片在12 μ m内没有明显扭曲,但较厚的切片可能不是这样。这一假设在距离低至50 μ m时是不成立的,正如在iid图像与h&e染色切片的配准中观察到的那样。较厚的切片也会降低深度分辨率和检测效率,因为很少有α粒子从组织中逃脱,但它们更容易从活检中切割,没有样本处理错误。量化空间分辨率和精确剂量定位之间的权衡,切片厚度和检测效率之间的权衡,将提供对最佳视野和冷冻手术设置的深入了解。
结论
这项工作构成了一套方法,以获得定量的、空间敏感的体外α -粒子吸收剂量测量,这是临床转化α -粒子治疗所需要的。我们提出了先进的工具,在可能的情况下自动化,用单粒子数字放射自显像量化细胞规模的吸收剂量和剂量率,并评估摄取均匀性,组织病理和必要的切片数。这些方法提高了临床前和临床活检吸收剂量测量的可行性,进一步加深了我们对α粒子放射性药物及其在细胞水平上的生物效应的了解。
数据可用性
本研究中所分析的数据集可根据合理要求从通讯作者处获得。
参考文献
sguros, G., Bodei, L., McDevitt, m.r.和Nedrow, J.癌症放射药物治疗:临床进展和挑战。Nat. Rev.药物发现。19, 589 - 608。https://doi.org/10.1038/s41573-020-0073-9(2020)。
Makvandi, M。et al。肿瘤中的α -发射器和靶向α -治疗:从基础科学到临床研究。目标。肿瘤防治杂志。13, 189 - 203。https://doi.org/10.1007/s11523-018-0550-9(2018)。
“C。et al。225Ac-PSMA-617用于psma靶向α-放疗治疗转移性去势抵抗性前列腺癌。j .诊断。地中海。57, 1941 - 1944。https://doi.org/10.2967/jnumed.116.178673(2016)。
Frantellizzi, V。et al。钍-227靶向α治疗。癌症Biother。Radiopharm。35, 437 - 445。https://doi.org/10.1089/cbr.2019.3105(2020)。
Lawhn-Heath C。et al。放射性核素治疗中的剂量学:测量辐射剂量的临床作用。柳叶刀杂志。23, e75-e87。https://doi.org/10.1016/s1470 - 2045 (21) 00657 - 4(2022)。
Sgouros G。et al。ICRU报告96,剂量计引导的放射药物治疗。j . ICRU21, 1 - 212。https://doi.org/10.1177/14736691211060117(2021)。
Tronchin, S., Forster, J. C., Hickson, K. & Bezak, E.靶向α治疗中的剂量学。系统回顾:当前的发现和需要做什么。理论物理。地中海,杂志。67, 09年tr01。https://doi.org/10.1088/1361-6560/ac5fe0(2022)。
α发射治疗性放射性药物的定量成像。诊断。地中海。摩尔。成像2010(53), 182 - 188。https://doi.org/10.1007/s13139-019-00589-8(2019)。
辛多夫,南卡罗来纳州奇滕登,阿克斯内斯,阿肯色州。,Parker, C. & Flux, G. D. Quantitative imaging of223a-氯离子(Alpharadin)用于靶向α发射放射性核素治疗骨转移瘤。诊断。地中海,Commun。33, 726 - 732。https://doi.org/10.1097/MNM.0b013e328353bb6e(2012)。
Sgouros G。et al。MIRD小册子。22(节选):用于放射性核素靶向治疗的α粒子发射器的放射生物学和剂量学。j .诊断。地中海。51, 311 - 328。https://doi.org/10.2967/jnumed.108.058651(2010)。
Bäck, T. &雅各布森,L. α-相机:一种使用电荷耦合器件的α-粒子体外高分辨率生物成像定量数字自放射技术。j .诊断。地中海。51, 1616 - 1623。https://doi.org/10.2967/jnumed.110.077578(2010)。
山本S,平野Y, Kamada K. &吉川a .用于观测闪烁体中α粒子轨迹的超高分辨率辐射实时成像系统的开发。Radiat。量。134, 106368年。https://doi.org/10.1016/j.radmeas.2020.106368(2020)。
Darwish, R. A, Staudacher, A. H, Bezak, E. & Brown, M. P.时间像素探测器在靶向α治疗中的放射自显像成像。第一版。数学。方法Med。2015, e612580。https://doi.org/10.1155/2015/612580(2015)。
米勒,b . W。et al。使用iQID相机的靶向放射性核素治疗用α粒子发射器定量单粒子数字放射自显影。地中海,物理。4212(2015)。
弗罗斯特。et al。α-成像证实有效靶向cd45阳性细胞后211造血细胞移植的放射免疫治疗。j .诊断。地中海。56, 1766 - 1773。https://doi.org/10.2967/jnumed.115.162388(2015)。
Lamart, S。et al。组织中的锕系元素生物成像:乳剂和固体轨迹放射自显影技术与iQID相机的比较。《公共科学图书馆•综合》12, e0186370。https://doi.org/10.1371/journal.pone.0186370(2017)。
米勒,c。欧洲核医学协会第34届年会(虚拟,2021)
巴尔加斯,c . S。et al。小鼠肾脏的多区域-辐射源剂量测定。欧元。j .诊断。地中海。摩尔。成像47S57-S57(2020)。
Dekempeneer Y。et al。的治疗效果213卵巢癌临床前模型的双标记数据库。摩尔。制药。17, 3553 - 3566。https://doi.org/10.1021/acs.molpharmaceut.0c00580(2020)。
塔巴塔泽,米勒,B. W.和托尔马切夫,S. Y.制图241数字放射自显像在解剖骨结构中的空间分布。健康的今天。117, 179 - 186。https://doi.org/10.1097/HP.0000000000000947(2019)。
霍布斯,r F。et al。小尺度(亚器官和细胞水平)α -粒子特异性剂量学模型在肿瘤和肾脏转移性前列腺癌临床前模型中的应用211At-YC-I-27是转移性前列腺癌的psma靶向配体。近距离放射疗法15, S196。https://doi.org/10.1016/j.brachy.2016.04.359(2016)。
回来,T。et al。基于图像的小尺度三维剂量测量在靶向α治疗中使用体素剂量点核和连续组织切片的α相机成像。j .诊断。地中海。55(增刊1),50-50(2014)。
陈,Y。et al。同种异体造血细胞移植中使用α-发射器砹-211标记的抗cd45抗体进行放射免疫治疗后的持久供体移植。血119, 1130 - 1138。https://doi.org/10.1182/blood-2011-09-380436(2012)。
Ito, D, Frantz, a . M. & Modiano, J. F.犬淋巴瘤作为人类非霍奇金淋巴瘤的比较模型:最新进展和应用。兽医。Immunol。Immunopathol。159, 192 - 201。https://doi.org/10.1016/j.vetimm.2014.02.016(2014)。
维拉诺沃,D, mcclearly - wheeler, a . L. &理查兹,K. L.《找到正确的树:用自发的犬类模型推进我们对淋巴瘤的理解和治疗》。咕咕叫。当今。内科杂志。24, 359 - 366。https://doi.org/10.1097/MOH.0000000000000357(2017)。
实验动物的护理和使用指南.8 edn,(美国国家科学院出版社,2011)。
伯杰,m . J。et al。电子、质子和氦离子的停止功率和范围表(2009)。
米勒,b . W。et al。iQID相机:一种电离辐射量子成像探测器。诊断。Instrum。物理方法。研究一个767, 146 - 152。https://doi.org/10.1016/j.nima.2014.05.070(2014)。
掺Ce3+−闪烁体的光输出和能量分辨率。诊断。Instrum。物理方法。研究一个486, 208 - 213。https://doi.org/10.1016/s0168 - 9002 (02) 00704 - 0(2002)。
沃尔特·范德,S。et al。scikit-image: Python中的图像处理。PeerJ2, e453。https://doi.org/10.7717/peerj.453(2014)。
Itseez。开源计算机视觉库(2015)。
利希特纳,G. PyStackReg(2021)。
Thevenaz, P, Ruttimann, U. e & Unser, M.一种基于强度的金字塔方法的亚像素配准。IEEE反式。图像的过程7, 27-41。https://doi.org/10.1109/83.650848(1998)。
贾伯华,马西,邓杰,贝尤斯,J. E.和波耶,a.l.。剂量点核卷积技术在内部剂量测量中的验证。理论物理。地中海,杂志。40, 365 - 381。https://doi.org/10.1088/0031-9155/40/3/003(1995)。
Peer-Firozjaei, M.,塔吉克-曼苏里,M. A., Geramifar, P., Parach, A. A. & Zarifi, S.剂量点核(DPK)在剂量优化中的实现177陆/90内剂量测定中的Y鸡尾酒放射性核素。达成。Radiat。Isot。173, 109673年。https://doi.org/10.1016/j.apradiso.2021.109673(2021)。
Agostinelli, S。et al。Geant4-a仿真工具包。诊断。Instrum。物理方法。研究一个506, 250 - 303。https://doi.org/10.1016/s0168 - 9002 (03) 01368 - 8(2003)。
从灰度直方图中选择阈值的方法。IEEE反式。系统。男人Cybern。9, 62 - 66。https://doi.org/10.1109/TSMC.1979.4310076(1979)。
格雷夫斯,S. A.弗林,R. T.和海尔,D. E. 2174放射性核素的剂量点核。地中海,物理。46, 5284 - 5293。https://doi.org/10.1002/mp.13789(2019)。
Khazaee Moghadam, M., Kamali Asl, A., Geramifar, P. & Zaidi, H.评估组织特异性剂量核而不是水剂量核在内部剂量测定中的应用:蒙特卡洛研究。癌症Biother。Radiopharm。31, 367 - 379。https://doi.org/10.1089/cbr.2016.2117(2016)。
Vaziri B。et al。MIRD小册子。25: MIRDcell V2.0软件工具,用于多细胞群体生物反应的剂量分析。j .诊断。地中海。55, 1557 - 1564。https://doi.org/10.2967/jnumed.113.131037(2014)。
Katugampola, S., Wang, J., Prasad, A., Sofou, S.和Howell, R. W.用MIRDcell V3预测微转移反应:用225Ac-DOTA封装脂质体在肿瘤球体中产生不同活性分布的原理证明。欧元。j .诊断。地中海。摩尔。成像https://doi.org/10.1007/s00259-022-05878-7(2022)。
斯图尔特,r D。et al。光子、中子和光离子的DNA双链断裂(DSB)相对生物有效性(RBE)的快速MCNP模拟。理论物理。地中海,杂志。60, 8249 - 8274。https://doi.org/10.1088/0031-9155/60/21/8249(2015)。
斯图尔特,r D。et al。粒子相对生物有效性(RBE)机制启发模型的比较。地中海,物理。45, e925-e952。https://doi.org/10.1002/mp.13207(2018)。
确认
这项工作是在ARCS基金会的财政支持下进行的。美国国立卫生研究院也资助了P01HL122173、R01CA172582、P01CA78902、R01EB026331和R01HL160688。
作者信息
作者和联系
贡献
所有作者都对这篇手稿中的合作研究做出了重大贡献。首席研究员B.W.M.提出了剂量学研究的概念;R.P.和B.W.M.开发并实施了提出的方法;b.m.s.、s.h.f.、e.b.s.、a.k.、D.K.H和D.S.W.设计并实施了放射免疫治疗研究,在此基础上论证了剂量测定方法;M.P.D, rd.s和rrf监督剂量测定的技术方面;K.V.和Y.S.提供数据分析指导,并担任学生作者的导师。R.P.进行了数据分析并起草了手稿。所有作者都已审阅、修改并批准了最终稿。
相应的作者
道德声明
相互竞争的利益
B. W. Miller是QScint成像解决方案有限责任公司的创始人,该公司已将iid相机商业化用于数字放射自显影应用。不存在其他已知的与本文相关的潜在利益冲突。
额外的信息
出版商的注意
施普林格自然对出版的地图和机构附属的管辖权要求保持中立。
补充信息
权利和权限
开放获取本文遵循创作共用署名4.0国际许可协议(Creative Commons Attribution 4.0 International License),该协议允许在任何媒体或格式中使用、分享、改编、分发和复制,只要您给予原作者和来源适当的署名,提供创作共用许可协议的链接,并说明是否有更改。本文中的图片或其他第三方材料包含在文章的创作共用许可中,除非在材料的信用额度中另有说明。如果材料不包含在文章的创作共用许可中,并且您的预期用途不被法律法规允许或超出了允许的用途,您将需要直接从版权所有者那里获得许可。欲查看此许可证的副本,请访问http://creativecommons.org/licenses/by/4.0/.
关于这篇文章
引用这篇文章
彼得,R,桑德梅尔,b.m.,迪昂,议员et al。使用iQID数字放射自显像系统的小尺度(子器官和细胞水平)α -粒子剂量测定方法。Sci代表1217934(2022)。https://doi.org/10.1038/s41598-022-22664-5
收到了:
接受:
发表:
DOI:https://doi.org/10.1038/s41598-022-22664-5