摘要
由于包括气候变化在内的几种人为影响,全球海洋森林正在萎缩。形成森林的大型藻类,如Cystoseiras.l。物种对环境条件(例如温度升高、污染或沉积)特别敏感,特别是在生命早期阶段。然而,关于它们对海洋变暖(OW)和酸化(OA)相互作用的反应,我们知之甚少。这些驱动因素也可以影响壳层珊瑚藻的性能和生存,它们是相关的下层植被物种,可能在后期演替物种(如形成森林的大型藻类)的招募中发挥作用。我们测试了温度升高、pH值降低和物种促进作用对植物募集的交互作用Cystoseira泥蜂.我们证明了OW和OA的交互作用对招聘产生了负面影响c .泥蜂以及与之相关的珊瑚藻类Neogoniolithon brassica-florida.研究结果表明,气候变化和壳珊瑚藻存在的交互作用会对新入鱼的数量产生负面影响,而低ph对新入鱼的大小有积极影响Cystoseiras.l。物种。虽然新的恢复技术最近为海洋森林恢复打开了大门,但我们的研究结果表明,必须考虑多个驱动因素和物种相互作用的相互作用,以实现长期的种群可持续性。
简介
海洋在调节气候方面发挥着重要作用,并为人类提供了大量的生态系统服务。然而,海洋受到包括气候变化在内的多种人为影响1.海洋变暖(OW)和海洋酸化(OA)预计将影响大多数海洋生态系统,并对人类造成影响2,3.,4.随着海水温度的上升,全球生态系统的栖息地结构、生物多样性和营养复杂性预计都会减少5海洋pH值降低6,7.与此同时,可以预见机会主义和草皮形成物种的扩大,导致生态系统服务的丧失8,9,10.
在温带和寒冷地区的潮间带和潮下岩岸,大型棕色森林形成的大型藻类(包括层流纲、翼藻纲、Desmarestiales和Fucales)是主要的基础物种11.它们形成了所谓的海洋森林12,13提供重要的生态系统功能14,15,16.然而,全球海洋森林正在萎缩17,18由于城市化、海洋养殖、当地污染和草食等几个方面的影响11,19,20.;使这些栖息地对全球变化更加敏感5,21.海洋森林的结构和生产力受到许多环境因素的影响,这些因素推动生物的生长、生存、繁殖和代谢,进而影响整个栖息地或生态系统22,23,24.全球变化对海洋森林的影响因地理位置、种群特征和物种而异20.,25,26.因此,在一些情况下,海洋森林被限制在具有最有利条件的地点,可以作为避难所26,27,28.有证据表明,这些物种的早期生命阶段比成年物种更脆弱,从长远来看,这可能导致海洋森林的损失12,29,30..在早期阶段自然会观察到很高的死亡率,种群对未来影响的恢复力在很大程度上取决于有效地招募和培养青少年31,32.
与OA相关的碳酸盐化学变化导致溶解的CO增加2这有利于光合作用和光合生物的生长6,33.CO的增加2改变溶解的CO2来啊2RuBisCO活性位点的比例,即固定碳代谢的关键酶。由于后者是在缺氧环境中产生的,因此对O具有较高的亲和力2比有限公司234.因此,电流增加溶解CO2来啊2该比值有利于RuBisCO的固碳效率,进而有利于光合生物的生长。为了提高RuBisCO的固碳效率,许多藻类还开发了碳浓缩机制(CCM),增加CO2来啊2RuBisCO固定位点前的比例6,35.然而,尽管有或没有CCM,还不清楚大多数藻类是否对CO的增加有积极的反应26,35,36.因此,OA可能对一些物种有有益的影响,比如形成森林的大型棕色大藻类,它们被认为在高CO环境下茁壮成长2浓度6,36,37.然而,钙化生物(如珊瑚和珊瑚藻类等基础物种)预计尤其受OA的影响38.特别是,作为海洋森林下层植被重要组成部分的甲壳珊瑚藻是最容易受到OA影响的生物之一39,40.由于钙化率降低,与受益于CO升高的藻类的竞争加剧,该物种可以直接或间接地受到OA的影响235,41,42.甲壳珊瑚藻是最早在光秃秃的岩石上定居于阳光充足的海洋栖息地的物种之一,很快就被后来的演替物种(如结构更复杂的大型棕色森林形成大型藻类)过度生长43,44.一些作者45报告指出,壳珊瑚藻可以通过防止后期殖民者(例如大型棕色巨藻)的招募来帮助维持替代栖息地状态,即使这可能是特定物种的46.而其他研究表明,相比之下,甲壳珊瑚藻可以通过促进包括无脊椎动物在内的后来殖民者的定居来增强生物多样性44,47,48通过与形成森林的大型藻类建立积极的联系49,50,51.因此,由于气候变化,地壳珊瑚藻覆盖的减少可能会影响形成森林的大型藻类的补充,从而影响海洋森林栖息地的维持52,53以及他们对气候变化的抵抗42,54.
在地中海的岩石底部Cystoseira感官的种(包括属Cystoseira,Ericaria而且Gongolaria,以下简称Cystoseira)是海洋森林的主要代表13,55.然而,只有少数研究调查了气候变化对该类群的影响,更少关注它们的早期阶段21,56,57,58.大多数研究表明OW对新兵和成年人都有负面影响Cystoseira他们的生存26,57,59、弹性21和物候学60,61.相反,降低pH值可提高成虫的生产力、抗氧化活性和光保护化合物的产量Cystoseira56,58.尽管如此,一些物种Cystoseira(包括Cystoseira泥蜂而且Cystoseira foeniculacea)被认为是CCM物种,其CCM不会因为额外的CO而下调2因此,不能从增加CO中获益235.据我们所知,目前还没有关于OW和OA对早期生命阶段或新兵的联合影响的研究Cystoseira,而且只有一项研究56调查了这两种司机对成年人的影响。
在这里,我们测试了温度,pH值和物种促进对招募的交互影响Cystoseira泥蜂.该物种是一种常见的森林形成的大型藻类,可以在地中海周围的浅水和庇护的岩石海岸上产生密集的种群62.它被认为是最具耐药性的病毒之一Cystoseira是唯一不受《巴塞罗那公约》保护的物种(附件二;联合国环境规划署/地中海行动计划- unep /MAP63.我们设计了两个独立的实验来测试高温、低pH值和壳珊瑚藻的存在对珊瑚早期生命阶段的影响c .泥蜂.第一个实验着重于温度对新兵的影响泥蜂。在第一个实验结果的基础上,我们进行了第二个补充实验,以评估温度、pH值和物种促进作用(甲壳珊瑚藻)对珊瑚招募的交互作用泥蜂。因为珊瑚藻对OA很敏感,是一种潜在的有利底物Cystoseira,我们评估招聘c .泥蜂关于生与死Neogoniolithon brassica-florida,是浅海最常见的物种之一Cystoseira森林44,64.我们还比较了招聘的情况Cystoseira在非生物人工粘土基质上,已提出作为修复的有效基质59,65,66.本研究的主要假设是,气候变化将对招聘产生负面影响c .泥蜂.我们的假设是OW可能会对新兵产生直接的负面影响c .泥蜂而OA可以促进他们的生长和生产力。我们还假设定居和生存c .泥蜂可能间接受到气候变化对其相关的下层物种(壳层珊瑚藻)的影响,这些物种作为底物。
结果
供体种群位置的原位温度
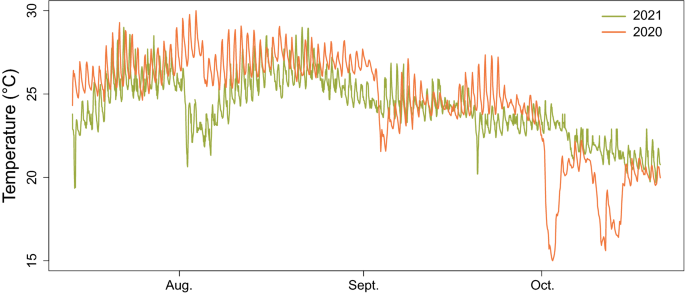
那里的温度Cystoseira泥蜂在第一次实验(2020年7月14日至10月13日)和第二次实验(2021年8月10日至10月20日)期间,供体种群地点在2020年的15.2°C(10月27日)和29.5°C(8月2日)的最小值和最大值之间变化,在2021年的19.4°C(7月14日)和29.0°C(7月22日)之间变化(图2)。1).
实验一:海洋变暖对海獭招募的影响Cystoseira泥蜂
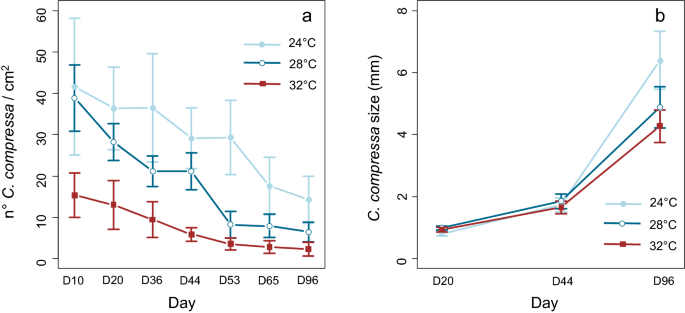
从实验开始,温度就对新兵的密度产生了负面影响(GLMM, p值< 0.001;补充材料S1).自第一次采样日期(第10天;无花果。2a),而从第36天开始,24°C的密度仍然高于28°C和32°C(图。2a).在实验结束时,温度也会影响新兵的大小,24°C下的新兵明显大于在较高温度下生长的新兵(ANOVA, P-value < 0.001;补充材料S1和无花果。2b)。
实验二:气候变化和物种便利化对白蚁招募的影响Cystoseira泥蜂
招募的Cystoseira泥蜂
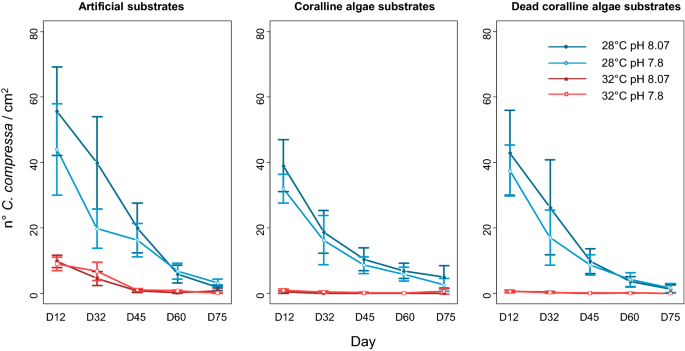
温度和pH分别与基质类型和时间对新兵密度有交互影响(GLMM, p值< 0.001;补充材料S2).温度对新兵密度有很强的负向影响,特别是在有Neogolithon brassica-florida(无花果。3.).低pH值对缺乏磷的新兵密度有负面影响n brassica-florida,但在珊瑚藻存在的情况下,没有检测到pH值之间的密度差异(补充材料S2而且S3).活珊瑚藻和死珊瑚藻的存在对新入鱼的密度有负向影响c .泥蜂相比之下,人造基质的密度更高。温度、pH和时间的交互作用(温度× pH ×时间)也影响新兵密度(GLMM, p值< 0.001;补充材料S2).在低温-环境pH值下发现了更高的新兵密度,而在高温下检测不到pH值之间的差异(补充材料S2).总的来说,在低温、pH值较低的环境中,以及在没有水的情况下,新兵密度较高n brassica-florida.新兵的密度随着时间的推移而下降,这导致了实验结束时大多数考虑因素的结果的均匀化(只有在没有珊瑚藻和在低温下,补充材料时发现pH和温度的显著差异S3).这是因为只有少数新兵存活到实验结束(图2)。3.).
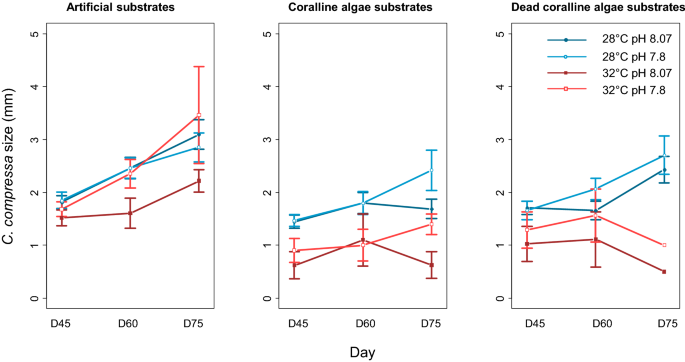
温度、pH、珊瑚藻的存在和时间的交互作用影响了新入鱼的大小(GLMM, pH ×底物类型×时间、温度× pH和温度×底物类型、补充材料的交互作用p值< 0.001)S2).低温、低ph条件下新兵的尺寸较大,无温度条件下新兵的尺寸也较大n brassica-florida在所有治疗组合中(图;4).研究人员观察到活着的新兵和死去的新兵在大小上有差异n brassica-florida,但只在低温下。实验结束时,在活珊瑚藻环境中生长的新珊瑚体积变小了,而在死珊瑚藻环境中生长的新珊瑚在大小上没有差异N.芸苔属佛罗里达和粘土基质(图;4;补充材料S4).
钙化的Neogoniolithon brassica-florida
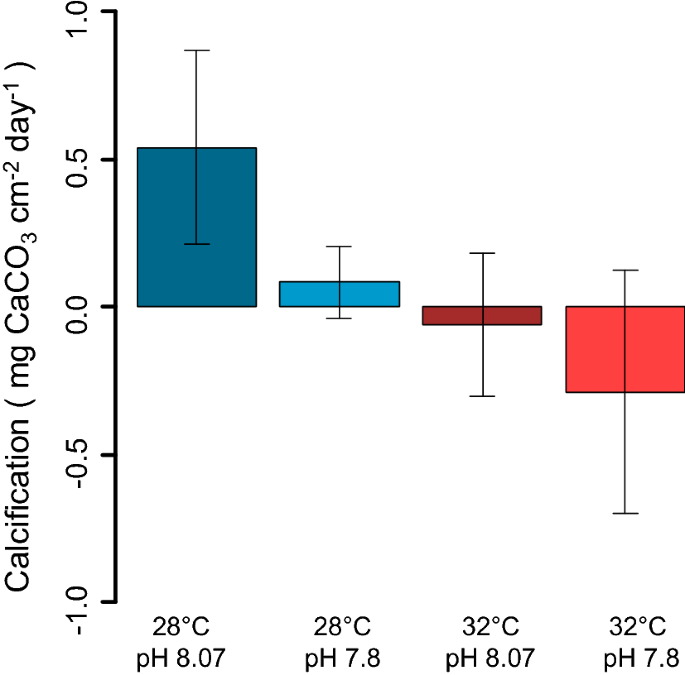
温度和pH值对生物净钙化有负向影响Neogoniolithon brassica-florida(LM,温度p值< 0.01,pH p值< 0.05;补充材料S2).28°C时钙化率显著高于32°C时,环境pH值高于低pH值时(图2)。5).
讨论
世界上许多地方的海洋森林正在退化17,18,67尤其是在地中海68,69,70.尽管如此,不同生命阶段对气候变化的响应仍然知之甚少,但近年来,人们已努力评估气候变化与其他局部压力因素(如污染、高光和OW的强烈负面影响)一起对森林形成物种的单一或综合影响21,71,72.结果表明,温度、pH值和潜在促进物种的存在对新兵密度有显著影响Cystoseira泥蜂.与我们最初的假设一致,温暖的温度对新兵的密度和大小都有最大的负面影响,正如已经在其他森林形成物种身上观察到的那样,对新兵也是如此21,26,71和成人28,57,73,74.温度升高不仅会影响植物的生存和生长Cystoseira还会影响他们的新陈代谢56,75,76.一项关于c .泥蜂据报道,最大量子产额(Fv/F米)的含量从28℃开始下降,而总酚含量随着海水温度的升高而升高76.在全球范围内,海水温度的升高是对海洋森林的直接威胁,将形成森林的大型藻类隔离到条件更合适的避难地点,而在某些物种分布的北部界限(例如地中海北部界限),可以预期会出现局部灭绝。26,27.此外,温度对海洋森林的间接影响是不可忽视的,因为它们有助于栖息地的热带化和温水物种的范围扩大,可以重新塑造藻类群落和营养级联77,78.
海水pH值对新兵密度和大小的影响是相反的,低pH值对密度有负面影响,而对大小有正面影响。低pH值已被证明会对其他关键物种(如巨型海带)的沉降和早期生命阶段产生负面影响25,79、珊瑚及软体动物38是什么导致了一种范式,即生命早期阶段可能对全球变化更敏感,因此可能构成一个瓶颈21,57.然而,在我们的实验中,较低的pH值正影响的大小c .泥蜂在一些研究中,巨型海带可能表现出更好的性能80,81.非钙化的大型藻类通常被认为对OA不是特别敏感,因为它们可以从增加溶解的CO中获益2特别是不具有CCM的碳限制物种6,36.溶解一氧化碳的增加2因此,预期OA对碳限制物种有积极影响,CCM对非碳限制物种有中性或积极影响36.大多数大型棕色巨藻物种都具有表明CCM存在的属性,但它们受益于增加的CO256,75,82.同样的情况似乎也发生在高CO的有益影响上2新兵的规模。c .泥蜂对溶解无机碳(DIC)具有高亲和力的CCM,不会因OA而改变CCM的活性,因此在CO升高时不会特别受益2.因此,它们可能最终会比其他受益于CO升高的物种更具竞争力235.值得注意的是,在我们的一些实验条件下(即32°C和低pH),最大的尺寸对应的是最低的密度,这不能让我们除了CO的影响之外,还排除密度依赖过程的影响2.OA还可能对海洋森林产生间接影响,有利于提高通常碳限制的草皮的性能,特别是在存在营养物的情况下(例如,当地营养物污染)。6,83.草皮形成的物种是快速生长的,因此是巨大的空间竞争对手,可能会限制长寿命物种的招募,如森林形成的物种。因此,草皮形成的物种可以扩张并取代基础物种(例如;Cystoseiras.l.已经受到全球变暖和其他人为影响的物种)17,84.OA对海洋森林的这种间接影响可能会降低海洋森林的结构复杂性,损害其功能并促进制度转变6,10,85.
我们的结果与研究结果一致,表明OA对森林形成的大型藻类的直接影响可能小于变暖38: pH值对新兵密度的影响可能被温度的强烈影响所掩盖。低温(28°C)和pH(8.07)条件下密度最高,高温(32°C)对尺寸有负面影响,pH降低(7.8)对尺寸有正面影响。在自然系统中,非生物和生物因素的复杂相互作用是众所周知的。在我们的研究中,我们最初假设OW和OA会影响早期的殖民珊瑚藻Neogoniolithon brassica-florida,降低其潜在的促进作用c .泥蜂招聘。温度和pH值对珊瑚藻的钙化率影响较大,这可能解释了温度和pH值对与珊瑚藻共生的新兵生长影响较大的原因。然而,活珊瑚藻和死珊瑚藻的存在对新兵的密度和大小都有负面影响,其中人工粘土基质是最有利的。与其他物种的文献报道相反44,是非常常见的珊瑚藻N.芸苔属佛罗里达在后来的演替物种的招募中没有起到促进作用c .泥蜂在我们的实验中。从实验一开始就少了c .泥蜂观察到与珊瑚共生的藻类,有活的也有死的。在有活珊瑚藻底物的情况下,其生理状态n brassica-florida可能并不能解释这一结果,因为它们表现出的钙化率与其他珊瑚藻类的报告一致86,87.活珊瑚的低招募可能是由于抑制了新成员的定居和发展c .泥蜂由珊瑚藻表面形成的附面层的pH值或其他化学参数的变化引起86,88.此外,壳珊瑚藻与它们的微生物组有生物相互作用89并以其物理和化学防污机制控制附生植物46,90,91.珊瑚藻表面的这些特征并不能最优地进行招募c .泥蜂从而降低了实验中的沉降。从应用的角度来看,值得注意的是粘土衬底,它已经在地中海的许多修复行动中使用59,65,66,是沉淀的适宜底物C.泥蜂.我们的研究结果支持这种衬底特别有趣,因为它有利于沉降,并提供了许多技术上的实用性(例如,它们便宜,可生物降解,易于生产,可以形成任何形状)。59,65,66.
总的来说,我们的结果表明,OW和OA相加,都影响招募c .泥蜂钙化率n brassica-florida。有趣的是,在珊瑚的存在下,OW和OA的相互作用可能会加剧n brassica-florida.这可能是因为(1)在珊瑚藻存在的情况下,珊瑚藻的补充量较低;(2)由于OW和OA对珊瑚藻的作用加剧了其对珊瑚藻的抑制作用c .泥蜂48,53.我们的实验表明,生物和非生物因素的复杂相互作用可能会影响塑造海洋森林群落的关键物种,并在生态系统层面产生最终影响24.由于大多数实验研究是在受控条件下进行的,因此必须强调一些局限性。首先,我们的实验不允许分离不同驱动因素对定居过程和新兵生存的影响。其次,附生植物(草皮藻类)在我们的实验槽中逐渐出现,并且在较高的温度和较低的pH值下增殖增强(作者个人观察),这最终影响了性能c .泥蜂.但在自然条件下也可能观察到这种现象,在OW和OA条件下,草皮形成物种预计会激增17.许多关于新兵和成人的研究Cystoseira报告在实验条件下死亡率升高,这证实了维持的困难Cystoseira在坦克30.,59,65以及在实验室里复制自然栖息地的条件。这可能是由于水族馆设施中光线、温度和流动条件的不同变化所致22.不同的相关生物(例如微生物组、附生藻类、无脊椎动物)也可以解释培养这些藻类时观察到的不同表现92.当新兵表现出退化迹象时,我们的实验就会停止,但我们的实验持续时间与其他研究一致Cystoseira26,30.,57.实验得到的密度非常高,平均达到94 100.07±89 324.78c .泥蜂市的米−2(MEAN±SD, n = 28)为第一次实验2个月后的14 213.20±17.67c .泥蜂市的米−2(MEAN±SD, n = 197)−2;max。:320,000 ind. m−2第一次实验,最小:10,000 ind. m−2和马克斯。:210,000 ind. m−2对于第二种)。有趣的是,我们的团队在第一次实验的同时进行了一项平行研究,用本研究中提出的相同技术在田间直接播种天然石,2个月后产生了较低的密度。相反,2个月后,在自然条件下野外生长的新兵(11.33±3.27 mm)比第一次试验(5.18±2.70 mm)和第二次试验(2.51±1.61 mm)生长的新兵(11.33±3.27 mm)要大,说明水箱条件并不适合新兵的生长c .泥蜂和/或密度依赖因素会导致实验室中新兵密度高,规模小。供体种群的自然密度仅为76.36±0.72c .泥蜂市的米−2(MEAN±SD, n = 22;最大可达128个−2最低:16英镑/米−2;作者的个人观察,文章在准备中)。尽管与自然条件的比较往往突出了罐中研究的一些局限性,但继续使用这种方法很重要,因为它是唯一允许在受控条件下(即温度和pH值)测试多个因素的方法。
研究结果表明,气候变化的交互作用对浅海森林具有明显的负面影响。这一结果对于在岩石池中茁壮成长的形成森林的大型藻类尤其引人注目,这些藻类预计更能适应当地因素的变化(即温度和pH值)。除了全球变化,海洋森林还面临着其他一些压力(例如水污染、城市化、践踏、草食)。19这已经让他们很紧张了。其中一些压力源已通过管理措施得到解决,现在已得到缓解(例如水质)93在少数情况下,允许森林的自然恢复或规划恢复行动的可行性94,95,96,97.最近,新的恢复技术为恢复这些生态系统打开了大门,尽管如此,海洋森林将受到全球变化的越来越多的影响1为了实现长期的人口可持续性和/或成功的恢复行动,必须考虑到这一点。保护这些关键生态系统的下一步是了解气候变化和其他在局部范围内发挥作用的驱动因素是如何相互作用的,最终产生附加效应或协同效应98这可能会导致海洋森林的重组和重新分配,并影响它们在极端条件下抵御和恢复的能力24,26,28.
材料与方法
实验一:海洋变暖对海獭招募的影响Cystoseira泥蜂
招募新兵
的顶端可育的分枝Cystoseira泥蜂于2020年7月13日从圣玛格丽特岛(Lérins Islands, France)一个岩池(地表至1米深之间)的捐赠人群中手工收集。这个地点是位于戛纳海岸前的自然2000年遗址,它是最后一个健康的地点之一Cystoseira法国里维埃拉的人口69.在目视检查花托中含有可育受精卵后,人工收集了约140克鲜重(FW)的顶端可育分枝,并在阴凉黑暗的条件下用塑料袋运输到实验室。采样是非破坏性的,因为只收集了顶端的分支(大约5厘米长)。温度数据记录器(HOBO Pendant MX Temp, ONSET)安装在岩石池中,每小时进行一次测量,以监测供体区域的温度。容器在4°C的黑暗环境中保存一夜,然后将其放置在装满过滤海水(20 μ m)和作为沉降基质的大理石基质的实验罐中59,66,99.在每个容器中,将15g FW的花托放置在表面的网中,使受精卵落在基质上。容器在无水循环条件下放置72 h,以促进受精卵的沉降。在目标温度处理下,受精卵释放和沉降过程中温度保持不变。在打开供水系统后,容器被移除,新兵被保存在水箱中96天。潜水水泵(NEWA)提供了每个实验水箱的水运动。
实验设置与处理
每种温度(24、28、32℃)分别设置3个独立的5 L水箱(n = 3);表格1),共放置9个实验缸,并安装三个约25厘米的方形大理石衬底2放置在每个水箱内。过滤海水(20µm)从3 m深的Villefranche Bay泵入,以7 L h的速度连续注入实验槽−1.实验槽被放置在一个温度调节浴槽中,以保持温度在目标值。每次处理用温度控制器(T controller TWIN AQUA MEDIC)控制两次温度调节浴。照明由37 W LED灯条(PRO2LED, aquistik)和辐照度从0 μmol光子m逐渐增加−2年代−1在06:30到最大110 μmol光子m−2年代−1在12:00 ~ 14:00之间,逐渐下降到0 μmol光子m−2年代−121:00 (LI-185B与LI-190SB量子传感器,美国林肯LI-COR生物科学公司)。三种温度处理是根据供体群体在繁殖季节登记的温度来选择的c .泥蜂以及全球变暖导致的气温上升。
测量
的密度和大小c .泥蜂新兵被选为响应变量。新兵密度的计算方法是每10天或15天拍摄一张照片,并使用ImageJ软件(ImageJ, NIH美国卫生与公众服务部)从照片中计算每个基质中间3 × 3厘米区域的新兵总数。从每个基底中取出5个新兵(n = 45),每月测定新兵的大小(µm)。它们的总长度是用装有刻度目镜的显微镜测量的。
实验二:气候变化和物种便利化对白蚁招募的影响Cystoseira泥蜂
招募新兵
的顶端可育的分枝c .泥蜂均于2021年8月4日从上述相同的供体人群中收集,并遵循相同的规程(见“招募新兵(摘自实验1)。在本实验中,人工收集了约500g FW的根尖可育分枝,并在阴凉和黑暗的条件下用塑料袋运输到实验室。将花托在4°C的黑暗中保存过夜,然后将其置于实验条件下的实验罐中,以在不同的基质和不同的温度和酸化条件下获得新兵。在每个容器中,将10 g FW的容器放置在网内,在表面保持72 h。在此期间,温度和pH保持在目标处理条件下。之后,容器被移除,新兵被关在坦克里75天。
实验设置与处理
招聘Cystoseira泥蜂在两种不同的温度条件下,28°C和32°C,以及两种pH值,环境(pHT= 8.07)和低pH值(pHT= 7.8)。为了研究其潜在的促进作用Neogoniolithon brassica-florida,用三种不同的基质安置新兵:(1)活的和(2)死的n brassica-florida(分别为“珊瑚”因子和“死珊瑚”因子)和(3)人工粘土基质(“人工基质”因子)。温度根据第一个实验(实验1)的结果进行选择T= 7.8)对应SSP2-4.5 CO下本世纪末预期的pH值2排放情况75,One hundred..三种基质的表面均为10 cm左右2(人工基底直径3厘米,高度1厘米)。珊瑚藻类于2021年4月在法国圣让费拉角(Saint-Jean-Cap-Ferrat) 0.5至1米深的Anse des Fossés收集。选择了最均匀和被其他生物定植最少的样本。然后,用刷子和镊子清理并去除附生植物。死珊瑚基质是通过将n brassica-florida将底物在淡水加漂白剂(1:50)中浸泡24小时。然后用淡水冲洗几次并干燥,然后放入水槽中。在实验开始前3个多月,将所有底物置于环境海水温度和pH下的实验罐中,并逐渐恢复到实验温度和pH水平。
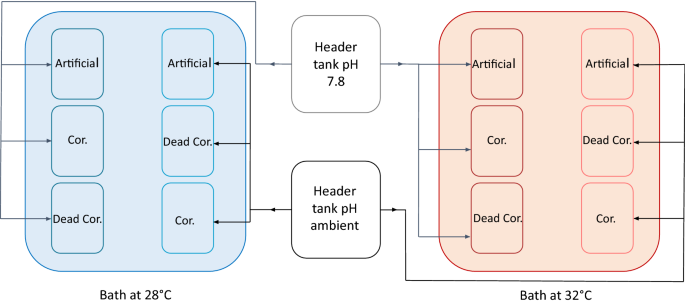
实验装置由4个独立的1.8 L容器(n = 4)组成,分别对应12种条件(基质类型× pH ×温度),共48个实验容器。每个水箱装有5个重复的基质(人工、珊瑚或死珊瑚基质)。从每个实验槽中取一种底物作为对照,不播种合子c .泥蜂.来自维莱弗朗湾的海水被连续输送到8个20升的集箱中,然后重力输送给6个1.8升的独立实验箱,每个箱的水速率为3升小时−1(无花果。6).海水pH值在4个20 L集箱内进行控制。使用pH控制器(APEX, Neptune Systems)控制纯CO的起泡,将pH维持在目标值2在头部油箱里。实验槽被放置在温度调节槽内(每个温度四个),连接到相同的控制系统(APEX,海王星系统;无花果。6)以维持温度在28及32度。潜水水泵(NEWA)提供了每个实验水箱的水运动。
光由89 W LED光棒(Aqualumix, aquistik)提供,辐照度从0 μmol光子m逐渐增加−2年代−1在06:30到最大175 μmol光子m−2年代−1在12:00 ~ 14:00之间,逐渐下降到0 μmol光子m−2年代−1在21:00 (LI-185B与LI-190SB量子传感器,LI-COR生物科学,林肯,美国)26.
碳酸盐化学
每周使用手持pH计(826 pH移动,Metrohm)测量集水槽和实验槽中的pH值,并使用TRIS缓冲液校准(批次#T33由斯克里普斯海洋研究所a . Dickson提供)。每周在8个随机选择的容器中测量总碱度,并按照Dickson等人的方法使用Metrohm 888 Titrando电位滴定法测定。101,样本测量三次,取平均值。A. Dickson提供的认证标准物质(第186批)用于评估测量的准确性,其范围在7.73 μ mol kg以内−1.维莱弗朗湾海水含量为2565.41±12.1 μmol kg−1(平均值±sd;表格1;补充材料S5).
测量
新兵的密度和大小c .泥蜂并选取活珊瑚藻底物的钙化率作为响应变量。新兵的密度是通过使用放大灯直接在容器中计算基质上新兵的总数来评估的。新兵总数由基底表面归一化。通过测量从每种基质中随机挑选的10个个体(n = 160)的长度来确定新兵的大小。当基质上存在10个或更少的个体时,所有的个体都被测量。测量是在放大台灯下用图表纸完成的。
总钙化率n brassica-florida是否使用浮力重量技术进行评估102.在获得之前已经进行了称重c .泥蜂在实验结束时,64天之后。使用以下公式将湿重的变化转换为干重:
含方解石密度2.73克厘米−3.钙化率以称重时刻珊瑚藻表面归一化的干重变化和天数(64天)来确定。使用ImageJ软件(ImageJ, NIH,美国卫生与公众服务部)在照片上确定珊瑚基材的表面。
所有实验均按照有关规定和指南进行Cystoseira泥蜂而且Neogoniolithon brassica-florida抽样。后者是根据地中海区域间管理局管理/管制处发出的第277号县命令收集的,该命令授权ECOSEAS实验室仅为科学目的对动植物进行取样。
数据分析
实验1
采用具有泊松链对数分布函数的广义线性混合效应模型(GLMM),以温度(3级)和时间(7级)为固定因素,槽内嵌套基质为随机因素,测试温度对新兵密度的影响。以温度(三层)和时间(三层)为固定因素,采用双因素方差分析检验温度对受试者大小的影响。通过QQ图函数对残差进行图形分析,评估正态性和方差相等的假设。当没有达到方差相等的假设时,使用0.01的alpha。
实验2
采用具有泊松分布的GLMM测试温度、pH值和基质类型对新兵密度的影响,温度(两级)、pH值(两级)、基质类型(三级)和时间(五级)为固定因素,基质嵌套在槽内为随机因素,以解释观察结果之间缺乏独立性(随时间重复测量)。以温度(两级)、pH值(两级)、基质类型(三级)和时间(三级)为固定因素,水箱为随机因素,使用具有Gamma误差分布函数和logit链接函数“逆”的GLMM分析了变量大小对处理的响应。以温度(两级)和pH(两级)为固定因素,采用线性模型(LM)对珊瑚藻的总钙化率进行了分析。
拟合GLMM和LM模型分析各变量的影响,并采用aic似然最小值在可能的组合中选择最佳模型。使用包lme4中的函数“glmer”和“lm”对不同的模型进行拟合103在统计环境中104.p值由Wald χ得到2使用CAR包中的“ANOVA”函数进行测试105.最后,包中的函数“emmeans”106采用snk检验(Student-Newman-Keuls)对双向方差分析(two-way ANOVA)进行事后分析。
数据可用性
在当前研究中生成和分析的数据集可在生物复杂性知识库知识网络中获得,https://knb.ecoinformatics.org/view/urn:uuid:daa9cc97-47eb-48a3-addc-ed0047f0f3c4.
参考文献
政府间气候变化专门委员会。气候变化中的海洋和冰冻圈:政府间气候变化专门委员会的特别报告(剑桥大学出版社,2022)。https://doi.org/10.1017/9781009157964.
多尼,s.c。et al。气候变化对海洋生态系统的影响。为基础。3月科学牧师4, 11-37(2012)。
加图索,j。et al。对比不同人为CO对海洋和社会的未来2排放场景。科学349, aac4722(2015)。
霍尔-斯宾塞,J. M.和哈维,B. P.海洋酸化对沿海生态系统服务的影响,由于栖息地退化。紧急情况。上面。生命科学。3., 197-206(2019)。
斯特劳布。et al。抵抗,灭绝,以及介于两者之间的一切——海藻对海洋热浪的不同反应。前面。3月科学。6, 763(2019)。
康奈尔,S. D.,克鲁克,K. J.,法布里修斯,K. E.,克莱恩,D. I.和罗素,B. D.另一个海洋酸化问题:CO . D.2作为生态系统优势竞争者中的一种资源。费罗斯。反式。r . Soc。B杂志。科学。368, 20120442(2013)。
Kroeker, K. J., Micheli, F., Gambi, M. C. & Martz, T. R.底栖海洋群落对海洋酸化的不同生态系统响应。Proc。国家的。学会科学。108, 14515-14520(2011)。
Harvey, B. P., Kon, K., Agostini, S., Wada, S. & Hall-Spencer, J. M.海洋酸化将藻类群落锁定在物种贫乏的早期演替阶段。水珠。改变医学杂志。27, 2174-2187(2021)。
星期天,j.m.。et al。海洋酸化可以通过改变生物栖息地来调节生物多样性的变化。Nat,爬。改变7, 81-85(2017)。
Wernberg, T。et al。气候驱动的温带海洋生态系统政权转移。科学353, 169-172(2016)。
施特内克,r.s.。et al。海带森林生态系统:生物多样性、稳定性、恢复力和未来。环绕。Conserv。29, 436-459(2002)。
Schiel, D. R. & Foster, M. S.大型棕色海藻的种群生物学:动态沿海环境中多期生活史的生态后果。为基础。启生态。另一个星球。系统。37, 343-372(2006)。
韦恩伯格,T. &菲尔比-德克斯特,K.为了树木而错过了海洋森林。3月生态。掠夺。爵士。612, 209-215(2019)。
Cheminee,。et al。地中海岩礁鱼类的育苗价值。J. Exp. Mar. Biol。生态。442, 70-79(2013)。
斯梅尔,D. A.,巴罗斯,M. T.,摩尔,P.,奥康纳,N.和霍金斯,S. J.海带林提供的生态系统服务的威胁和知识缺口:东北大西洋的视角。生态。另一个星球。3., 4016-4038(2013)。
Carbajal, P., Gamarra Salazar, A., Moore, P. J. & Pérez-Matus, A.不同的海带物种支持独特的大型无脊椎动物组合,这表明沿着洪堡海带洋流系统采集海带对整个社区的潜在影响。Aquat。Conserv。3月Freshw。Ecosyst。32, 14-27(2022)。
菲尔比-德克斯特,K. & Wernberg, T.草皮的兴起:全球海带森林下降的新战线。生物科学68, 64-76(2018)。
Pessarrodona,。et al。温带海洋森林生境结构的均质化与小型化。水珠。改变医学杂志。27, 5262-5275(2021)。
Orfanidis, S。et al。自然和人为胁迫对地中海不同空间尺度褐藻的影响。前面。3月科学。8, 1330(2021)。
克鲁姆汉斯。et al。全球海带林的格局在过去半个世纪发生了变化。Proc。国家的。学会科学。113, 13785-13790(2016)。
Capdevila, P。et al。对生命早期阶段的变暖影响增加了长期栖息地形成的大型藻类的脆弱性,并推迟了它们的种群恢复。j .生态。107, 1129-1140(2019)。
欧文,A. D.,巴拉塔,D.,科洛西奥,F.,费兰多,G. A. &艾罗尔迪,L.光,沉积物,温度和栖息地形成藻类的早期生活史Cystoseirabarbata.3月的杂志。156, 1223-1231(2009)。
Smith, K. E., Moore, P. J., King, N. G. & Smale, D. A.研究温度和光照可用性区域尺度变化对潮下海带林深度分布的影响。Limnol。Oceanogr。67, 314-328(2022)。
斯梅尔,d。et al。气候驱动的基础物种替代导致促进级联的破坏,并可能影响更高的营养水平。j .生态。00, 1-13(2022)。
Hollarsmith, J. A., Buschmann, A. H., Camus, C. & Grosholz, E. D.在海洋变暖和酸化下巨大海带的不同繁殖成功(Macrocystispyrifera)的人口。J. Exp. Mar. Biol。生态。522, 151247(2020)。
Verdura, J。et al。在海洋热浪期间,当地规模的气候避难所为栖息地形成的物种提供了避难所。j .生态。109, 1758-1773(2021)。
马里安尼,S。et al。过去和现在的Fucales从浅和庇护海岸在加泰罗尼亚。Reg。钉。3月科学。32, 100824(2019)。
海洋变暖对海带森林生态系统的影响。新植醇。225, 1447-1454(2020)。
Coelho, s.m., Rijstenbil, J. W. & Brown, m.t.人为胁迫对海藻早期发育阶段的影响。j . Aquat。Ecosyst。Recov压力。7, 317-333(2000)。
de Caralt, S., Verdura, J., Vergés, A., Ballesteros, E. & Cebrian, E.污染对冠状形成藻类成虫和新生虫的差异影响:低污染水平下种群生存能力的影响。科学。代表。10, 17825(2020)。
Capdevila, P。et al。地中海深水藻类的繁殖模式Cystoseirazosteroides.3月的杂志。162, 1165-1174(2015)。
瓦达斯,R. L.,约翰逊,S. &诺顿,t.a.底栖藻类早期定居阶段的招募和死亡率。Br。Phycol。J。27, 331-351(1992)。
科赫,M.,鲍斯,G.,罗斯,C. &张晓辉。气候变化和海洋酸化对海草和海洋大型藻类的影响。水珠。改变医学杂志。19, 103-132(2013)。
Shih, p.m.。et al。预测的前寒武纪RuBisCO的生化特征。Commun Nat。7, 10382(2016)。
康沃尔,加州。et al。无机碳生理学支持大藻类对升高的CO的反应2.科学。代表。7, 46297(2017)。
赫本,c.d.。et al。海带林群落碳利用策略的多样性:对高CO的影响2海洋。水珠。改变医学杂志。17, 2488-2497(2011)。
波尔齐奥,布亚,M. C. &霍尔-斯宾塞,J. M.海洋酸化对大型藻类群落的影响。J. Exp. Mar. Biol。生态。400, 278-287(2011)。
克洛克,k。et al。海洋酸化对海洋生物的影响:量化敏感性和与变暖的相互作用。水珠。改变医学杂志。19, 1884-1896(2013)。
Kroeker, K. J., Kordas, R. L., Crim, R. N. & Singh, G. G.元分析揭示了海洋酸化对海洋生物的负面而可变的影响:海洋酸化的生物反应。生态。列托人。13, 1419-1434(2010)。
Rindi F。et al。不断变化的地中海中的珊瑚藻:如果我们不知道它们的现在,我们如何预测它们的未来?前面。3月科学。6, 723(2019)。
James R. K., Hepburn C. D., Cornwall, C. E., McGraw, C. M. & Hurd, C. L.珊瑚藻和底栖硅藻早期演替组合对海洋酸化的生长响应。3月的杂志。161, 1687-1696(2014)。
科莫,S.和康沃尔,C. E.海洋酸化对珊瑚礁“动物森林”和海藻“海带森林”的对比影响。在海洋动物森林:底栖生物多样性热点生态学(eds Rossi, S。et al。) 1-25(施普林格国际出版,2016)https://doi.org/10.1007/978-3-319-17001-5_29-1.
扰动、生活史和过度生长对藻壳和草皮共存的影响。生态81, 798-814(2000)。
Asnaghi, V。et al。殖民过程和珊瑚藻在岩岸群落动态中的作用。J. Sea Res。95, 132-138(2015)。
布雷利,F.,贝尔托奇,I. &米凯利,F.在维持替代栖息地的壳珊瑚藻和海胆的相互作用。3月生态。掠夺。爵士。243, 101-109(2002)。
别墅Bôas, a.b. & Figueiredo, m.a.d.o.防污效果在珊瑚藻类物种特异性?布拉兹。j . Oceanogr。52, 11-18(2004)。
Bulleri, F., Benedetti-Cecchi, L., Acunto, S., Cinelli, F. & Hawkins, S. J.冠层藻类对地中海西北部岩石海岸低岸组合垂直分布模式的影响。J. Exp. Mar. Biol。生态。267, 89-106(2002)。
Maggi, E., Bertocci, I., Vaselli, S. & Benedetti-Cecchi, L. Connell和Slatyer的生物多样性时代的演替模型。生态92, 1399-1406(2011)。
欧文,A. D.,康奈尔,S. D.,约翰斯顿,E. L.,佩尔,A. J. &吉兰德斯,B. M.结壳珊瑚藻对冠层损失的响应:对南极海岸预测的独立检验。3月的杂志。147中国生物医学工程学报,2005)。
欧文,A. D.,康奈尔,S. D.和埃尔斯登,T. S.海藻冠层对珊瑚藻的漂白和光合活性的影响。J. Exp. Mar. Biol。生态。310, 1-12(2004)。
梅尔维尔,A. J. &康奈尔,S. D.海带冠层对潮下珊瑚藻类的实验影响。南国。生态。26, 102-108(2001)。
放牧的残余效应:通过覆盖珊瑚藻抑制竞争对手的招募。生态65, 1136-1143(1984)。
布雷利,布鲁诺,J. F.西利曼,B. R. & Stachowicz, J. J.促进作用和生态位:共存、范围转移和生态系统功能的影响。功能。生态。30., 70-78(2016)。
van der Heide, T., Angelini, C., de Fouw, J. & Eklöf, J. S.兼性互惠主义:面对人为全球变化的基础物种的双刃剑。生态。另一个星球。11, 29-44(2021)。
Molinari-Novoa, E. A. & Guiry, E. Gongolaria Boehmer属和Ericaria Stackhouse属的恢复(马藻科,褐藻科)。Notulae Algarum1 - 10(2020)。
Celis-Plá, P. S. M.,马丁内斯,B.,科尔比,N.,霍尔-斯宾塞,J. M. & Figueroa, F. L.对升高CO的生态生理反应2温度在Cystoseiratamariscifolia(褐藻纲)。爬。改变142, 67-81(2017)。
Falace,。et al。南地中海正在形成冠层吗Ericariagiacconei(=Cystoseirahyblaea海洋变暖的输家?前面。3月科学。8, 1758(2021)。
Hernández, C. A., Sangil, C., Fanai, A. & Hernández, J. C.巨藻对海洋温度升高的响应2浓度。3月包围。Res。136, 99-105(2018)。
Falace, A., Kaleb, S., Fuente, G. D. L., Asnaghi, V. & Chiantore, M.非原位栽培方案Cystoseiraamentacea从恢复的角度来看,严格变种(藻科,褐藻科)。《公共科学图书馆•综合》13, e0193011(2018)。
Bevilacqua, S。et al。气候异常可能通过改变基础物种的繁殖而造成持久的生态相移。生态One hundred., 1-4(2019)。
Savonitto G。et al。通过实施缓解解决方案,解决繁殖随机性和放牧对冠层形成的褐藻恢复的影响。Aquat。Conserv。3月Freshw。Ecosyst。31, 1611-1623(2021)。
Mangialajo, L。et al。微潮环境中岩藻类的分带模式及种间关系。J. Exp. Mar. Biol。生态。412, 72-80(2012)。
维尔拉克,M.;布杜雷斯克,c - f。& Perret-Boudouresque, M.根据巴塞罗那公约被列为受威胁的地中海海藻:批判性分析。科学。纳特尔(Port-Cros Natl)众议员。公园。33, 179-214(2019)。
陈志伟,陈志伟,陈志伟,等。林冠盖度、植食性和基质类型对植物生长的影响Cystoseira沿海岩池的沉降与补充。3月生态。掠夺。爵士。90, 183-191(1992)。
富恩特,G. D. L., Chiantore, M., Asnaghi, V., Kaleb, S. & Falace, A.首次栖息地形成海藻的迁地外植Cystoseiraamentacea从修复的角度来看。PeerJ7, e7290(2019)。
Orlando-Bonaca, M。et al。第一次修复实验Gongolariabarbata在斯洛文尼亚沿海水域会出什么问题?植物10, 239(2021)。
克里斯蒂,H。et al。挪威糖海带和草皮海藻之间的变化:不同机会主义海藻物种之间的政权变化或波动?前面。3月科学。6, 72(2019)。
Orlando-Bonaca, M., Pitacco, V. & Lipej, L.亚得里亚海北部形成冠状藻丰富度和覆盖度的损失。生态。印度的。125, 107501(2021)。
Thibaut, T., Blanfune, A., Boudouresque, c.f。法国里维埃拉Fucales的衰落和局部灭绝:未来灭绝的前兆?Mediterr。3月科学。16, 206-224(2015)。
Thibaut, T., Pinedo, S., Torras, X. & Ballesteros, E.岩藻类种群的长期下降(Cystoseira种虫害和海藻在Albères海岸(法国,地中海西北部)。3月Pollut。公牛。50, 1472-1489(2005)。
Leal, P。et al。铜污染加剧了海洋酸化和变暖对海带微观生命早期阶段的影响。科学。代表。8, 14763(2018)。
Fernández, P. A.,纳瓦罗,J. M.,加缪,C.,托雷斯,R. & Buschmann, A. H.环境历史对形成栖息地的海藻大囊藻对海洋酸化和变暖的反应的影响:生理和分子方法。科学。代表。11, 2510(2021)。
林德,A. C. &科纳尔,B.非生物应激源对海带早期生活史阶段的影响。藻类32, 223-233(2017)。
Fernández, p.a.。et al。氮的充足性提高栖息地形成的海带的热耐受性:在热胁迫下的驯化的影响。科学。代表。10, 3186(2020)。
Celis-Plá, p.s.m。et al。大型藻类对海洋酸化的反应取决于营养和光照水平。前面。3月科学。2, 26(2015)。
曼库索,f.p.et al。环境温度对潮间带光合活性和酚含量的影响Cystoseira泥蜂沿着意大利海岸线。j:。Phycol。31, 3069-3076(2019)。
路边,。et al。温带海洋生态系统的热带化:气候介导的草食和群落相移的变化。Proc. R. Soc。B杂志。科学。281, 20140846(2014)。
路边,。et al。热带兔子鱼和暖温带海洋的森林砍伐。j .生态。102, 1518-1527(2014)。
Gaitán-Espitia, j.d。et al。温度升高与pCO的交互效应2巨型海带的早期生活史Macrocystispyrifera.J. Exp. Mar. Biol。生态。457, 51-58(2014)。
Leal, P. P., Hurd, C. L., Fernández, P. A. & Roleda, M. Y.海洋酸化和海带发育:降低pH对海带减数孢子萌发和配子体发育没有负面影响Macrocystispyrifera而且Undariapinnatifida.j . Phycol。53, 557-566(2017)。
罗莱达,M. Y.莫里斯,J. N.麦格劳,C. M.和赫德,C. L.海洋酸化和海藻繁殖:增加CO2改善了pH降低对巨藻减数孢子萌发的负面影响Macrocystispyrifera(海带目,褐藻纲)。水珠。改变医学杂志。18, 854-864(2011)。
张X。et al。高有限公司2浓度促进了褐藻的生长和光合作用Saccharina粳稻.j:。Phycol。https://doi.org/10.1007/s10811-020-02108-1(2020)。
Falkenberg, L. J., Russell, B. D. & Connell, S. D.对比海洋初级生产者的资源限制:富CO条件下竞争相互作用的影响2以及营养体系。环境科学172, 575-583(2013)。
Nagelkerken, I., Russell, B. D., Gillanders, B. M. & Connell, S.海洋酸化通过栖息地改变间接改变鱼类种群。Nat,爬。改变6, 89-93(2016)。
康奈尔,S. D. & Russell, B. D.增加CO的直接影响2温度对非钙化生物的影响:增加了海带森林相移的可能性。Proc. R. Soc。B杂志。科学。277, 1409-1415(2010)。
Cornwall, c.e., Comeau, S. & McCulloch, m.t.珊瑚藻类在海洋酸化下提高钙化部位的pH值。水珠。改变医学杂志。23, 4245-4256(2017)。
马丁,S. &加图索,j.p。地中海珊瑚藻对海洋酸化和温度升高的响应。水珠。改变医学杂志。15, 2089-2100(2009)。
康沃尔,加州。et al。扩散边界层改善了海洋酸化对温带珊瑚巨藻的负面影响Arthrocardiacorymbosa.《公共科学图书馆•综合》9, e97235(2014)。
Gefen-Treves, S。et al。与造礁者相关的微生物群Neogoniolithon特别是在地中海东部。微生物9, 1374(2021)。
约翰逊,C. R. & Mann, K. H.地壳珊瑚藻,植石化石,抑制海藻的过度生长,而不依赖于食草动物。J. Exp. Mar. Biol。生态。96, 127-146(1986)。
济慈,奈特,M. a . &普埃斯切尔,C. M.珊瑚礁上三种外壳珊瑚藻(红藻属,珊瑚属)上皮脱落的防污效果。J. Exp. Mar. Biol。生态。213, 281-293(1997)。
Mancuso, F., D 'Hondt, S., Willems, A., Airoldi, L. & Clerck, O.与冠状形成海藻相关的附生细菌群落的多样性和时间动态Cystoseira泥蜂(Esper) Gerloff和Nizamuddin。前面。Microbiol。7, 476(2016)。
Blanfuné, A., Boudouresque, C. F., Verlaque, M. & Thibaut, T.在一个多世纪的跨度内形成冠层的海藻的起伏。科学。代表。9, 1-10(2019)。
Cebrian E。et al。地中海巨藻林恢复路线图。前面。3月科学。8, 1456(2021)。
詹尼·F。et al。地中海海洋森林的保护和恢复以及海洋保护区的潜在作用。放置Oceanogr。Limnol。4, 83-101(2013)。
戈尔曼,D. &康奈尔,S. D.在人类主导的景观中恢复潮下森林。j:。生态。46, 1258-1265(2009)。
Riquet F。et al。在形成栖息地的海藻中高度限制的扩散可能阻碍受干扰种群的自然恢复。科学。代表。11, 16792(2021)。
Halpern, b.s., McLeod, k.l., Rosenberg, a.a.和Crowder, l.b.通过海洋分区管理基于生态系统的累积影响。海洋海岸。等内容。51, 203-211(2008)。
Verdura, J., Sales, M., Ballesteros, E, Cefalì, m.e. & Cebrian, E.基于招募增强的冠状形成藻类的恢复:方法和长期成功评估。前面。植物科学。9, 1832(2018)。
Kwiatkowski, L。et al。根据CMIP6模式预测,21世纪海洋变暖、酸化、脱氧以及海洋上层营养物质和初级产量下降。Biogeosciences17, 3439-3470(2020)。
狄克森,A. G.,萨宾,C. L. &克里斯蒂安,J. R.。海洋公司最佳实践指南2测量。https://repository.oceanbestpractices.org/handle/11329/249(2007)。
斯宾塞戴维斯,P.短期生长测量珊瑚使用精确浮力称量技术。3月的杂志。101, 389 - 395。https://doi.org/10.1007/BF00428135(1989)。
贝茨,D, Mächler, M., Bolker, B. & Walker, S.用lme4拟合线性混合效应模型。ArXiv14065823统计(2015)。
R:统计计算R项目。https://www.r-project.org/.
福克斯,J. &韦斯伯格,S。应用回归的R伴侣(SAGE Publications, 2018)。
伦斯,r.v.et al。emmeans:估计边际均值,又名最小二乘均值(2022)。
确认
这项工作由Région Provence-Alpes-Côte d’azur(合同)资助的博士赠款支持雇佣Jeunes医生2019-2022年)和AFRIMED项目由中小企业执行机构(EASME)和欧洲海事和渔业基金(EMFF)根据N°789059赠款协议资助。我们感谢C. Carbonne的富有成效的交流和支持,以及在项目期间给予帮助的所有实习学生:M. Ortolani, B. Brunet, M. Gillio, K. Vigreux和A. Muret。我们非常感谢来自Atelier Terracotta(尼斯,法国)的Sandra,她帮助我们制作了粘土衬底。感谢M. Drake对文章的英文校对。
作者信息
作者及隶属关系
贡献
L.M.拿到了资金。l.m., S.C.和M.M.设计了这项研究。l.m., J.V.和M.M.参与了现场调查。l.m., s.c., J.V.和M.M.进行了实验。G.S.和G.R.帮助计算和测量了2020年第一次实验的数据。m.m., G.R.和F.P.做了粘土基底。S.A.为碳酸盐化学的维持和措施做出了贡献。S.C.和M.M.分析了数据。M.M.写了手稿的初稿,然后由所有共同作者最终确定。
相应的作者
道德声明
相互竞争的利益
作者声明没有利益竞争。
额外的信息
出版商的注意
施普林格自然对出版的地图和机构从属关系中的管辖权主张保持中立。
补充信息
权利和权限
开放获取本文遵循知识共享署名4.0国际许可协议,允许以任何媒介或格式使用、分享、改编、分发和复制,只要您对原作者和来源给予适当的署名,提供知识共享许可协议的链接,并注明是否有更改。本文中的图像或其他第三方材料包含在文章的创作共用许可协议中,除非在材料的信用额度中另有说明。如果材料未包含在文章的创作共用许可协议中,并且您的预期使用不被法定法规所允许或超出了允许的使用范围,您将需要直接获得版权所有者的许可。如欲查看本牌照的副本,请浏览http://creativecommons.org/licenses/by/4.0/.
关于本文
引用本文
蒙塞拉特,M.,科莫,S., Verdura, J.。et al。气候变化和物种便利化影响海洋大藻类森林的补充。Sci代表12, 18103(2022)。https://doi.org/10.1038/s41598-022-22845-2
收到了:
接受:
发表:
DOI:https://doi.org/10.1038/s41598-022-22845-2