摘要
羟氯喹(HCQ)治疗的潜在风险包括QT间期延长、低血糖、广泛的神经精神表现、血液毒性和潜在的遗传缺陷。HCQ过量使用时毒性极大,可导致个体心动过速、低血压、已知中枢神经系统、传输缺陷、低钾血症和其他表现。HCQ过量导致这些表现的机制尚不清楚。本文采用不同浓度的过量HCQ处理斑马鱼胚胎,得到了类似于人类的心率加快、神经系统抑制等现象。随着浓度增加到100 μM,胚胎死亡率和畸形率增加,孵化率降低,原位杂交显示胚胎胚层分化异常和重要器官形成异常。选择50 μM HCQ处理的胚胎进行转录组分析,该浓度处理的胚胎死亡率、孵化率和畸形率与对照组相似。虽然上述指标变化不明显,但与心脏、眼睛、神经等重要器官发育相关的分子变化明显。本研究为进一步研究HCQ过量的毒性机制提供了有用的信息,并为今后的人体研究提供了一些指导。
简介
羟氯喹(HCQ)是一种4-氨基喹啉衍生物,由氯喹的-羟基化反应制备。它被用于治疗疟疾、类风湿性关节炎和系统性红斑狼疮(SLE)。1.在过去的几年里,由于HCQ是治疗和/或预防2019年冠状病毒疾病(COVID-19)的候选药物,人们对HCQ的兴趣日益浓厚。在2020年3月30日至6月15日期间,美国食品和药物管理局授予HCQ紧急使用授权,允许其在临床试验之外用于COVID-19,导致在这段时间内广泛使用2,3..后来的调查显示发病率和死亡率增加,主要是由于与HCQ相关的心脏毒性。FDA于2020年6月15日撤销了EUA,警告不要使用这些药物治疗COVID-194,5.
HCQ通常耐受性良好,但临床医生和患者应该意识到可能发生的严重不良事件,即使是在短期治疗期间。治疗的潜在风险包括QT间期延长(心电图测量,计算为从Q波开始到T波结束的时间)、低血糖、神经精神影响、药物-药物相互作用和特征性超敏反应6.这些药物代谢的遗传变异是相当大的,影响其安全性和有效性7.HCQ过量是罕见的,而且非常严重。可能在30分钟内出现危及生命的症状,并在几小时内迅速发展至死亡1.先前的一项研究发现,一名16岁女孩在发病前30分钟摄入少量HCQ 200 mg,出现心动过速(心率110次/分钟)、低血压(收缩压63 mmHg)、中枢神经系统抑制、传导缺陷(QRS = 0.14 ms)和低钾血症(K = 2.1 meq/L)。1.意识到症状的发作、潜在的严重程度、毒副作用和治疗建议将大大有助于患者的生存。不幸的是,针对这种药物过量的治疗建议还没有很好地建立起来,而且往往是非常规的。
研究过量HCQ对心脏、神经等重要器官的影响及其毒性机制,将为过量摄入HCQ的治疗提供理论依据。本研究以斑马鱼为模式生物,研究过量HCQ对机体的毒性作用。我们相信,我们的研究为研究动物模型中HCQ的毒性提供了见解。此外,考虑到斑马鱼被认为是一种很好的人类翻译模型8这项研究提供了一些见解,可以指导未来的人类研究。
结果
hcq诱发的发育缺陷
死亡率
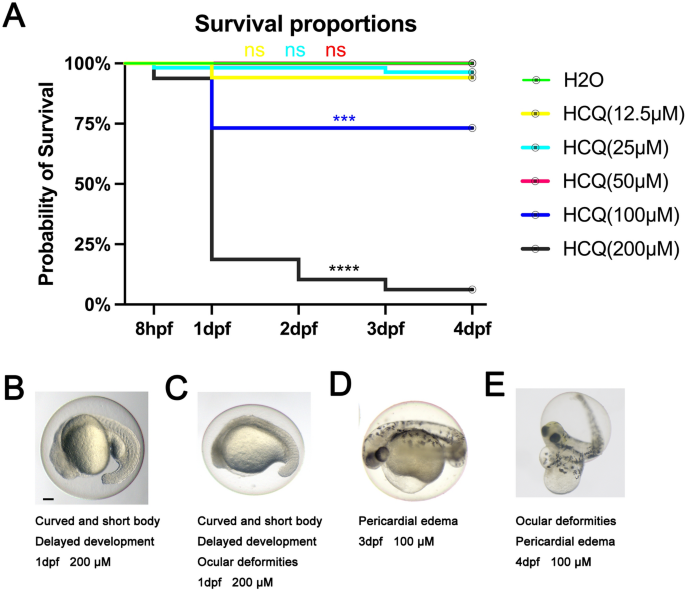
在0 μM、12.5 μM、25 μM、50 μM、100 μM和200 μM HCQ作用下,分别在受精后8 h (hpf)、受精后1天(dpf)、2 dpf、3 dpf和4 dpf记录斑马鱼胚胎死亡率。
HCQ浓度不超过50 μM时,对照组和实验组的累积死亡率较低(p > 0.05),分别为0 μM(0.0%)、12.5 μM(5.9%)、25 μM(3.6%)和50 μM(0.0%)。在完成1 dpf处理之前,实验组在浓度超过50 μM时的死亡率仍然很低。当浓度达到1 dpf时,100 μM的累积死亡率显著上升至26.8% (p < 0.05)。在200 μM下,1 dpf时死亡率为81.2%,2 dpf时死亡率为89.6%,3 dpf时死亡率最高为93.8% (p < 0.05)(图5)。1一个)。
畸形
而对照组的胚胎在所有暴露期间都能正常发育。HCQ组在浓度高于50 μM时出现异常。如图所示。1B-E,包括尾部畸形、脊柱侧凸、蛋黄畸形、发育迟缓、心包水肿和眼部畸形,其中后两者最为明显。与在胚胎死亡率方面观察到的影响类似,异常的严重程度,包括心包水肿、卵黄囊畸形和眼部畸形,随着HCQ浓度的增加而增加。暴露在200 μM HCQ下的胚胎畸形最严重。
孵化率
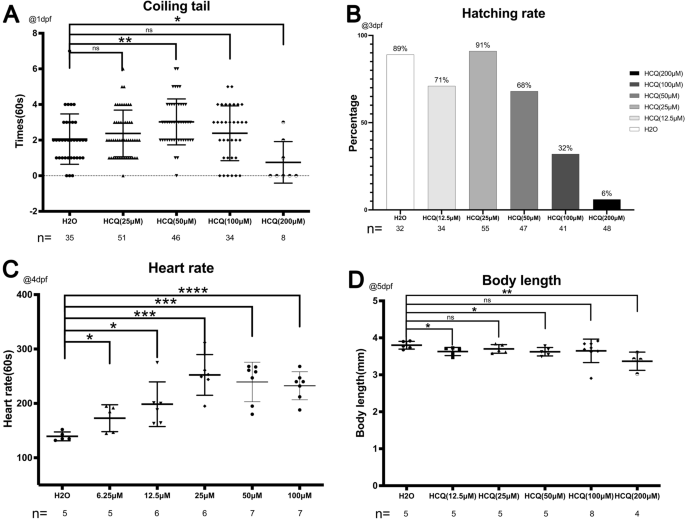
在3 dpf时,对照组孵化率为89%。HCQ浓度低于50 μM时,孵化率分别为71% (12.5 μM)、91% (25 μM)和68% (50 μM)。在浓度超过50 μM时,孵化率迅速下降到32% (100 μM)和6% (200 μM)(图2)。2B),这可能与胚死亡率增加有关(100 μM时为26.8%,200 μM时为93.8%)(图2)。1A) HCQ浓度相似。在96 hpf时,所有的活胚胎都被发现脱层(图。2B)。
心率
记录斑马鱼胚胎在4 dpf时的心率。为此,从每组中选取胚胎,记录胚胎心跳在室温下稳定10分钟后20 s的心率9.
对照组的心率为139.4±8.1次/ min, HCQ作用后心率增加至172.8±24.7 (6.25 μM)、198.5±41.0 (12.5 μM)、252.3±37.4 (25 μM)、239.4±36.4 (50 μM)和232.4±25.8 (100 μM)次/ min,表明HCQ影响斑马鱼胚胎心脏收缩能力。
这些结果表明,HCQ显著提高了斑马鱼胚胎的心率(p < 0.05),并呈剂量依赖性。然而,在浓度超过25 μM时,这种作用较慢,这可能是高浓度HCQ具有潜在的心脏毒性的结果10,11(无花果。2C)。
身体长度
研究发现,当HCQ浓度为5 dpf时,斑马鱼的体长随着浓度的增加而减少。对照组斑马鱼体长为3.8±0.1 mm,实验组分别为3.6±0.1 mm (12.5 μM)、3.7±0.1 mm (25 μM)、3.6±0.1 mm (50 μM)、3.6±0.3 mm (100 μM)和3.3±0.2 mm (200 μM)。此外,暴露在12.5 μM、50 μM和200 μM HCQ下的实验组与对照组差异显著,在200 μM HCQ下体长减少最明显(图2)。2D)。
行为
以1 dpf记录卵黄囊内的自发胚胎运动1分钟(图。2A).对照组每分钟卷尾次数为2.1±1.4次,与25 μM组(2.4±1.3次/min)和100 μM组(2.4±1.5次/min)有显著差异。50 μM组(3.0±1.3次/min)显著增加(p < 0.005), 200 μM组(0.8±1.2次/min)显著降低(p < 0.05)。
从补充视频中可以明显看出1,在3 dpf时,HCQ组幼虫在游动距离和速度方面的运动与对照组相比,对外界刺激的反应性降低。这种影响随着HCQ浓度的增加而日益明显。
此外,将50 μM HCQ组实验溶液替换为与对照组相同的鸡蛋水,在3 dpf时,我们观察到在4pdf(24小时后)对外部刺激的反应性恢复。因此,可以推断HCQ会干扰斑马鱼的自发运动,尽管这种干扰是可逆的。
原位杂交
为确定HCQ对斑马鱼胚胎组织发育的影响,对对照组、50 μM HCQ处理组和100 μM HCQ处理组进行连续监测。
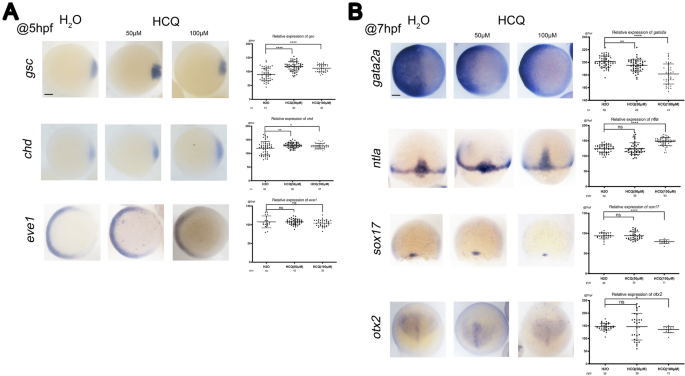
在5 hpf时,全坐位原位杂交(WISH)显示背侧组织者标记物显著增加gsc而且冠心病50 μM HCQ和100 μM HCQ对屏蔽期胚胎的影响(p < 0.05)。在这些组中,HCQ改变了斑马鱼背腹轴细胞的命运,扩大了背腹面积,从而表明HCQ可以调节斑马鱼背腹轴的发育。相比之下,腹侧标记的表达eve150 μM组(p > 0.05)、100 μM组(p > 0.05)与对照组差异无统计学意义(图2)。3.一个)。
表皮标记的表达gata2a在屏蔽期(7 hpf), 50 μM和100 μM组斑马鱼的外胚层发育显著降低(p < 0.05),且两组斑马鱼的外胚层发育显著降低(图5)。3.B)。
此外,与标记基因在7 hpf处的观察结果相似,中胚层标记的表达水平ntla在50 μM组中无显著差异(p > 0.05),而在100 μM组中与对照组相比显著升高(p < 0.05)。因此,100 μM HCQ可以上调斑马鱼中胚层的发育(图2)。3.B)。
内胚层标记sox17和前神经外胚层标记otx250 μM组与对照组差异不显著(p > 0.05),而100 μM组显著降低(p < 0.05)。因此,100 μM HCQ下调了斑马鱼内胚层(肠道、肝脏和其他内脏器官)和前神经外胚层的发育(图2)。3.B)。
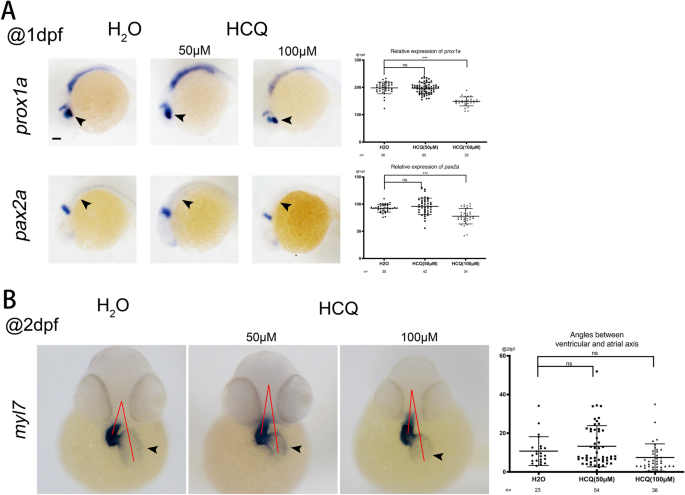
Prox1a斑马鱼眼睛中β-catenin-TCF/LEF信号的靶点是什么12,Pax2a在几种结构中表达,包括未成熟的眼睛、中胚层、神经系统、神经龙骨和原肾。在1 dpf时,表达水平prox1a而且pax2a50 μM组与对照组差异不显著(p > 0.05),而100 μM组显著降低(p < 0.05)。这两个标记物表达的降低表明HCQ下调了斑马鱼眼睛、神经系统和肾脏系统的发育(图2)。4一个)。
Myl7,心脏标记物在整个心脏的心肌细胞中表达。在2 dpf时,的表达式myl750 μM组(p > 0.05)和100 μM组(p > 0.05)间无显著差异(图2)。4B)。
转录组分析
通过转录组实验(NCBI SRA登录号:PRJNA879284)分析了HCQ处理对斑马鱼胚胎RNA水平影响的分子机制。
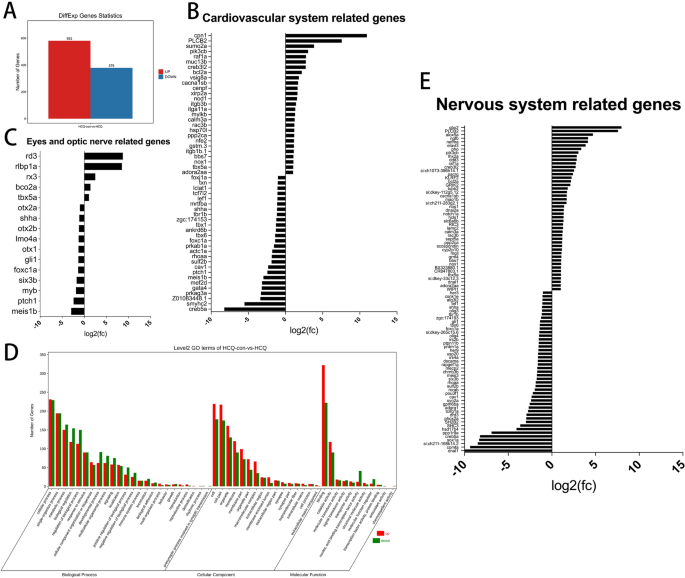
与对照组相比,50 μM HCQ处理导致960个转录本表达差异,其中581个转录本表达上调,379个转录本表达显著下调。5A及补充表1).
基因本体(GO)富集分析显示,与24个生物过程、16个细胞成分和11个分子功能相关的基因表达被显著修饰(图2)。5D)在参与生物过程的基因中,1322个基因表达增加,1489个基因表达减少。与细胞成分相关的上调基因为1062个,下调基因为801个。在与分子功能相关的基因中,另有518个基因上调,424个基因下调。5D及补充表2).
鉴于ISH结果和HCQ处理导致的斑马鱼发育异常,我们专门分析了某些系统的转录组学。结果显示,HCQ组和对照组之间有53个与心血管发育相关的基因存在显著差异,其中26个基因下调,27个基因上调(图2)。5B及补充表3.).
此外,HCQ组与对照组之间有16个与眼部发育相关的基因表达有显著差异,其中5个基因表达上调,11个基因表达下调(图2)。5C及补充表4).我们发现HCQ组与对照组相比,神经系统发育相关的91个基因存在显著差异。46个基因表达上调,45个基因表达下调(图;5E及补充表4).
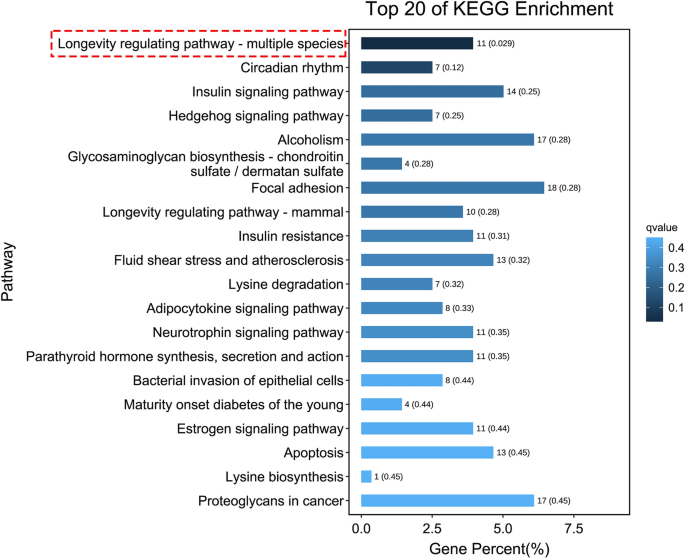
为了描述这些差异表达转录本的功能,我们对细胞过程、环境信息处理、遗传信息处理、人类疾病、代谢和有机体系统进行了京都基因和基因组百科全书(KEGG)基于路径的分类分析。这表明,与对照胚胎相比,hcq处理的胚胎中唯一显著富集的寿命调节途径(图2)。6及补充表5).先前的一项研究表明,暴露在HCQ中会增强斑马鱼的氧化应激过程13.我们发现了两个基因,即nfe2而且pxdn,它们参与了氧化应激过程。的基因nfe2它还与癌症途径、心血管疾病和衰老有关;然而,这些途径均未发现显著富集(补充表6).
讨论
羟氯喹口服吸收好,血浆消除时间长,肾脏清除慢,可穿过胎盘屏障,在脐带血和母体血液中浓度相似14.治疗范围为500 ~ 2000 ng/ml (1.15 ~ 4.61 μM)。,高于2000 ng/ml为超治疗15.本研究以斑马鱼为模式生物,研究过量HCQ对机体的毒性作用。实验浓度分别为6.25 μM、12.5 μM、25 μM、50 μM、100 μM和200 μM。约为最低治疗血药浓度的5倍、10倍、20倍、40倍、80倍、160倍、320倍,而起始浓度为6.25 μM与最高治疗浓度相近。我们观察了过量HCQ处理斑马鱼胚胎的表型、死亡率、孵化率、体长、心率和行为,并通过原位杂交和转录组分析胚胎分化和组织形成等重要标记基因,以获得过量HCQ对斑马鱼胚胎表型和功能的影响。
本研究发现:(1)当浓度大于50 μM时,胚死亡率显著增加,发育异常死亡率显著增加,孵化率迅速下降;(2)在所有过量HCQ浓度下,斑马鱼胚胎心率均显著升高;(3)与对照组相比,HCQ组幼虫在游动距离和速度方面的运动表现出对外界刺激的反应性降低。这种影响随着HCQ浓度的增加而日益明显。
在50 μM HCQ中,除背侧组织标记物gsc和chd显著升高外,腹侧标记物eve1、表皮标记物gata2a、中胚层标记物ntla、内胚层标记物sox17、prox1a和pax2a较对照组无显著变化。但在100 μM HCQ中,所有标记物均较对照组有显著变化。
利用转录组实验分析了HCQ处理对斑马鱼胚胎RNA水平影响的分子机制。与对照组相比,50 μM HCQ处理后960个转录本表达差异显著,其中581个转录本表达上调,379个转录本表达显著下调,包括与眼部发育、心脏发育和神经相关的基因。
我们首次评估了过量HCQ对斑马鱼胚胎的毒性,为进一步研究过量HCQ的毒性机制提供了有用的信息,并为今后的人类研究提供了一些指导。
材料与方法
伦理批准和伦理声明
本研究中的所有实验均按照reach指南和《实验动物护理和使用指南》进行。16,经四川大学华西第二医院动物保护使用专业委员会批准(批准号:HXDEYY20131021)17.
斑马鱼线和胚胎
利用野生型(WT) AB株系。胚胎分期如前所述进行18.胚胎的年龄以受精后数小时(hpf)或受精后数天(dpf)表示。斑马鱼在14小时的光照/10小时的黑暗周期下饲养,每天喂虾幼虫2-3次。水温维持在28±1°C, pH值为7。在产卵前一天,两对成年斑马鱼被放置在带有产卵托盘的繁殖池中,用隔板将雄性和雌性分开过夜。第二天早上,取出护板后,斑马鱼开始交配,然后收集胚胎,将其放入装有蛋水(60 μg海盐/mL)的培养皿中(https://zfin.org/zf_info/zfbook/zfbk.html).
试剂
HCQ原液
硫酸HCQ购自MedChemExpress (MCE) (Cat # HY-B1370, China),用于实验使用,在超纯水(Millipore milliq - q)中制备10 mM的原液®集成3水净化系统),然后储存在- 80°C(海尔超低温冷冻柜DW-86L626)。
HCQ工作方案
用鸡蛋水稀释制备浓度为12.5、25、50、100、200 μM的HCQ工作溶液[含60 mg海盐的反渗透水(晶海)]®,水生生态系统公司,Apopka, FL, USA)每升水(pH值7.5),添加新鲜制作的碳酸氢钠溶液]19.所有溶液在使用前暂时保存在4°C。
HCQ处理斑马鱼胚胎及各阶段测量参数
HCQ(12.5、25、50、100、200 μM)处理1细胞期受精后胚胎模拟体内受精。对于每一个导致相关终点分析的实验,在完全相同的时间下的蛋被聚集在一起。对于每个处理,大约50个胚胎(±5)被放置在每个含有20ml缓冲卵子水的培养皿中。在5 hpf、7 hpf、24 hpf和48 hpf阶段,采集胚胎和幼虫进行ISH实验。我们计算了8 hpf, 1 dpf, 2 dpf和3 dpf的生存率。3 dpf后计算孵化率。在60 hpf时,尾盘活动被录像。在80 hpf阶段,记录心率。在5 dpf阶段用ImageJ软件测量体长,并在同一阶段采集虹膜图像。对照组(鸡蛋-水)同时检测。
斑马鱼胚胎原位杂交及统计
如Thisse等人先前所述,进行了原位杂交。20.和Sun等人。21.原位杂交用反义探针RNA用DIG RNA Labeling Kit (SP6/T7) (Roche)合成,MEGAclear (Ambion)纯化。如前所述进行灰度测量和统计22.使用尼康SMZ1270显微镜在相同的放大倍率和曝光设置下拍摄全挂装ISH图像,并使用相同的软件设置进行标准化。采用ImageJ软件对全身ISH图像进行信号强度灰度测量。测量2 dpf处的心环角,如Peng等人所做。23乔杜里和特雷德24描述25.统计学意义被定义为P < 0.05 (*), P < 0.01 (* *), P < 0.001(* * *)。
转录组分析
我们收集胚胎进行RNA提取和RNA-seq实验,由Genedenovo生物技术有限公司(中国广州)进行RNA-seq转录组分析,如前所述26.取对照组和实验组胚胎,用50 μM HCQ在5 hpf级处理。
统计分析
GraphPad Prism,版本9 (GraphPad Software Inc., CA, USA)用于统计分析。我们使用非配对t检验来评估两组之间期望频率的显著差异。生存分析采用log-rank (Mantel-Cox)检验。双侧检验认为P < 0.05有统计学意义。
数据可用性
本研究转录组分析的原始测序数据已存入NCBI Sequence Read Achieve (SRA),登录号为PRJNA879284(发布日期:2022-09-13)。http://www.ncbi.nlm.nih.gov/sra/).
参考文献
马夸特,K. &艾伯森,T. E.羟基氯喹过量治疗。点。j .紧急情况。地中海。19, 420 - 424。https://doi.org/10.1053/ajem.2001.25774(2001)。
惠布莱希茨et al。妊娠早期使用羟氯喹与出生缺陷风险有关。点。j .。。Gynecol。224290. e291 e222——290.。https://doi.org/10.1016/j.ajog.2020.09.007(2021)。
列维,R. A。et al。羟氯喹(HCQ)治疗狼疮妊娠:双盲和安慰剂对照研究。红斑狼疮10, 401 - 404。https://doi.org/10.1191/096120301678646137(2001)。
罗森博格,e.s.。et al。纽约州COVID-19患者使用羟氯喹或阿奇霉素治疗与住院死亡率的相关性《美国医学会杂志》323, 2493 - 2502。https://doi.org/10.1001/jama.2020.8630(2020)。
Hidano, D, Dhruva, S. S. & Redberg, R. F.美国食品和药物管理局规定的高风险心血管设备上市后研究已批准2015-2019年。JAMA实习生。地中海。182, 556 - 558。https://doi.org/10.1001/jamainternmed.2022.0184(2022)。
Juurlink, D. N.在SARS-CoV-2感染管理中使用氯喹、羟氯喹和阿奇霉素的安全性考虑。可以。地中海,协会。J。192, E450。https://doi.org/10.1503/cmaj.200528(2020)。
Juurlink, D. N.在SARS-CoV-2感染管理中使用氯喹、羟氯喹和阿奇霉素的安全性考虑。医疗协会192, E450-E453。https://doi.org/10.1503/cmaj.200528(2020)。
Tal, T., Yaghoobi, B. & Lein, P. J.斑马鱼的转化毒理学。咕咕叫。当今。Toxicol。23 - 24日56 - 66。https://doi.org/10.1016/j.cotox.2020.05.004(2020)。
潘康唑对斑马鱼发育毒性的影响(鲐鱼类)的胚胎。光化层200,地位。https://doi.org/10.1016/j.chemosphere.2018.02.094(2018)。
氯喹的心脏作用和毒性:一个简短的更新。Int。j . Antimicrob。代理56, 106057年。https://doi.org/10.1016/j.ijantimicag.2020.106057(2020)。
乔达安,P。et al。羟氯喹、氯喹和阿奇霉素对成人原代心肌细胞的毒性。Toxicol。科学。180, 356 - 368。https://doi.org/10.1093/toxsci/kfaa194(2021)。
Loh, S.-L。et al。斑马鱼yap1在后侧线毛细胞分化中起作用。科学。代表。4, 4289年。https://doi.org/10.1038/srep04289(2014)。
Mendonça-Gomes, j.m。et al。COVID-19治疗的环境影响:阿奇霉素和羟氯喹在成年斑马鱼中的毒理学评估。科学。总环境。790, 148129年。https://doi.org/10.1016/j.scitotenv.2021.148129(2021)。
Bouariu,。et al。羟氯喹治疗与不良妊娠结局相关病因不明的慢性胎盘炎症的潜在益处。医疗保健10, 168(2022)。
Durcan, L., Clarke, W. A., Magder, L. S. & Petri, M.系统性红斑狼疮中羟氯喹血水平:澄清剂量争议和改善依从性。j . Rheumatol。42, 2092 - 2097。https://doi.org/10.3899/jrheum.150379(2015)。
国家研究委员会委员会更新指南,C.和实验室的使用,A.在《实验动物护理和使用指南》(美国国家科学院出版社版权所有©2011,美国国家科学院,2011)。
林志军,罗敏,周斌,刘勇,孙辉。CFTR通过Wnt信号通路调控斑马鱼胚胎T淋巴细胞的生成。Immunol。列托人。234, 47-53。https://doi.org/10.1016/j.imlet.2021.04.010(2021)。
金梅尔,C. B.,巴拉德,W. W.,金梅尔,S. R.,乌尔曼,B. &席林,T. F.斑马鱼胚胎发育的阶段。Dev,直流发电机。203, 253 - 310。https://doi.org/10.1002/aja.1002030302(1995)。
Gu Q., Rodgers, J., Robinson, B. & Kanungo, J. n -乙酰半胱氨酸预防维拉帕米诱导的心脏毒性,对斑马鱼去甲肾上腺素能拱门相关神经元无影响。食品化学。Toxicol。144, 111559年。https://doi.org/10.1016/j.fct.2020.111559(2020)。
这,c,这,b,高分辨率的原位杂交到整个体位的斑马鱼胚胎。Protoc Nat。3.59 - 69。https://doi.org/10.1038/nprot.2007.514(2008)。
太阳,H。et al。自力通过与Smad4相互作用抑制转化生长因子- β信号。生物。化学。285, 4243 - 4250。https://doi.org/10.1074/jbc.M109.079533(2010)。
太阳,H。et al。CFTR突变增强了无序降解,导致wnt依赖性造血功能受损。细胞死亡。9, 275年。https://doi.org/10.1038/s41419-018-0311-9(2018)。
彭,X。et al。在斑马鱼中,CXXC5是与tgf - β信号通路相关的心脏环路所必需的。Int。j .心功能杂志。214, 246 - 253。https://doi.org/10.1016/j.ijcard.2016.03.201(2016)。
Choudhry, P. & Trede, N. S. DiGeorge综合征基因tbx1通过wnt11r调节心循环和分化。《公共科学图书馆•综合》8, e58145。https://doi.org/10.1371/journal.pone.0058145(2013)。
刘,Y。et al。CFTR缺乏导致斑马鱼胚胎发生期间心脏发育不良,并与扩张型心肌病相关。动力机械。Dev。163, 103627年。https://doi.org/10.1016/j.mod.2020.103627(2020)。
刘,M。et al。CFTR抑制剂CFTRinh-172治疗人t细胞急性淋巴母细胞白血病细胞Leuk。Res。86, 106225年。https://doi.org/10.1016/j.leukres.2019.106225(2019)。
资金
国家自然科学基金(82271692、81670346、81974365、81974226)、四川省自然科学基金(2022NSFSC0782)、四川省科技计划(2020ZYD007、2018HH0014、2019YFS0350)、中央高校基本科研业务费专项(SCU2022F4080)、华西第二医院(no . KS151、KS152)资助。
作者信息
作者及隶属关系
贡献
H.S.和Y.L.构想并设计了实验;m.l.、D.X.和z.l进行了实验;h.s., y.l., m.l., d.x.s和z.l分析了数据;m.l., d.x., Y.L.和H.S.写了这篇论文。
相应的作者
道德声明
相互竞争的利益
作者声明没有利益竞争。
额外的信息
出版商的注意
施普林格自然对出版的地图和机构从属关系中的管辖权主张保持中立。
权利和权限
开放获取本文遵循知识共享署名4.0国际许可协议,允许以任何媒介或格式使用、分享、改编、分发和复制,只要您对原作者和来源给予适当的署名,提供知识共享许可协议的链接,并注明是否有更改。本文中的图像或其他第三方材料包含在文章的创作共用许可协议中,除非在材料的信用额度中另有说明。如果材料未包含在文章的创作共用许可协议中,并且您的预期使用不被法定法规所允许或超出了允许的使用范围,您将需要直接获得版权所有者的许可。如欲查看本牌照的副本,请浏览http://creativecommons.org/licenses/by/4.0/.
关于本文
引用本文
罗敏,谢东,林中。et al。过量羟氯喹对斑马鱼的毒理学评价(鲐鱼类)的胚胎。Sci代表12, 18259(2022)。https://doi.org/10.1038/s41598-022-23187-9
收到了:
接受:
发表:
DOI:https://doi.org/10.1038/s41598-022-23187-9