摘要
尽管有症状的COVID-19患者中有近五分之一患有严重的肺部炎症,但发展为严重疾病的机制尚未完全了解。为了鉴定重症COVID-19患者中显著改变的基因,我们对5名COVID-19患者(2名重症患者和3名轻症患者)和3名健康对照(HC)的外周血单个核细胞(PBMCs)进行了信使RNA和微RNA分析。为了进一步评估,使用了两个公开的RNA-Seq数据集(GSE157103和GSE152418)和一个单细胞RNA-Seq数据集(GSE174072)。基于RNA-Seq数据集,血栓反应蛋白1 (THBS1)和白细胞介素-17受体A (IL17RA)在COVID-19重症患者血液中显著上调。从单细胞rna测序数据,IL17RA单核细胞和中性粒细胞水平升高,而THBS1水平主要在血小板中升高。此外,我们通过微rna测序鉴定了重症COVID-19中三种差异表达的microrna。有趣的是,hsa-miR-29a-3p在严重的COVID-19中被显著下调,预计会结合两者的3 ' -非翻译区IL17RA和THBS1信使rna。进一步验证分析我们的队列(8例HC, 7例重度和8例轻度患者)表明THBS1,但不是IL17RA显著上调,而hsa-miR-29a-3p在重症患者的pbmc中下调。这些发现强烈提示THBS1,IL17RA,hsa-miR-29a-3p包括严重的COVID-19。
介绍
由严重急性呼吸系统综合征冠状病毒2型(SARS-CoV-2)引起的2019冠状病毒病(COVID-19)是对全球公共卫生的严重威胁。根据世卫组织2019冠状病毒病管理生活指南,有症状的COVID-19患者中有15%发展为以呼吸窘迫为特征的严重疾病,5%为危重疾病1,2。到目前为止,人们已经努力了解与COVID-19严重程度相关的临床、生物学和免疫特征。最近的荟萃分析研究发现,血清c反应蛋白、乳酸脱氢酶和d -二聚体水平与COVID-19的严重程度显着相关3.,4。此外,年龄较大、男性和合并症已被确定为SARS-CoV-2引起危重疾病和死亡的危险因素5,6,7。重症监护病房收治的重症患者通常住院时间更长,更有可能因呼吸衰竭而需要机械通气,死亡率更高8,9。为有效控制不良后果,了解重症COVID-19发生机制至关重要。
对重症COVID-19的多项研究都强调了免疫扰动,如T细胞亚群减少、中性粒细胞与淋巴细胞比例增加、促炎细胞因子产生升高10,11,12。促炎细胞因子过表达与COVID-19细胞因子释放综合征患者肺部炎症和病理性肺损伤有关13,14。白细胞介素(IL)-17是covid -19相关细胞因子释放综合征患者释放的促炎因子之一15,16。此外,血栓形成是呼吸道病毒感染的致命并发症,包括COVID-19。凝血和免疫系统之间的串扰可能决定病毒感染期间肺部病理的严重程度17,18。MicroRNA (miRNA)是一种小的非编码RNA,被广泛研究为许多人类疾病的生物标志物和调节剂19,20.。最近的研究试图找出与COVID-19患者外周血中临床严重程度相关的miRNA谱21,22,23。尽管如此,直到最近,COVID-19严重程度的实际预测指标仍然模糊不清。确定与临床严重程度相关的有效靶点将制定针对COVID-19的新的预防和治疗策略。因此,本研究旨在探讨与COVID-19重症相关的转录组学特征。
我们之前通过nCounter Human Immunology基因表达测定显示,在免疫相关转录组谱的背景下,重症和轻度/中度COVID-19病例之间没有显著差异24。然而,为了对轻度和重度COVID-19患者之间的全转录本进行无偏筛选,我们对COVID-19患者(3例轻度和2例重度疾病)和3例健康对照(HC)的外周血单个核细胞(PBMCs)的总信使rna和小rna进行了测序。我们的测序数据,以及公开的两个RNA测序(RNA- seq)和一个单细胞RNA- seq数据显示,IL-17受体A (IL17RA)和血栓反应蛋白1 (THBS1) mRNA水平均升高hsa-miR-29a-3p与来自hc和COVID-19轻度组的患者相比,来自重症组的pbmc的水平下调。进一步的实验分析我们的队列(8例hcc患者,7例重度和8例轻度患者)表明THBS1,但不是IL17RA显著上调,而hsa-miR-29a-3p与hcc患者相比,来自重症患者的pbmc中表达下调。这些发现有助于为开发针对重症COVID-19的新治疗策略奠定基础。
方法
患者和样本
采用实时定量聚合酶链反应法确定COVID-19患者鼻咽和口咽拭子或痰液中是否存在SARS-CoV-2。根据世卫组织的严重程度评分,轻度和重度患者分别被分为“0-1”和“6-7”1。该研究纳入了在忠南大学医院住院的COVID-19患者,所有受试者都获得了知情同意,包括年龄/性别匹配的hc。19岁以下的患者被排除在外。所有临床和实验室结果都是在采集样本时得出的。
样品制备和总RNA提取
从肝素化静脉血中分离pbmc,使用密度梯度培养基,lymphooprep (STEMCELL Technologies, Vancouver, Canada),如前所述24。根据制造商的说明,用QIAzol裂解试剂(Qiagen, Hilden, Germany)和miRNeasy Mini Kits (Qiagen)从pbmc中分离总RNA。使用带有RNA 6000 Pico芯片的Agilent 2100生物分析仪(Agilent Technologies, CA, USA)评估RNA质量。RNA的定量使用NanoDrop 2000分光光度计系统(Thermo Fisher Scientific, MA, USA)。
文库制备和测序
rna测序(RNA-Seq)使用QuantSeq 3 ' mRNA-Seq Library Prep Kit (Lexogen, Wien, Austria)构建文库。简而言之,使用oligo-dT引物在5 '端与illumina兼容序列连接后,对每个500 ng总RNA进行反转录。在RNA模板降解之后,用随机引物合成第二条链,该引物在其5 '端含有一个与illumina兼容的连接序列。用磁珠净化双链文库去除所有反应组分。通过对库的扩增,增加了完整的集群生成适配器序列。完成文库纯化后,使用NextSeq 500 (Illumina, CA, USA)进行单端75次测序。
对于小RNA测序(smRNA-Seq),使用NEBNext Multiplex small RNA Library Prep试剂盒(New England BioLabs, MA, USA)构建文库。将接头连接到每个1 μg总RNA后,用接头特异性引物进行反转录。使用QIAquick PCR纯化试剂盒(Qiagen)和AMPure XP珠(Beckman Coulter, CA, USA)对文库进行扩增和纯化。小RNA文库的产率和大小分布采用Agilent 2100生物分析仪进行高灵敏度DNA测定(Agilent Technologies)。单端测序由NextSeq500系统(Illumina)完成。
RNA-Seq分析
为了去除低质量碱基(< Q20),将所有原始序列读段送入BBduk, BBMap软件包(https://sourceforge.net/projects/bbmap)。接下来,将QuantSeq 3 ' mRNA-Seq和小RNA-Seq的剩余reads定位到人类参考基因组(GRCh37/hg19)。25和miRBase数据库成熟的miRNA序列26使用Bowtie2软件27,分别。我们用Bedtools计算了基因的读取计数28并使用EdgeR进行分位数归一化29。除非另有说明,否则我们分析中的表达级别单位是分位数规范化读计数。为鉴别差异表达基因(differential expression genes, DEGs),应用Student’s软件统计各组间基因表达水平t我们以p值< 0.05和双变化来定义deg。为了表征COVID-19疾病的基因,我们使用数据库注释、可视化和集成发现(DAVID)分析了基因本体(GO)的富集情况。http://david.abcc.ncifcrf.gov)。使用R pheatmap包(1.0.12版本)绘制deg的表达热图。使用STRING蛋白相互作用数据库(version 11)分析蛋白相互作用关系。30.。
公开的rna测序数据的元数据分析
从NCBI GEO数据库中检索到三个与covid -19相关的公开rna序列数据集31。第一个队列数据32对100例covid -19阳性患者外周血白细胞转录组进行研究(GSE157103)。采用机械呼吸机支持对42例重症和58例中度covid -19阳性患者进行区分。第二个队列数据33(GSE152418)包含来自16例COVID-19急性住院患者的PBMC转录组,包括8例重症、4例ICU和4例中度患者。标记为重症或ICU的12例为重症病例,标记为中度的4例为中度病例。从每个获得的定量转录组表达数据中,edgeR R-package(版本3.36.0)29用于将原始计数转化为每百万计数(CPM)并排除非常低表达的基因。保留至少2个样本中log2-CPM≥1的基因作进一步分析。过滤后,使用R包(版本3.36.0)的edgeR中的calcNormFactors函数,使用m值的修剪平均值(TMM)方法计算归一化因子,以缩放原始库大小。29。使用edgeR包中嵌入的glmFit和glmLRT函数进行差异表达分析。采用Benjamini和Hochberg的错误发现率(false discovery rate, FDR)进行校正进行多重检验,只有FDR < 0.05且1.5倍变化截止值的基因才被认为有显著差异表达。
在第三组队列数据中34(GSE174072),有41份样本的红细胞裂解全血单细胞rna测序(scRNA-Seq)数据集,其中包括33名COVID-19患者和8名健康对照。我们从COVID-19 Cell Altas获得处理后的scRNA-Seq数据(https://www.covid19cellatlas.org/)。为了鉴定细胞群中差异表达的基因,我们使用了Seurat(4.0.5版本)中的“FindAllMarkers”功能。35使用默认参数。采用Seurat的双侧Wilcoxon秩和检验和Bonferroni的校正来确定统计显著性。
MiRNA靶基因预测
使用miRWalk 3.0在线预测软件(http://mirwalk.umm.uni-heidelberg.de/;最后访问日期为2022年2月)36。每个mirna -靶对的最小自由能(ΔG)也通过miRWalk 3.0计算。
细胞培养和转染
THP-1细胞购自American Type Culture Collection (TIB-202, ATCC, VA, USA)。THP-1细胞在37°C温度和5% CO的加湿培养箱中保持2在RPMI 1640培养基(12-702F, Lonza, Basel, Switzerland)中添加10%胎牛血清和1%青霉素/链霉素。转染时,THP-1细胞以3 × 10次接种5用500 nM浓度的phorpol -12-肉豆酸盐-13-乙酸酯(P8139, Sigma-Aldrich, MO, USA)分化3小时。3 h后,用模拟阴性对照(50 nM)转染THP-1细胞hsa-miR-29a-3p(5,20,50 nM),根据制造商的说明使用Lipofectamine 2000 (12566014, Invitrogen, MA, USA)。的hsa-miR-29a-3pmimic (5 ' -UAGCACCAUCUGAAAUCGGUUA-3 ')购自Genolution (Seoul, South Korea)。模拟阴性对照购自Ambion (4464058, texas, Austin)。
实时定量聚合酶链反应分析(qPCR)
提取总RNA后,使用逆转录母混合物(EBT-1515C, Elpis Biotech, London, England)合成互补DNA进行mRNA表达分析,使用miScript II RT试剂盒(218161,Qiagen)进行miRNA表达分析。在Rotor-Gen Q 2plex系统(9001620,Qiagen)中使用quantiinova SYBR绿色PCR试剂盒(208056,Qiagen)或miScript SYBR绿色PCR试剂盒(218073,Qiagen)进行qPCR。采用delta-delta CT与人的相对定量方法对数据进行分析肌动蛋白或RNU6-2作为一种内部控制基因。引物序列如下:肌动蛋白正向:5 ' -CACCATTGGCAATGAGCGGTTC-3 ',反向:5 ' -AGGTCTTTGCGGATGTCCACGT-3 ',IL17RA正向:5 ' -AGTTCCACCAGCGATCCAAC-3 ',反向:5 ' - ggcatgtagtccggaattg -3 ',THBS1正向:5 ' -CAGGGATACTCGGGCCTTTC-3 ',反向:5 ' -GAAACCCGTCTTTGGCCTGT-3 ',Hsa-miR-29a-3p: 5“-TAGCACCATCTGAAATCGGTTA-3”。引物对RNU6-2购自Qiagen (MS00033740)。
道德声明
本研究已获得忠南大学医院(大田,韩国;CNUH 2019-04-046, CNUH 2020-07-082),并根据赫尔辛基宣言进行37。所有受试者在入组时均提交知情同意书。
结果
COVID-19患者免疫特征与临床严重程度的关系
所有样本均采集自患有COVID-19轻、重度疾病和健康状态的韩国受试者。他们的临床特点和实验室结果总结于表中1。临床上仅有1例轻度患者有发热症状,但超过85%的重度患者在采血时有发热症状(P= 0.0101)。在基础疾病方面,轻度组和重度组之间没有显著差异。与所有重症患者都需要机械通气相反,所有轻度患者在隔离期间均保持稳定,除了一些镇痛药(P= 0.0002)。本研究的采样点相对较早,即发病后5至7天。与我们之前的报道一致,c反应蛋白(P = 0.0003)和白蛋白(P = 0.0068)在MILD组和SEVERE组之间存在显著差异24。
转录组分析表明两者都有IL17RA和THBS1重症患者血液中基因水平上调
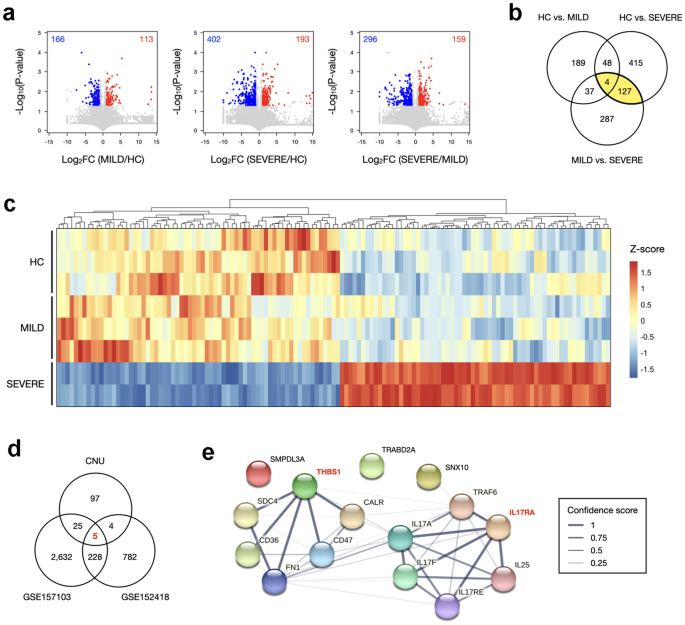
为了探索基因表达模式并识别重症COVID-19病例中显著改变的基因,我们生成了5例COVID-19患者的PBMCs RNA-Seq数据,包括2例重度和3例轻度表型以及3例HC。三组两两比较显示,尽管Spearman相关系数(ρ)介于中度及轻度(ρ= 0.966),略高于SEVERE与hcc (ρ= 0.951),重度与轻度(ρ= 0.947)(补充图1a).接下来,我们通过综合生物信息学分析,分别确定了每个数据集的deg及其相关途径和功能。使用279度的HC对轻度,595度的SEVERE对HC, 455度的SEVERE对MILD(图2)。1a)进行基因本体(GO)富集分析,考察靶基因的主要功能。尽管在HC与MILD的279个deg中没有显著富集的GO项或途径,但与SEVERE比较的deg中富集了GO项。595度的SEVERE与HC表现出与核糖体相关途径相关的富集功能,包括srp依赖的协同翻译蛋白靶向膜、rRNA加工和翻译起始(补充图)。1b).有趣的是,我们发现与T细胞激活及其信号通路相关的基因在455度的SEVERE和MILD中特异性富集(补充图2)。1c).这些发现令人信服地表明了COVID-19重症患者免疫相关基因表达的改变。
为了鉴定SEVERE特异性表达标记基因,我们筛选了SEVERE与HC、SEVERE与MILD之间表达差异的基因。在重症COVID-19患者中131个常见改变的deg中(图2)。1b),与轻度和HC相比,重度患者中64个基因上调,67个基因下调(图2)。1c)。
随后,我们试图使用来自covid -19患者PBMC样本的两个公开可用的人类RNA-Seq数据集验证我们的结果。在GSE157103队列中,在42例重症和58例中度covid -19阳性患者中鉴定出2890个deg(补充图)。2a)。此外,从GSE152418队列中筛选了1019例deg,包括12例重度和4例中度COVID-19患者(补充图2)。2b).将它们与我们的实验结果进行比较,我们发现了5个假定的severe特异性表达标记基因,即4个上调基因(IL17RA,SMPDL3A,SNX10,THBS1)和一个下调基因(TRABD2A)(图。1d)进一步,利用STRING数据库对蛋白-蛋白相互作用进行了研究30.表示,IL17RA和THBS1特征性地显示为枢纽,并与免疫系统中与细胞因子和白细胞介素信号通路相关的几个基因直接相连(图2)。1e).这些数据表明两者IL17RA和THBS1与HC和轻度患者相比,重症COVID-19患者的pbmc水平上调。
在COVID-19重症患者中,IL17RA主要在单核细胞和中性粒细胞中表达,而THBS1在血小板中高度表达
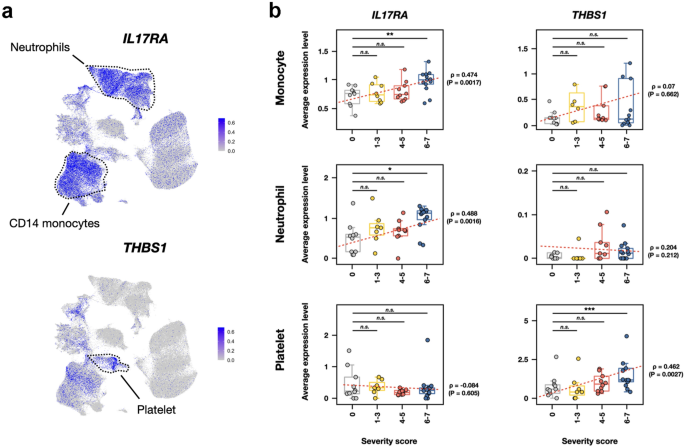
研究对哪些免疫相关细胞类型有反应IL17RA和THBS1,我们使用了GSE174072队列34scRNA-Seq数据包括来自33名COVID-19患者和8名具有世卫组织COVID-19严重程度评分的健康对照者的17.5万个单转录组。给出预处理后的scRNA-Seq数据,我们使用均匀流形逼近和投影(UMAP)方法在二维上可视化它们,并得到与原始研究相同的图(补充图2)。3.)。在UMAP绘制的14种不同细胞类型簇中,IL17RA表达在“CD14阳性单核细胞和中性粒细胞类型。另一方面,THBS1表情表现出明显不同的模式,这只是一种弱表达。CD14阳性单核细胞”,在“中性粒细胞”细胞类型中无明显表达,但主要在“血小板”中观察到(图2)。2a).接下来,我们质疑这些基因表达模式是否可以预测COVID-19严重程度评分。的表达水平IL17RA基因与患者COVID-19严重程度评分呈显著正相关CD14-阳性单核细胞(ρ= 0.474和P= 0.0017)和中性粒细胞(ρ= 0.488和P= 0.0016)。2B,左侧面板)。值得注意的是,IL17RA6 ~ 7分严重程度组的基因表达水平显著高于0分严重程度组CD14阳性单核细胞(P= 0.0015, Wilcoxon秩和检验)和中性粒细胞(P= 0.0100, Wilcoxon秩和检验)细胞类型,而这些变化在THBS1基因表达模式(图2)2B,右侧面板)。相比之下,THBS1基因显著(P= 0.0009, Wilcoxon秩和检验)在严重组COVID-19患者的血小板中表达上调。总之,这些数据有力地表明,单核细胞和中性粒细胞都是IL17RA而血小板是…的主要来源THBS1在人类免疫细胞类型中此外,基因表达水平升高IL17RA和THBS1这些基因可以作为COVID-19严重程度的指标。
Hsa-miR-29a-3p一个潜在的microRNA靶向吗IL17RA和THBS1在来自重症COVID-19患者的pbmc中
最近,有令人信服的证据表明,宿主和病毒编码的mirna对SARS-CoV-2的复制和感染至关重要38,39,40。因此,我们试图鉴定在严重COVID-19样本中差异表达的人类mirna,从而进行smRNA-seq实验。在根据归一化读计数阈值< 5过滤低表达mirna后,两个显著下调(hsa-miR-29a-3p和hsa - mir - 146 a - 5 - p)和一个显著上调的(hsa - mir - 144 - 5 - p)鉴定出miRNAs(图2)。3.一个)。
我们质疑这些在严重COVID-19样本中特别下调的mirna是否被预测会结合3 ' -UTRIL17RA和THBS1。对miRWalk数据库的分析发现hsa-miR-29a-3p两者都可以绑定IL17RA和THBS1(无花果。3.b)为IL17RAmRNA中,从5′端第3位开始共有13对hsa-miR-29a-3p,具有两个鸟-尿嘧啶摆动碱基对,假设理论计算的自由能为- 17.4 kcal/mol(图2)。3.B,上面板)。为THBS1mRNA中,miRNA靶位点既缺乏完美的种子配对,也缺乏3 ' -补偿配对,但却有17对沃森-克里克对和3对摆动对,理论上计算的自由能为- 20.2 kcal/mol(图2)。3.B,下面板)。此外,我们还发现ρ=−0.675和P= 0.004)hsa-miR-29a-3p和两个靶基因(图2)。3.c).这些发现暗示升高IL17RA和THBS1mRNA的表达可能部分与hsa-miR-29a-3p在COVID-19重症患者中
THBS1,但不是IL17RA在COVID-19患者的pbmc中升高,并受hsa-miR-29a-3p
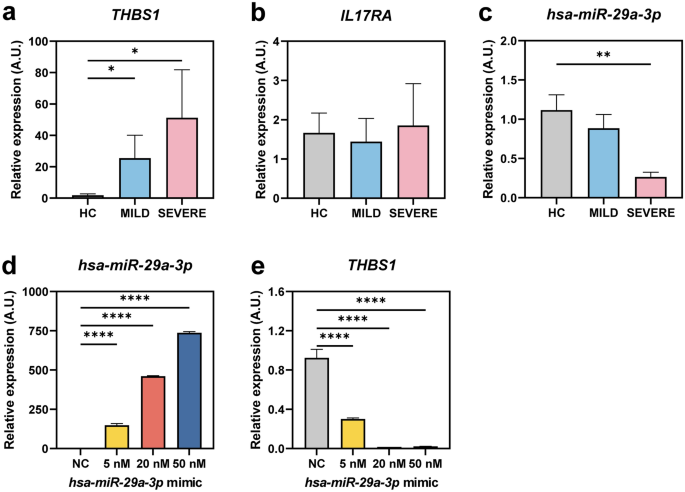
为了进一步验证生物信息学结果,我们进行了qRT-PCR分析IL17RA和THBS1来自COVID-19患者(7名重症患者和8名轻症患者)和8名健康对照者的PBMC样本。我们发现THBS1,但不是IL17RA,在轻度和重度患者中,与hc患者相比,明显增加(图2)。4a、b)。此外,hsa-miR-29a-3p与hcc患者相比,重症患者的pbmc水平明显下调(图2)。4c).因为我们发现THBS1以及对hsa-miR-29a-3p在重症患者中,我们进一步研究了hsa-miR-29a-3p的mRNA表达THBS1人类THP-1细胞如图所示。4D e,我们找到了hsa-miR-29a-3p被过度表达hsa-miR-29a-3p模拟转染,然而THBS1mRNA表达下调。总的来说,这些数据有力地表明THBS1是上调的,而hsa-miR-29a-3p在重症患者的pbmc中下调。此外,我们的数据表明hsa-miR-29a-3p过度表达负性调节THBS1在人类单核细胞中的水平。
THBS1是被上调的,但是hsa-miR-29a-3p是下调的,在重症患者的pbmc中THBS1目标是hsa-miR-29a-3p。(一个- - - - - -c)从轻度(n = 8)、重度(n = 7)和hc (n = 8)患者中分离出人PBMCs。THBS1(一个),IL17RA(b),hsa-miR-29a-3p(c)的表达水平通过qRT-PCR分析。(d,e) THP-1细胞转染阴性对照(50 nM)或hsa-miR-29a-3p模拟(5,20,50 nM)。转染后提取总RNA测定hsa-miR-29a-3p(d),THBS1(e)表达水平。实验重复或三次进行,数值以均数±SEM (一个- - - - - -e)。*P< 0.05;**P< 0.01;* * *P< 0.001;* * * *P< 0.0001。Kruskal-Wallis测验(一个- - - - - -c)和单因素方差分析(d,e)。数控负性控制hsa-miR-29a-3p模仿。
讨论
最近,一些研究表明,严重的COVID-19患者在SARS-CoV-2感染期间表现出失调的免疫反应14,15,16,41。SARS-CoV-2感染的肺部病理表现为与广泛炎症相关的弥漫性肺血管内血栓形成17,42,43。静脉血栓栓塞的风险增加通常表现为COVID-19患者循环d -二聚体水平上调44。在免疫血栓形成过程中,病毒与宿主因子之间存在密切的相互作用(凝血和免疫系统)。此外,这些串串可以在病毒被清除后很长时间内持续存在,并影响COVID-19不同阶段的发病机制17,45。最近的荟萃分析研究提出了治疗性肝素对中度COVID-19患者的有希望的效果46。事实上,肝素抗凝治疗可降低COVID - 19住院患者的死亡风险43,44。然而,在血栓栓塞的背景下,COVID-19严重程度的准确预测指标尚未广为人知。
通过对三个队列的信使RNA-Seq数据进行组合分析,本研究发现THBS1在严重的COVID-19中增加。单细胞RNA-seq数据集显示THBS1在单核细胞中表达,但在严重程度的单核细胞中无显著变化。另一方面,我们发现THBS1主要在血小板中表达,在重症患者中表达较高。众所周知,THBS1是由凝血酶激活的血小板分泌的,在血栓栓塞中起重要作用47,48,49。最近的研究表明THBS1不仅与血栓形成有关,还与免疫调节剂有关50,51。在免疫和感染环境下,THBS1及其受体CD47抑制T细胞分化52,53,54。先前的一项蛋白质组学研究发现,COVID-19患者血浆中THBS1水平明显高于健康对照组55。虽然样本量很小,但我们也确认THBS1与hcc患者相比,来自轻度和重度患者的PBMCs表达上调。需要进一步研究THBS1在COVID-19疾病进展和发病机制中的作用,以及它如何在凝血级联反应和炎症反应中上调。
mirna已被认为是SARS-CoV2感染期间病理反应的潜在生物标志物和调节因子21,22,23。通过靶向感染过程中参与病理生理反应的众多基因,候选mirna可能参与调控靶基因的多种分子功能,从而影响COVID-19的不同模式或临床结局21,23。我们的数据随着表达的减少hsa-miR-29a-3p在重症患者中部分与之前的研究结果相关hsa-miR-29a-3pCOVID-19重症组患者血清和血浆中的水平被抑制56,57。有趣的是,下降的水平hsa-miR-29a-3p呈负相关COL5A3任何级别的COVID-19患者56。我们的数据在显示负相关方面是独一无二的hsa-miR-29a-3p与IL17RA和THBS1在本研究分析的所有受试者中。进一步的实验分析有力地表明hsa-miR-29a-3p有助于过度表达THBS1在COVID-19严重病例中。据我们所知,这是第一份披露这一点的报告THBS1是潜在的目标hsa-miR-29a-3p在严重的患者中,该水平是失调的。最近的一项研究也表明,miR-29a通过靶向卷曲5受体对不同甲型流感病毒株具有抑制作用58。此外,miR-29a水平与HIV-1的复制和传播呈负相关59,60表明miR-29a在病毒感染期间的抗病毒反应中起着至关重要的作用。最近的计算机数据表明,miR-29a与SARS-CoV-2基因组具有高亲和力61强调miR-29a可能是SARS-CoV-2感染的一个有吸引力的治疗靶点。未来的研究迫切需要评估是否hsa-miR-29a-3p在COVID-19严重状态下有助于抗病毒和抗炎反应。
此外,我们的计算机分析数据显示IL17RA还有THBS1被预测为目标miR-29a-3p。Th17细胞是主要产生细胞因子IL-17A的T淋巴细胞亚群62。IL-17也由其他细胞类型如CD8+ T细胞、γδ T细胞和自然杀伤细胞产生63。Th17细胞可分为两种类型;表达IL-17和IL-10的宿主保护性Th17亚群64,65炎症性Th17细胞类型与IL-17、IL-22和IFN-γ的表达增加有关66,67。到目前为止,已知IL-17家族成员至少有6个,分别是IL-17A(通常称为IL-17)、IL-17B、IL-17C、IL-17D、IL-17E/IL-25和IL-17F68。IL-17A及其受体(IL17RA)是触发下游信号通路激活病理性炎症事件的最具特征的成分68,69。IL-17/IL17RA信号触发CXCL1、CXCL2、CXCL5和CXCL8/IL-8的产生,从而诱导中性粒细胞的募集62。该研究反复观察到,IL17RA在四个不同的RNA-seq数据集中持续升高,这些数据集分析了重症COVID-19患者的外周血,包括单细胞数据集。新出现的数据表明,针对IL-17/IL17R的单克隆抗体(例如,Ixekizumab, Secukinumab和Brodalumab)治疗各种免疫介导性疾病是有效的68。迄今为止,IL17R水平的临床意义在很大程度上是未知的。Scalia等人最近的一项研究发现,在35名意大利COVID-19患者的血清中,IL-17A较高,但晚期严重程度的可溶性il - 17ra较低。血清IL17RA的升高可阻止IL-17与其细胞受体的相互作用,提示靶向IL-17途径的单克隆抗体可用于治疗COVID-1970。因此,有必要积累更多的数据来了解IL17RA在COVID-19重症治疗背景下的临床相关性。此外,未来的一项大型队列分析研究应阐明IL17RA是否是has-miR-29a-3p在COVID-19严重程度的背景下。
我们的工作有各种局限性,包括韩国COVID-19患者的样本量较小,由于设施和患者入组限制,在更大的人群中缺乏基因表达验证。然而,增加的THBS1和减少has-miR-29a-3p表明它们是预测COVID-19临床表现的潜在有价值的候选者。因此,有必要在一个大的队列中进行进一步的研究,以提供新的生物标志物和治疗选择THBS1,IL17RA,miR-29a-3p用于治疗COVID-19重症患者。
数据可用性
本研究生成的所有RNA-Seq数据均可在NCBI Gene Expression Omnibus (GEO)中获得,登录号为SRR18361588-SRR18361603,编号为BioProject PRJNA817356。
参考文献
谁。2019冠状病毒病临床管理生活指南:生活指南,2021年11月23日(世界卫生组织,2021年)。
吴志和,McGoogan, J. M.中国2019冠状病毒病(COVID-19)暴发的特点及重要教训——中国疾病预防控制中心72314例病例报告摘要。《美国医学会杂志》323科学通报,1239-1242(2020)。
王,L。et al。CRP、SAA、LDH和DD预测冠状病毒病(COVID-19)的不良预后:来自7739例患者的荟萃分析Scand。j .中国。实验室。Investig。81, 679-686(2021)。
马利克,P。et al。COVID-19住院治疗的生物标志物和结果:系统回顾和荟萃分析BMJ Evid。地中海。26, 107-108(2021)。
g·N·约安诺et al。10131名感染SARS-CoV-2的美国退伍军人住院、机械通气或死亡的危险因素JAMA Netw。开放3., e2022310(2020)。
托特-曼尼科夫斯基,s.m。et al。COVID-19危重症患者死亡率、急性肾损伤和呼吸衰竭的性别差异医学(巴尔的摩)One hundred., e28302(2021)。
周,F。et al。武汉成人COVID-19住院患者临床病程及死亡危险因素:一项回顾性队列研究《柳叶刀》395中文信息学报,1054-1062(2020)。
苏莱曼,G。et al。底特律大都会一系列患者2019冠状病毒病的临床特征和发病率JAMA Netw。开放3., e2012270(2020)。
Grasselli G。et al。意大利伦巴第大区icu收治的1591例SARS-CoV-2感染患者的基线特征和结局《美国医学会杂志》323中文信息学报,1574-1581(2020)。
文,x。S。et al。中重度COVID-19患者CD4(+)T细胞水平降低的临床特征及预测价值:一项多中心回顾性研究BMC感染。说。21, 57(2021)。
秦,C。et al。武汉新型冠状病毒2019 (COVID-19)患者免疫反应失调中国。感染。说。71, 762-768(2020)。
哈罗德,T。et al。IL-6和CRP水平升高预测COVID-19患者是否需要机械通气。J.过敏临床。Immunol。146, 128 - 136。e124(2020).
梅塔,P。et al。COVID-19:考虑细胞因子风暴综合征和免疫抑制。《柳叶刀》395中文信息学报,1033-1034(2020)。
Darif D。et al。促炎细胞因子在COVID-19发病机制中的作用:哪里出了问题?活细胞。Pathog。153, 104799(2021)。
陈晓明,陈晓明,陈晓明,等。COVID-19疾病的免疫反应失调和细胞因子释放风暴(CRS)。Int。Immunopharmacol。90, 107225(2021)。
Martonik, D, Parfieniuk-Kowerda, A, Rogalska, M. & Flisiak, R. Th17应答在COVID-19中的作用。细胞10, 1550(2021)。
张丽娟,张丽娟,张丽娟,等。感染、炎症和血栓形成:流感和严重急性呼吸综合征冠状病毒相关动脉血栓形成的潜在机制综述[j]。医学杂志。化学。403, 231-241(2022)。
Mizurini, D. M., Hottz, E. D., Bozza, P. T.和Monteiro, R. Q.: covid -19相关血栓形成的基础:分子和细胞方面。前面。Cardiovasc。地中海。8, 785738(2021)。
O 'Connell, R. M., Rao, D. S., Chaudhuri, A.和Baltimore, D. microrna在免疫系统中的生理和病理作用。Nat. Rev. Immunol。10, 111-122(2010)。
Bautista-Becerril B。et al。从进化垃圾到2019冠状病毒病可能的预后标志物和治疗靶点的mirna病毒14, 41(2021)。
李春丽,胡晓明,李丽丽,李建辉。人新冠肺炎患者外周血microRNA的差异表达。j .中国。实验室。分析的34, e23590(2020)。
de Gonzalo-Calvo, D。et al。循环microRNA谱预测住院患者COVID-19的严重程度。Transl。Res。236, 147-159(2021)。
加戈,A。et al。COVID-19危重症患者循环心血管microrna欧元。J.心脏衰竭。23, 468-475(2021)。
孙,K. M。et al。COVID-19患者上调toll样受体4介导的炎症信号,模拟细菌性败血症。[j]韩国医学科学。35, e343(2020)。
兰德,e。S。et al。人类基因组的初步测序和分析。自然409, 860-921(2001)。
Kozomara, A., Birgaoanu, M. & Griffiths-Jones, S. miRBase:从microRNA序列到功能。核酸测定。47, d155-d162(2019)。
Langmead, B. & Salzberg, S. L. Fast与Bowtie的间隙阅读对齐。Nat方法。9, 357-359(2012)。
昆兰,a.r.和霍尔,i.m. BEDTools:一套灵活的比较基因组特征的实用工具。生物信息学26, 841-842(2010)。
Robinson, m.d, McCarthy, d.j. & Smyth, g.k. edgeR:用于数字基因表达数据差异表达分析的生物传导包。生物信息学26, 139-140(2010)。
Szklarczyk D。et al。蛋白质-蛋白质关联网络与增加的覆盖率,支持全基因组实验数据集的功能发现。核酸测定。47, D607-d613(2019)。
巴雷特,T。et al。NCBI GEO:功能基因组数据集存档-更新。核酸测定。41, d991-d995(2013)。
Overmyer, k.a。et al。COVID-19严重程度的大规模多组学分析。细胞系统。12, 23-40。e27(2021).
** *am, p.s.。et al。人类对COVID-19轻度和重度感染免疫的系统生物学评估。科学369, 1210-1220(2020)。
威尔克,a.j.。et al。多组学分析显示COVID-19中先天性免疫和造血功能普遍失调。实验,医学。218, e20210582(2021)。
, Y。et al。多模态单细胞数据综合分析。细胞184, 3573 - 3587。e3529(2021).
Sticht, C, De La Torre, C, Parveen, A.和Gretz, N. miRWalk:预测microRNA结合位点的在线资源。《公共科学图书馆•综合》13, e0206239(2018)。
世界医学协会。世界医学协会赫尔辛基宣言:涉及人体受试者的医学研究的伦理原则。《美国医学会杂志》310, 2191-2194(2013)。
孟,F。et al。在感染过程中检测到由SARS-CoV-2核衣壳基因编码的病毒microrna,并靶向宿主细胞的代谢途径。细胞10, 1762(2021)。
Pawlica, P。et al。SARS-CoV-2表达一种能够选择性抑制宿主基因的微小RNA样小RNA。Proc。国家的。学会科学。美国118, e2116668118(2021)。
保罗,S。et al。microrna在解决COVID-19从感染到治疗的难题中的作用:一个小型综述。病毒Res。308, 198631(2022)。
马登,E. A.和戴蒙德,M. S.宿主细胞内在先天免疫识别SARS-CoV-2。咕咕叫。当今。性研究。52, 30-38(2022)。
洛布,H。et al。重症COVID-19患者静脉血栓栓塞的危险因素:21项研究的荟萃分析Int。j .包围。Res.公共卫生18, 12944(2021)。
McGonagle, D, O 'Donnell, J. S, Sharif, K., Emery, P.和Bridgewood, C. COVID-19肺炎肺血管内凝血功能障碍的免疫机制。柳叶刀Rheumatol。2[j], 2014 - 12。
Nopp, S., Moik, F., Jilma, B., Pabinger, I.和Ay, C. COVID-19患者静脉血栓栓塞的风险:系统回顾和荟萃分析。Pract >,Thromb。Haemost。4中文信息学报,1178-1191(2020)。
Hernández-Huerta, m.t.。et al。SARS-CoV-2免疫血栓形成机制生物分子11, 1550(2021)。
Sholzberg, M。et al。肝素治疗COVID-19的随机试验:一项荟萃分析。Pract >,Thromb。Haemost。5, e12638(2021)。
Phillips, D. R., Jennings, L. K.和Prasanna, H. R. Ca .2 +糖蛋白G(凝血酶敏感蛋白,血栓反应蛋白)与人血小板介导的关联。生物。化学。255, 11629-11632(1980)。
Dubernard, V., Arbeille, b.b., Lemesle, m.b.和Legrand, C.人类血小板中细胞骨架蛋白α -肌动蛋白的α颗粒池与黏附糖蛋白血小板反应蛋白-1在胞外过程中重新分配的证据。Arterioscler。Thromb。Vasc。医学杂志。17, 2293-2305(1997)。
赵,C, Isenberg, J. S.和Popel, A. S.人凝血反应蛋白-1在生理和病理条件下的表达模式:定性和定量分析。j .细胞。摩尔。地中海。22, 2086-2097(2018)。
高强,陈坤,高亮,郑勇,杨玉刚,等。血小板反应蛋白-1信号通过CD47抑制内皮细胞周期进程和诱导衰老。细胞死亡。7, e2368(2016)。
Kaur, S., Cicalese, k.v., Bannerjee, R.和Roberts, D.。靶向CD47在肿瘤微环境中功能的治疗性抗体的临床前和临床发展。Antib。其他。3., 179-192(2020)。
Cham, L. B, Adomati, T., Li, F., Ali, M. & Lang, K. S. CD47在感染性疾病治疗中的潜在靶点。抗体(巴塞尔)9, 44(2020)。
Miller, T. W., Kaur, S., Ivins-O 'Keefe, K.和Roberts, D. D.血栓反应蛋白-1是T细胞活化中依赖cd47的内源性硫化氢信号抑制剂。矩阵杂志。32, 316-324(2013)。
Rodriguez-Jimenez, P。et al。血小板反应蛋白-1/CD47相互作用调节银屑病Th17和Treg分化。前面。Immunol。10, 1268(2019)。
蜀,T。et al。血浆蛋白质组学鉴定COVID-19的生物标志物和发病机制。免疫力53, 1108 - 1122。e1105 (2020).
Keikha, R., Hashemi-Shahri, S. M.和Jebali, A.不同分级COVID-19患者住院期间血清中miR-31、miR-29、miR-126和miR-17及其mRNA靶点的相对表达。欧元。J. Med. Res。26, 75(2021)。
Grehl C。et al。SARS-CoV-2衍生小rna的检测及与COVID-19相关的循环小rna的变化病毒13, 1593(2021)。
杨,X。et al。miR-29a通过靶向卷曲5受体成为流感病毒感染的负调控因子。拱门。性研究。166, 363-373(2021)。
帕特尔,P。et al。microRNA miR-29a与人类免疫缺陷病毒潜伏期相关。Retrovirology11, 108(2014)。
Frattari, G., Aagaard, L.和Denton, P. W. miR-29a在HIV-1复制和潜伏期中的作用。J.病毒。3., 185-191(2017)。
Jafarinejad-Farsangi, S, Jazi, M. M., Rostamzadeh, F.和Hadizadeh, M. SARS-CoV-2基因组的高亲和力分析。非编码RNA。5, 222-231(2020)。
Gaffen, S. L, Jain, R., Garg, A. V.和Cua, D. J. IL-23-IL-17免疫轴:从机制到治疗测试。Nat. Rev. Immunol。14, 585-600(2014)。
贝里,s.p.d。et al。IL-17和抗IL-17药物在自身免疫性和炎症性疾病的免疫发病机制和管理中的作用Int。Immunopharmacol。102, 108402(2022)。
麦吉奇,m.j.。et al。tgf - β和IL-6驱动T细胞产生IL-17和IL-10,抑制T(H)-17细胞介导的病理。Immunol Nat。8, 1390-1397(2007)。
Esplugues E。et al。TH17细胞的控制发生在小肠中。自然475, 514-518(2011)。
兰格里什,c.l.。et al。IL-23驱动致病T细胞群诱导自身免疫性炎症。实验,医学。201, 233-240(2005)。
郑,Y。et al。白细胞介素-22,一种T(H)17细胞因子,介导il -23诱导的皮肤炎症和棘层增生。自然445; 648-651 (2007)
IL-17受体家族的结构和信号传导。Nat. Rev. Immunol。9, 556-567(2009)。
王玉华,刘玉杰。IL-17细胞因子家族及其在过敏性炎症中的作用。咕咕叫。当今。Immunol。20.; 697-702(2008)。
Cacciapuoti, S。et al。COVID患者的免疫细胞分析:对个性化治疗的贡献?生命科学。261, 118355(2020)。
致谢
我们非常感谢所有医务人员及其家属在这场大流行病的最前沿不懈努力。本研究由韩国政府(MSIT)资助的韩国国家研究基金(NRF)资助(No. 2017R1A5A2015385)。
作者信息
作者及隶属关系
贡献
概念:y.s.k., e.k.j., C.P.;数据管理:S.G.L。,I.S.K k.m., H.J,南卡罗来纳州,j.k., S.K, C.P.;形式分析:S.G.L。,I.S.K k.m., H.J,南卡罗来纳州,j.k., S.K, C.P.;融资收购:e.k.j.;项目管理:H.J。,k.m. I.S.K, S.G.L, Y.S.K, E.-K.J, C.P.;软件:S.G.L, I.S.K, C.P.;监督:C.G.P。,I.S.K Y.S.K, C.P。E.-K.J。验证:密度。,S.G.L I.S.K, E.-K.J, C.P.;原创作品草案:H.J。,k.m. I.S.K, S.G.L, Y.S.K, C.P。E.-K.J。写作-评审和编辑:s.g.s., k.s., h.j., k.m.s., i.s.k., s.g.l., p.s., y.s.k., e.k.j., C.P.所有作者都严格审查并批准了手稿的最终版本。
相应的作者
道德声明
相互竞争的利益
作者声明没有利益竞争。
额外的信息
出版商的注意
施普林格自然对出版的地图和机构从属关系中的管辖权主张保持中立。
补充信息
权利和权限
开放获取本文遵循知识共享署名4.0国际许可协议,该协议允许以任何媒介或格式使用、共享、改编、分发和复制,只要您适当地注明原作者和来源,提供知识共享许可协议的链接,并注明是否进行了更改。本文中的图像或其他第三方材料包含在文章的创作共用许可协议中,除非在材料的信用额度中另有说明。如果材料未包含在文章的创作共用许可协议中,并且您的预期使用不被法定法规所允许或超出了允许的使用范围,您将需要直接获得版权所有者的许可。如欲查看本牌照的副本,请浏览http://creativecommons.org/licenses/by/4.0/。
关于本文
引用本文
金,I.S,李,SG。申,S.G.et al。重症COVID-19患者血栓反应蛋白1和miRNA-29a-3p异常。Sci代表12, 21227(2022)。https://doi.org/10.1038/s41598-022-23533-x
收到了:
接受:
发表:
DOI:https://doi.org/10.1038/s41598-022-23533-x