文摘
DNA甲基化是一个重要的表观遗传修饰在哺乳动物细胞调节基因的表达。异常的DNA甲基化在人类癌症基因启动子是常见的类型。DNMT3B是主要的新创甲基转移酶增强在几个主要的肿瘤。如何建立从头甲基化与癌症相关的基因知之甚少。CpG岛(cgi)、常见序列和转录因子(TFs)种能阻碍DNMT3B相互作用与新创异常甲基化有关。我们最初确定的独联体元素种能阻碍DNMT3B与DNA甲基化相关调查的贡献可能放松管制的目标基因的超表达在上皮细胞模型。一组表达下调的基因(n = 146)从种能阻碍DNMT3B HaCaT细胞进行靶向治疗,我们发现CGI,常见的序列,TFs种能阻碍DNMT3B结合位点相互作用(我们称之为P-down-3B)。PPL1、VAV3 IRF1, BRAF P-down-3B种能阻碍DNMT3B基因表达下调和增加了甲基化的存在。这些研究结果表明,甲基化促进剂有一些异常独联体种能阻碍DNMT3B可能有助从头甲基化的元素。
介绍
DNA甲基化在CpG上下文中是一个关键的表观遗传调控基因表达的过程。DNA甲基化是由化学添加甲基五碳在胞核嘧啶。在基因组中结构合理,广泛的CpG控制的地区,叫做cgi存在。1 kb的cgi的平均大小,和CpG含量> 60%,普遍地出现在启动子区域1。胞嘧啶甲基化基因序列中所包含的信息增加,从这个意义上说,相同的序列可能阅读不同,参与特定基因的开/关开关2。论文认定人类沉积的甲基化DNA甲基转移酶(DNMTs)的酶3。DNMT1维护DNMT和建立DNA甲基化在hemimethylated基质,主要在DNA复制,丰富体细胞。种能阻碍DNMT3B DNMT3A和新创DNMTs建立DNA甲基化在hemimethylated unmethylated基质和他们在胚胎细胞的表达水平较高4,5,6。DNA甲基化提出了在开发过程中调节基因的表达和维护细胞的命运,但是放松管制的3甲基转移酶催化地活跃在胚胎或体细胞,导致异常的基因表达,导致人类疾病7,8。从头甲基化主要是建立了种能阻碍DNMT3B DNMT3A,尽管分享功能和类似的目标,有特定的目标区域和他们每个人的基因9不同的功能机制10,11在相同的上下文中,微分函数的结果12,有不同的表达谱为每个DNMTs的癌症13。种能阻碍DNMT3B在一些实体肿瘤,调节,与肿瘤抑制基因的表观遗传失活,并增加的数量和体积肿瘤14。人类基因组是分段在生物独联体监管元素(启动子、增强子、cgi TFBS,和其他人),这是一个关键的管理非编码DNA序列,邻近基因的转录调控行为15。种能阻碍DNMT3B的直接监管的目标基因已经稀疏地测试,但存在的报道独联体从头甲基化相关的元素作为cgi, TFs,甲基化促进剂的共同主题。这些元素被发现在种能阻碍DNMT3B表达下调的基因。
CpG人类启动子上的内容有至关重要的作用在体细胞的DNA甲基化。通常,启动子高含量的CpG (HCP)是稀疏甲基化和表达。发起人与中间内容的论文认定动态甲基化,并通过管理他们的转录状态是甲基化根据组织的不同,分化,细胞周期。含量较低的启动子论文认定(LCP)甲基化及其目标基因抑制转录16,17。CpG上下文在癌症成为相关的异常甲基化模式的建立由DNMTs CpG有DNA甲基化获得丰富的地区或cgi18。种能阻碍DNMT3B当表达增加,也是增强从头甲基化19种能阻碍DNMT3B,优惠绑定,其酶活性在cgi20.,21。
从头甲基化相关信息包含在自己的独联体序列,据报道,序列相邻CpG参与人类的亲和力DNMTs从头甲基化22,23,24。种能阻碍DNMT3B DNA甲基化沉积的一直在观察CANAGCTG序列(N,任何核苷酸)25。分析新创种能阻碍DNMT3B图案说明甲基化区域的显示一个浓缩的胸腺嘧啶残留在位置−1和鸟嘌呤残留在位置+ 1主题发现这些区域,NTCpGGN26。鸟嘌呤在种能阻碍DNMT3B CpG首选的+ 1最近被生化检测,证实了在特定的氨基酸(Asn779和Lys777)种能阻碍DNMT3B的催化域27。cgi被认为是生物活性图案和平台的招聘chromatin-modifying蛋白质,促进转录调控。在cgi,我们发现许多TFBS,有些是转录抑制因子的因素。有几个交互的TFs DNMTs和调节目标基因28,29日,30.,31日。RASSF1A基因是一种能阻碍DNMT3B基因可以由通过DNA甲基化在癌症。Myc TF与致癌相关函数和被描述为支持种能阻碍DNMT3B招募RASSF1A基因启动子,导致其表观遗传沉默和改善其功能作为一个肿瘤抑制32。同时,在前列腺癌,REX1过度种能阻碍DNMT3B新兵,会使RASSF1A基因启动子甲基化33。
种能阻碍DNMT3B有过度的证据及其相关肿瘤抑制基因的表观遗传失活34。几个关键基因甲基化,发现了细胞正常结肠种能阻碍DNMT3B和有趣的是,在鼠标开始从头甲基化的基因就像基因甲基化在人类结肠癌。在前面的工作,他们认为这种相似性的一个可能的解释是,异常甲基化在癌症可以归因于特定序列的目标,而不是随机的甲基化35。此外,在癌症、种能阻碍DNMT3B已经发现,过度导致hypermethylator表型36。
种能阻碍DNMT3B获得知识和表达下调基因过度表达,我们专注于共同的元素,函数表达式,并在一组基因甲基化状态。我们确认独联体种能阻碍DNMT3B元素在这组基因表达下调在HaCaT细胞过度。我们选择四个基因独联体元素和发现表达和降低启动子甲基化在PPL1, VAV3 IRF1, BRAF。综上所述,我们的数据表明,种能阻碍DNMT3B异常增加有助于异常从头甲基化和这个事件可以影响独联体种能阻碍DNMT3B元素中找到可能的靶基因。
结果
种能阻碍DNMT3B表达下调的基因超表达有共同的cis元素
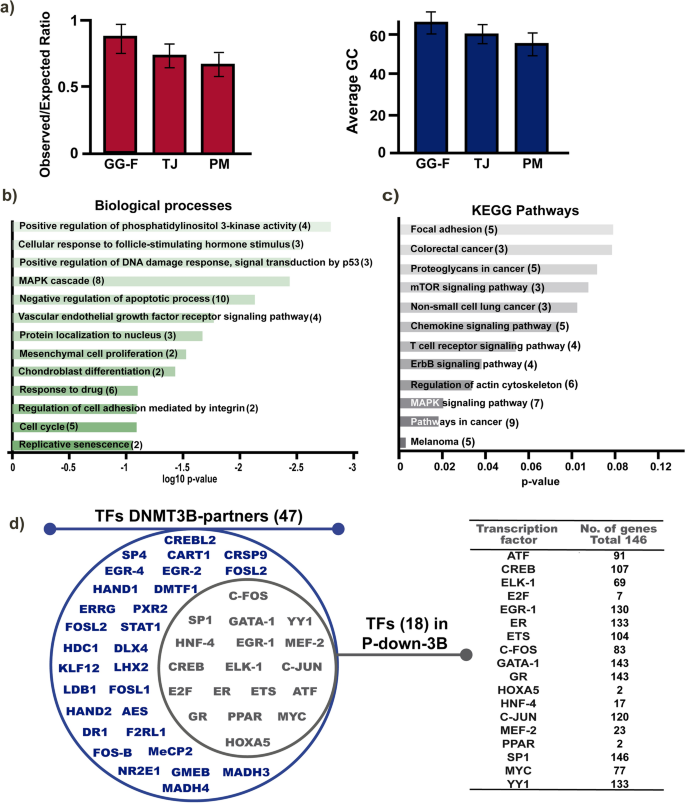
我们工作组种能阻碍DNMT3B以前生成的超表达在HaCaT细胞模型。通过一个微阵列表达,我们发现252种能阻碍DNMT3B表达下调基因的超表达的z分数2到6.837。种能阻碍DNMT3B可能目标基因表达减少,我们的第一个目标的识别独联体元素,可以影响从头甲基化。由于种能阻碍DNMT3B的阻遏作用和影响CpG-context从头甲基化,我们首次发现基因与CGI是一种能阻碍DNMT3B可能的元素参与针对表达下调的基因。通过三个算法,我们发现146/252与CpG岛基因启动子区域。这些cgi观察/预期比> 0.6和CpG平均超过50%(图。1一个)。
种能阻碍DNMT3B超表达的降低癌症和与相关基因的表达独联体在甲基化促进剂元素呈现。(一个)观察/预期比率和CpG平均从CpG岛发现P_Down_CGI认同三个算法:GG-F, Gardiner-Garden Frommer算法;TJ Takai-Jones算法;点,Ponger-Mouchiroud算法。(b)生物过程完成,(c)KEGG通路显著富集的136个基因表达降低种能阻碍DNMT3B (Z分数2.0到6.8)在其监管过度和CGI地区(P-down-3B)。(d)维恩图(左)显示所有种能阻碍DNMT3B TFs发现直接交互和TFs分数结合位点和浓缩P-down-3B基因。TFs具有不同的频率分布(右)在P-down-3B基因集。
DNMT3B过度导致基因异常甲基化与关键角色在生物正常过程38,39。知道的流程与CGI参与表达下调的基因,我们做了一个基因本体论(去)和豹途径分析。根据基因,参与细胞周期、衰老、MAPK级联,PI3K监管、细胞凋亡等(图1b)。在KEGG分析中,表达下调的基因被发现在癌症通路,MAPK和ErbB信号,黑色素瘤,肠癌和非小细胞肺癌,等等(无花果。1c)。
除了cgi,被描述在某些推动者,招聘与TFs DNMTs可能由交互32。我们问题如果表达下调的基因(CGI)可能会结合位点的TFs种能阻碍DNMT3B直接与互动。我们发现在文献47种能阻碍DNMT3B TFs,形状复杂(图。1d,左)40。生物信息学分析与阿里巴巴2.0,Expasy(环保署),和基因组浏览器数据结合位点识别的种能阻碍DNMT3B TFs监管序列的表达下调基因(图。1d,左)。我们发现18/47 TFBSs种能阻碍DNMT3B以前报道的交互(TFs DNMT3B-partners)分析基因的启动子。我们发现对TF结合位点SP1, EGR-1,呃,GATA-1, GR, c-JUN y YY1,在120年到146年选择基因。ATF结合位点,分子、ELK1 c-FOS y MYC债券107 - 77/146的基因,和一些TFs稀缺的结合位点;E2F、HOXA5 HNF4 MEF2 y PPAR中发现(图2 - 23基因。1d,对吧)。种能阻碍DNMT3B表达下调基因的超表达的CpG岛和TFBS名叫P-down-3B基因。
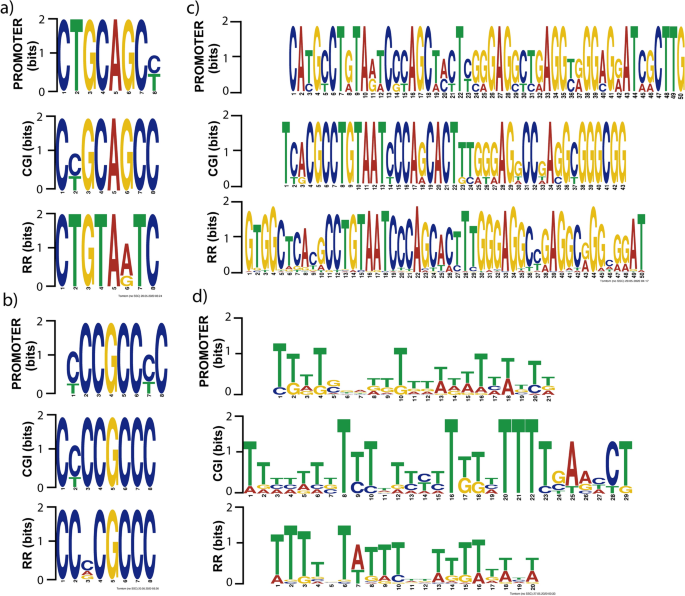
迄今为止,已报告可能绑定序列种能阻碍DNMT3B DNMT3A或在特定的上下文中。这些序列中发现存在种能阻碍DNMT3B DNMT3A或甲基化促进剂25。我们相信会有序列种能阻碍DNMT3B反映偏好的表达下调的基因。因此,我们与MEME套件进行主题分析,识别常见的图案P-down-3B基因。我们从P-down-3B搜索主题三个功能区域的基因;监管区域−2000 - 1000 (RR), CpG岛(CGI),德密切启动子(−400年到100年,(发起人))。短期和ungapped主题引出显示3功能区域之间的几种常见主题。我们展示两个短代表图案非常喜欢对方(图。2a、b)。小说的发现和ungapped RR图案显示出巨大的共同主题,CGI和启动子(图。2c)。综合主题分析人类5-methylcytosine转录因子结合DNA甲基化在P-down-3B基因(图显示类似的主题。2种能阻碍DNMT3B d)。这些可能的优先序列分析了the146 P-down-3B基因和至少80%的人被发现。
TCGA DNMT3B过度是常见的癌症患者的数据集
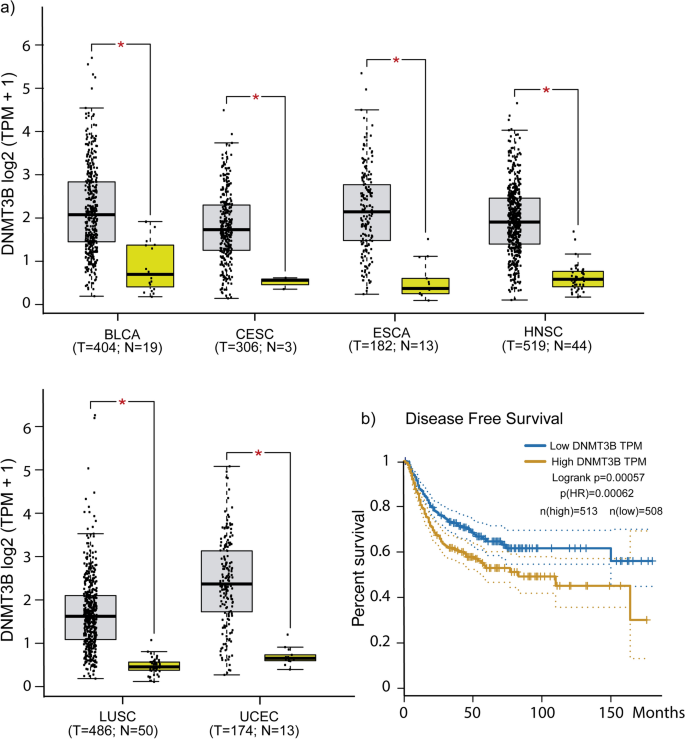
接下来,我们检查了种能阻碍DNMT3B是否表达增加的癌症患者。种能阻碍DNMT3B我们审问TCGA水平和无病生存在癌症患者数据集。DNMT3B是人类固体中也是明显在六个代表上皮肿瘤(BLCA,塞斯克,光电子能谱、HNSC LUSC,和UCEC)对正常组织(无花果。3kaplan meier)。生存分析结果种能阻碍DNMT3B情节描述之间的关系表达水平和癌症预后;种能阻碍DNMT3B高表达在代表肿瘤与不良预后显著相关(无花果。3b)。同样的六个被讯问DNMT3A人类肿瘤的表达水平。我们发现没有4/6的癌症样本中表达有显著变化有关正常组织和预后没有发现重大协会关于DNMT3A表达水平(补充文件2,补充图。1)。
PPL1, VAV3、BRAF和IRF1独联体元素,种能阻碍DNMT3B获得甲基化,减少他们的表情超表达
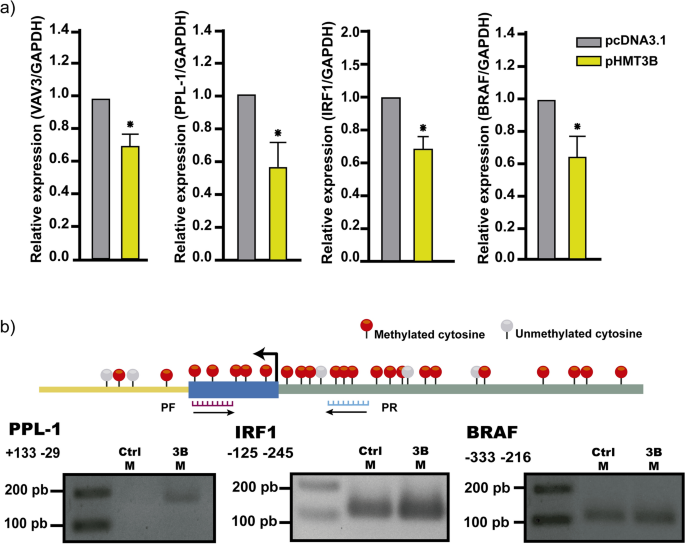
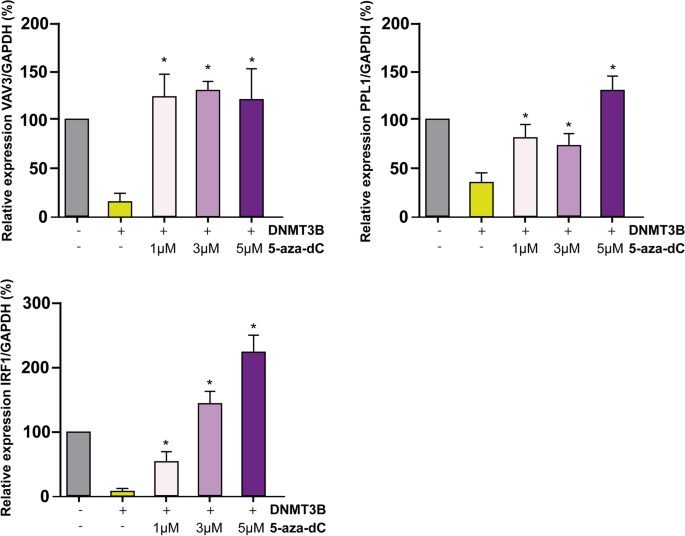
我们下了一些关键的表达下调基因选择独联体元素(补充文件2,补充图。2)及其在癌症相关的功能流程。我们屏幕PPL1特定转录和甲基化状态,VAV3, BRAF和IRF1。我们想知道如果这些基因表达减少,如果他们获得种能阻碍DNMT3B HaCaT细胞进行靶向治疗的甲基化。然后,我们分析了VAV3的表达,PPL1, BRAF, IRF1 RT-qPCR,发现这些基因的mRNA表达下降(图。4a)。这些基因的表达也减少HaCaT细胞内源性激活种能阻碍DNMT3B稳定表达(补充文件2,补充图。3)。因此,我们调查是否降低PPL1表达式,BRAF和IRF1的获得是由于在其启动子甲基化。我们发现,在种能阻碍DNMT3B HaCaT细胞进行靶向治疗,PPL1, BRAF和IRF1获得甲基化有关控制HaCaT细胞(无花果。4VAV3 b),获得2区域的甲基化之前确定亚硫酸氢VAV3子由修改和测序37。补充的甲基化分析,我们进行下一个实验与5-aza-2´脱氧胞苷(5-aza-dC)种能阻碍DNMT3B HaCaT细胞过度。VAV3的表达减少,PPL1 e IRF1种能阻碍DNMT3B由过度治疗1µM恢复,3µM, 5µM 5-aza-dC(无花果。5)。
DNMT3B过度增加HaCaT细胞的细胞迁移
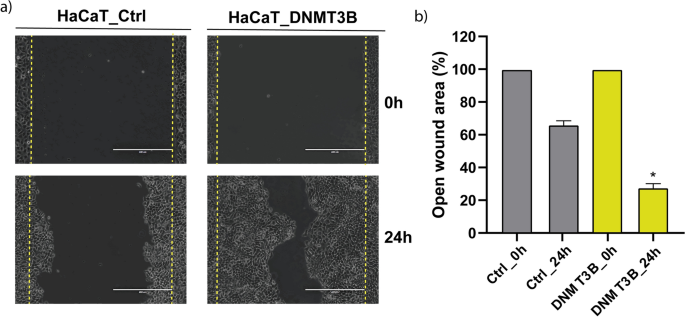
种能阻碍DNMT3B凸显一般的发现与超表达,涉及多个基因和关键途径,我们选择一个共同的生物过程汽车在癌症,细胞迁移。我们执行一种能阻碍DNMT3B伤口关闭试验控制和超表达HaCaT细胞。我们观察到显著增加细胞迁移种能阻碍DNMT3B在24小时超表达有关控制HaCaT细胞(无花果。6量化的)。种能阻碍DNMT3B伤口关闭表明过度导致近78%对35%的地区在控制细胞(无花果。6b)。
讨论
基因异常的沉默,DNMTs过度产生负面影响细胞正常。在关键基因异常甲基化模式在体细胞导致致癌的项目41。DNMT3B是一个关键的新创DNMT及其绑定基因组甲基化沉积密切相关的几个功能区域,例如,增强剂12,基因转录的尸体20.,基因内区42、赞助商43,44,45,46,47,48,49与不同的功能结果。启动子甲基化在cgi相关基因转录沉默而基因内甲基化与基因激活和影响同种型mRNA的长度50,51,52。DNMT3B目标基因在癌症上下文和包含一些被描述独联体元素与DNA甲基化有关。在基因组结构意义上,我们共同进行调查独联体种能阻碍DNMT3B元素表达下调基因的超表达和功能意义上的,我们评估的甲基化和表达状态四种能阻碍DNMT3B癌症相关基因和的影响癌症的关键生物过程。
种能阻碍DNMT3B在这项工作中,我们发现,基因表达下调与cgi的监管区域(146个基因),与DNMTs招聘相关的TFBS,和常见的序列(无花果。1和2)。DNMTs家人并´t结合位点在基因组,但可以引导目标网站通过cgi等methylation-prone序列。关于cgi和CpG内容的信息已成功用于预测基因启动子的甲基化水平。种能阻碍DNMT3B尤其是优先结合丰富的CpG高度重复的异色的区域53,54,55。种能阻碍DNMT3B证据一起,我们相信´s偏爱基因与cgi种能阻碍DNMT3B可以增加在某些疾病是汽车,例如在致癌作用56。种能阻碍DNMT3B CGI与甲基化被发现增加癌症,因此,基因的甲基化与CGI增强19,57,58。
cgi,相邻或发起人,也绑定TFs的平台。结合位点的甲基化可以支持或防止助教招聘目标的推动者,因此调节转录率59。此外,一些致癌TFs复杂DNMTs定位目标基因和沉默32,60,61年。在文献中,有报道称种能阻碍DNMT3B TFs之间的直接交互,我们发现在P-down-3B结合位点18 TFs(图。1d)。在蛋白质相互作用,微阵列发现几个TFs与DNMTs交互40和证明了正则表达式的监管机构的目标基因种能阻碍DNMT3B通过招聘和DNA甲基化。在肝癌细胞中,FOXO1的表达被压抑FOXM1之间的交互,种能阻碍DNMT3B RB1,62年。另一个例子是种能阻碍DNMT3B与ZEB1 TF,后果是Ddr1启动子甲基化63年。种能阻碍DNMT3B TBX2新兵,在乳腺癌细胞和其他阻遏蛋白NDRG1近端启动子64年。种能阻碍DNMT3B的入住率在HCT116基因组中调制基因子集ZBTB24的目标,参与细胞一般维护和协调维护基因体内的DNA甲基化65年。
通常,大多数蛋白质与DNA相互作用的指导下具体绑定序列。从这个意义上说,一些蛋白质甲基化的级联,如DNMT3A和TET1已报告主题结合在dna蛋白质相互作用的研究66年,67年。在这项研究中,我们发现常见序列之间共享P-down-3B基因(图。2)。检索中包含的信息独联体序列,启动子区域,CpG岛和广泛的监管区域P-down-3B分别进行扫描。同意我们的结果,常见的主题已报告在DNMTs超甲基化促进剂25,26种能阻碍DNMT3B和结构功能分析显示偏好的CpG, G + 1的位置27,68年类似的互补链上发现无花果。2b主题。我们发现一个高度保守的大图案的P-down-CGI独立分析区域(图。2c),图中所示的图案。2一个和无花果。2d胞嘧啶、胸腺嘧啶之间有趣的变化,丰富的存在只有胸腺嘧啶残留,分别。的解释是,5 mc是propense脱氨基作用成为胸腺嘧啶,导致C-to-T转换69年。同时,中央人民政府损失通常是在启动子甲基化的结果转换对胸腺嘧啶甲基胞核嘧啶70年。的独联体元素,特别是独联体启动子序列,包含必要的信息对DNA甲基化71年。额外的实验来验证这些的直接含义是必要的独联体种能阻碍DNMT3B元素执行的DNA甲基化。
DNMT3B是主要的新创甲基转移酶在不同类型的癌症和肿瘤发展被认为是必要的13,14,72年,73年,74年。一般方法,探索一种能阻碍DNMT3B对频率的调节异常上皮来源的肿瘤。在TCGA的数据集,我们种能阻碍DNMT3B看到是主要的新创甲基转移酶过表达在上皮癌(6/6)对DNMT3A(2/6)(图3和补充文件2,补充图。1)。这可以表明异常的DNA甲基化在这些癌是一种能阻碍DNMT3B种能阻碍DNMT3B部分结果的贡献和高水平与预后不良相关(无花果。3种能阻碍DNMT3B b)。全球DNA甲基化增加了反映其重要性在癌症和同样重要的是要知道具体的种能阻碍DNMT3B表达下调的基因的甲基化。销售税和cgi的发起人是´t通常甲基化16,但有致癌作用期间甲基化模式的改变75年,确定它的情况下或元素是知之甚少。DNMT3B有几个目标基因在癌症,包括癌基因和肿瘤抑制。种能阻碍DNMT3B白血病,没有或减少是一个事件,倾向于恶性转变76年,77年C-met等,目标基因78年。然而,是种能阻碍DNMT3B最常报道,超表达密切相关的肿瘤抑制基因沉默在几个肿瘤38,39,79年,80年,81年。迄今为止,没有种能阻碍DNMT3B报道,绑定在启动子导致基因表达增加如果不是恰恰相反,因此,我们专注于四个基因表达下调独联体元素和功能相关的癌症,PPL1, IRF1, BRAF和VAV3。这些基因具有共同的独联体元素异常甲基化促进剂(补充文件2,补充图。2)。我们发现,这些基因种能阻碍DNMT3B减少他们的表达增加,获得启动子的甲基化区域(图。4)。此外,这些基因的表达水平与5-aza-dC获救治疗(图。5)。PPL1脚手架蛋白参与细胞桥粒连接,在分化上皮细胞角蛋白细丝82年。PPL1报道几乎表现在晚期食管鳞状细胞癌(ESCC)83年,食道癌84年。损失表达PPL1 ESCC与甲基化和PPL1感应提升粘附和延迟细胞迁移85年。BRAF基因,汇总为一个丝氨酸/苏氨酸激酶,通常突变在癌症86年。一直的沉默与激活BRAF蛋白一种生产在微卫星不稳定区域和hypermutable表型87年。干扰素调节因子1 (IRF1)参与基因的转录调节的中介抗病毒、免疫调节、抗增殖效果88年。IRF1已被确定为一个肿瘤抑制乳腺癌89年。VAV3鸟嘌呤核苷酸交换因子参与调节ρgtpase和各种细胞过程。VAV3基因被甲基化在乳腺癌和胃癌90年,91年。甲基化,因此损失的获得这些基因的表达可能与放松管制的相关规范在致癌过程。我们知道更好的实验是必要种能阻碍DNMT3B证实这些可能的目标基因。种能阻碍DNMT3B多种方法的研究在人类癌症的具体目标是有限的,他们中的大多数是由干细胞在人类和动物模型。我们重新分析RNA-Seq数据从人类表皮干细胞(EpSC)种能阻碍DNMT3B与损耗12。在这些数据中,我们发现PPL1和IRF1增加他们的表达与si-DNMT3B EpSC(补充文件2,补充图。4)。在另一项研究在H1 hESC线92年种能阻碍DNMT3B,峰值分布在不同地区的基因组(补充文件2、补充图。5)和最近的种能阻碍DNMT3B基因的识别峰显示57/146基因种能阻碍DNMT3B CGI从我们的工作附近发现了山峰,包括IRF1, BRAF VAV3, PPL1。另一方面,只有发现23/100基因表达下调没有种能阻碍DNMT3B CGI基因集的山峰(补充文件2,补充图5 b)。在这些山峰,我们发现6/18 TFs(补充文件2、补充图。5 c)确定在监管种能阻碍DNMT3B从表达下调的基因序列(图1d)。我们知道这些实验被执行在干细胞和反映出细胞的甲基化景观种能阻碍DNMT3B设立的,高水平的表达相对分化细胞。在癌症,据报道,胚胎或未分化细胞癌细胞有相似之处93年。尽管他们应该谨慎对待,巧合的发现反映强烈的相似性是种能阻碍DNMT3B HaCaT细胞进行靶向治疗和干细胞的报道模式。P-down-3B基因被发现参与几个关键信号通路在癌症(图表达下调。1b, c),其中的一些过程,如细胞迁移的影响。种能阻碍DNMT3B我们发现过度增加HaCaT细胞迁移(图。6)。种能阻碍DNMT3B的角色在这个过程中也观察到种能阻碍DNMT3B膀胱癌在击倒抑制迁移和入侵48,94年。种能阻碍DNMT3B我们的研究结果表明,超表达足够的几个基因表达下调。这些基因参与过程密切相关的癌症和独联体元素与发起人获得从头甲基化有关。
癌症细胞系是良好的学习模型进行调查的异质的因素导致一个特定的癌症类型,然而,与永生的角化细胞模型(HaCaT)我们试图模仿和一线事件在癌症发病阶段,DNMT3B老年病。这个模型可以解释异常的CGI在启动子甲基化。我们的方法与cgi表达下调基因,但重要的是种能阻碍DNMT3B宣布超表达也与几个基因的上调有关。甲基化的基因内cgi51细胞分化有关吗52,95年、活跃转录和浓缩的组蛋白修饰如H3K36me350。我们研究相关基因可能是种能阻碍DNMT3B催化功能,和我们的研究的局限性在于,我们不能歧视是否变化观察到所有的管制基因是一种能阻碍DNMT3B催化或辅助功能96年,我们专门测试中的催化功能4选择基因。
的证据表明DNMTB过度导致基因放松管制,这发生在超过一种类型的癌症。一个详尽的不求甚解地探索这些基因甲基化在超过一种类型的癌症是必要的。的独联体元素可以进一步研究预测基因异常甲基化。
结论
在这项研究中,我们描述了一些独联体种能阻碍DNMT3B元素被发现表达下调基因的超表达。这些基因中最常见的元素是CGI,紧随其后的是共同的主题和TFBS。全部或部分这些元素的存在可能建议倾向某些地区获得甲基化在异常情况下。基因与独联体元素在这个工作是种能阻碍DNMT3B并获得甲基化降低了超表达。种能阻碍DNMT3B的全球作用影响细胞迁移等关键生物过程。
方法
细胞培养
的HaCaT人类角化细胞永生化细胞系从美国购买类型文化集合(写明ATCC,美国)。HaCaT生长在DMEM / F12 1: 1中(Sigma-Aldrich)补充10%胎牛血清(奥地利的边后卫,PAA实验室GmbH), 100 U /毫升的青霉素(Penprocilin 800000 U、湖边、墨西哥)和100µg /毫升的链霉素(Sulfestrep、比萨实验室、墨西哥)。细胞种植在37°C存在5%的二氧化碳。
表达系统
我们使用生成的建筑pCDNA3.1-DNMT3B Peralta-Arrieta et al。,2017 a)。~ 25×103HaCaT细胞转染3.5μg pcDNA3.1-DNMT3B或3.5μg de pCDNA3.1(+)使用lipofectamine 2000试剂(lipofectamine, 2000年表达载体,生活技术,卡尔斯巴德、钙、美国)。pos-transfeccion 48 h后,HaCaT细胞RNA的收获(Direct-Zol RNA miniprep ZymoResearch)和DNA (向导®基因组DNA的净化,Promega麦迪逊,美国)提取。
种能阻碍DNMT3B稳定表达的HaCaT dCAS9系统生成的。设计和评价的引导序列CRISPR-Cas9系统,我们使用了CRISPOR软件(http://crispor.tefor.net/)。种能阻碍DNMT3B人类序列启动子是一个用户为指导设计。选择引导序列在非目标分数最低。序列中使用的所有指导这项研究提供了补充文件1,补充表1。寡核苷酸的指南被克隆到lentiSAM-v2(嘌呤霉素)(Addgene质粒# 92062)。质粒被扩大,使用试剂盒纯化慢病毒转染前MiniPrep工具包。我们执行HaCaT细胞转染sg-1 /法律政策专员二(接近TSS)和sg-3 / sg-4。转染细胞放置在37°C和72 h后转染细胞re-suspended在新鲜培养基补充5μg /毫升的嘌呤霉素(σ)和转移到井6-well板。6天后(9天post-transfection)整除的细胞用于RNA提取和rt - pcr基因表达是量化。
生物信息学分析:识别CpG岛基因本体,共识序列甲基化启动子,转录因子结合位点
以前,我们实验室集团分析全球表达基因(H35K微阵列)种能阻碍DNMT3B HaCaT细胞过度在48 h37。我们选择的252个基因列表减少他们的表达与z分数2.0−−6.8 H35K微阵列。在这些基因中,我们选择了监管区域覆盖从2000−+ 1000 bp相对于转录起始站点。基因的序列从真核生物启动子数据库(下载https://epd.epfl.ch//index.php)。CpG岛进行了预测与MethPrimer计划(https://www.urogene.org/cgi-bin/methprimer/methprimer.cgi)。CGI)。考虑CpG岛的标准是一个地区> 300个基点,GC的比例超过50%,并预期/观察到比≥0.6分析dbCGI (CpG岛注释工具)。共识在表达下调的基因序列分析CpG岛在MEME套件(主题引出多个Em) (http://meme-suite.org/)。监管上的所有TFBS P-down-CGI地区被发现与阿里巴巴2.0 (http://gene-regulation.com/pub/programs/alibaba2/)我们重叠日期与转录因子直接种能阻碍DNMT3B相互作用的实验证据。我们把基因组浏览器(https://genome.ucsc.edu)信息的浓缩P-down-3B转录因子。去分析与基因功能注释工具大卫网站(https://david.ncifcrf.gov/,6.8版本)。默认参数用于浓缩分析BP,蜂窝组件(CC)和分子功能(MF)。结果去条款和相应的假定值然后加工使用REVIGO去除冗余。十个最重要的英国石油公司类别都显示。数据挖掘。从基因表达分析获得的数据交互分析(GEPIA;http://gepia.cancer-pku.cn/)数据库是用来分析六种能阻碍DNMT3B mRNA表达水平的癌症和正常宫颈组织。一种能阻碍DNMT3B高低之间的关系mRNA表达与患者的总生存期(OS)分析了癌症Kaplan - Meier分析和风险比(人力资源)和日志- P -值计算。
RNA提取和Quantitative-RT-PCR
总RNA提取HaCaT细胞转染48 h和pCDNA3.1-DNMT3B或pCDNA3.1(+)试剂盒(Direct-Zol RNA miniprep ZymoResearch)。100年总RNA是用于RT-qPCR ng装备KAPPA TM SYBR®快一步(Kapa生物系统公司,波士顿,麻萨诸塞州,美国)。引物序列所示(补充文件1,补充表1)。
甲基化特异性PCR (MSP)
MSP, 2μg HaCaT细胞的DNA转染con pCDNA3.1-DNMT3B或pCDNA3.1(+) 48小时处理一个EZ DNA Methylation-Gold™工具包(ZymoResearch,欧文CA美国)。MSP引物补充文件1所示,补充表1进行了总共10µL,包含1µL bisulfite-treated DNA,每个引物250海里,AmpliTaq Gold360大师混合(应用生物系统公司,美国加州福斯特城)。
伤口愈合化验
种能阻碍DNMT3B控制HaCaT细胞和HaCaT细胞过度生长,直到60毫米文化融合菜肴补充DMEM / F12如前所述。细胞饥饿24 h在DMEM / F12的边后卫和治疗2 h与胞嘧啶β-D-Arabinofuranoside (AraC)抑制细胞增殖实验。饥饿后,细胞scratch-wounded使用无菌200μL吸管,暂停了与PBS的细胞被洗两次,和文化re-fed DMEM / F12。细胞迁移到伤口的进步是在0和24小时监控使用奥林巴斯BX43显微镜和一个10×目标。板的底部被标记为参考,以及同一领域表现层后立即被拍到的伤口(时间= 0 h),治疗后24 h,每板5图像进行了分析。伤口的边缘之间的距离测量* 0和24小时,和报告的迁移距离对应于这两个之间的区别。迁移区是由测量伤口面积的使用图像J软件和MRI愈合的工具。
数据可用性
所有数据分析了在本研究中包括发表的这篇文章及其补充信息文件37。数据补充4和5中使用的数据集从基因表达数据库综合(GEO)下载下加入数字GSE65838 GSE150072,分别。
引用
Gardiner-Garden, m & Frommer m . CpG岛在脊椎动物的基因组。j·摩尔,杂志。196年,261 - 282。https://doi.org/10.1016/0022 - 2836 (87) 90689 - 9(1987)。
•贝斯特,t·H。,Edwards, J. R. & Boulard, M. Notes on the role of dynamic DNA methylation in mammalian development.Proc。国家的。学会科学。美国112年,6796 - 6799。https://doi.org/10.1073/pnas.1415301111(2015)。
•贝斯特,t·h·DNA甲基转移酶的哺乳动物。嗡嗡声。摩尔,麝猫。9,2395 - 2402。https://doi.org/10.1093/hmg/9.16.2395(2000)。
冈,M。,Bell, D. W., Haber, D. A. & Li, E. DNA methyltransferases Dnmt3a and Dnmt3b are essential for de novo methylation and mammalian development.细胞99年,247 - 257。https://doi.org/10.1016/s0092 - 8674 (00) 81656 - 6(1999)。
廖,J。et al。种能阻碍DNMT3B DNMT1中断,DNMT3A和人类胚胎干细胞。Nat,麝猫。47,469 - 478。https://doi.org/10.1038/ng.3258(2015)。
赫尔曼,。,Goyal, R. & Jeltsch, A. The Dnmt1 DNA-(cytosine-C5)-methyltransferase methylates DNA processively with high preference for hemimethylated target sites.生物。化学。279年,48350 - 48359。https://doi.org/10.1074/jbc.M403427200(2004)。
金井,y & Hirohashi美国改变与异常相关的DNA甲基化DNA甲基转移酶在人类癌症转换从一个恶性癌前状态。致癌作用28,2434 - 2442。https://doi.org/10.1093/carcin/bgm206(2007)。
顾,J。et al。映射的变量在多个细胞DNA甲基化类型定义了一个人类基因组的动态监管环境。G3(贝塞斯达)6,973 - 986。https://doi.org/10.1534/g3.115.025437(2016)。
八木天线,M。et al。识别不同的种能阻碍DNMT3B DNMT3A新创DNA甲基化的位点,在哺乳动物的发展。Commun Nat。11,3199年。https://doi.org/10.1038/s41467 - 020 - 16989 - w(2020)。
Norvil, a, B。et al。Dnmt3b DNA甲基化的非合作的机制,其活动影响预测二聚体的操作界面。生物化学57,4312 - 4324。https://doi.org/10.1021/acs.biochem.6b00964(2018)。
Boyko, K。et al。种能阻碍DNMT3B结构添加域表明缺乏DNMT3A-like autoinhibitory机制。物化学。Biophys。Commun >,619年,124 - 129。https://doi.org/10.1016/j.bbrc.2022.06.036(2022)。
里纳尔蒂,L。et al。种能阻碍Dnmt3b Dnmt3a和与增强剂来调节人类表皮干细胞体内平衡。细胞干细胞19,491 - 501。https://doi.org/10.1016/j.stem.2016.06.020(2016)。
蒙沙,即K。et al。Misregulation DNA甲基转移酶的表达和活性的癌症。NAR癌症3,zcab045。https://doi.org/10.1093/narcan/zcab045(2021)。
Linhart, h·G。et al。Dnmt3b促进肿瘤发生在体内通过gene-specific从头甲基化和转录沉默。Dev的基因。21,3110 - 3122。https://doi.org/10.1101/gad.1594007(2007)。
Wittkopp, p . j . &师上校g基因元素:分子机制和演化过程潜在的分歧。Nat,启麝猫。1359 - 69。https://doi.org/10.1038/nrg3095(2011)。
Saxonov, S。,Berg, P. & Brutlag, D. L. A genome-wide analysis of CpG dinucleotides in the human genome distinguishes two distinct classes of promoters.Proc。国家的。学会科学。美国103年,1412 - 1417。https://doi.org/10.1073/pnas.0510310103(2006)。
Boukas, L。,Bjornsson, H. T. & Hansen, K. D. Promoter CpG density predicts downstream gene loss-of-function intolerance.点。j .的嗡嗡声。麝猫。107年,487 - 498。https://doi.org/10.1016/j.ajhg.2020.07.014(2020)。
科斯特洛,j·F。et al。异常的cpg岛甲基化的非随机和tumour-type-specific模式。Nat,麝猫。24,132 - 138。https://doi.org/10.1038/72785(2000)。
张,Y。et al。种能阻碍Dnmt3b异位表达的目标和基因组的约束。Elife71。https://doi.org/10.7554/eLife.40757(2018)。
Baubec, T。et al。基因组DNA甲基转移酶的分析揭示了基因的甲基化的一种能阻碍DNMT3B角色。自然520年,243 - 247。https://doi.org/10.1038/nature14176(2015)。
Dukatz, M。et al。种能阻碍DNMT3B复杂的DNA序列读出机制DNA甲基转移酶。诊断。酸Res。48,11495 - 11509。https://doi.org/10.1093/nar/gkaa938(2020)。
Mallona,我。et al。旁侧序列偏好调节新创老鼠基因组DNA甲基化。诊断。酸Res。49,145 - 157。https://doi.org/10.1093/nar/gkaa1168(2021)。
Jeltsch,。亚当,S。,Dukatz, M。,Emperle, M. & Bashtrykov, P. Deep enzymology studies on DNA methyltransferases reveal novel connections between flanking sequences and enzyme activity.j·摩尔,杂志。433年,167186年。https://doi.org/10.1016/j.jmb.2021.167186(2021)。
粉丝,H。et al。全基因组DNA甲基化的分析揭示了优先序列的DNMTs肝癌细胞。肿瘤。医学杂志。37,877 - 885。https://doi.org/10.1007/s13277 - 015 - 3202 - z(2016)。
高桥,M。et al。种能阻碍Dnmt3b分析DNA甲基化改变引起的小鼠肝细胞。物化学。Biophys。Commun >,434年,873 - 878。https://doi.org/10.1016/j.bbrc.2013.04.041(2013)。
Wienholz, b . L。et al。DNMT3L调节重要和独特的旁侧序列偏好种能阻碍DNMT3B DNMT3A和体内的DNA甲基化。公共科学图书馆麝猫。6,e1001106。https://doi.org/10.1371/journal.pgen.1001106(2010)。
林,C . C。,Chen, Y. P., Yang, W. Z., Shen, J. C. K. & Yuan, H. S. Structural insights into CpG-specific DNA methylation by human DNA methyltransferase 3B.诊断。酸Res。48,3949 - 3961。https://doi.org/10.1093/nar/gkaa111(2020)。
李,h·J。,Hore, T. A. & Reik, W. Reprogramming the methylome: erasing memory and creating diversity.细胞干细胞14,710 - 719。https://doi.org/10.1016/j.stem.2014.05.008(2014)。
Stadler m B。et al。dna结合因素塑造鼠标methylome在远端监管区域。自然480年,490 - 495。https://doi.org/10.1038/nature10716(2011)。
齐勒尔称,m . J。et al。绘制一个动态景观的人类基因组DNA甲基化。自然500年,477 - 481。https://doi.org/10.1038/nature12433(2013)。
胡,S。et al。DNA甲基化呈现截然不同的人类转录因子结合位点。Elife2,e00726。https://doi.org/10.7554/eLife.00726(2013)。
Palakurthy, r·K。et al。RASSF1A基因的表观遗传沉默肿瘤抑制基因通过HOXB3-mediated种能阻碍DNMT3B诱导表达。摩尔。细胞36,219 - 230。https://doi.org/10.1016/j.molcel.2009.10.009(2009)。
刘,W。,Xie, A., Tu, C. & Liu, W. REX-1 represses RASSF1a and activates the MEK/ERK pathway to promote tumorigenesis in prostate cancer.摩尔。癌症Res。19,1666 - 1675。https://doi.org/10.1158/1541 - 7786. - mcr - 20 - 0974(2021)。
Ben Gacem R。et al。临床病理的意义的DNA甲基转移酶1,3,3 b超表达在突尼斯的乳腺癌。嗡嗡声。病理学研究。43,1731 - 1738。https://doi.org/10.1016/j.humpath.2011.12.022(2012)。
Steine, e . J。et al。基因甲基化DNA甲基转移酶3 b在小鼠肠道和人类结肠癌是相似的。j .中国。投资。121年,1748 - 1752。https://doi.org/10.1172/JCI43169(2011)。
滚,j . D。,Rivenbark, A. G., Jones, W. D. & Coleman, W. B. DNMT3b overexpression contributes to a hypermethylator phenotype in human breast cancer cell lines.摩尔。癌症7,15。https://doi.org/10.1186/1476 - 4598 - 7 - 15所示(2008)。
Peralta-Arrieta,我。,Hernandez-Sotelo, D., Castro-Coronel, Y., Leyva-Vazquez, M. A. & Illades-Aguiar, B. DNMT3B modulates the expression of cancer-related genes and downregulates the expression of the gene VAV3 via methylation.点。j .癌症Res。7,77 - 87 (2017)。
Teneng,我。et al。种能阻碍DNMT3b全球识别的目标基因在肺癌表观遗传沉默。致癌基因34,621 - 630。https://doi.org/10.1038/onc.2013.580(2015)。
Yu, J。et al。端粒酶逆转录酶种能阻碍DNMT3B调节表达/异常的DNA甲基化表型和AKT激活肝细胞癌。癌症。434年,33-41。https://doi.org/10.1016/j.canlet.2018.07.013(2018)。
Hervouet E。,Vallette, F. M. & Cartron, P. F. Dnmt3/transcription factor interactions as crucial players in targeted DNA methylation.表观遗传学4,487 - 499。https://doi.org/10.4161/epi.4.7.9883(2009)。
金,j . H。et al。LRpath分析揭示了常见癌症通路通过DNA甲基化特异表达。BMC染色体组。13,526年。https://doi.org/10.1186/1471 - 2164 - 13 - 526(2012)。
李,s M。et al。基因内CpG岛扮演重要角色在二价基因染色质组装的发展。Proc。国家的。学会科学。美国114年,E1885-E1894。https://doi.org/10.1073/pnas.1613300114(2017)。
朱,X。et al。DNMT3B-mediated FAM111B甲基化糖酵解促进乳头状甲状腺肿瘤,生长和转移。Int。生物。科学。18,4372 - 4387。https://doi.org/10.7150/ijbs.72397(2022)。
刘,Y。,张,Y。杜,D。,Gu, X. & Zhou, S. PCDH17 is regulated by methylation of DNMT3B and affects the malignant biological behavior of HCC through EMT.Exp。细胞Res。418年,113245年。https://doi.org/10.1016/j.yexcr.2022.113245(2022)。
杨,J。et al。DNA甲基转移酶3β微调节基因启动子甲基化- 149增加食管鳞状细胞癌发展无名指蛋白2 / Wnt /β-连环蛋白轴。生物工程13,4010 - 4027。https://doi.org/10.1080/21655979.2022.2031411(2022)。
王,J。et al。种能阻碍DNMT3B之间的交互和MYH11通过甲基化调节胃癌进展。BMC癌症21,914年。https://doi.org/10.1186/s12885 - 021 - 08653 - 3(2021)。
林,Z。et al。种能阻碍DNMT3B FOXC1促进肝细胞增殖和转移的移植诱导DNA甲基化的车车启动子。j . Exp。中国。癌症Res。40,50。https://doi.org/10.1186/s13046 - 021 - 01829 - 6(2021)。
徐,K。et al。DNMT3B沉默抑制迁移和入侵epigenetically促进miR-34a膀胱癌。老化(奥尔巴尼纽约)12,23668 - 23683。https://doi.org/10.18632/aging.103820(2020)。
孟,X。et al。DNMT3B表达可能导致RASSF1A基因的异常甲基化啤酒肠癌腺瘤息肉。杂志。Pract >,2020年,1798729。https://doi.org/10.1155/2020/1798729(2020)。
Jeziorska, d . M。et al。DNA甲基化的基因内CpG岛取决于他们的转录活动在分化和疾病。Proc。国家的。学会科学。美国114年,E7526-E7535。https://doi.org/10.1073/pnas.1703087114(2017)。
该隐,j . A。,Montibus, B. & Oakey, R. J. Intragenic CpG islands and their impact on gene regulation.前面。细胞Dev。杂志。10,832348年。https://doi.org/10.3389/fcell.2022.832348(2022)。
崔,w . Y。et al。DNA甲基化的基因内CpG岛需要分化iPSC人大。干细胞启代表。16,1316 - 1327。https://doi.org/10.1007/s12015 - 020 - 10041 - 6(2020)。
宋,S。et al。选择性锚定的DNA甲基转移酶3 a和b核小体包含DNA甲基化。摩尔。细胞杂志。29日,5366 - 5376。https://doi.org/10.1128/MCB.00484-09(2009)。
Kashiwagi, K。宇宙,K。,Ura, K. & Kaneda, Y. DNA methyltransferase 3b preferentially associates with condensed chromatin.诊断。酸Res。39,874 - 888。https://doi.org/10.1093/nar/gkq870(2011)。
Rhee,我。et al。种能阻碍DNMT3b DNMT1和配合沉默基因在人类癌症细胞。自然416年,552 - 556。https://doi.org/10.1038/416552a(2002)。
伊犁,C。et al。景观的全基因组DNA甲基化的结直肠癌转移。癌症(巴塞尔)121。https://doi.org/10.3390/cancers12092710(2020)。
黑泽尔,S。et al。急性淋巴细胞白血病显示一个不同的基因高度甲基化的。Nat。癌症3,768 - 782。https://doi.org/10.1038/s43018 - 022 - 00370 - 5(2022)。
伊林沃思,r s &鸟,a . p . CpG岛——“一个粗略的向导”。2月。583年,1713 - 1720。https://doi.org/10.1016/j.febslet.2009.04.012(2009)。
Heberle,大肠& Bardet a . f .敏感性DNA甲基化的转录因子。学生物化学的论文。63年,727 - 741。https://doi.org/10.1042/EBC20190033(2019)。
Di Croce L。et al。甲基转移酶招聘和DNA甲基化的目标由致癌转录因子启动子。科学295年,1079 - 1082。https://doi.org/10.1126/science.1065173(2002)。
铃木M。et al。位点DNA甲基化的复杂PU.1和Dnmt3a / b。致癌基因25,2477 - 2488。https://doi.org/10.1038/sj.onc.1209272(2006)。
集,V。,Liao, X., Guzman, G., Benevolenskaya, E. & Raychaudhuri, P. Hepatocellular carcinoma evades RB1-induced senescence by activating the FOXM1-FOXO1 axis.致癌基因41,3778 - 3790。https://doi.org/10.1038/s41388 - 022 - 02394 - 8(2022)。
陈,Y Y。et al。ZEB1诱发Ddr1启动子甲基化,导致慢性疼痛在铂治疗后大鼠脊髓。Neurochem。Res。46,2181 - 2191。https://doi.org/10.1007/s11064 - 021 - 03355 - 5(2021)。
克劳福德,n . T。et al。TBX2与异染色质蛋白1招募一个小说镇压复杂EGR1-targeted推动者乳腺癌细胞的增殖。致癌基因38,5971 - 5986。https://doi.org/10.1038/s41388 - 019 - 0853 - z(2019)。
汤普森,J·J。et al。ZBTB24是一种能阻碍DNMT3B转录监管机构协调与控制DNA甲基化。诊断。酸Res。46,10034 - 10051。https://doi.org/10.1093/nar/gky682(2018)。
胡,S。et al。分析人类protein-DNA interactome揭示ERK2的转录阻遏干扰素信号。细胞139年,610 - 622。https://doi.org/10.1016/j.cell.2009.08.037(2009)。
曾,Y。et al。Lin28A结合积极的推动者和新兵Tet1调节基因的表达。摩尔。细胞61年,153 - 160。https://doi.org/10.1016/j.molcel.2015.11.020(2016)。
高,L。et al。种能阻碍DNMT3B综合结构表征和DNMT3A揭示独特的新创DNA甲基化机制。Commun Nat。11,3355年。https://doi.org/10.1038/s41467 - 020 - 17109 - 4(2020)。
Coulondre C。,Miller, J. H., Farabaugh, P. J. & Gilbert, W. Molecular basis of base substitution hotspots in Escherichia coli.自然274年,775 - 780。https://doi.org/10.1038/274775a0(1978)。
韦伯,M。et al。分布,沉默潜在和进化启动子在人类基因组中DNA甲基化的影响。Nat,麝猫。39,457 - 466。https://doi.org/10.1038/ng1990(2007)。
Lienert F。et al。自动识别的遗传元素确定DNA甲基化状态。Nat,麝猫。43,1091 - 1097。https://doi.org/10.1038/ng.946(2011)。
粉丝,H。et al。MTSS1,小说的目标DNA甲基转移酶3 b,在肝细胞癌肿瘤抑制功能。致癌基因31日,2298 - 2308。https://doi.org/10.1038/onc.2011.411(2012)。
Ghoshal, K。et al。种能阻碍DNMT3B HOXB13,目标是甲基化在一个上游CpG岛,作为原发性结直肠肿瘤的肿瘤抑制功能。《公共科学图书馆•综合》5,e10338。https://doi.org/10.1371/journal.pone.0010338(2010)。
斋藤,Y。et al。过度的剪接变体DNA甲基转移酶3 b, DNMT3b4,与DNA hypomethylation pericentromeric卫星地区人类hepatocarcinogenesis期间。Proc。国家的。学会科学。美国99年,10060 - 10065。https://doi.org/10.1073/pnas.152121799(2002)。
比达尔,E。et al。人类癌症的DNA甲基化地图单碱基对决议。致癌基因36,5648 - 5657。https://doi.org/10.1038/onc.2017.176(2017)。
Schulze,我。et al。种能阻碍Dnmt3b DNA甲基化的增加影响白血病生成目标。血127年,1575 - 1586。https://doi.org/10.1182/blood - 2015 - 07 - 655928(2016)。
郑,Y。et al。种能阻碍Dnmt3b丧失加速MLL-AF9白血病进展。白血病30.,2373 - 2384。https://doi.org/10.1038/leu.2016.112(2016)。
Lopusna, K。et al。Dnmt3b催化活性是至关重要的肿瘤抑制功能便与c-Met致癌信号相关联。EBioMedicine63年,103191年。https://doi.org/10.1016/j.ebiom.2020.103191(2021)。
Gui, T。et al。种能阻碍DNMT3B TCF3由EZH2 epigenetically沉默,和功能作为一个肿瘤抑制子宫内膜癌。细胞死亡是不同的。28,3316 - 3328。https://doi.org/10.1038/s41418 - 021 - 00824 - w(2021)。
吴,H。et al。种能阻碍DNMT3B miR-29c-3p调节和LATS1甲基化抑制肝细胞癌肿瘤恶化。细胞死亡说。1048岁。https://doi.org/10.1038/s41419 - 018 - 1281 - 7(2019)。
Camero, S。et al。种能阻碍DNMT3B DNMT3A和目标作为一个有效的机体策略在胚胎性横纹肌肉瘤。细胞101。https://doi.org/10.3390/cells10112956(2021)。
Ruhrberg C。,Hajibagheri, M. A., Parry, D. A. & Watt, F. M. Periplakin, a novel component of cornified envelopes and desmosomes that belongs to the plakin family and forms complexes with envoplakin.j .细胞杂志。139年,1835 - 1849。https://doi.org/10.1083/jcb.139.7.1835(1997)。
Nishimori, T。et al。蛋白质组学分析原发性食管鳞状细胞癌的差别显示对这些细胞粘附蛋白,periplakin。蛋白质组学6,1011 - 1018。https://doi.org/10.1002/pmic.200500262(2006)。
畠山直哉,H。et al。蛋白质与致癌作用相关的集群,在食管癌组织学分化和淋巴结的转移。蛋白质组学6,6300 - 6316。https://doi.org/10.1002/pmic.200600488(2006)。
Otsubo, T。et al。异常的DNA甲基化减少desmosome-related分子的表达periplakin在食管鳞状细胞癌。癌症地中海。4,415 - 425。https://doi.org/10.1002/cam4.369(2015)。
戴维斯,H。et al。BRAF基因突变在人类癌症。自然417年,949 - 954。https://doi.org/10.1038/nature00766(2002)。
方,M。欧,J。,Hutchinson, L. & Green, M. R. The BRAF oncoprotein functions through the transcriptional repressor MAFG to mediate the CpG Island Methylator phenotype.摩尔。细胞55,904 - 915。https://doi.org/10.1016/j.molcel.2014.08.010(2014)。
(T。,Yanai, H., Savitsky, D. & Taniguchi, T. The IRF family transcription factors in immunity and oncogenesis.为基础。启Immunol。26,535 - 584。https://doi.org/10.1146/annurev.immunol.26.021607.090400(2008)。
卡瓦利,l·R。,Riggins, R. B., Wang, A., Clarke, R. & Haddad, B. R. Frequent loss of heterozygosity at the interferon regulatory factor-1 gene locus in breast cancer.乳腺癌治疗》。121年,227 - 231。https://doi.org/10.1007/s10549 - 009 - 0509 - 8(2010)。
损失,洛杉矶。et al。预测epigenetically调节基因在乳腺癌细胞系。BMC Bioinf。11,305年。https://doi.org/10.1186/1471 - 2105 - 11 - 305(2010)。
宗庆后,L。et al。建立DNA甲基化标记评估胃癌癌细胞分数。胃癌19,361 - 369。https://doi.org/10.1007/s10120 - 015 - 0475 - 2(2016)。
迪克逊,G。et al。QSER1保护从从头甲基化DNA甲基化的山谷。科学372年1。https://doi.org/10.1126/science.abd0875(2021)。
史密斯,z D。et al。表观遗传限制胚胎外的血统反映了体细胞转变为癌症。自然549年,543 - 547。https://doi.org/10.1038/nature23891(2017)。
咚,G。,Qiu, F., Liu, C., Wu, H. & Liu, Y. High expression of DNMT3B promotes proliferation and invasion of hepatocellular carcinoma cells via Hippo signaling pathway.保南方亦可达雪雪39,1443 - 1452。https://doi.org/10.12122/j.issn.1673-4254.2019.12.08(2019)。
Amante, s M。et al。转录的基因内CpG岛时空影响宿主基因pre-mRNA处理。诊断。酸Res。48,8349 - 8359。https://doi.org/10.1093/nar/gkaa556(2020)。
Nowialis, P。et al。种能阻碍Dnmt3b催化地活动救助小鼠胚胎发育的配件和压抑的功能。Commun Nat。10,4374年。https://doi.org/10.1038/s41467 - 019 - 12355 - 7(2019)。
确认
发展的调查期间,Loaeza-Loaeza J CONACYT赠款接受者。作者承认的技术援助乔治娜格雷罗州阿根廷慢病毒生产和迁移爱德华多·卡斯塔涅达Saucedo博士提供的化验。
资金
本研究由国家科学技术委员会(批准号242812)。
作者信息
作者和联系
贡献
J.L.L. A.C.C.设计并进行实验。H.R.R.,F.R.T. and D.H.S. conceived and designed the study. Y.C.C., O.d.M., J.L.L., and D.H.S. wrote the manuscript. All authors read and approved the manuscript.
相应的作者
道德声明
相互竞争的利益
作者宣称没有利益冲突。
额外的信息
出版商的注意
施普林格自然保持中立在发表关于司法主权地图和所属机构。
权利和权限
开放获取本文是基于知识共享署名4.0国际许可,允许使用、共享、适应、分布和繁殖在任何媒介或格式,只要你给予适当的信贷原始作者(年代)和来源,提供一个链接到创作共用许可证,并指出如果变化。本文中的图片或其他第三方材料都包含在本文的创作共用许可证,除非另有说明在一个信用额度的材料。如果材料不包括在本文的创作共用许可证和用途是不允许按法定规定或超过允许的使用,您将需要获得直接从版权所有者的许可。查看本许可证的副本,访问http://creativecommons.org/licenses/by/4.0/。
关于这篇文章
引用这篇文章
Loaeza-Loaeza, J。,Cerecedo-Castillo, A.J., Rodríguez-Ruiz, H.A.et al。DNMT3B过度会使基因CpG岛,常见的图案,和种能阻碍DNMT3B与转录因子结合位点。Sci代表1220839 (2022)。https://doi.org/10.1038/s41598 - 022 - 24186 - 6
收到了:
接受:
发表:
DOI:https://doi.org/10.1038/s41598 - 022 - 24186 - 6