摘要
本研究旨在比较乳香酸衍生物对乳腺癌存活率、凋亡和表观基因组谱的影响。根据可行性分析,3-O与3-相比,-乙酰-11-酮-β-乳香酸(AKBA)对MDA-MB-231细胞的毒性更强O-乙酰-β-乳香酸(ABA)。相比之下,ABA对MCF-10A的毒性较小。细胞周期和凋亡检测表明,AKBA对MCF-7和MDA-MB-231细胞的凋亡影响最大。有趣的是,β-乳香酸(BA)和ABA对MCF-10A细胞凋亡无促进作用。Transwell迁移实验表明,AKBA对MDA-MB-231细胞迁移的抑制作用最大(约160%)。的表达式P53,伯灵顿,BCL2在癌细胞系的基因中证实了AKBA和ABA都能诱导最大限度的凋亡。Western-blot研究表明P53在MDA-MB-231细胞中,AKBA引起的蛋白含量为1.96倍,其次是MCF-7细胞中的ABA。的BCL2蛋白表达与先前报道的结果一致。ABA降低了两种癌细胞的整体DNA甲基化。这些结果表明ABA对乳腺癌细胞系具有更强的表观遗传调节作用,而AKBA对乳腺癌细胞系具有更强的细胞毒作用和凋亡作用。
简介
乳腺癌由于其高发病率和潜在的转移,被认为是女性中最致命的癌症之一1.很明显,乳腺癌的开始是由突变基因的增加引起的,这些突变基因改变了它们的功能2.这些有限的细胞功能可以被视为不同的标准,如炎症、细胞周期控制、解毒、凋亡和细胞迁移。事实上,这些突变既可以导致抑癌基因失活,也可以导致原癌基因激活,原癌基因在将细胞转化为恶性状态中起着重要作用2.最近有研究表明,表观遗传(epigenetic)作为Waddington首次提出的术语,在肿瘤发展中起着与遗传同样重要的作用3..基因CpG岛高甲基化诱导的抑癌基因沉默和全基因组DNA低甲基化被认为是DNA甲基化导致的非常重要的分子途径4.
癌症化疗的疗效受到细胞对多种药物耐药性的极大限制,这些药物在结构和机制上都是不相关的5.多药耐药(MDR)主要是由于atp结合盒(ABC)转运体在癌细胞中的过表达导致药物被挤出细胞外5.人工合成的化学增敏剂通过阻断ABC转运体来逆转MDR,但尚未在临床应用6.具有低全身毒性的天然化学增敏剂可以单独应用,也可以作为辅助剂用于提高抗MDR的治疗效果。这将通过提高药物疗效和最小化毒性剂量水平来发挥作用7.最近的研究支持植物化学物质(包括生物碱、多酚和类黄酮)使三阴性乳腺癌细胞系变敏以恢复MDR的能力7,8.
的Boswellia骶骨传统上,树脂被作为一种民间药物用于治疗各种疾病,包括炎症和癌症疾病9.乳香抗炎活性的基本机制主要与五环三萜酸有关,即乳香酸,已被公认为乳香的有效成分10.而乳酸菌酸的化学结构与类固醇相似11,它们通过抑制5-脂氧合酶显示出与非甾体类抗炎药有很大不同的性质12.根据之前的体内外研究,乳香酸衍生物是公认的具有乳香抗癌活性的活性成分13.此外,据报道,它们具有癌症化学预防活性14.
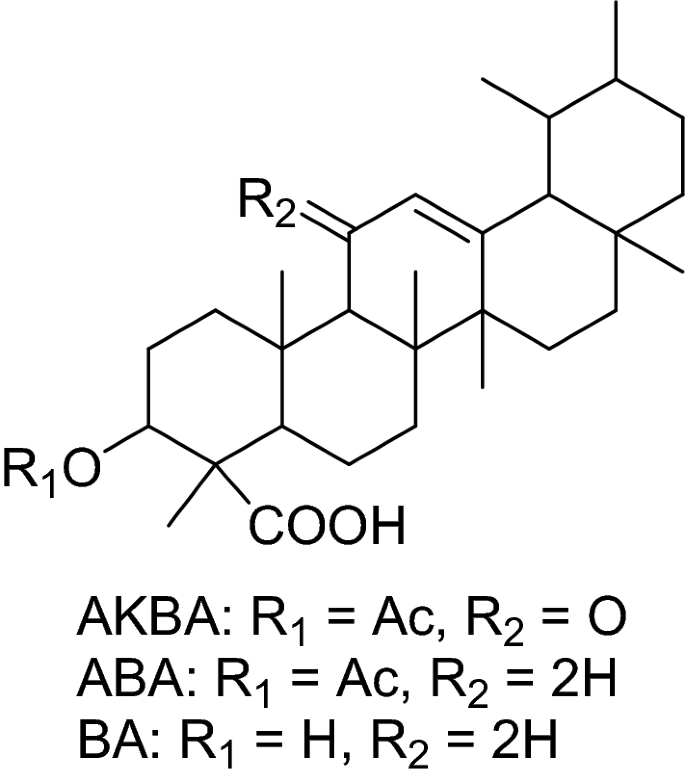
β-乳香酸(BA) 3-O-乙酰-β-乳香酸(ABA)和3-O-乙酰-11-酮-β-乳香酸(AKBA)是乳香酸的主要衍生物15,16.已证实BA可通过caspase-8依赖通路诱导结肠癌细胞凋亡17.与BA和AKBA相比,ABA对胶质母细胞瘤细胞凋亡的影响更大18.此外,ABA的全转录组研究表明,ABA可以通过干扰不同的分子途径诱导细胞凋亡,抑制上皮-间质转化、癌细胞活力、增殖和转移18.与BA和AKBA相比,ABA对胶质母细胞瘤细胞的抗癌作用更大19.据报道,ABA对正常细胞没有毒性,但它会导致黑色素瘤细胞的DNA断裂20..据报道,在乳香酸衍生物中,AKBA具有最强的抗癌特性。AKBA可以降低人类癌症的化疗耐药性,例如,AKBA通过抑制多药耐药蛋白功能来降低紫杉醇耐药人类卵巢癌的恶性程度,同时,通过阻断Akt和Stat3信号通路,在体外和体内抑制多西他赛耐药前列腺癌细胞21,22.我们最近研究了AKBA对人类前列腺和乳腺癌细胞凋亡的影响23.
尽管乳香酸衍生物具有良好的抗癌活性,但其生物利用度较低,特别是AKBA,由于细胞和组织摄取不足而降低了其药理作用。为了提高这些化合物的药效学性能,已经采用了几种方法。标准化餐后给予11-酮-β-乳香酸(KBA)可增强KBA的生物利用度24.乳香酸衍生物的生物利用度可通过与阴离子药物共给药而提高25.通过胶束、乳剂、脂质纳米颗粒、脂质纳米载体、脂质体和合成高分子纳米颗粒等药物给药体系来改善这些化合物的药效学效果26,27,28.Riva等报道,乳香酸与卵磷脂的配方可以促进组织吸收和扩散,从而提高生物利用度29.
根据最近的研究,这些化合物具有很好的抗癌潜力,但它们对非致瘤性非转化乳腺上皮细胞(MCF-10A)和癌性细胞(MCF-7和MDA-MB-231)的机制作用尚不清楚。因此,在本比较研究中,通过毒性、细胞周期、细胞迁移、凋亡、表观遗传、基因和蛋白质研究,评估了这些生物活性化合物(BA、ABA和AKBA)对MCF-10A细胞和乳腺癌细胞的影响。
结果
细胞毒性试验
为了研究BA、ABA和AKBA对MCF-7、MDA-MB-231和MCF-10A细胞的细胞毒性作用,使用MTT法评估了处理和未处理细胞的活力。根据MTT结果(数据未显示),我们选择了对MCF-10A细胞影响最小而对癌细胞增殖抑制作用最大的最佳药物浓度。因此,从测试的浓度中,我们选择65 μM浓度进行下一步。
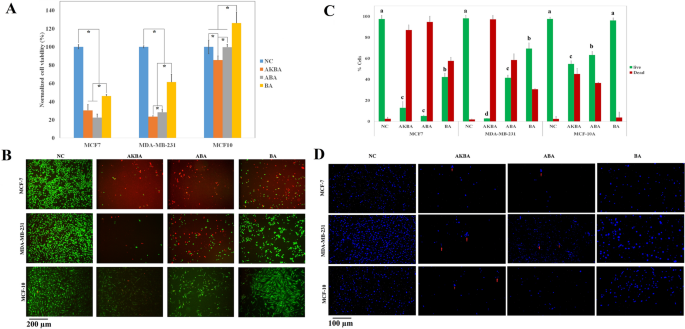
如图所示。1A, BA、ABA或AKBA处理时,两种癌细胞(MCF-7和MDA-MB-231)的正常化活力均显著下降。AKBA和ABA处理后MCF-7细胞活力无显著差异。另一方面,与ABA相比,用AKBA处理的MDA-MB-231细胞的存活率较低。BA对两种癌细胞的抗增殖作用均低于ABA和AKBA。
(一个AKBA、ABA和BA处理24 h后,MTT法测定MCF-7、MDA-MB-231和MCF-10A细胞的正常化活力,并与阴性对照(NC)进行比较。*表示差异有统计学意义(P < 0.05) (N值= 3)。(B) AKBA、ABA和BA处理24 h后MCF-7、MDA-MB-231和MCF-10A的活、死测定结果与阴性对照(NC)比较。绿色和红色分别代表活细胞和死细胞。(C)定量分析AKBA、ABA和BA处理24 h后MCF-7、MDA-MB-231和MCF-10A的活染色和死染色,并与阴性对照(NC)进行比较。a、b、c、d表示活细胞数量显著(P < 0.05) (N值= 3)。D.与阴性对照(NC)相比,AKBA、ABA和BA处理24 h后MCF-7、MDA-MB-231和MCF-10A的DAPI染色。箭头代表凋亡小体。
与MTT结果一致,所有三种化合物(BA, ABA和AKBA)对MCF-7细胞显示出显著的抗癌活性(图7)。1B). ABA和AKBA对MCF-7细胞的抗癌活性最高,分别有87%和95%的死亡细胞;但两者之间的差异无统计学意义(图;1C),虽然大约97%的MDA-MB-231细胞被AKBA治疗根除,但只有58%的MDA-MB-231细胞被ABA治疗根除。虽然ABA和BA对MCF-10A细胞没有明显的毒性,但AKBA导致MCF-10A细胞(MCF-10A)的存活率下降了15%。
与MTT和活、死检测结果并行,DAPI染色(图。1D)显示AKBA和ABA对MCF-7、MDA-MB-231和MCF-10A细胞的增殖有抑制作用。NC组两种癌细胞系染色后细胞核呈圆形,而ABA和akba处理后的癌细胞系细胞核形态改变,出现凋亡小体(红色箭头)。在MCF-10A细胞中,BA-和aba处理的细胞的细胞核显示出比AKBA更少的凋亡形态。
细胞周期试验
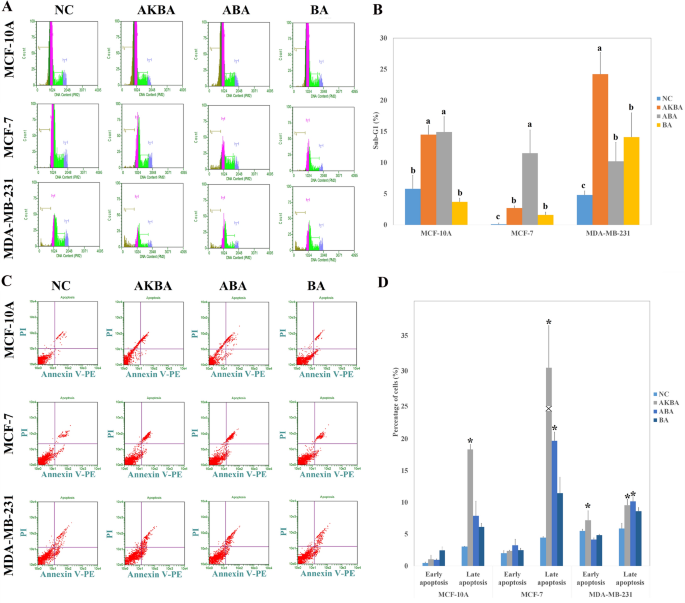
如图所示。2通过细胞周期试验进一步研究了AKBA、ABA和BA对MCF-7、MDA-MB-231和MCF-10A细胞增殖的影响。在MCF-10A细胞中,亚g1期,与阴性对照相比,AKBA和ABA处理后凋亡细胞分别增加3.6倍和4.8倍。另一方面,BA没有发现明显的效果。此外,与阴性对照相比,AKBA处理的MCF-7细胞的亚g1期增加了7.8倍,而ABA和BA对该细胞的影响较小。最后,与阴性对照相比,AKBA处理过的MDA-MB-231细胞的亚g1期增强3.8倍。
(一个) AKBA、ABA和BA处理24 h后MCF-7、MDA-MB-231和MCF-10A细胞的细胞周期测定,与阴性对照(NC)比较。(B)与阴性对照(NC)相比,AKBA、ABA和BA处理24小时后MCF-7、MDA-MB-231和MCF-10A中处于亚g1期的细胞百分比。a、b、c、d表示亚g1期细胞百分比显著(P < 0.05) (N值= 3)。(C) Annexin V-FITC细胞凋亡检测试剂盒检测经AKBA、ABA和BA处理24 h后MCF-7、MDA-MB-231和MCF-10A细胞的凋亡,并与阴性对照(NC)进行比较。(D) AKBA、ABA和BA处理24 h后MCF-7、MDA-MB-231和MCF-10A细胞凋亡百分比与阴性对照(NC)比较。*表示与NC比较有显著性差异(P < 0.05) (N值= 3)。
细胞凋亡检测
采用Annexin-V/碘化丙dium凋亡法,进一步考察BA、ABA、AKBA对MCF-10A和癌细胞系早期和晚期凋亡的影响,如图所示。2C, D。而活性化合物均不能影响MCF-10A细胞的早期凋亡,AKBA可显著诱导MCF-10A细胞的晚期凋亡阶段(较NC组增加约6倍)。AKBA对MCF-10A细胞的凋亡作用与细胞周期实验结果一致。纯化合物对MCF-7细胞早期凋亡期均无显著影响。另一方面,与对照组相比,AKBA和ABA分别使MCF-7细胞的凋亡晚期增强了7倍和4.5倍。在MDA-MB-231细胞系中,AKBA和ABA均显著增加了细胞凋亡晚期阶段(分别是对照组的1.6倍和1.7倍),而只有AKBA显著诱导细胞凋亡早期阶段。
体外迁移试验
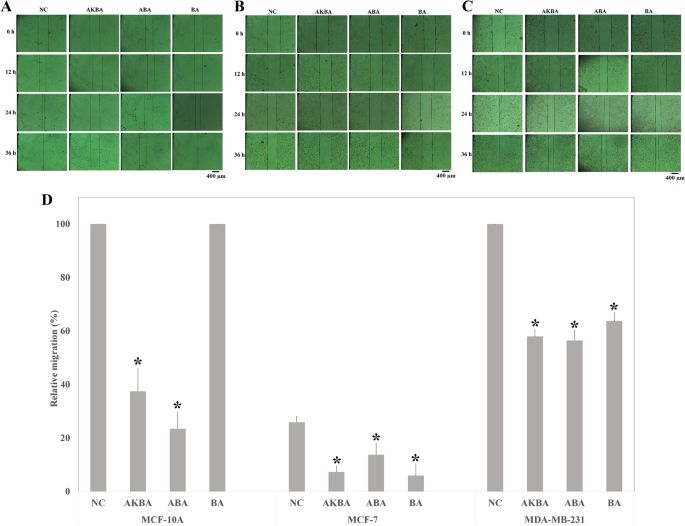
采用2d划痕试验评估纯化合物对MCF-10A和癌细胞系迁移的影响(图2)。3.模拟)。虽然AKBA和ABA显著抑制MCF-10A细胞的迁移,但BA对MCF-10A细胞的迁移没有影响(图2)。3.A)。换句话说,MCF-10A细胞的迁移被AKBA和ABA限制了近66%和84%,随后(图。3.2d划痕迁移实验显示,所有化合物都能显著阻碍癌细胞的迁移过程(p < 0.05),尤其是在癌细胞中(MCF-7和MDA-MB-231)(图。3.B, C)。如图所示。3.D、18.5%、12%和20%的MCF-7细胞迁移被AKBA、ABA和BA抑制。此外,在2D划痕实验中,与对照组相比,AKBA、ABA和BA分别抑制了MDA-MB-231细胞迁移约42%、43.5%和36%。
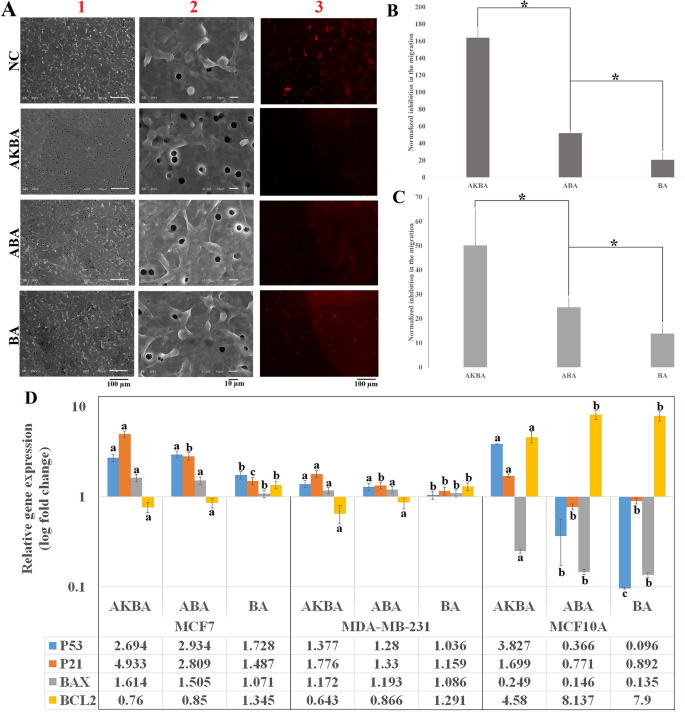
如图所示。4A,与划痕试验平行,transwell迁移试验结果证明AKBA, ABA和BA可以抑制MDA-MB-231细胞的侵袭。井间运移定量分析(图2)4B,C)表明AKBA对MDA-MB-231细胞的迁移有最大的抑制作用。
Transwell迁移试验。(A1, 2)从transwell膜下部迁移的MDA-MB-231细胞的扫描电镜照片。这些照片(200X和1000X)是在AKBA、ABA、BA和阴性对照(NC)处理细胞48小时后拍摄的。(A3)红标记MDA-MB-231细胞迁移到膜下侧的荧光成像。(B) SEM照片定量分析得到MDA-MB-231细胞迁移的归一化抑制。*表示差异有统计学意义(P < 0.05) (N = 3)。(C)与阴性对照相比,归一化迁移抑制,从红标记细胞迁移的定量分析中获得(n = 3)。(D的相对基因表达P53,P21,伯灵顿,BCL2与阴性对照比较,AKBA、ABA和BA处理24 h后MCF-7、MDA-MB-231和MCF-10A细胞的基因。a、b、c、d在各基因中表现出不同的显著水平(N值= 3)。
相对基因表达
如图所示。4维,P53与NC相比,AKBA和ABA处理的MCF-7细胞的基因水平分别过表达2.7倍和2.9倍,但差异无统计学意义。另一方面,P21基因在akba处理的MCF-7细胞中表达上调4.9倍,显著高于aba处理的MCF-7细胞(2.8倍)。的伯灵顿基因在ABA和akba处理的MCF-7细胞中均显著诱导,且诱导水平相似。的相对表达式BCL2与NC相比,ABA-和AKBA-处理的MCF-7细胞的抗凋亡基因显著降低。
同样,在MDA-MB-231细胞中,相对基因表达P53,P21,伯灵顿ABA和AKBA组均显著上调。另一方面,BCL2基因在ABA和akba处理的MDA-MB-231细胞中分别下调0.64倍和0.86倍。结果表明,ABA和AKBA均可通过诱导MCF-7和MDA-MB-231细胞凋亡P53,P21,伯灵顿,BCL2基因水平调控。
的水平P53而且P21仅在AKBA处理的MCF-10A细胞中表达上调,提示AKBA可能对MCF-10A细胞的凋亡有影响。尽管如此,在akba处理的MCF-10A细胞中观察到BAX基因的相对基因表达下降,尽管这种下降明显小于ABA和ba处理的MCF-10A细胞。BCL2而AKBA-的过表达明显低于ABA-和ba处理的MCF-10A细胞。综上所述,ABA相比AKBA具有更强的凋亡活性,因为在上述途径中,ABA不会引起非致瘤性非转化乳腺上皮细胞系的凋亡。
相对蛋白表达
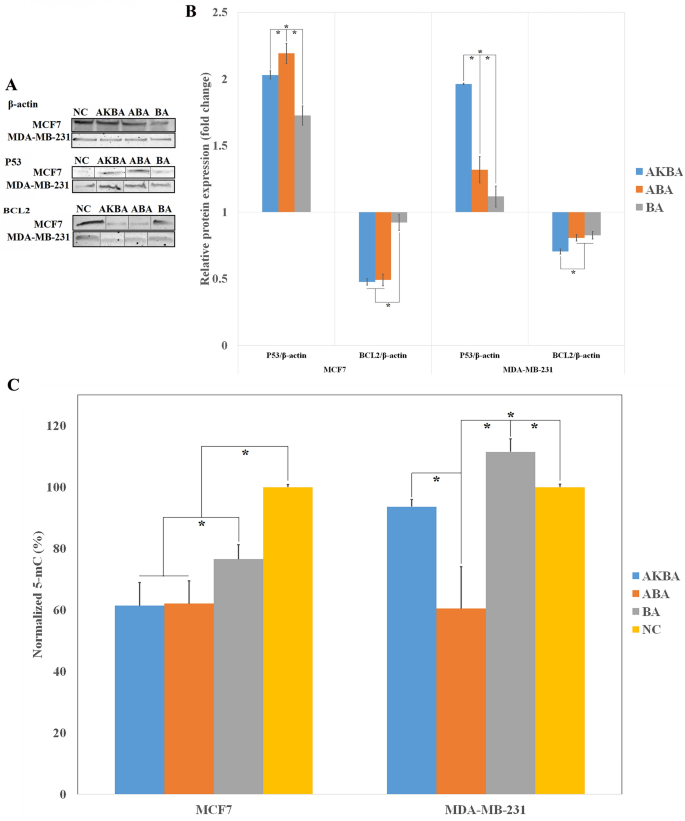
如图所示。5A,B, ABA和akba处理的MCF-7细胞均过表达P53蛋白。在aba处理的MCF-7细胞中P53蛋白的表达达到最大值。此外,ABA和AKBA均能显著抑制BCL2与NC相比,MCF-7细胞中蛋白质含量较高。这与基因表达结果完全一致。对于MDA-MB-231细胞,而P53AKBA组表达上调1.96倍,ABA仅能诱导P53蛋白质。此外,在akba处理的MDA-MB-231细胞中检测到BCL2蛋白的显著下降。
(一个)代表性的western blot图像,显示蛋白的表达P53而且BCL2处理和未处理的MCF-7和MDA-MB-231细胞。虚线表示裁剪后的图像。未裁剪的图像显示在补充图中。S1.(B) western blot定量分析相对蛋白表达量(N值= 3)。*表示差异显著(p值≤0.05)。(C) BA-、ABA-和akba处理的MCF-7和MDA-MB-231细胞的全局DNA甲基化试验与阴性对照组比较。*表示差异显著(p值≤0.05)。
全球DNA甲基化
归一化的5-mC百分比如图所示。5C. BA-、ABA-和akba处理的MCF-7细胞归一化5-mC百分比显著低于NC, ABA和akba处理的MCF-7细胞中5-mC减少最大。另一方面,aba诱导MDA-MB-231细胞的整体DNA甲基化明显低于AKBA。此外,与NC相比,ba处理过的MDA-MB-231细胞的5-mC百分比增加。
讨论
我们的毒性结果与Schmiech等人报道的结果一致,表明AKBA和ABA在体外对MDA-MB-231细胞表现出最高的细胞毒性作用30..此外,BA对MDA-MB-231细胞的抗增殖活性最低,占活细胞的69%。AKBA对MCF-10A细胞的毒性最大,死亡细胞达45%。此外,ABA的毒性明显低于AKBA。Kumar等人已经证明了ABA可以被认为是一种细胞抑制药而不是细胞毒性药物,并且可以应用于化学预防干预方法20..此外,DAPI染色也证实了ABA、AKBA在两种癌细胞系中均能有效抑制增殖、促进凋亡。对于MCF-10A和MDA-MB-231细胞,ABA和AKBA处理的细胞看起来比其他组更小(图。1B,D),这可能是由于细胞在凋亡早期发生收缩和固缩所致31.另一方面,BA处理后的细胞体积较大,其增殖率较高,DNA含量增加,基因组大小与细胞大小有很强的相关性32.
细胞周期测定结果与Kunnumakkara等报道的数据一致,表明AKBA在Sub-G1期积累细胞33.ABA和BA均增加了MDA-MB-231细胞的Sub-G1期,但两者之间无显著差异。Syrovets等人研究表明ABA和AKBA诱导前列腺癌细胞发生亚g0 /G1期34.
AKBA细胞凋亡检测结果证实了Li等人的报道。35.此外,Lu等和Toden等也分别证实了AKBA对卵巢癌和结直肠癌细胞的早期和晚期凋亡诱导作用21,36.结果表明,与ABA相比,AKBA具有更强的凋亡活性,但同时引起早期和晚期的凋亡。
AKBA对细胞迁移的预防作用与以往文献一致21.结果表明,BA是唯一一种对MCF-10A细胞的迁移没有抑制作用的化合物,而它可以阻止癌细胞的迁移。这可能被认为是有益的,因为它可以帮助手术后伤口的愈合率。此外,ba处理的MDA-MB-231细胞的迁移抑制作用明显强于ba处理的细胞。
似乎P53这种途径是AKBA或ABA诱导细胞毒性的主要原因。此外,P53介导的细胞凋亡证明了ABA和AKBA作为乳腺癌潜在治疗药物的抗癌作用。虽然AKBA对MCF-7和MDA-MB-231癌细胞有诱导凋亡作用,但对MCF-10A细胞有毒性作用。与我们的结果一致,Jiang等人报道了AKBA在癌症和非致瘤性非转化乳腺上皮细胞系中诱导凋亡37.Liu等人揭示了P21而且P53在AKBA治疗后的结肠癌细胞中38.我们的数据表明,与BA相比,乙酰化化合物(AKBA和ABA)对癌细胞更有效,这证实了Schmiech等人的发现30..
MDR背后的一些机制已经被确定,如DNA修饰。P53基因突变可能破坏促凋亡平衡,导致MDR39.这种相关性已经在60种细胞系和100多种抗癌药物中得到证实40.因此,根据结果,AKBA和ABA都是有效的天然化学增敏剂,可通过激活P53途径逆转MDR。此外,研究人员提供的证据表明,AKBA可能克服卵巢癌的耐药性21.
P53导致的凋亡通过线粒体途径发生,主要由BCL2蛋白介导,如BAX。BAX和BCL2作为促凋亡和抗凋亡标记物,通过产生异源二聚体激活细胞凋亡的延缓机制41.Bax/BCL2表达水平的比值被认为是细胞凋亡易感性的指标42.AKBA和aba处理的MCF-7细胞中Bax与BCL2的比值分别为2.12±0.15和1.77±0.13,显著高于NC处理。同样,在MDA-MB-231细胞中,AKBA-和ABA-处理的Bax/BCL2比值显著高于NC(分别为1.82±0.06和1.38±0.07)。与ABA组相比,AKBA中Bax/BCL2表达水平的升高比例表明,AKBA组对两种癌细胞都具有更强的凋亡鲁棒性。
结果表明,AKBA和ABA对MCF-7细胞的整体DNA甲基化有影响,而MDA-MB-231细胞的整体DNA甲基化仅受ABA的影响。全球DNA甲基化的改变或变异被认为是癌症表观基因组学的重要标准,因为它们通常与细胞生存、增殖、分化和癌症进展相关43.肿瘤抑制基因的整体低甲基化和启动子高甲基化已在大多数癌症中被检测到44.ABA在两种癌细胞中抑制全局DNA甲基化的功能作用使其成为潜在的表观遗传操作,用于乳腺癌治疗的前瞻性临床手段。
在大多数类型的癌症中发生的一种常见的表观遗传改变是肿瘤抑制基因启动子区域CpG岛的DNA超甲基化。尽管基因组改变,甲基化沉默基因的异常甲基化被认为是可逆的使用治疗药物45.DNA甲基转移酶抑制剂5-aza-2 ' -脱氧胞苷已被广泛应用于通过逆转DNA超甲基化来治疗人类恶性肿瘤45.由于表观遗传改变会发生在癌症的早期阶段,使用去甲基化诱导剂作为癌症预防剂而不是治疗线索的趋势正在上升45,46.因此,ABA可以引起两种类型癌细胞的去甲基化,可以有效地应用于癌症预防,副作用最小。
与Du等人的研究相对应。与AKBA相比,ABA显示出更大的体内生物利用度47.由于AKBA和ABA都具有优异的内在特性,因此AKBA和ABA的组合可能会改善乳香酸衍生物的药效学性能。据我们所知,这是第一个比较乳香酸衍生物的凋亡、毒性、抗转移和表观遗传调节作用的综合研究。在这项研究中,ABA和AKBA揭示了互补的特性,它们的协同作用有望在乳腺癌的预防和治疗中发挥作用。虽然ABA对MCF-10A显示出更多的表观遗传调节和更小的毒性,但AKBA对乳腺癌细胞系表现出更多的细胞毒性、凋亡和抗转移活性。
材料与方法
AKBA、β-ABA、β-BA的提取与分离
的乳酸菌树脂样品(1.4千克)采集自阿曼佐法尔的不同地点。标本(BSHR-01, 2020年4月)保存在阿曼尼兹瓦大学自然和医学科学研究中心(NMSRC)的植物标本室。
的风干粉末树脂b .骶骨(1.4 kg)用甲醇(MeOH, 2.0 L)在室温下(3次)提取,减压蒸发得到黄色半固体残渣(900 g), MeOH粗提物依次分馏为正己烷(472.5 g)、乙酸乙酯(EtOAc, 388.0 g)和水(35.0 g), EtOAc馏分用等液相流动相即10%、20%、30%、40%和50% EtOAc/正己烷进行柱层析(CC),得到18个馏分(BSF)队).服用TLC后,4个亚馏分(BSF4 - 8)结合并进一步在CC上色谱,得到两种化合物的混合物阿坝(220毫克)和英航(160 mg),使用20%和30% AcOEt/正己烷体系作为流动相,以及一些半纯化合物,然后使用CHCl通过制备型高效液相色谱(prep. HPLC)进行纯化3.溶剂。亚分数(BSF10到16)因其TLC形貌相似而结合,并进一步用EtOAc/正己烷以增加极性(30、35、40、45和50%)的CC反应得到化合物AKBA其中含有一些杂质,这些杂质后来通过使用CHCl的高效液相色谱进行纯化3.溶剂。所有这些化合物的结构阐明是通过广泛的光谱技术实现的,包括1D (1H和13C)和2D (NOESY, COSY, HMBC和HSQC)核磁共振和质谱,以及已知化合物的光谱数据与文献报道的比较48,49.
细胞培养
MDA-MB-231和MCF-7细胞系购自美国型培养收藏(ATCC), MCF-10A购自伊朗生物资源中心(IBRC)(德黑兰,伊朗)。mda - mb -231在Dulbecco's改良Eagle's培养基(DMEM)/F12(1:1)中富集100u /ml青霉素和100 μg/ml链霉素,10%胎牛血清(FBS;Gibco)和l -谷氨酰胺(6 mM)。MCF7在含100 U/ml青霉素和100 μg/ml链霉素的微量必需培养基(MEM)中培养,10%胎牛血清(FBS;Gibco)。MCF-10A在含5%马血清、20 ng/mL EGF、10 μg/mL胰岛素、50 μg/mL氢化可可松、100 U/ mL青霉素和100 μg/mL链霉素的DMEM/F12(1:1)培养液中维持。所有细胞在37°C含5% CO的潮湿气氛中孵育2.
细胞增殖试验
每个细胞系在10点播种于96孔板4细胞。一旦粘附,细胞分别用不同剂量的AKBA、ABA、BA和DMSO作为阴性对照。处理24小时后,使用3-(4,5-二甲基噻唑-2-基)-2,5-二苯基溴化四氮唑(MTT)检测试剂盒(Bio-idea,德黑兰,伊朗)评估细胞活力。光学值由BIO-RAD (Hercules, CA, USA)读取器在570 nm波长下读取。
细胞经65 μM AKBA、ABA和BA处理24 h后,根据制造商的协议,使用活和死检测试剂盒(ThermoFisher Scientific, USA)进一步评估细胞的生存能力。使用该方法,通过荧光显微镜(Optika XDS 3FL4,意大利)将活细胞与死亡细胞区分开来,荧光显微镜激发并发射绿色(Calcein AM为ex/em 494/530 nm)荧光,死亡细胞为红色(EthD-1为ex/em 528/645 nm)荧光50.核染色时,用4′,6-二氨基-2-苯基吲哚(DAPI)染料(Sigma-Aldrich,美国)对24 h处理的细胞进行染色,然后用PBS冲洗细胞。最后使用荧光显微镜(Optika XDS 3FL4)对细胞进行评估。
细胞周期试验
细胞在12孔板上2 × 10培养5播种24小时后,用65 μM AKBA、ABA和BA处理24小时。收集细胞,在70%乙醇中4℃固定过夜,然后用番石榴细胞周期试剂(Cat。No.4500-0220)在室温下放置30分钟。使用流式细胞仪进行细胞周期分析(番石榴easyCyte™HT系统,Millipore, Bedford, MA, USA)51.
细胞凋亡检测
65 μM AKBA、ABA和BA处理24 h后,观察细胞凋亡情况。处理过的细胞用胰蛋白酶化培养,在冰冷的PBS中洗涤。随后,将细胞重新悬浮在1x结合缓冲液中,浓度为1.25 × 105细胞。使用eBioscience™Annexin V-FITC凋亡检测试剂盒(赛默飞世尔科学公司)根据制造商的方案研究细胞凋亡。简单地说,用AnnexinV-FITC对细胞进行染色,并在室温黑暗条件下孵育15分钟。然后用碘化丙啶(PI)对细胞进行冲洗和染色,然后使用流式细胞仪(guava easyCyte™HT System)评估细胞凋亡。
体外迁移实验
划痕试验
通过对所有三种细胞系进行相同的划痕区域来确定细胞迁移。细胞在12孔板中培养至80%合流,然后用10µl无菌移液管尖端人工划痕。之后,用PBS清洗细胞两次以去除分离的细胞。用含有65 μM AKBA、ABA或BA的培养基替换培养基24小时。用原培养基更换培养基后,在伤后12、24、36和48小时对划伤区域的迁移进行成像。最后,用ImageJ软件计算经DMSO处理的细胞与阴性对照组细胞的闭合率和迁移抑制。
井间迁移试验
MDA-MB 231细胞以2.7 × 10的频率接种524孔组织培养板中8微米孔跨孔膜上部的细胞。培养24 h后,将培养基改为添加AKBA、ABA或BA(65µm)的无血清DMEM培养基。24小时后,将培养基替换为无血清、无化合物的DMEM培养基。MDA-MB-231细胞使用Cell Tracker Red CMTPX染料(赛默飞世尔科学公司)根据生产商的协议进行标记。利用荧光显微镜(Optika XDS 3FL4)观察MDA-MB-231细胞迁移到细胞插入膜的下侧。使用ImageJ 1.52a软件(NIH, Bethesda, MD, USA)获得迁移细胞的数量。然后固定细胞插入膜,分别用2.5%戊二醛在PBS和增加浓度的乙醇中脱水。细胞迁移到插入物下部的照片是使用电子扫描显微镜(SEM, JEOL Ltd.,东京,日本)拍摄的。50.
RNA分离和实时PCR
MCF-7、MDA-MB-231和MCF-10A细胞在6孔板中处理24小时后,使用RNX- Plus Solution (Sinaclon,伊朗)获得mrna。随后,根据制造商的说明(ThermoFisher Scientific),使用高容量cDNA逆转录试剂盒(High-Capacity cDNA Reverse Transcription Kit)与RNase Inhibitor合成cDNA。表达水平P53,P21,伯灵顿而且BCL2采用Real-time PCR检测,并与阴性对照进行比较。采用SYBR™Green PCR Master Mix (ThermoFisher Scientific)进行PCR扩增,Beta-actin转录本作为内源性对照。将mRNA表达的变化归一化至相关内控,最后利用2——ΔΔCt方法。QuantStudio (ThermoFisher Scientific的应用生物系统)用于定量mRNA转录本表达。qPCR反应所用引物详见表1.
免疫印迹
经AKBA、ABA或BA处理24小时后,MCF-7和MDA-MB-231细胞被胰蛋白酶化,并用RIPA缓冲液和蛋白酶抑制剂(ThermoFisher Scientific)裂解。蛋白浓度由Pierce™Rapid Gold BCA蛋白检测试剂盒(ThermoFisher Scientific)检测。裂解物与Laemmli样品缓冲液合并。Western blot分析P53而且BCL2通过加载50 μg总蛋白,用10%丙烯酰胺凝胶(Bolt bi - tris Plus凝胶)(Invitrogen, USA)在200 V恒定电压下运行。在SDS-PAGE之后,通过Pierce power blotter (ThermoFisher Scientific)以高M.W.预编程方法将凝胶中的蛋白质转移到硝化纤维膜上。随后用TBS/Tween-20溶解的BSA (5% BSA, 0.5% Tween-20 1小时)阻断膜,同时用免疫印迹法P53单克隆抗体(1/1500稀释)和BCL2单克隆抗体(1/50稀释)(ThermoFisher Scientific)以及β肌动蛋白单克隆抗体作为负载对照(ThermoFisher Scientific)过夜。然后,用山羊抗小鼠IgG辣根过氧化物酶偶联二抗(ThermoFisher Scientific, 1/5000稀释)孵育。使用增强化学发光(Abcam,美国)和iBright™1500成像系统(Invitrogen)检测条带52.
全局DNA甲基化检测
MCF-7和MD-MB-231细胞分别用65 μM AKBA、ABA或BA处理24小时,然后使用GeneJET基因组DNA纯化试剂盒(Thermo Fisher Scientific)进行基因组DNA分离。根据制造商的说明,使用MethylFlash全球DNA甲基化量化试剂盒(Epigentek, USA)获得全球DNA甲基化水平。
统计分析
所有实验均重复三次。数据以平均值±标准差表示。结果采用单向方差分析和Tukey事后检验进行分析。对比研究使用Minitab 17软件(Minitab, Pennsylvania, USA)进行。P < 0.05为差异有统计学意义。
道德声明
根据国际和本地指南53,树脂样本被小心地收集,树木被伦理地处理。在收获过程中,当地环境没有受到损害。阿曼苏丹国马斯喀特环境部(6210/10/73,2019年3月19日)批准为科学目的收集生物材料。目前的研究不涉及濒危或受保护物种。该植物由阿曼尼兹瓦大学自然和医学科学研究中心的植物学家穆罕默德·阿尔-布鲁米先生鉴定,凭证标本(BSHR-01, 2020年4月)保存在该中心的植物标本室。
结论
本研究显示,AKBA对癌细胞的体外抗增殖、抗转移和凋亡活性最强。尽管如此,ABA表现出最安全的特性,因为它不会诱导MCF-10A细胞凋亡。此外,ABA可以降低MCF-7和MDA-MB-231细胞的整体DNA甲基化,这有利于癌症的化学预防。由此得出结论,ABA作为一种潜在的表观遗传操作因子和AKBA作为一种凋亡因子的协同作用可能有利于乳腺癌的预防和治疗策略,与传统化疗方法相比,MDR更少,选择性更高。进一步研究ABA和AKBA的协同作用,以获得一种潜在的乳腺癌治疗药物。
数据可用性
支持本研究结果的数据可根据合理要求从通讯作者[Ahmed Al-Harrasi]处获得。
参考文献
Wahba, H. A. & El-Hadaad, H. A.目前治疗三阴性乳腺癌的方法。癌症医学杂志。地中海。12, 106(2015)。
Veeck, J. & Esteller, M.乳腺癌表观遗传学:从DNA甲基化到microRNAs。J.乳腺生物学。瘤形成15, 5-17(2010)。
华丁顿,南卡罗来纳州。胚胎学原理.(出版社,2017)。
李志强,李志强,李志强。DNA甲基化及其基本功能。神经精神药理学38, 23-38(2013)。
布考斯基,K., Kciuk, M. & Kontek .癌症化疗的多药耐药机制。Int。理学。21, 3233(2020)。
Kars, m.d, İşeri, o.d, Gunduz, U. & Molnar, J.在耐药MCF-7细胞系中合成和天然化合物逆转多药耐药。化疗54, 194-200(2008)。
Hamed, a.r., Abdel-Azim, n.s., Shams, K. A. & Hammouda, F. M.天然化学增敏剂靶向癌症多药耐药。公牛。国家的。研究中心43, 1-14(2019)。
Cooray, H. C, Janvilisri, T., van Veen, H. W., Hladky, S. B. & Barrand, m.a .乳腺癌抵抗蛋白与植物多酚的相互作用。物化学。Biophys。Commun >,317, 269-275(2004)。
Lardos, A, Prieto-Garcia, J. & Heinrich, M.树脂和口香糖在塞浦路斯的历史医学文献-植物学和医学药理学方法。前面。杂志。2, 32(2011)。
阿蒙,H.乳酸菌酸在慢性炎症性疾病中的作用。足底地中海。72, 1100-1116(2006)。
Nusier, M. K., Bataineh, H. N., Bataineh, Z. M. & Daradka, H. M.乳香(Boswellia thurifera)对成年雄鼠生殖系统的影响。健康科学。53, 365-370(2007)。
Siemoneit U。et al。乳香酸对5-脂氧合酶的干扰:体外机制研究和药理相关性。欧元。j .杂志。606, 246-254(2009)。
罗伊,北。et al。乳酸菌酸在癌症预防和治疗中的潜在作用。癌症。377, 74-86(2016)。
此人,T。et al。乳香树脂中三萜酸的抗癌化学预防作用及细胞毒活性。医学杂志。制药。公牛。29, 1976-1979(2006)。
侯赛因,H。et al。甘草次酸的治疗潜力:专利审查(2010-2017)。当今专家。其他。帕特。28, 383-398(2018)。
黄m.t。et al。三萜β-乳香酸的抗肿瘤和抗癌活性。BioFactors13, 225-230(2000)。
刘,j j。,Nilsson, A., Oredsson, S., Badmaev, V. & Duan, R.-D. Keto-and acetyl-keto-boswellic acids inhibit proliferation and induce apoptosis in Hep G2 cells via a caspase-8 dependent pathway.Int。J. Mol. Med。10, 501-505(2002)。
Mazzio, E. A., Lewis, C. A. & Soliman, K. F. MDA-MB-231细胞暴露于Serrata乳酸菌和3- o -乙酰- b -乳酸菌酸的转录组分析;ER/UPR介导的程序性细胞死亡。癌症Genomics-Proteomics14, 409-425(2017)。
格拉泽,T。et al。乳酸菌酸与恶性胶质瘤:诱导细胞凋亡但不调节药物敏感性。Br。j .癌症80, 756-765(1999)。
Kumar, D., Kumar, V. & Jalwal, P. boswell酸-潜在肿瘤抑制剂萜类-光化学,提取和分离方法-一项综合综述研究。j . Pharmacogn。Phytochem。5, 231(2016)。
金,L。et al。3-乙酰-11-酮- -乳香酸通过抑制多药耐药(MDR)蛋白功能降低紫杉醇耐药人卵巢癌的恶性程度。生物医学。Pharmacother。116, 108992(2019)。
刘,Y.-Q。et al。乙酰-11-酮-β-乳香酸通过阻断Akt和Stat3信号通路在体外和体内抑制多西他赛耐药前列腺癌细胞,从而抑制耐药干细胞样特性。学报杂志。罪。40, 689-698(2019)。
比尼阿拉巴,A。et al。11-酮-β-乳香酸(KBA)的新衍生物诱导乳腺癌和前列腺癌细胞凋亡。Nat. Prod. Res。1 - 10(2019)。
Skarke C。et al。健康男性志愿者标准化餐后单次口服乳香提取物可增加11-酮-β-乳香酸的生物利用度:评估药物暴露的建模和模拟考虑因素j .中国。杂志。52, 1592-1600(2012)。
克鲁格,P。et al。乳酸菌提取物在Caco-2模型中的渗透及其组分KBA和AKBA与OATP1B3和MRP2的可能相互作用。欧元。j .制药。科学。36, 275-284(2009)。
Husch, J。et al。乳酸菌提取物的卵磷脂传递形式(Phytosome®)增强乳酸菌酸的吸收。Fitoterapia84, 89-98(2013)。
Aqil, F., Munagala, R., Jeyabalan, J. & Vadhanam, M. V.植物化学物质的生物利用度及其通过药物输送系统的增强。癌症。334, 133-141(2013)。
王的年代。et al。纳米技术在提高膳食植物化学物质生物利用度和生物活性中的应用。j .减轻。物化学。25, 363-376(2014)。
莉娃,一个。et al。一项单剂量、随机、交叉、双向、开放标签的研究,用于比较乳香酸及其卵磷脂配方的吸收。植物学期刊23, 1375-1382(2016)。
Schmiech, M。et al。乳香保健品的比较研究:乳香酸和芦油酸含量与细胞因子释放抑制和对三阴性乳腺癌细胞毒性的相关性。营养物质11, 2341(2019)。
杜南,F. & Cotter, T. G.细胞凋亡的形态学评估。方法44, 200-204(2008)。
DNA含量,细胞大小和细胞衰老。学生物化学的发展趋势。科学。44, 645-647(2019)。
Kunnumakkara, A. B., Nair, A. S., Sung, B., Pandey, M. K. & Aggarwal, B. B.乳酸菌酸通过蛋白酪氨酸磷酸酶SHP-1阻断信号转导和转录激活3信号,增殖和多发性骨髓瘤的生存。Mol. Cancer Res。7, 118-128(2009)。
Syrovets, T。et al。乙酰乳糜酸抑制IκB激酶活性促进雄激素不依赖的PC-3前列腺癌细胞在体外和体内凋亡。生物。化学。280, 6170-6180(2005)。
李,W。et al。3- o-乙酰-11-酮-β-乳香酸通过阻滞G2/M期细胞周期在胶质母细胞瘤中发挥抗肿瘤作用。J.临床经验。癌症Res。37, 1-15 (2018)
Toden, S。et al。通过调控结直肠癌中的miR-34a和miR-27a,姜黄素和乳酸菌酸诱导的化学预防的新证据癌症上一页。Res。8, 431-443(2015)。
江,X。et al。乙酰-11-酮-β-乳酸菌酸通过调控降低雌激素受体-α的LINC00707/miR-206抑制癌前病变MCF-10AT细胞。癌症等。Res。12, 2301(2020)。
刘俊杰,黄波,胡世昌。乙酰酮-β-乳香酸通过p21依赖通路抑制结肠癌细胞增殖。Br。j .杂志。148, 1099-1107(2006)。
Hientz, K, Mohr, A, Bhakta-Guha, D. & Efferth, T. p53在癌症耐药和靶向化疗中的作用。Oncotarget8, 8921(2017)。
黄,Y. & Sadée, W.肿瘤细胞化疗耐药和敏感性的膜转运蛋白和通道。癌症。239, 168-182(2006)。
奥斯本,C,威尔逊,P.和Tripathy, D.乳腺癌中的癌基因和肿瘤抑制基因:潜在的诊断和治疗应用。肿瘤学家9, 361-377(2004)。
Vucicevic, K。et al。慢性淋巴细胞白血病Bax表达和Bcl2/Bax比值与临床和分子预后标志物的关系J.医学,生物化学。35, 150(2016)。
德沃,R. S. & Herschkowitz, J. I.超越DNA:表观遗传学在乳腺癌癌前进展中的作用。J.乳腺生物学。瘤形成23, 223-235(2018)。
表观遗传学和癌症:对环境和饮食因素影响的评估。诱变22, 91-103(2007)。
DNA甲基化在癌症管理中的相关性。柳叶刀杂志。4, 351-358(2003)。
Pop, S., Enciu, A. M., Tarcomnicu, I., Gille, E. & Tanase, C.植物化学制剂在癌症预防中的作用:调节DNA甲基化的表观遗传改变。Phytochem。牧师。18, 1005-1024(2019)。
杜,Z。et al。乳香酸作为潜在药物的前景。足底地中海。81, 259-271(2015)。
乌尔·拉赫曼,N。et al。三萜酸作为非竞争性α-葡萄糖苷酶抑制剂的构效关系:体外和硅晶研究。生物分子10, 751(2020)。
拉赫曼,联合国。et al。来自乳酸菌属树脂的新型α-葡萄糖苷酶抑制剂结构-葡萄糖苷酶活性及分子对接研究Bioorg。化学。79, 27-33(2018)。
Vakilian, S。et al。构建微流体血脑屏障模型评价β-乳香酸的抗转移活性。Biotechnol。J。16, 2100044(2021)。
Jamshidi-Adegani F。et al。侧柏次生代谢产物抑制4T1细胞,促进间充质干细胞(MSCs)增殖。摩尔。杂志。代表。47, 5421-5430(2020)。
格米,S。et al。microRNA-342抑制抗凋亡基因BCL2L1和MCL1的表达,诱导胶质母细胞瘤细胞凋亡。生物医学。Pharmacother。121, 109641(2020)。
莱梅尼赫;乳香可持续生产管理指南:推广人员和管理树脂生产和销售干林的公司手册.(CIFOR, 2011)。
确认
作者感谢Saleh Al-Amri先生收集了来自阿曼佐法尔地区的乳香树(B. sacra)的油胶树脂。本研究由研究委员会外部资助号BFP/RGP/HSS/18/ 024,2019和海湾合作委员会共同资助号CL/ squo -GCC/17/03资助。
作者信息
作者及隶属关系
贡献
F.J.-A。:conceptualization, methodology, investigation, funding acquisition, writing-original draft. S.G.: methodology, investigation. S.A.-H.: conceptualization, project administration, writing-original draft, supervision. S.V.: investigation, writing-original draft. J.A.-K.: methodology, investigation. N.U.R.: investigation, writing—review and editing. K.A.: investigation, writing—review and editing, K.A.-R.: investigation, funding acquisition. R.C.: methodology. E.A.: supervision, conceptualization, investigation, writing—review and editing. A.A.-H.: supervision, conceptualization, funding acquisition, writing—review and editing.
相应的作者
道德声明
相互竞争的利益
作者声明没有利益竞争。
额外的信息
出版商的注意
施普林格自然对出版的地图和机构从属关系中的管辖权主张保持中立。
补充信息
权利和权限
开放获取本文遵循知识共享署名4.0国际许可协议,允许以任何媒介或格式使用、分享、改编、分发和复制,只要您对原作者和来源给予适当的署名,提供知识共享许可协议的链接,并注明是否有更改。本文中的图像或其他第三方材料包含在文章的创作共用许可协议中,除非在材料的信用额度中另有说明。如果材料未包含在文章的创作共用许可协议中,并且您的预期使用不被法定法规所允许或超出了允许的使用范围,您将需要直接获得版权所有者的许可。如欲查看本牌照的副本,请浏览http://creativecommons.org/licenses/by/4.0/.
关于本文
引用本文
贾姆希迪-阿德加尼,F.,格米,S., Al-Hashmi, S.。et al。乳香酸衍生物对乳腺癌的细胞毒性、凋亡和表观遗传效应的比较研究。Sci代表12, 19979(2022)。https://doi.org/10.1038/s41598-022-24229-y
收到了:
接受:
发表:
DOI:https://doi.org/10.1038/s41598-022-24229-y