摘要
皮下脂肪组织(SAT)中的脂肪细胞肥大和脂肪因子表达与脂肪变性、非酒精性脂肪性肝炎(NASH)和病态肥胖(BMI≥40 kg/m)中的纤维化有关2)科目。对于肥胖程度较轻(BMI < 35 kg/m)的NAFLD患者是否也是如此,目前尚不清楚2).32例经活检证实为NAFLD的受试者和15例BMI匹配的非糖尿病对照组进行了SAT细针活检。计算脂肪细胞体积。在20例NAFLD患者中进行了SAT rna测序。脂肪细胞体积和基因表达水平与NASH或显著纤维化的存在相关。与对照组相比,NAFLD患者的脂肪细胞体积更大(1939 pL, 95% CI 1130-1662 vs. 854 pL, 95% CI 781-926,p< 0.001)。脂肪细胞体积与NASH之间无相关性。先前描述的脂肪因子基因表达与病态肥胖中的NASH相关,与NASH或纤维化无关。我们的结果表明,与对照组相比,NAFLD患者的SAT脂肪细胞更大,脂肪细胞参与了NAFLD肝脏脂肪变性的病理生理过程。然而,在不同程度肥胖的NAFLD受试者中,脂肪细胞体积与NASH或纤维化无关。
简介
非酒精性脂肪性肝病(NAFLD)的患病率在全球范围内呈上升趋势,目前估计约为25%1.这一发展与肥胖和2型糖尿病(T2D)的增加并行。2.NAFLD和T2D共享胰岛素抵抗(IR)作为共同的病理生理标志3.,4.最近来自美国、欧洲、澳大利亚和新西兰的数据显示,NAFLD是肝移植最快速增长的适应证5,6,7.然而,大多数NAFLD患者不会发展为晚期肝病8.一个主要的挑战是确定少数具有疾病进展风险的NAFLD患者9.虽然肝纤维化的存在是肝病随后发病率和死亡率的最重要的预后因素,但非酒精性脂肪性肝炎(NASH)已被确定为疾病进展的重要预测因子10,11,12.关于为什么一部分患者会发生NASH的潜在致病机制在很大程度上是未知的。一种假设是腹部皮下脂肪组织(SAT)和肝脏之间通过脂肪因子的释放相互作用13.SAT的形态和生理特征都与NAFLD的发展和疾病进展有关14,15.已经证明,脂肪细胞的大小与脂肪变性的水平部分独立于代谢综合征的其他特征16.此外,在对接受减肥手术的病态肥胖患者的研究中,SAT的脂肪细胞肥大与NAFLD、NASH和肝纤维化的较高患病率相关17,18.然而,尚不清楚这种关联是否也适用于身体质量指数(BMI)较低的NAFLD患者。
脂肪组织通过分泌促或抗炎脂肪因子,直接作用于肝脏19,20.,21.先前的研究发现,特定脂肪因子的表达既与NASH的存在相关,也与NAFLD的肝纤维化相关22,23,24,25.尽管有几个很有希望的候选指标,但目前还没有发现一个单独的标志物能够高灵敏度地预测NASH或肝纤维化的存在。最近的研究使用基因阵列技术来识别与NASH和肝纤维化相关的脂肪因子组26,27.这些研究基于正在接受减肥手术的病态肥胖(BMI≥40)患者的选定队列。目前尚不清楚这些脂肪因子表达模式是否可以预测非选择性NAFLD人群中NASH或显著肝纤维化的存在。
本研究的目的是探讨SAT中脂肪细胞体积或脂肪因子表达与活检证实的NAFLD患者的NASH或肝纤维化特征之间的关系。
结果
群体特征
总共包括32例经活检确诊为NAFLD的患者。53%为男性,平均年龄为55.2岁。总共有20名(62.5%)受试者患有NASH, 18名(56%)受试者患有严重或晚期纤维化(F2-4)。15名受试者(47%)有T2D。NASH患者中T2D患病率较高,n = 13(65%),与无NASH患者相比,n = 2 (17%), (p= 0.008)。HOMA-IR (8.2 vs. 4.7,p= 0.008)和BMI (31.8 vs. 27.9 kg/m2,p= 0.019)在NASH组中高于非NASH组。研究队列在SAT活检时的特征见表1.
NAFLD脂肪细胞形态及不同特征
在未调整的分析中,NAFLD受试者的脂肪细胞明显大于BMI匹配的对照组(p< 0.001),调整性别后,BMI和T2D (p< 0.001)(表2a)。在敏感性分析中,从NAFLD组中排除T2D受试者后,差异仍然显著(非糖尿病NAFLD组1855 pL, 95% CI 1559-2151 vs.对照组854 pL, 95% CI 781-926;p< 0.001)。
在简单回归分析中,NASH和非NASH受试者之间的脂肪细胞体积有显著差异的趋势,但在调整BMI、性别和T2D的多元回归中没有这种趋势(表2)2B和Fig。1A).未发生或轻度纤维化的受试者与发生显著或晚期纤维化的受试者相比,未检测到脂肪细胞体积的差异(表2)2C和图。1B).在NAFLD队列中未观察到脂肪细胞体积与HOMA-IR之间的关联。
脂肪因子在SAT中的基因表达及NASH和纤维化的预测
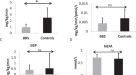
应用先前发表的5个基因签名(CCL2, DMRT2, GADD45B, IL1RN和IL8)26对于我们的队列,我们发现该模型不能准确预测NASH或纤维化阶段(图2)。2).接下来,我们在调整年龄、性别、BMI和T2D的多元逻辑回归分析中分别评估了这五个基因,但没有发现任何一个基因的表达与NASH或纤维化阶段之间的关联(数据未显示)。
小提琴图显示了先前发表的基因表达模型与(一个)纳什vs非纳什,以及(B)肝纤维化期。y轴(预测)显示了基于皮下脂肪组织中五个基因(CCL2, DMRT2, GADD45B, IL1RN和IL8)表达的统计模型的输出计算值。26.
我们还探索了与NASH和纤维化相关的脂肪因子和促炎细胞因子编码基因的SAT基因表达数据:脂联素、瘦素、TNF-α、IL-6和IL-8。然而,这些脂肪因子在rna测序中均未检测到NASH与非NASH或纤维化F0-1和F2-4之间的差异表达基因。
NASH患者的基因表达不同
由于我们发现先前描述的脂肪因子与NASH或纤维化之间没有关联,我们继续对rna测序数据进行探索性研究。共分析了12171个基因,线性回归分析显示86个基因与NASH状态显著相关。我们进一步对这86个基因进行差异表达分析,通过比较它们在NASH受试者和非NASH受试者中的表达,得到31个基因的方差分析p-value < 0.05。经过Benjamini-Hochberg多重假设修正,8个基因达到调整p-value < 0.05。对于rna测序分析中所有deg的更详细描述,请参见图。3.及补充表。
讨论
在这项横断面研究中,我们评估了皮下脂肪组织脂肪细胞肥大是否在NAFLD或与NASH相关的受试者中更为常见。预计在肥胖患者中发现脂肪细胞肥大,从而在患有肥胖相关疾病(如NAFLD)的患者中发现脂肪细胞肥大28.然而,NAFLD发生的肥胖程度在个体之间有显著差异29,30..在本研究中,与健康对照组相比,所有NAFLD受试者均有肥厚性脂肪细胞,独立于BMI和T2D的存在。这一结果与芬兰一项研究的发现部分一致,该研究发现119名非糖尿病受试者的皮下脂肪形态与磁共振波谱测量的肝脏脂肪变性程度相关。他们发现21%的肝脏脂肪含量变化是由脂肪细胞大小单独解释的16.据我们所知,我们的研究是第一个在活检证实为NAFLD的队列中证实这些发现的研究,其中也包括T2D患者。
本研究结果表明,脂肪细胞肥大是NAFLD中存在的SAT的常见形态学标志,对该疾病的病理生理学具有重要意义。先前的研究表明,随着肥胖和IR水平的增加,肥厚脂肪细胞最终会达到临界体积31,32.在这一阶段,脂肪分解导致FFA流向循环的增加,从而导致异位脂肪在肝脏中沉积32,33,34.然而,脂肪细胞达到最大体积的BMI阈值在个体之间是不同的,就像NAFLD可以在不同程度的超重时发生一样。根据我们的结果,我们假设倾向于发生脂肪细胞肥大的个体有发生NAFLD的倾向,这是脂质代谢障碍的一部分。
我们发现SAT中脂肪细胞体积与NASH或显著或晚期纤维化之间没有关联,尽管与NASH相关的脂肪细胞体积有显著差异的趋势。我们的结果与澳大利亚的一项研究一致,该研究对216名接受减肥手术的肥胖受试者进行了研究,他们的平均BMI为46 kg/m2.他们发现SAT中脂肪细胞直径与组织学定义的NASH或纤维化之间没有显著相关性35.然而,在一项类似的研究中,脂肪细胞体积与NASH的存在呈正相关,但仅在女性中18.他们收集了668名接受减肥手术的肥胖患者的组织样本和肝脏活检。该研究的人群由基线BMI为47.5 kg/m的病态肥胖受试者组成2女性比例也很高(78%)。SAT形态与NASH或纤维化之间缺乏关联,这表明肝脏炎症和纤维化背后的机制比单纯的脂肪变性更为复杂。
接下来,我们探讨了特定脂肪因子在SAT中的表达及其与NASH和显著纤维化的关系。首先,我们应用了du Plessis等人首先描述的模型。26.我们无法复制先前发表的评分与NASH或显著纤维化之间的相关性。像其他几项调查脂肪组织和NAFLD之间联系的研究一样,最初的试验评估了接受减肥手术的受试者。中位BMI为40 ~ 42 kg/m2女性的比例约为75%19,27.应该承认,这些研究是精心进行的,并基于大量的材料。此外,他们使用验证队列来加强他们的发现。然而,该研究队列的特征可能不能代表在肝病门诊监测的典型NAFLD人群。在我们看来,对肝脏脂肪变性合并病态肥胖患者的研究结果,如那些接受减肥手术的患者,可能很难在普通的临床实践中实施。目前的结果进一步加强了这一立场。
我们的研究有几个优势。NAFLD、NASH和肝纤维化的结局测量由肝活检证实,肝活检是表征肝脏组织病理学的金标准36.活组织检查采用盲法,并由一位经验丰富的肝脏病理学家进行复查。我们纳入了一组年龄和BMI相匹配的健康对照,以比较NAFLD患者的脂肪细胞形态。我们通过RNA测序对SAT中的基因表达进行了高度准确的测定37,38.
我们的研究有几个不足之处应该得到承认。该研究队列仅包括32名受试者,在20名受试者的子集中进行rna测序。由于这是一个探索性的横断面研究,没有先天的关于基因表达结果的假设,我们无法做统计幂的计算。因此,不能排除亚组间基因表达存在微小差异的II型错误。同样,我们发现的一些与NASH相关的基因也应谨慎解释。测量脂肪细胞体积的方法取决于用户。为了解决这一问题,所有样本都由一名研究者(MH)测量和审查,然后由一名不了解临床结果的独立合作者检查准确性。由于活检的处理和组织病理学切片的固定可能存在差异,绝对细胞体积的测量不能直接与其他组的类似分析进行比较。
结论
我们的研究结果建立了皮下脂肪细胞肥大与NAFLD之间的联系,但与NASH无关。这支持了脂肪细胞肥大是NAFLD病理生理的重要因素的理论。在接受减肥手术的病态肥胖受试者中观察到的SAT基因表达预测模型不能转化为典型的NAFLD患者队列。我们的发现需要进一步研究NAFLD与临床招募的大组患者皮下脂肪组织基因表达之间的相互作用。
材料与方法
研究人群
在2016年5月至2018年4月期间,在卡罗林斯卡大学医院上消化道门诊随访的活检证实为NAFLD的患者被筛查参与研究。排除标准为:(1)女性饮酒量≤140克/周,男性饮酒量≤210克/周,(2)接受胰岛素、胰高血糖素样肽1类似物或格列酮类药物治疗,(3)慢性肝病(非NAFLD除外),(4)怀孕或哺乳,(5)凝血疾病或抗凝血治疗,(6)BMI降低≥1.5 kg/m2从肝活检开始。所有参与者签署了知情同意书,该研究得到了瑞典斯德哥尔摩地区伦理委员会的批准(Dnr 2011/13-31/1)。所有干预措施都是根据卡罗林斯卡大学医院有关临床研究的当地法规和赫尔辛基宣言进行的。在进行SAT活检时,收集了年龄、性别、体重指数(BMI)、是否存在T2D、胰岛素抵抗稳态模型评估(HOMA-IR)和谷丙转氨酶(ALT)的数据。为了比较SAT脂肪细胞的大小,从以前的研究中描述的非糖尿病受试者队列中选择了15名健康对照组39与BMI(在+/−1.0 kg/m内的最接近值)相匹配2)以1:1的比例与15名NAFLD受试者。在最初的研究中,对照组没有进行NAFLD筛查,而是非糖尿病患者(平均fp -胰岛素= 6.0±3.3 mU/l)、非肥胖者和身体成分正常(平均腰臀比= 0.88±0.05,平均体脂= 22±8 kg)。代谢健康个体的这些特征表明他们患NAFLD的可能性非常低。本研究纳入的15个对照组的基线特征见表1.
肝活检和组织学评估
所有参与者之前都在纳入后12个月内通过经皮肝活检作为临床检查的一部分诊断为NAFLD。所有活组织检查都由肝脏病理学家(OD)重新评估,对临床数据不知情。根据Kleiner et al, NAFLD活性评分(NAS)计算为脂肪变性程度(0-3)、小叶炎症程度(0-3)和肝细胞膨大程度(0-2)的未加权和。40.根据脂肪肝抑制进展(FLIP)算法,NASH被诊断为同时存在脂肪、小叶炎症和气球41.根据Kleiner分级评估纤维化分期40.
皮下脂肪组织活检和脂肪细胞测量
参与者在禁食一晚后接受检查。在无菌条件下,使用14g穿刺针和10ml Hepafix®注射器(Braun, Kornberg, Germany)吸入约2g SAT。将SAT置于尼龙滤网(Sefar™,Heiden, Switzerland)上,并用0.9%无菌生理盐水溶液清洗。将约500 mg的SAT快速冷冻在液氮中,并储存在−80°C的冷冻室中,用于后续的rna测序。剩余的SAT用福尔马林固定,并在石蜡中包埋。石蜡包埋的SAT切片厚度为7-10µm,安装在显微镜载玻片上,使用标准方法用苏木精和伊红染色。CellInsight™CX5系统(赛默飞世尔科学公司,沃尔瑟姆,美国)用于生成组织学切片图像。使用ImageJ软件和Watershed脂肪细胞分割插件测量平均脂肪细胞直径。脂肪细胞体积由Goldrick描述的公式计算42.这个公式的基本原理已经在前面描述过了31,43.简而言之,球体的直径是由公式计算出来的\(\pi \times \frac{{d^{3}}}{6}\).组织学切片上脂肪细胞的平均直径(d)为正态分布变量,但其立方体(d3.的算术平均值为d3.因此不能用来计算平均脂肪细胞体积。脂肪细胞的平均体积可以用这个公式更好地近似\(\压裂{\π}{6}\离开({3σ^ \ d{2} \倍^{2}}\右)d \)在哪里σ是直径的方差。
rna测序-脂肪因子在SAT中的测量
使用STAR比对仪将RNA-seq数据的原始读数与人类基因组(hg38)进行比对44.将唯一对齐的reads映射到RefSeq基因注释用于每千碱基转录本的reads和数百万个mapped reads (RPKMs)的基因表达估计rpkmforgenes软件45.当低质量样品未能满足以下保留细胞的标准时,将被排除在下游分析中:(1)≥50,000个序列reads;(2)≥30%的reads与基因组唯一排列;(3)≥40%的unique reads映射到RefSeq标注的外显子上;(4) RPKM≥2的基因≥1000个。根据rna测序的结果,我们首先评估了一个5基因标记的表达,该标记以前已被开发用于预测病态肥胖受试者中NASH和纤维化的患病率26.这5个基因分别是CCL2、DMRT2、GADD45B、IL1RN和IL8。接下来,我们以NASH状态、年龄、性别、BMI、DM2为因素,结合差异表达分析,采用普通最小二乘回归模型探索其他NASH相关基因。
统计数据
由于分布偏倚,脂肪细胞体积呈中位数和四分位范围。连续数据以平均值±标准差表示,分类数据以百分比表示。对于连续参数,使用正态分布数据的t检验计算组间的差异。使用Chi计算分类参数的差异2以及。多组间差异采用Kruskal wallis检验。
为了比较脂肪细胞体积,NAFLD受试者根据是否存在NASH (NASH vs.非NASH)和纤维化阶段(非或低阶段纤维化(F0-1) vs.显著或严重纤维化(F2-4))进行分组。比较脂肪细胞体积的差异Mann-Whitney U-test,由于数据分布偏倚,采用多元回归对年龄、性别、BMI和T2D进行调整。此外,作为敏感性分析,T2D受试者被排除在NAFLD组之外。
我们对基因表达进行了普通最小二乘线性回归分析。与NASH状态相关的基因的显著性水平为p< 0.05进行差异表达分析。最后,采用方差分析(ANOVA)比较NASH受试者和非NASH受试者,并进行Benjamini-Hochberg多重假设校正,经校正后的基因被鉴定为NASH相关基因p-value < 0.05,且至少有一种情况log2-RPKM中位数为1。
数据可用性
支持该试验结果的数据来自瑞典斯德哥尔摩的卡罗林斯卡研究所。原始RNA-seq数据已存入欧洲基因组-表型档案(EGA) (https://ega-archive.org/),现正等待批准。登记编号待定,但在数据公布后可应要求提供。应合理要求,可从通讯作者处获得匿名临床数据。这排除了与知情同意中的保密声明相冲突的数据共享。
参考文献
尤诺西,z。et al。全球非酒精性脂肪肝流行病学患病率、发病率和结局的meta分析评估肝脏病学(巴尔的摩,马里兰州)64, 73 - 84。https://doi.org/10.1002/hep.28431(2016)。
尤诺西,z。et al。2型糖尿病患者NAFLD和NASH的全球流行病学:系统回顾和荟萃分析j .乙醇。71, 793 - 801。https://doi.org/10.1016/j.jhep.2019.06.021(2019)。
Bugianesi E。et al。非糖尿病合并非酒精性脂肪肝患者的胰岛素抵抗:部位和机制Diabetologia48, 634 - 642。https://doi.org/10.1007/s00125-005-1682-x(2005)。
Bjorkstrom, K。et al。2型糖尿病患者的个性化治疗方案与肝脏脂肪变性的减少有关。欧元。j .杂志。乙醇。https://doi.org/10.1097/meg.0000000000001882(2020)。
尤诺西,z。et al。在美国,非酒精性脂肪性肝炎是增加最快的肝移植适应症。中国。杂志。乙醇。掉了。中国。Pract。j。杂志。Assoc。https://doi.org/10.1016/j.cgh.2020.05.064(2020)。
霍尔默,M。et al。在北欧国家,非酒精性脂肪性肝病是越来越多的肝移植指征。肝脏Int。掉了。j . Int。Assoc。研究肝38, 2082 - 2090。https://doi.org/10.1111/liv.13751(2018)。
Calzadilla-Bertot, L。et al。在澳大利亚和新西兰,非酒精性脂肪性肝炎发病率的增加是肝移植的指征。肝移植手术。掉了。出版。点。Assoc。研究肝脏疾病。肝移植手术。Soc。25, 25至34岁。https://doi.org/10.1002/lt.25361(2019)。
Dam-Larsen, S。et al。脂肪肝患者长期临床随访的最终结果。Scand。j .杂志。44, 1236 - 1243。https://doi.org/10.1080/00365520903171284(2009)。
非酒精性脂肪肝治疗临床实践指南j .乙醇。64, 1388 - 1402,https://doi.org/10.1016/j.jhep.2015.11.004(2016)。
Angulo, P。et al。肝纤维化与非酒精性脂肪性肝病患者的长期预后相关,但无其他组织学特征。胃肠病学149, 389 - 397。https://doi.org/10.1053/j.gastro.2015.04.043(2015)。
哈格斯特龙,H。et al。在活检证实的NAFLD中,纤维化阶段而非NASH可以预测死亡率和严重肝病发展的时间。j .乙醇。67, 1265 - 1273。https://doi.org/10.1016/j.jhep.2017.07.027(2017)。
强有力的,V。et al。超重患者的肝纤维化。胃肠病学118, 1117 - 1123。https://doi.org/10.1016/s0016 - 5085 (00) 70364 - 7(2000)。
Polyzos, s.a., Kountouras, J. & Mantzoros, c.s.非酒精性脂肪性肝病中的脂肪因子。新陈代谢65(8), 1062 - 1079。https://doi.org/10.1016/j.metabol.2015.11.006(2016)。
Skurk, T., Alberti-Huber, C., Herder, C. & Hauner, H.脂肪细胞大小与脂肪因子表达和分泌之间的关系。j .中国。性。金属底座。92, 1023 - 1033。https://doi.org/10.1210/jc.2006-1055(2007)。
Mendez-Sanchez, N。et al。非酒精性脂肪性肝炎中脂毒性的新情况。Int。理学。19, 2034(2018)。
Petaja, e。M。et al。脂肪细胞大小与NAFLD相关,与肥胖、脂肪分布和PNPLA3基因型无关。肥胖(马里兰州银泉市)21, 1174 - 1179。https://doi.org/10.1002/oby.20114(2013)。
Tordjman, J。et al。皮下脂肪组织的结构和炎症异质性:病态肥胖与肝脏组织病理学的关系。j .乙醇。56, 1152 - 1158。https://doi.org/10.1016/j.jhep.2011.12.015(2012)。
Bedossa, P。et al。对减肥手术肝活检的系统回顾阐明了严重肥胖患者肝脏疾病的自然史。肠道66, 1688 - 1696。https://doi.org/10.1136/gutjnl-2016-312238(2017)。
德因曹,r.b.et al。减肥手术患者脂肪因子水平与肝脏组织病理学的比较。ob。杂志。27, 2151 - 2158。https://doi.org/10.1007/s11695-017-2627-4(2017)。
埃斯特,j.m.。et al。细胞因子信号基因在非酒精性脂肪性肝炎和肝纤维化的病态肥胖患者中的表达ob。杂志。19, 617 - 624。https://doi.org/10.1007/s11695-009-9814-x(2009)。
Adolph, t.e., Grander, C, Grabherr, F. & Tilg, H.脂肪因子与非酒精性脂肪肝:多重相互作用。Int。理学。18, 1649 (2017)
波利佐斯,美国。et al。循环瘦素在非酒精性脂肪性肝病中的应用:系统综述和荟萃分析。Diabetologia59, 30-43。https://doi.org/10.1007/s00125-015-3769-3(2016)。
Polyzos, s.a., Toulis, k.a., Goulis, d.g, Zavos, C. & Kountouras, J.非酒精性脂肪肝患者血清总脂联素:系统综述和荟萃分析。新陈代谢60(3), 313 - 326。https://doi.org/10.1016/j.metabol.2010.09.003(2011)。
Rotter, V., Nagaev, I. & Smith, U.白细胞介素-6 (IL-6)在3T3-L1脂肪细胞中诱导胰岛素抵抗,并且与IL-8和肿瘤坏死因子一样,在胰岛素抵抗受试者的人类脂肪细胞中过表达。生物。化学。278, 45777 - 45784。https://doi.org/10.1074/jbc.M301977200(2003)。
曹强,麦凯敏,任志刚,李伯。瘦素刺激人肝星状细胞金属蛋白酶-1组织抑制剂:JAK/STAT和JAK介导的h2o2依赖的MAPK通路的各自作用。生物。化学。279, 4292 - 4304。https://doi.org/10.1074/jbc.M308351200(2004)。
杜立石。et al。脂肪组织炎症与非酒精性脂肪性肝病组织学严重程度的关系胃肠病学149, 635 - 648。https://doi.org/10.1053/j.gastro.2015.05.044(2015)。
沃尔夫斯,m.g.et al。确定脂肪因子在多种组织中的表达与肥胖非酒精性脂肪肝疾病表型特征之间的关系。减轻。糖尿病5, e146。https://doi.org/10.1038/nutd.2014.43(2015)。
崔世寿,许俊英,黄一杰,金俊英,金俊英。脂肪组织重塑在能量代谢和代谢紊乱中的作用。前面。性。7, 30岁。https://doi.org/10.3389/fendo.2016.00030(2016)。
卢米斯,a.k.。et al。体重指数与非酒精性脂肪性肝病风险:两项电子健康记录前瞻性研究j .中国。性。金属底座。101, 945 - 952。https://doi.org/10.1210/jc.2015-3444(2016)。
Mantovani, A, Byrne, C. D, Bonora, E. & Targher, G.非酒精性脂肪性肝病与2型糖尿病发病风险:荟萃分析糖尿病护理41, 372 - 382。https://doi.org/10.2337/dc17-1902(2018)。
Eriksson-Hogling D。et al。脂肪组织形态预测中等或显著的体重减轻后胰岛素敏感性的改善。Int。j . ob。2005(39), 893 - 898。https://doi.org/10.1038/ijo.2015.18(2015)。
朗格,M。et al。脂肪细胞增大是胰岛素抵抗和“高瘦素血症”的独立标志。Diabetologia50, 625 - 633。https://doi.org/10.1007/s00125-006-0572-1(2007)。
Jaworski, K, Sarkadi-Nagy, E, Duncan, R. E, Ahmadian, M. & Sul, H. S.甘油三酯代谢的调节。四、激素对脂肪组织中脂肪分解的调节。点。j .杂志。Gastrointest。肝脏杂志。293, G1-G4。https://doi.org/10.1152/ajpgi.00554.2006(2007)。
阿姆斯特朗,m.j.。et al。非酒精性脂肪性肝炎患者腹部皮下脂肪组织胰岛素抵抗和脂肪分解糖尿病ob。金属底座。16, 651 - 660。https://doi.org/10.1111/dom.12272(2014)。
Ooi, G. J。et al。体重指数、代谢健康和脂肪组织炎症对减肥手术患者非酒精性脂肪性肝病严重程度的影响:一项前瞻性研究ob。杂志。29, 99 - 108。https://doi.org/10.1007/s11695-018-3479-2(2019)。
NAFLD的组织学评估。挖。说,科学。61, 1348 - 1355。https://doi.org/10.1007/s10620-016-4062-0(2016)。
歌,C。et al。RNA-Seq分析鉴定了柴达木德牛、牛-牦牛和安格斯牛皮下脂肪组织的差异表达基因。动物9, 1077年。https://doi.org/10.3390/ani9121077(2019)。
Kukurba, K. R. & Montgomery, S. B. RNA测序与分析。冷泉港。Protoc。951 - 969, 2015年。https://doi.org/10.1101/pdb.top084970(2015)。
Ryden, M。et al。脂肪对胰岛素的转录反应是由肥胖决定的,而不是胰岛素敏感性。细胞的代表。16, 2317 - 2326。https://doi.org/10.1016/j.celrep.2016.07.070(2016)。
凯鹏华盈公司。et al。非酒精性脂肪性肝病组织学评分系统的设计与验证。肝脏病学41, 1313 - 1321。https://doi.org/10.1002/hep.20701(2005)。
Bedossa, P. & FLIP病理联盟。脂肪肝进展抑制(FLIP)算法和脂肪变性、活性和纤维化(SAF)评分在评估非酒精性脂肪肝活检中的实用性和适宜性肝脏病学60(2), 565-575(2014)。
脂肪细胞在脂肪沉积和动员过程中的形态变化。点。j .杂志。212, 777 - 782。https://doi.org/10.1152/ajplegacy.1967.212.4.777(1967)。
赫希,J. & Gallian, E.测定人和动物脂肪细胞大小的方法。脂质Res;9, 110-119(1968)。
多布林,一个。et al。STAR:超快通用RNA-seq对准器。生物信息学29, 15至21。https://doi.org/10.1093/bioinformatics/bts635(2013)。
Ramsköld, D.,王,E. T., Burge, C. B. & Sandberg, R.组织转录组序列数据揭示了大量无处不在的表达基因。公共科学图书馆第一版。医学杂志。5, e1000598。https://doi.org/10.1371/journal.pcbi.1000598(2009)。
资金
由卡罗林斯卡学院提供的开放获取资金。该研究由斯德哥尔摩地区(ALF20181157, ALF20200576,和临床研究预约K2017-4579), CIMED(20180889)和瑞典癌症协会(170690)资助。
作者信息
作者及隶属关系
贡献
研究构想与设计:h.h., P.S.数据获取:M.H., h.h., o.d., P.C.。统计分析:M.H., P.C.。数据分析与解释:M.H., P.C., P.S.。
相应的作者
道德声明
相互竞争的利益
作者声明没有利益竞争。
额外的信息
出版商的注意
施普林格自然对出版的地图和机构从属关系中的管辖权主张保持中立。
补充信息
权利和权限
开放获取本文遵循知识共享署名4.0国际许可协议,允许以任何媒介或格式使用、分享、改编、分发和复制,只要您对原作者和来源给予适当的署名,提供知识共享许可协议的链接,并注明是否有更改。本文中的图像或其他第三方材料包含在文章的创作共用许可协议中,除非在材料的信用额度中另有说明。如果材料未包含在文章的创作共用许可协议中,并且您的预期使用不被法定法规所允许或超出了允许的使用范围,您将需要直接获得版权所有者的许可。如欲查看本牌照的副本,请浏览http://creativecommons.org/licenses/by/4.0/.
关于本文
引用本文
霍默,M, Hagström, H.,陈,P.。et al。皮下脂肪细胞肥大与非酒精性脂肪肝之间的关系。Sci代表12, 20519(2022)。https://doi.org/10.1038/s41598-022-24482-1
收到了:
接受:
发表:
DOI:https://doi.org/10.1038/s41598-022-24482-1