摘要
气候变化正在导致新的物种相互作用,并深刻地改变生态系统。在海洋系统中,热带和亚热带物种在高纬度地区正在增加。这与温带海岸线的森林砍伐有关,因为海洋变暖的直接影响加上热带和亚热带鱼类的食草性增加,导致了形成冠层的海带的减少。在这里,我们验证了这样一个假设:与热带类群相比,温带海带和其他冠层海藻的适口性更强,可能促进了这种森林砍伐。我们使用多项选择摄食现场实验和化学分析来测量土佐湾(日本东南部)温带和热带海藻的食性,我们使用单物种摄食实验来测量海带消费量的变化Ecklonia静脉一年到头。我们没有发现证据表明温带海藻对草食性鱼类更美味。在多项选择测试中,消费集中在热带和温带地区海藻物种,是短暂的,在春季/初夏数量达到高峰。海带的消耗Ecklonia静脉在秋天达到顶峰,那时海藻物种缺失。海带食草性最高的季节正好是海带的繁殖季节e .静脉并可能导致日本南部这些海带森林的长期衰退。
简介
气候变化正在改变物种的分布1改变生态组合,因为不是所有的类群都通过改变它们的范围来应对变暖,而且移动的物种以不同的速度移动2.当相互作用的物种不再在空间中共存时,这种生态群落的重组可能导致一些生物相互作用的丧失,也可能导致先前分离的分类群之间产生新的相互作用3..在某些情况下,这些气候对物种相互作用的影响可能超过甚至逆转气候的直接影响4,5.
由气候引起的与物种重新分布相关的生物相互作用的中断已经影响到生态系统和人类的健康,以及我们的经济6.记录在案的影响包括从病虫害影响增加到不可预测的渔业和作物产量6,7.因此,更好地理解气候变化如何改变物种相互作用的机制是理解和预测未来生态系统功能的关键。
物种组合的变化在海洋生态系统中表现得特别快1.物种重新分布正在导致全球海洋群落的“热带化”,因为来自热带的物种在高纬度地区变得越来越丰富8.在海洋中,植物与食草动物的相互作用尤为重要9并受到气候变化和热带化的严重影响10,11.在世界各地,范围不断扩大的热带和亚热带食草动物正在过度放牧冠层海藻,并清除它们的新兵,导致制度转向以低生物量草皮藻类或海胆贫瘠为主的系统8,10,12.特别是近年来,热带和暖温带草食性鱼类的范围扩大与世界各地(包括日本)海藻林的砍伐有关13,地中海东部12以及澳大利亚的东西海岸线10,11.
热带和温带系统之间海藻-草食动物相互作用的功能差异可能促进了范围移动的草食鱼类对温带珊瑚礁的毁林8,14.特别是,热带地区的草食鱼类在分类和功能上比温带珊瑚礁更加多样化15.热带的另一个特点是草食鱼的比例比温带系统高16.这些模式与海藻适口性的差异有关,有一些证据表明,热带海藻可能不那么美味,但在化学上比温带类群防御得更好17.此外,对于食草动物来说,氮是一种非常重要的营养物质,温带植物和大型植物的氮含量通常高于热带物种18并因此可能进一步刺激消费。这些模式使科学家们推测,热带草食性鱼类向高纬度珊瑚礁的活动范围扩大可能是由于温带珊瑚礁中存在更多富氮且防御能力较弱的海藻14,19.
然而,大多数专注于识别特定营养性状的机制适口性试验都集中在无脊椎动物身上14,17在移动性和产生消化褐藻所需的纤维素酶的能力方面,它们在功能上与鱼类不同20..在热带草食性鱼类的范围不断扩大的背景下,更好地了解棕色海藻的适口性如何在物种之间变化,以及影响鱼类食草性的因素特别重要,因为这些海藻包括温带珊瑚礁中最重要的栖息地形成者(例如,层流纲和Fucales),而鱼类是以最快的速度向极地转移分布的分类群21.
在这里,我们通过实验验证了这样一个假设:温带棕色海藻优先被热带海岸线上的鱼类吃掉,因为它们比热带棕色海藻更有营养,化学防御更少。在日本东南部的野外测量了同时出现的温带和热带海藻的适口性。该地区是海洋变暖导致环境变化的全球热点地区,热带鱼目前在该地区占主导地位22.自20世纪90年代末以来,这些珊瑚礁中的温带海藻林一直在减少23,24,而珊瑚的覆盖面积和多样性则大幅增加25,26.此外,从温带迅速转变海藻物种(例如,美国micracanthum而且美国yamamotoi)转热带海藻物种(例如,美国ilicifolium而且美国carpophyllum)自20世纪80年代末以来一直在发生23.尽管水温上升对海藻生理的直接影响被认为是该地区海藻植被长期变化的重要因素(海藻床下降和藻类种类变化)。23,27但是,目前还不清楚这些变化是如何与鱼类食草性增加等间接影响有关的。Serisawa等人。27据报道,土沙湾的海带叶片和叶片受到了鱼类的破坏。此外,自20世纪90年代末以来,日本几个地区也报道了草食性鱼类对形成冠层的海藻(Laminariales和Fucales)种群的破坏28,29,30.,31,32.由于类似的沿海环境变化和草食性鱼类数量/活动的增加也发生在世界其他温带地区11,33,评估草食性鱼类是否以及如何优先食用温带海藻,有助于理解促进海带减少和热带海藻种类范围扩大的潜在机制。
为了评估草食性鱼类是否选择性地捕食温带海藻,以及海藻的生理和营养价值是否与这种摄食偏好有关,我们结合了多项选择摄食实验和同时发生的温带和热带树冠形成棕色海藻的化学分析。这包括研究区域的主要海带,Ecklonia静脉这是一个多年生物种,全年生物量高,主要分布在温带和热带地区海藻物种,在冬季和初夏有相对较短的高植被覆盖期34.饲养实验在夏季进行,随后用海带进行测定Ecklonia静脉(该地区唯一全年存在的树冠物种)每月进行一次,以表征全年海带消费量的变化35.
我们提出的具体问题是:(i)热带地区的草食性鱼类的丰度和生物量是否高于海带地区?(ii)温带褐藻是否会被草食性鱼类优先食用?(iii)鱼类的摄食偏好是否受海藻营养或化学防御特性的影响?(iv)占主导地位的多年生海带的消耗量如何Ecklonia静脉改变暂时吗?。
材料与方法
研究地点和物种
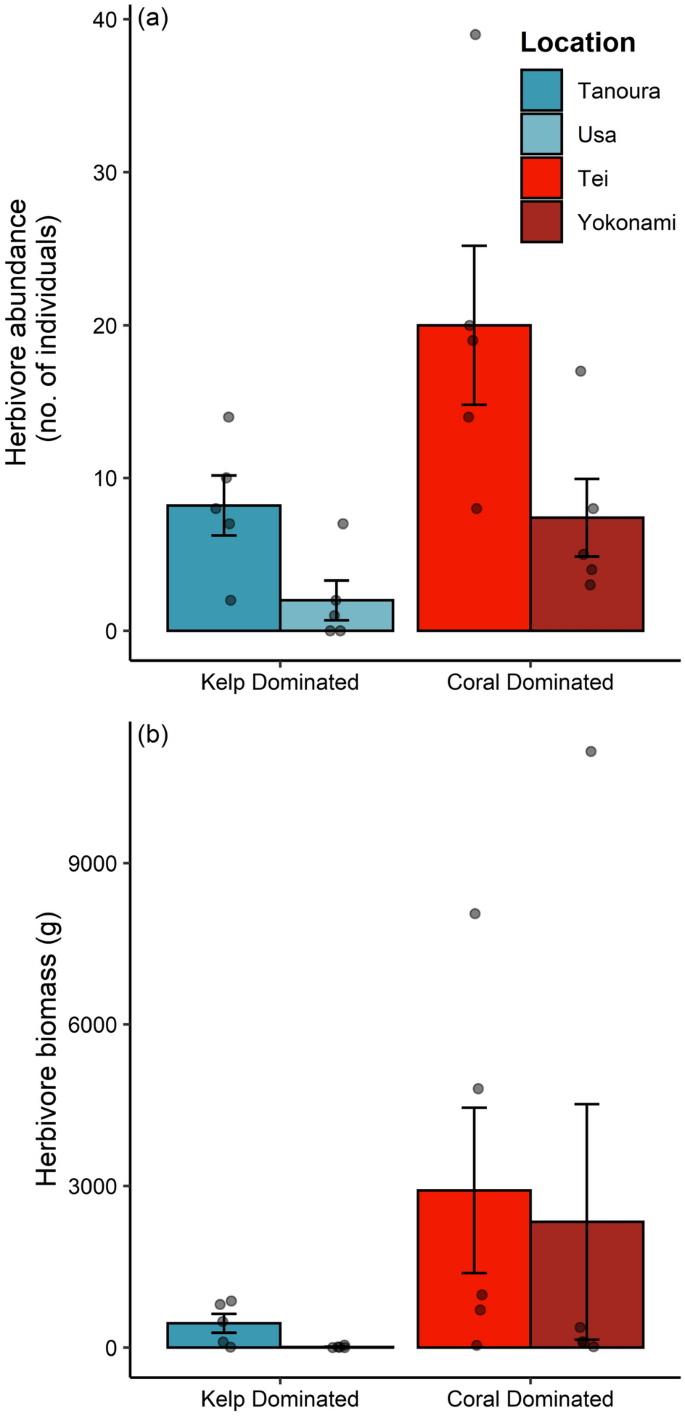
该研究在日本东南部高知县的土佐湾(33°N, 133°E)进行。在两个以珊瑚为主的地点(Tei和Yokonami)和两个附近以海带为主的地点(Usa和Tanoura;无花果。S1).Usa和Tanoura是该地区仅存的海带森林。Tei和Yokonami被称为热带地区。在Tei有广泛的海带床(180公顷)23但自21世纪初海带消失以来,珊瑚迅速生长8.在Yokonami,海藻床直到20世纪80年代才出现,但现在珊瑚已经发展起来了22.只在珊瑚为主的Tei和Yokonami进行了原位饲养实验,草食性鱼类生物量较高(见结果)。2014年夏季(7月)进行了调查,这是所有生物量的峰值海藻物种34.海藻物种是短暂的,从仲夏开始消失34.2014年10月进行了另一项生物测定实验,以测量多年生海带物种的消耗率Ecklonia静脉在没有海藻物种。随后是如下所述的每月生物测定部署。土佐湾中部的水温季节性变化,介于15-16°C(2月)和28-29°C(8月)之间22,34.
在我们的饲养实验中,我们使用了6种形成冠层的褐藻,其中3种分布在热带(海藻ilicifolium,美国carpophyllum,美国alternato-pinnatum)和温带分布的三个(Ecklonia静脉,s . micracanthum而且美国金属盘).所有种类都是土佐湾丰富的冠状藻类23.深度分布在1 ~ 10 m之间。海藻的适口性在区域和纬度尺度上因种群而异17可能是因为海水营养条件会影响适口性36.这项研究的目的是比较大型藻类物种之间的适口性差异,因此所有海藻都是从同一地点采集的(横海半岛的太平洋一侧,土佐湾中部)。虽然附生植物被认为是浏览鹦嘴鱼的重要食物资源37在本研究中,我们没有去除附生植物,因为(1)我们的目标不仅是鹦嘴鱼,而且是所有的草食性鱼类,(2)我们的目的是阐明在自然条件下,草食性鱼类对每个大型藻类物种的选择性。在实验中,我们避免使用附生负荷高的大型藻类。实验海藻在实验的前一天或前一天采集。后者被保存在一个大的、自由流动的海水罐中(美国海洋生物研究所,Kochi大学),直到实验当天,然后在适当的冷却条件下使用带气的盖桶运输到实验地点。
所有方法均按照新南威尔士大学动物研究伦理程序进行。在这种情况下,不需要动物伦理许可,因为鱼是在自然环境中拍摄的,没有直接的互动或操纵鱼。
草食鱼类和底栖生物群落特征
2014年7月,在上午9点至下午3点之间随机部署n = 5条横断面,并间隔至少10米,对每个珊瑚礁的草食性鱼类和底栖生物群落组成进行了量化。同一位专家(Yohei Nakamura)使用水下目视调查(25米长,5米宽)对草食性鱼类进行了调查,确定了所有鱼类的种类。每条鱼的总长度估计为最接近的厘米(游鱼)和0.5厘米(常驻鱼)。个体鱼的长度估计值使用异速长-重转换W =转换为生物量一个* TLb,其中W =重量(克),TL =总长度,参数a和b为从Fishbase (www.fishbase.se).不同生境类型(珊瑚和海带;固定因素)和地点(珊瑚:Tei, Yokonami;海带:Usa和Tanoura;固定因素嵌套在栖息地-这些被认为是固定的,因为海带站点代表了该地区唯一的海带主导站点)使用负二项广义线性模型。使用负二项分布,因为它提供了最好的数据拟合。用线性模型比较了相同协变量间的草食鱼类每样带总生物量(对数转换)。使用R包mvabund中的manyglm和manylm函数运行模型38使用方差分析函数从似然比检验中得到统计推论,对丰度模型采用蒙特卡罗重采样,对生物量模型采用残差重采样,迭代次数为1000次。模型假设(这里和以后的所有mvabund模型)按照Wang等人的方法进行了检查。40使用均值-方差对拟合图(manyglm, manylm)和均值-方差关系图(manylm)。在不满足均值-方差假设的地方进行了转换。
底栖生物群落的特征是由一名潜水员在进行鱼类计数时至少5米后游泳,每米(每样带25个)拍摄一个光样方(50 cm × 50 cm)。使用CPCe (National Coral Reef Institute, v4.1)在每张图像上随机叠加三个点,并确定每个点下的分类单元或基底,每个样带给出75点。每个点被分为以下八类:海带、其他大型藻类(海藻以及大型藻类)、桌珊瑚、其他活珊瑚(除了桌珊瑚外都是活珊瑚)、草皮和钙质藻类、死珊瑚(所有死珊瑚)、岩礁和裸露(裸露的岩石和沙子)。对不同生境类型(珊瑚、海带;固定因素)和地点(珊瑚:Tei, Yokonami;海带:美国,Tanoura;采用多元线性模型和r中的manylm函数进行统计推断,采用方差分析的似然比检验和1000次重复的残差重采样进行统计推断。
摄食偏好实验
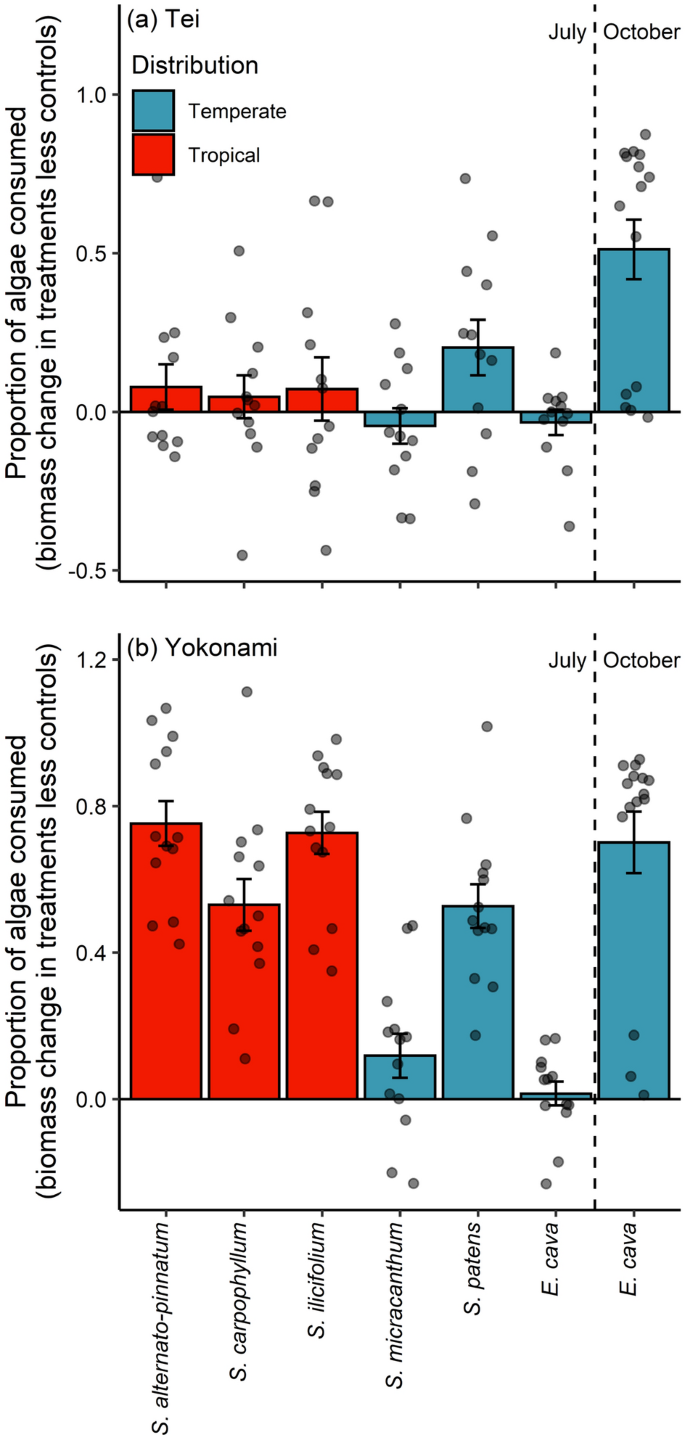
我们在浅礁栖息地(1-3米)进行了摄食实验,在由一层薄层附生藻基质(EAM)覆盖的斑块中进行。38在珊瑚为主的地区(Tei和Yokonami)。在每次重复试验中,我们以15厘米的间隔将6只海藻个体绑在一根1米长的绳子上,绳子两端都被压住。然而,我们的目标是在每个重复试验中保持物种之间的初始生物量值尽可能相似Ecklonia静脉总是比其他物种都重海藻micracanthum总是轻。六种海藻附着的顺序是随意的,在重复之间有所不同。每个重复试验都包括一个配对对照试验,用一个3毫米网箱(120 × 30 × 30厘米)保护草食动物不受影响,以控制任何不是由草食引起的生物量变化(例如,处理损失和水运动引起的藻类脱离)。在每个地点和时间,我们在2-3天内部署了8至15次重复试验:2014年7月在Tei部署了9次,10月部署了15次,7月在Yokonami部署了7次,10月部署了15次。为了最大限度地提高重复之间的独立性,我们将每个重复分析分离至少5米,并每天将它们放置在不同的位置。2014年10月,进行了另一组喂养试验,仅使用Ecklonia静脉,因为这是当年那个时候仅存的物种。实验期间7月水温约26℃,10月水温约24℃。
我们在上午10点到下午5点之间间隔3小时进行分析,因为野生草食性鱼类通常是白天活动的39.我们拍干大型藻类以去除多余的水分,并在部署前后测量鲜重至最接近0.1克。对于每个物种,我们计算生物量损失的方法是,用笼养对照的生物量损失比例(初始g -最终g/初始g)减去笼养处理的生物量损失比例;40.
检测部署后立即开始录像。我们每天拍摄2-4小时(平均±SE = 202±0.7 min)的布置喂食实验,以量化个体鱼的海藻消耗模式。对每一次复制拍摄的视频片段进行分析。我们统计了被拴在绳子上的实验海藻或实验周围的EAM上的单个鱼咬的总次数。一条鱼连续快速咬人而没有明显停顿的突袭被保守地归类为单次咬人,因为不可能准确地测量咬人的数量。
利用manylm线性模型对热带/温带起源的海藻(固定因子)和藻类物种(固定因子嵌套在热带/温带起源)之间以及不同地点之间(固定因子)的生物量损失进行了对比。统计推论进行似然比检验使用残差重采样1000次迭代。
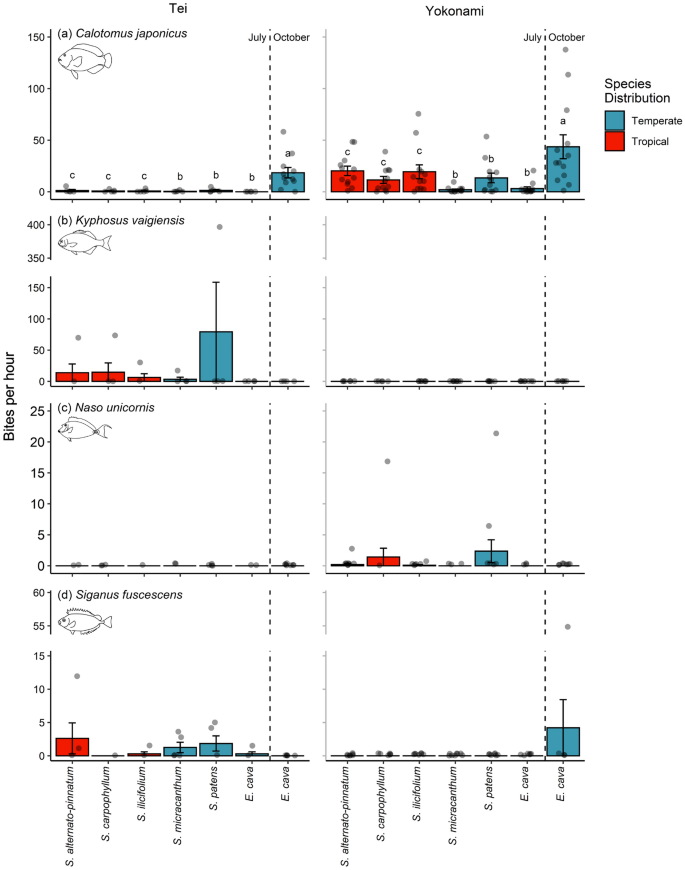
观察到的四种最常见的草食鱼类被咬的次数(Calotomus对虾,Kyphosus vaigiensis,Naso unicornis而且Siganus子鱼),并利用负二项广义线性模型对热带/温带藻类起源之间、藻类物种之间和不同地点之间进行了对比。利用方差分析函数,采用蒙特卡罗1000次重采样的似然比检验进行统计推断。
海带消耗的时间模式
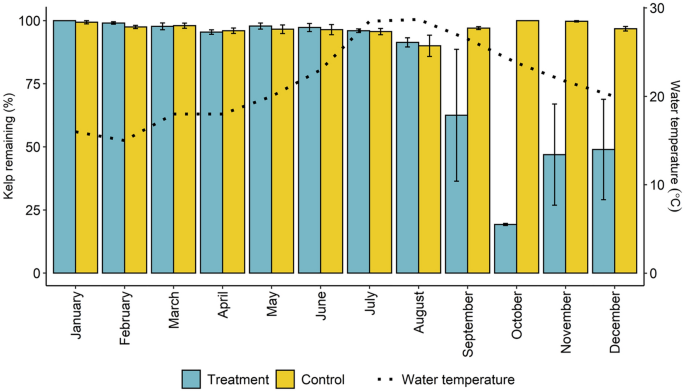
海带的消耗Ecklonia静脉在2014年10月作为单物种检测时,似乎高于7月,当e .静脉与其他种类的海藻一起提供(图;2).为了定量确定海带消费量是否在全年中变化,2018年在横海每月进行额外的喂养实验。六个e .静脉除10月份外,每个月(平均±SE = 50.6±2.6 g)分别用2 mm网眼、20 × 20 × 20 cm的草食动物排除笼(处理组和对照组各n = 2)放置海带个体(平均±SE = 50.6±2.6 g)。实验中使用的海带状态良好(没有枯萎),所有月份都很少有附生植物。从9月到12月,在美国采集实验海带,在海带叶片上观察到繁殖孢子。每个重复试验随机放置至少相隔20米。在三个处理海带中分别放置了一个水下摄像机,实验开始两小时后,海带和摄像机被回收。海带去除的百分比是根据部署前后海带的湿重来计算的。比较两种治疗的结果(治疗vs对照组;固定因素)和抽样月份(1 - 12月;采用自然对数变换数据进行双因素方差分析。模型诊断(残差图和Durbin-Watson检验)使用DHARMa包运行41.未检测到时间自相关。
海藻营养特性
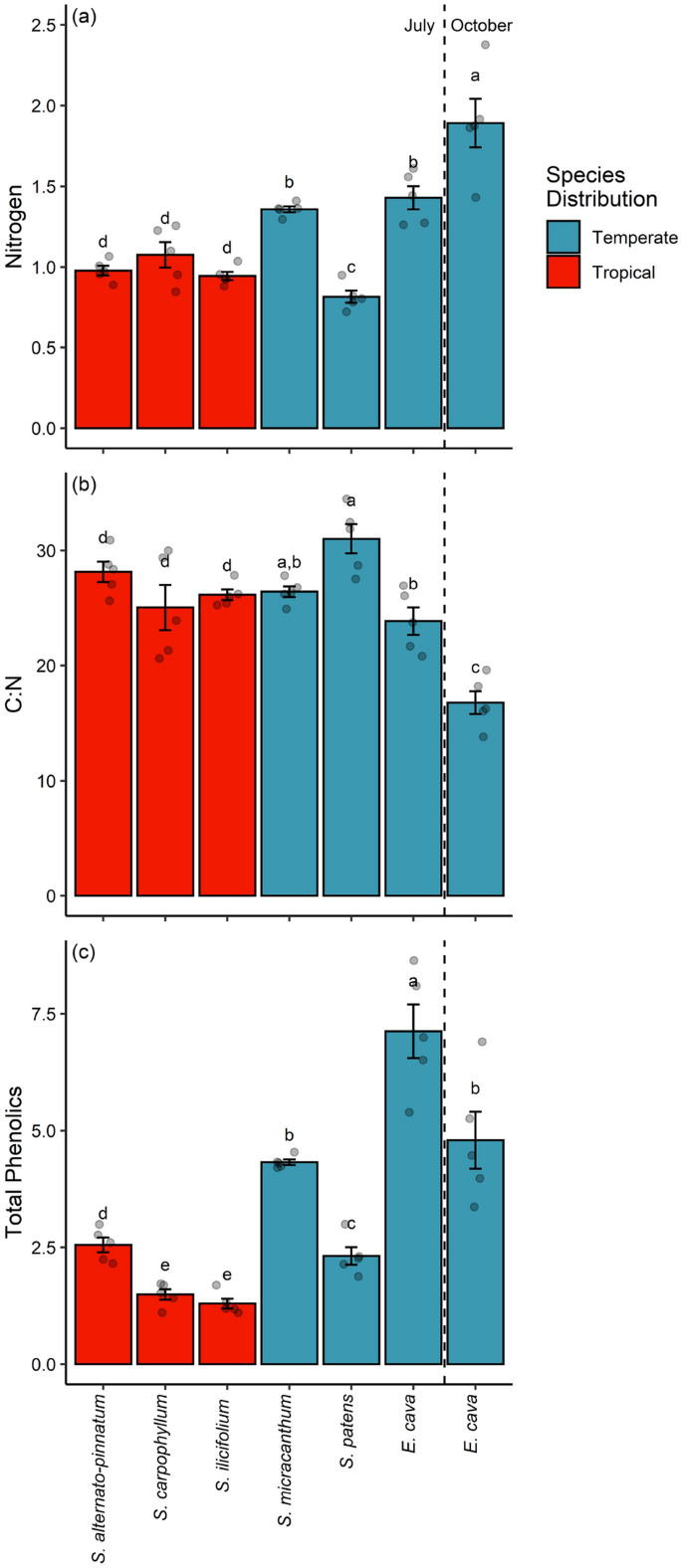
比较了6种海藻的营养性状(碳、氮和酚类物质)。每个品种的个体菌体(n = 5)冻干研磨。碳和氮含量分析使用CHN元素分析仪(TruSpec®微系列,密歇根)在新南威尔士大学悉尼分校的马克温赖特分析中心。以没食子酸为标准,采用Folin-Ciocalteu法比色分析酚含量。用甲醇-水(1毫升)从海藻中提取酚(4-4.5毫克);1:1)。样品使用Tissuelyser (Qiagen, WestSussex, UK)在室温下30 Hz震动5分钟,并在4℃下孵育24小时,然后使用福林- ciocalteu试剂和20%碳酸钠溶液进行比色分析。用荧光平板阅读器(SynergyTM, Vermont)在765 nm处读取吸光度。总酚以没食子酸当量(GAE %干重)表示。
采用manylm线性模型对热带和温带海藻(固定因子)和藻类(固定因子嵌套于热带和温带)的总氮含量、C:N比和总酚(对数变换)进行了比较。我们使用似然比测试和残差重采样进行10,000次迭代,以进行统计推断。
为测试所测得的任何营养特性(氮、碳氮比及酚类物质)是否与优势鱼类对海藻的食用有关(Calotomus对虾),用lm函数在r中进行多元回归c .对虾以每种海藻的平均氮、C:N比和酚类物质为预测变量。
结果
草食鱼类和底栖生物群落特征
珊瑚和海带主导生境的食草鱼类总丰度存在差异(df = 1,偏差= 5.41,P(df = 4,偏差= 11.16,P= 0.005;无花果。1a).珊瑚为主生境的草食鱼类总生物量高于海带生境(F1, 18= 6.505,P= 0.015;无花果。1b)不同地点的差异(F6、16= 1.163,P= 0.001026),这是由于美国食草动物的生物量非常低(图;1b)。
在海带栖息地,Prionurus骨刮而且Girella punctata在草食鱼类群落中占主导地位(分别占两个海带区草食鱼类总数的47%和40%)。然而,它们的体型大多较小(分别为5 ~ 15 cm和5 ~ 10 cm)。在热带珊瑚为主的栖息地,p .骨刮在数量上占草食鱼类群落的主导地位(占两个珊瑚地点草食鱼类总数的71%)。在珊瑚为主的生境中,草食鱼类群落的特点是有大量的大型个体p .骨刮而且c .对虾(分别为15-30厘米和20-40厘米),以及热带热带鱼(Acanthurus nigrofuscus,答:鱼,答:lineatus,Naso unicornis)及热带鹦嘴鱼(Scarus ghobban).
在海带和珊瑚为主的生境中,底栖生物群落的整体组成不同(F1, 18= 7266.00,P= 0.002)和位置之间(F6、16= 46.00,P= 0.002)。温带地区(Tanoura和Usa)以海带为主,Ecklonia静脉,在Usa有最高的覆盖率,而在Tei和Yokonami完全没有。S2).热带地区(Tei和Yokonami)以活桌珊瑚为主,在Yokonami更常见,而在Tanoura和Usa完全没有。S2).
草食鱼类的摄食偏好
我们观察到五种食草鱼类在喂食试验中共咬了7689口:Calotomus对虾,Kyphosus vaigiensis,Naso unicornis,Siganus fuscescen年代和Prionurus骨刮.然而,p .骨刮仅在四个视频中观察到咬人,随后被排除在分析之外。我们观察了海龟Caretta Caretta试图吸食Ecklonia静脉吃过一次,但它没能好好咬一口。在Tei的三个重复摄像机部署中没有观察到喂食;这一数据被排除在分析之外,因为它没有提供有关相对摄食偏好的信息。在实验期间,共有9只笼子里的对照组(7月份在Tei有3只,Yokonami有6只)被干扰,让食草动物食用藻类。给予这些对照的值是该位置未受干扰对照的平均初始生物量和最终生物量。7月份最终样本量为Tei n = 14, Yokonami n = 13;10月,Tei n = 15, Yokonami n = 15。
与Tei相比,Yokonami的生物量损失更高1178年= 48.10,P= 0.002;无花果。2)而温带海藻(F1177年= 4.49,P= 0.034)。海藻生物量损失在不同种类的海藻中存在差异(F6171年= 15.98,P< 0.001),但这在不同位置之间不一致(海藻种类和位置相互作用;F6166年= 6.01,P< 0.001;无花果。2).
被咬的次数c .对虾不受藻类来自热带还是温带的影响(df = 1,偏差= 1.70,P= 0.193;无花果。3.然而,a)。Calotomus对虾观察到四种藻类更经常在Yokonami取食(位置和藻类物种相互作用;Df = 6,偏差= 14.28,P= 0.031;无花果。3.a)海带e .静脉在10月份被蚊子叮咬的次数最多c .对虾在两个位置(图;3.a).咬一口k . vaigiensis不受热带或温带海藻来源的影响(df = 1,偏差= 0.02,P= 0.885;无花果。3.b)。k . vaigiensis观察到Tei的摄食频率更高(df = 1,偏差= 14.40,P< 0.001;无花果。3.B),主要是由于大量的咬海藻金属盘在其中一个视频中(地点和物种之间的相互作用;Df = 7,偏差= 0.001,P= 0.015;无花果。3.b).叮咬n unicornis也不受海藻产地(热带或温带)的影响(df = 1,偏差= 0.0001,P= 0.998;无花果。3.c)在Yokonami的频率略高(df = 1,偏差= 4.00,P= 0.051;无花果。3.c)。美国子鱼同样以热带/温带海藻为食(df = 1,偏差= 1.89,P= 0.171;无花果。3.d),并且在Tei喂食的次数更多,除了10月份被咬的次数更多e .静脉在横海(地点和物种相互作用;Df = 6,偏差= 12.14,P= 0.002;无花果。3.d)。
海带消耗的时间模式
在我们的实验中,我们发现在整个年度周期中,海带的食草性发生了明显的变化,在暴露于草食动物的处理中,海带生物量在部署后的剩余比例明显低于对照,但仅在9月至12月之间(处理和月份相互作用;F11日,46,P< 0.001;无花果。4).海带的食草性在10月份最为强烈。4).视频分析显示,所有的喂食都是由Calotomus对虾.在不以海带为食的月份(1月至7月),一些c .对虾他们也在视频中被捕捉到,但他们没有被观察到以海带生物测定为食。
海藻营养特性
热带藻类和温带藻类的氮含量不同(F1,33= 10.63,P= 0.003;无花果。5A),热带藻类通常表现出较低水平的氮。不同藻类的氮含量也有差异(F6日,28日= 18.02,P< 0.001;无花果。5a).不同种类海藻的C:N比值存在差异(F6日,28日= 13.66,P< 0.001),无论该物种是否具有热带或温带分布(F1,33= 1.42,P= 0.236;无花果。5b).总酚类物质在藻种间存在差异(F6日,28日= 23.36,P< 0.001),并且温带种中高于热带种(F1,33= 41.76,P< 0.001;无花果。5c)。
我们发现被咬的次数之间存在显著的负相关c .对虾增加氮含量(r2= 0.099, f98= 10.924,P= 0.001;无花果。S3a),与C:N比(r2= 0.029, f98= 1.040,P= 0.310;无花果。S3B)和酚醛(r2= 0.079, f98= 0.05,P= 0.831;无花果。S3c)。
讨论
在这项研究中,我们没有发现证据表明温带棕色海藻比最初假设的热带物种更适合草食性鱼类。虽然氮含量在温带物种中略高,但观察到的草食性鱼类中没有一种对温带物种表现出偏好,总的来说,热带物种的生物量以更高的速度下降。海带消费量下降Ecklonia静脉当这个物种与热带和温带一起提供时,它的价格低吗海藻所有草食性鱼类通常都喜欢这种鱼类。然而,海带的消费量在每年的周期中都有所不同,夏末和秋季是最高的海藻物种由于自然衰老而消失。高消费率e .静脉秋天正好是这种海带的繁殖季节42,并可能导致土沙湾这种海带的长期历史下降23.
食用海带的主要是鹦嘴鱼Calomotus对虾它是日本南部最常见的特有草食鱼之一。在日本其他地方变暖的珊瑚礁中,这种鹦嘴鱼也被认为是其他海带物种的主要消费者43.由于海带的最高消耗量在秋季与繁殖季节相吻合e .静脉,这是可能的c .对虾可能是针对植物的生殖组织。草食性唇虫Odax幼鸟也以褐藻上的生殖容器为目标44.不过,虽然消费率很高Ecklonia静脉秋季是氮素含量最高的季节,氮素积累与水源地的形成有关45,46,我们发现氮含量总体上呈负相关c .对虾在我们的多项选择实验中的消费率。
另一种可能的解释是观察到的变化Ecklonia静脉消费c .对虾可能与海带表面相关的表观生物有关。最近,Clements等人。37假设浏览鹦嘴鱼的目标是富含蛋白质的附生植物和大型植物上的微生物(如蓝藻)。一些研究表明,海带表面微生物群随季节和海洋温度的变化而变化47,因此有可能c .日语的我们会对这些变化做出反应。广泛的偏好由多种草食性鱼类朝向海藻也可能和外生生物有关。事实上,一些研究表明,热带地区以马尾藻为食的草食性鱼类可能针对的是生活在海藻上的附生植物,而不是海藻本身48,49.的海藻在摄食实验中使用的物种在小尺度上比海带具有更复杂的结构(即更多数量的小侧菌体)Ecklonia静脉它的结构更扁平、更层流。结构的复杂性更大海藻物种可能会创造出更适合真菌和微生物积累的微环境,这可能导致更大的消耗Sargasssum食草鱼。
总体而言,热带类群的海藻生物量损失略高。热带物种也显示出较低水平的酚类化合物,这被认为是一些食草动物的威慑50虽然不是所有物种都受到影响51.在这项研究中,没有一种草食鱼个体表现出对缺乏酚的热带类群的偏好。此处未测量的其他营养和结构成分也可能影响摄食偏好,因为脂类和广泛的次级代谢产物和结构材料等特征先前已与食草动物的摄食模式联系在一起52,53,54.
褐色冠状海藻的主要食用者是四种草食性鱼类。这一发现与对珊瑚礁的多项研究一致,在珊瑚礁中,少数物种推动了海藻的消费模式,如海藻在印度-太平洋55,56.此外,其中三个物种被确定为这里的主要消费者,鼓手Kyphosus vaigiensis也就是医生鱼Naso unicornis还有兔子鱼Siganus子鱼它们是最常被观察到以珊瑚礁中的棕色海藻为食的物种之一55,56.美国子鱼,而且程度较轻k . vaigiensis它们也被认为是澳大利亚热带地区温带海带的主要消费者,那里的海带正在减少,而热带和亚热带食草动物的数量正在增加11,57,58.进一步,两个同属Siganus种形态上与美国子鱼在地中海过度放牧形成海藻的主要消费者是谁12,从而证实了少数类群在推动气候介导的相移中的重要性。
沿海环境的热带化可以在同一区域内发生在时空上的异质性13.在一些地方,变化可能很快发生,而在另一些地方,变化可能较慢。如果草食鱼类是热带化的部分原因,那么在海带剩余区域的草食动物预计会比热带化区域的草食动物要少。我们的研究支持了这一假设。海带残留的地区(Usa和Tanoura)全年的水温比其他地区低约1摄氏度,可能是因为每个地区附近都有河流,这可能为海带的生存提供了合适的条件,减缓了海洋变暖下草食鱼类种群的入侵率和生长。热带珊瑚礁中草食动物的较高生物量是由大量的大型食草动物驱动的,例如Calotomus对虾还有像外科鱼这样的大型食草动物Prionurus骨刮.虽然p .骨刮一般没有观察到大量食用海藻,但观察到它们会咬咬周围的草皮和附生藻类,其中可能含有海藻的新兵海藻和海藻。因此,该物种可能通过防止种植海藻重新建立,从而在珊瑚占主导地位的国家发挥保护珊瑚礁的作用10,11.其他掠食动物也可能扮演类似的生态角色,例如热带刺尾鱼(Acanthurus科)及鹦嘴鱼(Scarus ghobban),在珊瑚为主的地区大量出现。除了本土温带草食鱼类之外,热带草食鱼类的增加被认为增加了草食功能的多样性,促进了海藻床的衰退和阻止了海藻床的恢复,如西澳大利亚所见59.由于土佐湾海带床的消失与夏季的高水温压力有关23,我们的结果表明,在海带繁殖和招募季节的高食草性加剧了这种下降。
总之,我们的研究结果表明,从温带到热带的转变海藻在土佐湾观察到的海藻种类可能与鱼类食草性的变化无关,而可能是由海洋变暖对海藻的直接生理影响引起的。相比之下,在历史上急剧下降Ecklonia静脉在土沙湾观察到海带林23很可能不仅仅是由于对海带的直接生理影响27,但也可能至少部分是由于成年海带在一年中其他海藻不丰富和海带本身繁殖时的高摄食压力所致。这些信息有助于我们理解变暖生态系统中营养相互作用的变化,并可以为沿海保护措施提供信息,例如为应对海洋变暖导致的海藻床下降而进行的海藻恢复工作。
数据可用性
数据和代码将通过Zenodo(出版后)提供。本研究数据的直接请求可以向Adriana Vergés (a.verges@unsw.edu.au)提出。
参考文献
Lenoir J。et al。海洋中的物种比陆地上的物种更能追踪气候变暖。Nat,生态。另一个星球。4(8), 1044-1059(2020)。
霍布斯,R. J.,瓦伦丁,L. E.,斯坦迪什,R. J. &杰克逊,S. T.搬运工和滞留者:变化环境中的新组合。生态发展趋势。另一个星球。33, 116-128(2017)。
吉尔曼,S. E.,厄本,M. C.,图克斯伯里,J.,吉尔克里斯特,G. W.和霍尔特,R. D.气候变化下社区互动的框架。生态发展趋势。另一个星球。25, 325-331(2010)。
Ockendon, N。et al。支持气候对自然种群影响的机制:改变的物种相互作用比直接影响更重要。水珠。改变医学杂志。20., 2221-2229(2014)。
Gómez-Aparicio, L., García-Valdés, R., Ruíz-Benito, P. & Zavala, m.a.《伊比利亚森林气候、规模和竞争对树木生长的相对重要性:全球变化对森林管理的影响》。水珠。改变医学杂志。17, 2400-2414(2011)。
Pecl, G. T。et al。气候变化下生物多样性的再分配:对生态系统和人类福祉的影响。科学https://doi.org/10.1126/science.aai9214(2017)。
谢弗斯,b.r.。et al。气候变化的广泛足迹,从基因到生物群落再到人类。科学354, aaf7671。https://doi.org/10.1126/science.aaf7671(2016)。
路边,。et al。温带海洋生态系统的热带化:气候介导的草食和群落相移的变化。Proc. R. Soc。B-Biol。科学。281, 20140846。https://doi.org/10.1098/rspb.2014.0846(2014)。
普尔,a.g.b.。et al。海洋食草动物对底栖生物初级生产者影响的全球模式。生态。列托人。15, 912 - 922。https://doi.org/10.1111/j.1461-0248.2012.01804.x(2012)。
Bennett, S., Wernberg, T., Harvey, E. S., Santana-Garcon, J. & Saunders, B. J.热带食草动物对气候介导的温带珊瑚礁相位变化提供恢复力。生态。列托人。18, 714-723(2015)。
路边,。et al。海洋变暖导致鱼类群落热带化、食草性增加和海带损失的长期经验证据。Proc。国家的。学会科学。113(48), 13791-13796(2016)。
路边,。et al。热带兔子鱼和暖温带海洋的森林砍伐。j .生态。102, 1518 - 1527。https://doi.org/10.1111/1365-2745.12324(2014)。
Kumagai,新罕布什尔州et al。气候变暖下洋流和草食驱动大藻类向珊瑚群落的转变。Proc。国家的。学会科学。115, 8990-8995(2018)。
德姆科et al。从极地到热带纬度地区,植物适口性的下降取决于食草动物和植物的特性。生态98, 2312 - 2321。https://doi.org/10.1002/ecy.1918(2017)。
弗洛特,S. R.,贝伦斯,M. D.,费雷拉,C. E. L.,帕达克,M. J.和霍恩,M. H.海洋草食性鱼类的地理梯度:模式和过程。3月杂志147, 1435-1447(2005)。
朗戈,G. O.,海,M. E.,费雷拉,C. E. L. &弗洛特,S. R.西大西洋横跨61度纬度的营养相互作用。水珠。生态。Biogeogr。28, 107 - 117。https://doi.org/10.1111/geb.12806(2019)。
Bolser, R. & Hay, M.热带植物能更好地保护吗?温带和热带海藻的适口性和防御。生态77, 2269-2286(1996)。
钻孔者,e.t.。et al。自养生物化学的全球生物地理学:日晒是一个驱动力吗?Oikos122, 1121 - 1130。https://doi.org/10.1111/j.1600-0706.2013.00465.x(2013)。
米兰达,T。et al。迁徙中的囚犯鱼:沿纬度梯度生长和营养生态位空间的变化。ICES, 3月科学。https://doi.org/10.1093/icesjms/fsz098%JICESJournalofMarineScience(2019)。
在无脊椎动物中纤维素酶(内do-β- 1,4 -葡聚糖酶)和半纤维素酶(β- 1,3 -葡聚糖酶和内do-β- 1,4 -甘露聚糖酶)的结构和功能,这些无脊椎动物消耗从微生物、藻类到落叶。学生物化学Comp。。杂志。学生物化学B。摩尔。杂志。240, 110354(2020)。
波洛赞斯卡,e.s.et al。气候变化对海洋生物的全球影响。Nat,爬。改变3., 919 - 925。https://doi.org/10.1038/nclimate1958(2013)。
Nakamura, Y., Feary, D. A., Kanda, M. & Yamaoka, K.热带鱼在日本西部的温带礁鱼群落中占主导地位。《公共科学图书馆•综合》8, e81107(2013)。
Tanaka, K., Taino, S., Haraguchi, H., Prendergast, G. & Hiraoka, M.日本西南部变暖与潮下冠状形成海藻的分布转移有关。生态。另一个星球。2, 2854 - 2865。https://doi.org/10.1002/ece3.391(2012)。
Pessarrodona,。et al。温带海洋森林生境结构的均质化与小型化。水珠。改变医学杂志。27, 5262-5275(2021)。
山野,H., Sugihara, K. &野村,K.热带珊瑚礁珊瑚在海平面温度上升的响应下向极地快速扩展。地球物理学。卷。38, L04601。https://doi.org/10.1029/2010gl046474(2011)。
日本高纬度高知县沿海海区雌雄珊瑚群落的变化。Aquabiology201, 332-337(2012)。
Serisawa, Y., Imoto, Z.,石川,T. &大野,M.Ecklonia静脉日本南部土佐湾海水温度升高与人口增多有关。鱼Sci70, 189 - 191。https://doi.org/10.1111/j.0919-9268.2004.00788.x(2004)。
Kiriyama, T., Mitsunaga, N., Yasumoto, S., Fujii, A. & Yotsui, T.褐藻的杂草生长现象,Hizikia fusiformis,被认为是由对马岛Tsutsuura的食草动物放牧引起的[日本]。日本长崎县水产研究所公报(1999)。
Kiriyama, T., Fujii, A. & Fujita, Y.几种草食性鱼类对马尾藻的摄食和特征咬痕。Aquac。科学。53, 355-365(2005)。
Yatsuya, K., Kiriyama, T., Kiyomoto, S., Taneda, T. & Yoshimura, T. 2013年在日本长崎县Iki岛Gounoura观察到的Ecklonia和Eisenia床的恶化过程。-夏季高水温引发河床退化,秋季草食鱼类放牧引发层叠效应。藻Resour。7, 79-94(2014)。
野田明,大原浩,村濑,池田一,山本凯。毛氏Siganus fuscescens对环状爱森藻(Eisenia bicyclis)和几种马藻科和囊藻科海藻的放牧与海藻床物种组成差异的关系。日本Suisan Gakkaishi80, 201-213(2014)。
野田敏,木下佳,田田,N. &村濑,N.草食性鱼类海带林短期觅食破坏所致海带林咬痕特征。j .国家的。鱼。大学。66, 111-122(2018)。
Wernberg, T。et al。海藻群落从海洋变暖中撤退。咕咕叫。医学杂志。21, 1828 - 1832。https://doi.org/10.1016/j.cub.2011.09.028(2011)。
Terazono, Y., Nakamura, Y., Imoto, Z. & Hiraoka, M.鱼类对热带扩张的反应海藻日本温带海岸的床3月生态。掠夺。爵士。464, 209 - 220。https://doi.org/10.3354/meps09873(2012)。
Duffy, J. E. & Hay, M. E.海藻对食草性的适应——化学、结构和形态防御经常根据攻击的空间或时间模式进行调整。生物科学40, 368-375(1990)。
Endo, H., Suehiro, K., Kinoshita, J. & Agatsuma, Y.温度和养分富集对褐藻马尾藻(山田)适口性的综合影响。点。植物科学。6, 275(2015)。
Clements, K. D., German, D. P, Piché, J., Tribollet, A. & Choat, J. H.整合珊瑚礁的生态角色和营养多样化:多条证据将鹦嘴鱼确定为噬菌体。医学杂志。j·林恩。Soc。120, 729 - 751。https://doi.org/10.1111/bij.12914(2017)。
王毅,罗曼,U,赖特,s.t.和沃顿,d.i. mvabundance -一个R包基于模型的多元丰度数据分析。生态方法。另一个星球。3., 471-474(2012)。
威尔逊,S. K,贝尔伍德,D. R.乔特,J. H. &弗纳斯,M. J.附生藻基质中的碎屑及其对珊瑚礁鱼类的利用。Oceanogr。3月的杂志。为基础。牧师。41, 279-309(2003)。
赫尔曼,g.s.硬骨鱼的行为366-387(施普林格,1986)。
Prince, J., LeBlanc, W. & Maciá, S.多项选择喂养偏好数据的设计和分析。环境科学138, 1-4(2004)。
Hartig, F. DHARMa:层次(多层次/混合)回归模型的残留诊断。R包版本0.33.(2020)。
大野,M. & Ishikawa, M.日本南部土佐湾海岸褐藻的生理生态学。一、Ecklonia床层的季节变化。美国海洋生物学代表。高知大学4, 59-73(1982)。
Agostini, S。et al。海洋变暖和酸化下的温带海洋生态系统的简化,而不是“热带化”。水珠。改变医学杂志。27, 4771-4784(2021)。
季节、个体发育和潮汐对温带海洋草食鱼欧达克斯(欧达克斯科)饮食的影响。3月的杂志。117, 213-220(1993)。
水田,杨晓明,杨晓明,杨晓明,等。日本北海道南部褐藻海带氮含量与荚膜形成的关系。鱼。科学。64, 909-913(1998)。
Kumura, T., Yasui, H. & Mizuta, H.两种滑翔科植物裙带菜(Harvey) Suringar和crassifolia Kjellman动物孢子形成的营养需求(褐藻科:层流科)。鱼。科学。72, 860-869(2006)。
秋,Z。et al。预计未来的气候变化将影响微生物群和形成栖息地的海带的条件。Proc. R. Soc。B286, 20181887(2019)。
霍伊,a . S. &贝尔伍德,D. R.高多样性系统中有限的功能冗余:单一物种主导着珊瑚礁的关键生态过程。生态系统12, 1316 - 1328。https://doi.org/10.1007/s10021-009-9291-z(2009)。
Streit, R. P., Hoey, A. S. & Bellwood, D. R.摄食特征揭示了珊瑚礁上食草鱼类的功能差异。珊瑚礁34, 1037-1047(2015)。
Van Alstyne, K. L. & Paul, V. J.海洋大藻类中多酚化合物的生物地理-温带褐藻防御阻止热带草食鱼类的摄食。环境科学84, 158-163(1990)。
Targett, n.m., Boettcher, a.a., Targett, t.e. & Vrolijk, n.h.热带海洋食草动物对富含酚类植物的同化。环境科学103, 170-179(1995)。
杂食性和草食性消费者的海草选择:决定因素。3月生态。掠夺。爵士。42945 - 55。https://doi.org/10.3354/meps09076(2011)。
Montgomery, W. L. & Gerking, S. D.作为鱼类食物的海洋大型藻类:潜在食物质量的评估。环绕。医学杂志。鱼。5, 143-153(1980)。
杜菲,J. &保罗& V.J。猎物营养质量和化学防御对热带礁鱼的有效性。环境科学90, 333-339(1992)。
Michael, P. J., Hyndes, G. A., Vanderklift, M. A. & Vergés, A.草食性鱼类的身份和行为对珊瑚礁大型藻类草食性空间格局的影响。3月生态。掠夺。爵士。482, 227-240(2013)。
贝内特,S. &贝尔伍德,D. R.大堡礁鱼类巨藻消耗的纬度变化。3月生态。掠夺。爵士。426, 241-252(2011)。
Zarco-Perello, S, Wernberg, T, Langlois, T. J. & Vanderklift, m.a .热带化加强了消费者对栖息地形成海藻的压力。科学。代表。7, 820年。https://doi.org/10.1038/s41598-017-00991-2(2017)。
史密斯,s.m.。et al。热带化和海带的消失改变了营养成分,导致鱼类群落的赢家多于输家。水珠。改变医学杂志。27(11), 2537-2548(2021)。
Zarco-Perello, S。et al。范围扩展的热带食草动物增加了温带海洋生态系统中食草功能的多样性、强度和程度。功能。生态。34, 2411 - 2421。https://doi.org/10.1111/1365-2435.13662(2020)。
确认
我们感谢C. Kitamine和M. Ohashi在实地的协助,感谢S. Evans在化学分析方面的协助,感谢新南威尔士大学统计中心的B. Maslen在统计分析方面的协助。我们也感谢两位匿名审稿人,他们以建设性的反馈改进了这篇手稿。这项研究得到了澳大利亚-日本双边交流计划(澳大利亚科学院)和两项澳大利亚研究委员会发现资助(DP170100023和DP190102030)的支持。
作者信息
作者及隶属关系
贡献
A.V.和Y.N.构想了最初的想法,设计并进行了实地实验。M.K.和S.O.对数据采集和数据处理做出了贡献。B.S.L.对数据分析做出了贡献。所有作者都对数据的解释、手稿的写作做出了重要贡献,并最终批准了出版。
相应的作者
道德声明
相互竞争的利益
作者声明没有利益竞争。
额外的信息
出版商的注意
施普林格自然对出版的地图和机构从属关系中的管辖权主张保持中立。
补充信息
权利和权限
开放获取本文遵循知识共享署名4.0国际许可协议,允许以任何媒介或格式使用、分享、改编、分发和复制,只要您对原作者和来源给予适当的署名,提供知识共享许可协议的链接,并注明是否有更改。本文中的图像或其他第三方材料包含在文章的创作共用许可协议中,除非在材料的信用额度中另有说明。如果材料未包含在文章的创作共用许可协议中,并且您的预期使用不被法定法规所允许或超出了允许的使用范围,您将需要直接获得版权所有者的许可。如欲查看本牌照的副本,请浏览http://creativecommons.org/licenses/by/4.0/.
关于本文
引用本文
Vergés, A.,兰哈姆,b.s.,科诺,M。et al。热带和温带海藻之间鱼类食草性的差异以及海带消费的年度模式影响着温带珊瑚礁的热带化。Sci代表12, 21202(2022)。https://doi.org/10.1038/s41598-022-24666-9
收到了:
接受:
发表:
DOI:https://doi.org/10.1038/s41598-022-24666-9