摘要
无刺蜜蜂是世界上最大的群居蜜蜂。它们作为作物传粉者发挥着重要作用,已被考虑纳入农药风险评估(RAs)。除了无刺蜜蜂幼虫和真菌的互惠关系,食真菌螨直腹型(Neotydeolus)肺泡对于研究无刺蜜蜂的关系很有趣。它们的存在与蜂群的强度和健康有关,显示出永久宿主关联水平。在这里,我们测试了是否与P。(N。)alvearii影响无刺蜂幼虫的生存和发育,包括喂食杀虫剂剂量的食物。我们选择了乐果(毒性试验的参考标准)和噻虫嗪(thiamethoxam),后者广泛用于新热带作物,并被列入RAs中重新评估。与螨虫相关的蜜蜂显示出更高的幼虫存活率,即使是在被喂食的蜜蜂中,并且显示出发育时间和体型的变化。我们的研究代表了无刺蜜蜂对繁殖细胞内食真菌螨共存的反应的第一个方法,这使我们相信这些螨在无刺蜜蜂中发挥了有益的作用,包括当它们暴露在杀虫剂中时。
简介
近几十年来,气候变化、土地利用集约化、入侵物种、转基因作物、寄生虫、栖息地丧失、花卉缺乏和农药使用等多种相互作用的压力因素与全球传粉者的损失有关1,2,3.,4,5.这种担忧包括一般的蜜蜂种群;因此,谨慎地寻找其他方法来保持蜜蜂的强壮和健康。无刺蜜蜂(蜜蜂科:Meliponini)是世界上主要的群居蜜蜂,分布于新热带地区。它们生活在多年生的群体中,通常包含数十到数千只个体6.无刺蜜蜂和微生物的相互作用是必不可少的:细菌、真菌和酵母在营养和抵御有害微生物方面发挥着基本作用7,8,9,10,11,12,13,14.无刺蜜蜂的摄食要求Scaptotrigona真菌幼虫ZygosaccharomycesSp.已被报道;然而,鸡窝中的微生物群并不局限于这种必需的真菌11,12,15.
除了这些互惠的联系,螨虫似乎是有趣的生物,包括在这个主题的研究中。弗莱彻曼和卡马戈16描述了食真菌螨的存在Neotydeolus therapeutikos(前柱头:泰蜂科)在无刺蜂的生殖细胞中Scaptotrigona postica,当螨虫存在时,幼虫死亡率显著降低。目前被归为亚属,Neotydeolus唯一的亚属Proctotydaeus含有与蜜蜂相关的螨虫)在新热带地区被发现,在那里有关于无刺蜜蜂和属的报道Melipona,Partamona,Scaptotrigona.宿主关联水平是永久的,因为这些螨虫不能离开蜜蜂或黄蜂生活16.螨虫并不总是在巢中,但当它们出现时,蜂群就会强壮而健康。
我们调查了是否存在Proctotydaeus(Neotydeolus)alverii食真菌的生活在孵化细胞内的螨类干扰了幼虫的存活和发育生物学参数美国postica体外饲养的幼虫,暴露或不暴露于杀虫剂。我们假设螨虫对无刺蜜蜂的生存起着有益的作用。我们进一步研究了食真菌螨是否能保护蜜蜂免受农药胁迫。我们的结果为进一步研究这些生物作为改善蜜蜂健康和保护蜜蜂免受农药侵害的替代品提供了信息。我们选择无刺蜜蜂作为研究对象美国postica在新热带地区,人们研究将其作为风险评估(RAs)的模式生物17,18,19.我们使用新热带作物中常用的新烟碱类杀虫剂噻虫嗪作为活性成分,并使用乐果作为毒性试验的参考标准。
我们发现,与螨虫相关的蜜蜂呈现出更高的幼虫存活率,即使在喂食蜜蜂中也是如此,并揭示了发育时间和体型的变化。我们的研究首次证明了无刺蜜蜂与食真菌螨的相互作用。我们的研究结果表明,螨虫对无刺蜜蜂的健康和对农药的耐受性起着有益的作用。
结果
螨的鉴定和行为观察
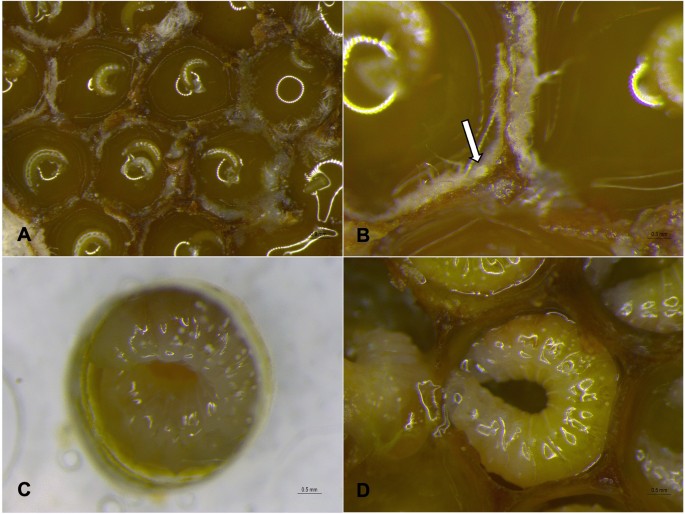
螨种鉴定为Proctotydaeus(Neotydeolus)alveariiRosa, André和Flechtmann20.(前气门亚目:Tydeidae)。行为的几个方面P.(N。)alvearii在新开帽的巢梳中观察到:在细胞中行走;走近并触摸蜂卵;并在幼虫进食前和进食期间以真菌或幼虫食物为食。1a-b和补充视频1).螨虫的行为与在孵化细胞内进行的清洁任务一致。可以看到螨虫在发育中的幼虫和幼虫的食物上行走,似乎是在以真菌为食。
无刺蜜蜂的一般存活
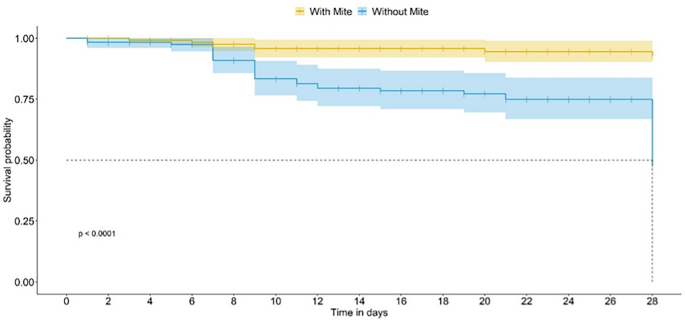
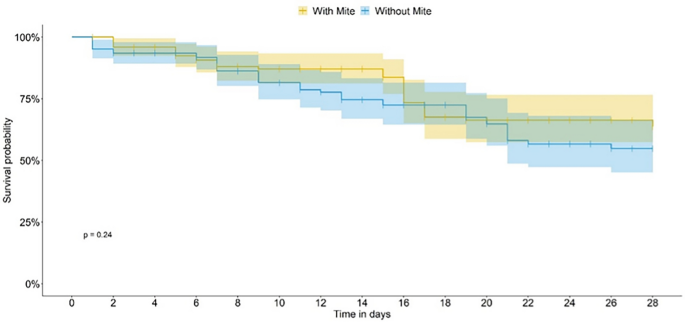
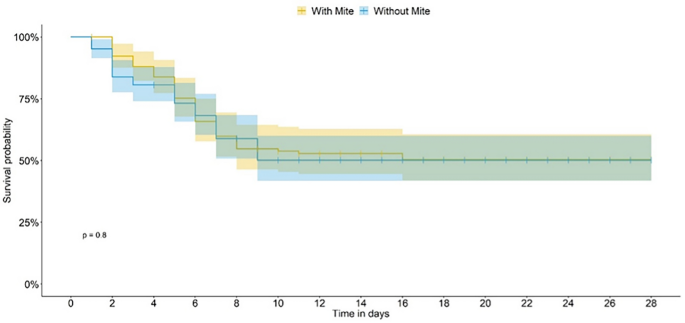
在未使用杀虫剂处理的食物上(对照- cont生物测定法),在实验单元引入螨的第7天,观察到存在或不存在螨的蜜蜂生存曲线之间的显著差异(广义线性模型(GLM);P< 0.0001;无花果。2),在这两种情况下,蜜蜂的平均寿命为28天。当蜜蜂被喂食噻虫嗪(tmx剂量)时,螨虫的存在不会影响生存曲线(图2)。3.而且4).当蜜蜂食用乐果(dim剂量)时,存活率大大降低,当没有螨虫时,没有存活率;蜜蜂的时间反应不允许我们估计TMX和DIM的中位寿命。
生存在每个发展阶段
在所有生物测定中,螨的存在都有利于幼虫:而有螨的CONT的存活率为91%,无螨的存活率为39% (GLM;F= 32.06,P= 0.004;表格1).TMX的相同参数有螨为69%,无螨为35% (GLM;F= 6.9273,P= 0.05;表格1).在DIM处理中,当无螨时,幼虫无存活率;然而,在他们的存在下,生存率几乎为8%(表1).
对于蛹,在CONT生物测定中,有螨的存活率(96%)显著高于无螨的存活率(63%)(GLM;F= 6.77,P= 0.05;表格1).在TMX生物测定中,螨类对蛹存活率没有显著影响(表1).在DIM生物测定中,幼虫也发现,只有当螨虫存在时,蛹才能存活(50%)(表2)1).
在有螨虫的CONT生物测定中,胚胎后未成熟的存活率(87%)高于无螨虫的存活率(24%)(GLM;F= 45.27,P= 0.0025;表格1).在TMX生物测定中,蜜蜂的平均存活率在27%到42%之间,处理之间没有显著差异(表2)1).在DIM生物测定中,发现了一些存活的蜜蜂(2%)(表1).
各个阶段的发展时间
对于幼虫,在CONT生物测定中观察到不同处理之间的显著差异,无螨时的时间更长(GLM;F= 87.59,P= 0.0007;表格2).在TMX生物测定中,螨类对幼虫存活率没有显著影响(表2).在DIM生物测定中,存活的幼虫(当螨虫存在时)的中位持续时间为17天(表2)2).
对于蛹,在CONT生物测定中观察到处理之间的显著差异,但在有螨(GLM;F= 53.47,P= 0.0018;表格2).在TMX生物测定中,螨类对蛹存活率没有显著影响(表2).在DIM生物测定中,存活蛹(当螨虫存在时)的中位持续时间为12天(表2)2).
在每只蜜蜂的幼虫和蛹的聚集时间(胚胎后未成熟)中,CONT (GLM;F= 40.96,P= 0.0001;表格2)和TMX (GLM;F= 56.82,P= 0.0016;表格2)生物测定,无螨时时间较长。DIM生物测定中没有进行比较,但存活蜜蜂的持续时间(当螨虫存在时)为19天(表2)2).
形态测量学
在CONT生物测定中,蜜蜂的头部(HW)明显更宽(GLM;F= 132.24,P= 0.0001;表格3.)和较短的齿间距离(ID) (GLM;F= 7.19,P= 0.0147;表格3.)当螨虫出现时。在TMX生物测定中,蜜蜂的头(HW)明显较短(GLM;F= 8.97,P= 0.0171;表格3.)和较短的齿间距离(ID) (GLM;F= 8.00,P= 0.0221;表格3.)当螨虫出现时。同样,DIM试验不能进行比较,因为当螨虫不存在时,所有的蜜蜂幼虫都死亡了(表2)3.).
讨论
我们的结果清楚地表明存在P.(N.)alvearii当幼虫(CONT:约2.3倍)或不暴露于农药(TMX:约1.9倍)时,存活率正增加。蛹和胚芽后未成熟体以不加剂量的食物为食,螨对其也很有利(分别为1.5倍和3.6倍)。虽然活性成分乐果具有杀螨和杀螨的特性,但我们观察到,当螨虫在所有发育阶段都存在时,至少存活率较低。这些发现的原因包括:(i)螨虫在降低育雏细胞中真菌密度方面发挥了作用;(ii)作为幼虫食物来源的螨虫;或(iii)两种可能性同时发生。
我们的发现证实了Flechtmann和Camargo的发现16为近亲螨种。作者认为,两者之间的联系美国postica蜜蜂和螨虫Proctotydaeus(Neotydeolus)therapeutikosFlechtmann和Camargo与去除真菌有关,他们认为真菌对蜜蜂是致病的。他们说鸟巢在哪里n therapeutikos引入后幼虫死亡率降低了近50%。然而,一个矛盾的发现值得注意:Flechtmann和Camargo能够为每个蜜蜂阶段建立一个固定的螨虫数量。在我们的研究中,由于螨虫的行为,做同样的事情是不可行的:n alverii在孵化细胞间快速行走,一个细胞接一个细胞快速移动。出于这些原因,在目前的工作中,我们可能正在描述具有其他类型角色和/或相互作用的不同螨种的行为。达科斯塔等人。21研究了三种无刺蜜蜂的螨虫多样性(四瓣凤梨,Scaptotrigona bipunctata,Tetragonisca fiebrigi)在巴西南部。作者发现,螨的多样性由无刺蜂宿主种类决定,并根据采样区域的不同而不同。这一说法加强了这样一种说法的可信度,即即使是从同一种蜜蜂(美国postica),我们在Flechtmann和Camargo的研究中发现了一种不同的有益螨种。
目前,至少有三种真菌在耵聍(用于建造巢梳的原材料)中繁殖:Zygosaccharomyces(需要被Scaptotrigona蜜蜂幼虫化蛹),假丝酵母(刺激Zygosacchromyces发展),以及红曲霉(重要的生态作用)11,12.我们的结果提出了螨可以有效控制真菌增殖的假设,正如我们对暴露于TMX的幼虫的结果所示。这种活性成分以前与发育时间的显著变化有关Scaptotrigona depilis不成熟的个体被喂食含有噻虫嗪的食物22.此外,其他先前的工作报告了暴露于同一农药的蜜蜂幼虫发育异常23,24.蜜蜂的发育进程可能受到这种神经毒性杀虫剂的影响,孵化细胞内的真菌微生物群甚至控制其他微生物群,如红曲霉.
在自然条件下,在蜂窝内有丰富的真菌供应蜜蜂幼虫和螨虫。然而,如果不摄入,真菌繁殖得太快。我们的假设是蜜蜂幼虫变弱是因为杀虫剂造成的影响(通过缓慢进食)。然后,真菌可能会以超过蜜蜂幼虫吸收它的能力的速度增殖,对幼虫有害。正如其他作者所描述的那样,螨虫会扮演清洁的角色25.这种相互作用将使幼虫得以发育和生存,而不是随着真菌占领整个细胞(通过窒息和杀死幼虫)而死亡。
这可能解释了在我们的治疗(TMX)中,在螨虫存在的情况下,存活率超过33%:由于幼虫暴露在杀虫剂中,Neotydeolus摄入真菌菌群,帮助蜜蜂生存。此外,可以观察到这些螨的有益作用,考虑到存活率,尽管喂食dim剂量食物(杀虫剂和杀螨剂)的幼虫很小(约8%)。
第二种可能涉及幼虫喂食期后不久螨的命运:观察到螨与幼幼虫一起在巢梳上和巢内以及巢细胞内行走,甚至在卵上行走。然而,从幼虫进食全部食物之前(大约第4天)到生物测定结束,在离体培养皿中再也看不到螨虫或在里面行走,也没有发现它们死亡(图2)。1c).在自然系统中也可以观察到同样的模式(图。1D),其中在较大的幼虫(从96 h龄开始)中不再报告螨虫。这一时期与Menezes等人建立的幼虫龄期相吻合。15,其中真菌菌丝已被无刺蜂幼虫吃掉。
无刺蜜蜂和微生物有着显著的进化关系,因为这些蜜蜂依靠发酵过程来保存蜂蜜和储存花粉6,26,27,28.De Paula等人。14指出了三个主要的无刺蜜蜂与微生物群的联系:共生,生物分子的产生,以及作为昆虫的食物。需要进一步的研究来证实我们的假设N。alvearii螨被幼虫连同幼虫的大部分食物一起摄取。如果这一假设是正确的,这些螨虫将作为蛋白质来源或补充食物,提高无刺蜜蜂的性能,正如我们的研究结果所表明的:螨虫的存在导致胚胎后阶段的存活率分别为88%,42%和0.2%,喂食非剂量,tmx剂量和dim剂量的食物;在没有螨的情况下,存活率依次为24、27和0%。
另一项发现加强了我们的假设,即螨虫是由未服用蜜蜂发育时期饲养的幼虫摄入的(表2)2):与无螨时相比,有螨时幼虫发育较短,而蛹发育较长。在昆虫中,幼虫摄取的所有食物都是为变态提供营养储备,在变态期间昆虫将处于无食状态(蛹期)。所产生的蛋白质将服务于幼虫后发育阶段的代谢过程29.花粉,无刺蜜蜂幼虫食物的主要来源30.是它们的蛋白质来源31.在幼虫阶段摄入的螨虫,以及幼虫食物中含有的蛋白质,为蜜蜂提供了额外的蛋白质,导致它们处理这些额外的量。这一过程将影响幼虫后阶段的持续时间,解释了蛹发育时间较长的原因。
Vollet等人。31新出巢工蜂对花粉的早期进食行为与下咽腺发育有关。下咽腺位于头部,参与幼虫食物的生产32,33,34.下咽腺的大小是一个常用来评估食物营养价值的参数35,36,随着蛋白质摄取量的增加而变大37.如上所述,摄入的螨虫为蜜蜂提供了额外的蛋白质,这可能会导致更大的下咽腺。测量下咽腺的大小超出了我们当前研究的范围,但值得注意的是,饲喂非剂量食物并与螨虫相关的新出现工人的头胶囊明显比不与螨虫相关的工人宽(宽约119微米)。喂食tmx剂量食物并伴有螨虫的工人也比没有伴有螨虫的工人有更宽的头囊,但差异仅为~ 25µm。这些发现可能与TMX的神经毒性作用有关,TMX已经被证明可以严重减小蜜蜂的头部尺寸22损害脑细胞38,39,40,41,42.
这些发现表明,生态和进化研究应该把无刺蜜蜂、真菌和食真菌螨放在一起,研究这些食真菌螨通过营养、免疫反应甚至异种代谢对无刺蜜蜂健康的潜在作用。蜜蜂养殖(无刺蜂箱管理)是新热带地区一项有前途的可持续社会经济活动。无刺养蜂人经常报告蜂群变弱。与蜜蜂不同,关于无刺蜜蜂病原体的知识很少43,44,45.更好地了解这些生物之间的相互作用可以优化蜂箱的培养,而在蜂箱中操纵螨可以作为保证蜂箱强度的另一种管理方法。
我们的工作突出了重要的数据空白:(i)不同幼虫阶段的育雏细胞是否含有不同类型的增殖真菌和不同的比例?(ii)螨虫是否会在孵化细胞内,等待某种可能对幼虫“有害”的真菌的增殖,在幼虫孵化之前或同时Zygosaccharomyces繁殖,这样他们就可以进行控制,从而保护幼虫?(iii)即使在控制Zygosaccharomyces,可能会以超过幼虫摄食能力的速度繁殖,杀死幼虫?此外,这些新情况也可能鼓励人们寻找共存于其他蜜蜂物种中的有益微生物,以减轻几种压力源的潜在不利影响,这些压力源可能会危及它们的种群。燕窝野外观测与实验操作Megalopta蜜蜂(汗蜂),例如,提供了与螨虫相关的清洁互惠关系的明确证据25.然而,到目前为止,还没有对这个问题进行进一步的调查。这种方法也可以在蜜蜂中进行研究,因为对蜜蜂有益微生物的关注已经提出,需要进行深入的调查46.最后,有必要提请注意全球范围内的蜂群管理实践,主要是针对作物授粉和这种实践的潜在风险。不适当的物种运输可能促进病虫害的传播47,48,49,50.因此,确定在不同地区流行的与蜜蜂有关的生物群落的成员以及它们之间相互作用的类型是至关重要的,以便采取适当的措施来防止未来的问题。我们希望我们的发现能引发对健康蜂群的可持续替代品的进一步研究,这些替代品也可以用来为作物授粉。
方法
幼虫的来源和饲养
殖民地的美国postica起源于保利斯塔州立大学“Júlio de Mesquita Filho”(UNESP)的实验蜂鸟,它们被保存在木质蜂箱中。6个非亲代蜂群被用于实验,从每个蜂群中移除一个巢梳。以前饲养无刺蜂幼虫的标准化方法被用来除去巢梳并获得幼虫17,18.
螨的来源、饲养和鉴定
螨标本取自本地无刺蜂的巢梳美国postica,起源于上文所述的同一种墨丘科植物。在70%乙醇中收集30个标本。样本取自相同的6个非亲本蜂群,用于蜂幼虫的来源和饲养(每个蜂群5只螨)。样品被送到São保罗大学“Luiz de Queiroz”高等农业学院的昆虫学和昆虫学部门,在那里,它们被安装在霍耶介质中,在差分干涉对比显微镜下进行识别(尼康,80i;尼康,中国无锡市)。
螨的行为观察
我们使用上述6个巢梳中的3个来监测螨的行为。这些梳子包含了蜜蜂从卵到48小时大的幼虫(更年轻的幼虫)。我们还从相同的蜂箱中收集了另外3个巢梳,包含72 h龄的幼虫(较老的幼虫)。然后,每组3把梳子(3个重复)进行螨类观察。一旦我们从蜂箱中取出巢梳,我们将每个巢梳分别放置在培养皿中。在盘子里,用湿棉花来保持湿度。这一过程对于保持幼虫食物的一致性至关重要18.一些湿度和温度要求允许我们进行不超过4小时的视频记录。在这段时间之后,真菌在孵化细胞中迅速增殖。这使得进一步的观察变得不可行。
我们通过视频记录(每个巢梳4小时)和带有耦合相机(LeicaM205 C)的立体显微镜和LAS V4.8软件获得的图像报告了我们的观察结果。
体外生物测定
如Rosa-Fontana等人所描述的,24小时大的幼虫从它们的自然梳子转移到含有幼虫食物的人工孵化细胞(丙烯酸板)。18.幼虫的来源和暴露条件改编自经合组织蜜蜂生态毒理学生物测定指南51.使用了来自6个非亲代蜂群的6个巢梳。从6个蜂群中获得幼虫食物总量,并在Falcon管中均质,然后分配给实验组。我们首先将生物测定分为“无螨”(去除所有螨)和“有螨”(添加螨)P。(N.)alvearii螨)。对于螨虫的添加,我们从含有螨虫的巢梳中取去巢盖的巢细胞;然后,我们把鸡窝梳摇到亚克力板上,添加螨虫。
在将幼虫食物、幼虫和螨转移到亚克力板上后,我们立即在体视显微镜下使用耦合摄像机(LeicaM205 C)和LAS V4.8软件对所有板进行检查。螨在这些条件下很容易看到,然后我们保证“无螨”和“有螨”的生物测定。每个生物测定法被细分为实验组:幼虫喂食(i)噻虫嗪剂量食物(TMX), (ii)乐果剂量食物(DIM),和(iii)对照(CONT)。对照组(阴性对照组)为不添加农药的纯饲料。从6个蜂群中每个蜂群抽取60只幼虫,其中20只被随机分配到不同的实验组。每个试验组设3个重复(每个重复1块亚克力板,每块板上有20只幼虫)。然后,每个实验组60只幼虫(180只/生物测定)。
用杀虫剂制备幼虫食物
有效成分(a.i) (Pestanal,分析标准,Sigma-Aldrich, Burlington, MA, USA)噻虫嗪(TMX)和乐果(DIM)通过食物提供给幼虫。剂量是根据在“农业、牲畜和供应部”(AGROFIT)注册的有蜜蜂吸引力的作物的现场建议。为了估计花蜜和花粉中的残留量,在美国环境保护署(USEPA)提出的Bee Rex表中绘制了该领域的推荐剂量。我们将1000 ng a.i./µL食物的原液按1:1稀释(10 mg TMX或DIM: 10 mL幼虫食物),使实验浓度达到0.00157 ng a.i./µL (TMX)和0.007 ng ia/µL (DIM)。这些浓度表示现场实际剂量(FDR): FDR/1000 (TMX)和FDR/100 (DIM)。根据既定方案,将活性成分直接稀释到幼虫食物中,使初始浓度达到1000 ng a.i./µL (Dorigo等人)。17).由于每个孵化细胞所需的食物量为25 μ L,我们将每个值乘以25,得到ng a.i. /幼虫的浓度:0.03925 (TMX)和0.175 (DIM)。无刺蜜蜂大量喂养它们的幼虫;也就是说,它们一次性将全部食物储存在繁殖细胞中,这些食物将被幼虫完全消耗掉17,18.这个庞大的系统使我们能够确定蜜蜂摄入的总浓度。
存活、发育和形态测量美国postica幼虫评估
每天监测体外培养板的死亡率和发育时间。死去的个体被从实验中移除。用纹间距离和头宽作为形态参数,检查有螨和无螨的生物测定之间可能的变化。因此,从每个实验组(如“体外生物测定”所述)中,30只蜜蜂被用于形态测量评估。测量是使用带有耦合相机(徕卡M205 C)的立体显微镜和LAS V4.8软件使用软件本身的测量模块获得的图像进行的。
统计分析
我们使用析因结构分析了处理(杀虫剂和对照)与螨效应(无螨和有螨)在以下变量中的相互作用:存活率、发育持续时间、头宽和齿间距离。因此,我们比较了各处理中螨的影响与无螨的关系。我们使用准二项分布的广义线性模型来比较生存率,这里选择的模型来拟合生存数据是根据残差图和半正态图的拟合优度精心选择的52.各组间比较(α = 0.05)采用Bonferroni 's t检验(受保护的最小显著性差异(LSD))分析发育持续时间、头宽和纹间距离等变量。使用软件包survminer进行生存曲线的多次比较和组间水平的两两比较,并进行多项测试的校正53和生存54在R软件中。
数据可用性
在本研究过程中产生或分析的所有数据均可根据合理要求从通讯作者处获得。
参考文献
Goulson, D, Nicholls, E, Botías, C. & Rotheray, E. L.蜜蜂下降是由寄生虫、杀虫剂和缺少花朵的综合压力造成的。科学347, 1255957(2015)。
-波茨,s.g.等.生物多样性和生态系统服务政府间科学政策平台关于传粉者、授粉和粮食生产的评估报告决策者摘要(eds。波茨,s.g.。等)。36页。(波恩,德国,2016)。
多尔扎尔,a.g.。et al。相互作用的压力因素:饮食质量和病毒感染在蜜蜂健康。r . Soc。开放的科学。6, 181803(2019)。
Annoscia D。et al。新烟碱类氯噻虫素降低蜜蜂免疫反应,促进瓦螨增殖。Commun Nat。11, 1-7(2020)。
Macías-Macías, j.o.。et al。小孢子虫引起细胞免疫抑制,并与噻虫脒相互作用,增加无刺蜜蜂的死亡率Melipona colimana.科学。代表。10, 1-8(2020)。
米切纳,c.d.大麻蜂蜜。在盆栽蜂蜜:无刺蜜蜂的遗产(eds Vit, P。et al。) 3-17(施普林格,2013)。
罗莎,c。et al。与无刺蜜蜂有关的酵母群落。FEMS酵母Res。4, 271-275(2003)。
梅内塞斯,C. Vollet-Neto, A. &丰塞卡,V. L. I.在体外培养无刺蜂后的进展。Apidologie44, 491-500(2013)。
Morais, P. B., Calaça, P. S. S. T. & Rosa, C. A.与无刺蜜蜂相关的微生物。在Pot-Honey蜜蜂(eds Vit, P。et al。) 173-186(施普林格,2013)。
我想,C。et al。Paenibacillus polymyxa与无刺蜜蜂有关Melipona scutellaris产生抗昆虫病原体的抗菌化合物。j .化学。生态。44, 1158-1169(2018)。
帕鲁多,c.r.。et al。无刺蜂幼虫需要真菌类固醇来化蛹。科学。代表。8, 1122321(2018)。
帕鲁多,c.r.。et al。微生物群落调节无刺蜜蜂变态所需共生真菌的生长。《公共科学图书馆•综合》14, e0219696(2019)。
哈姆扎,S. A.,扎瓦维,N. &萨布里,S.细菌与无刺蜜蜂关系的综述。理科马来人。49, 1853-1863(2020)。
德保拉,G. T.,梅内塞斯,C., Pupo, M. T.和罗莎,C. A.无刺蜜蜂和微生物相互作用。咕咕叫。当今。昆虫科学。44, 41-47(2020)。
德梅内塞斯,C。et al。巴西群居蜂必须培育真菌才能生存。咕咕叫。医学杂志。25, 2851-2855(2015)。
- Flechtmann, C. H. W. & de Camargo, C. A.与巴西无刺蜜蜂(Meliponidae,膜翅目)有关的蜱螨。在第四届国际螨虫学大会论文集,萨尔费尔登(奥地利)/ Edward Piffl编辑(布达佩斯,Akademiai Kiado,1979)。
多里戈,a。et al。无刺蜂种幼虫体外培养方法Melipona scutellaris用于毒理学研究。《公共科学图书馆•综合》14, e0213109(2019)。
Rosa-Fontana, A., Dorigo, A. S., Galaschi-Teixeira, J. S., Nocelli, R. C. F. & Malaspina, O.新热带地区最适合作为幼虫阶段毒性试验的模式生物的本地蜜蜂物种是什么?环绕。Pollut。265, 114849(2020)。
米奥特罗,L.,多斯·里斯,A. L. M.,马拉奎亚斯,J. B.,马拉斯皮纳,O. &罗特,T. C.。的蜜蜂而且Melipona scutellaris对噻虫嗪表现出不同的敏感性。环绕。Pollut。268, 115770(2021)。
罗萨,A. E., André, H. & Flechtmann, C. H. W.巴西蜱螨寄生体。Proctotydaeus alvearii45(1-2), 79-83(1985)。
Da-Costa, T., dos Santos, C. F., Rodighero, L. F., Ferla, N. J. & Blochtein, B.螨的多样性是由无刺蜂宿主物种决定的。Apidologie52(5), 950 - 959。https://doi.org/10.1007/s13592-021-00878-2(2021)。
德罗莎,a。et al。在幼虫期摄入新烟碱类噻虫嗪会影响无刺蜂的生存和发育Scaptotrigona等于off。depilis.Apidologie47, 729-738(2016)。
吴金勇,吴志明,王志强,王志强。农药残留对工蜂的亚致死效应(的蜜蜂)发展和长寿。《公共科学图书馆•综合》6, e14720(2011)。
Tavares, D. A., Roat, T. C., Carvalho, S. M., Silva-Zacarin, E. C. M. & Malaspina, O. thiamethoxam对非洲化蜜蜂幼虫的体外影响的蜜蜂(膜翅目蜜蜂科)。光化层135, 370-378(2015)。
Biani, n.b., Mueller, U. G. & Wcislo, W. T.清洁螨:新热带蜂巢微型生态系统中的卫生互惠主义。点。Nat。173, 841-847(2009)。
吉列姆,M.,鲁比克,D. W. &洛伦兹,B. J.无刺蜜蜂巢中与花粉、蜂蜜和育窝食物有关的微生物Meliponafasciata.Apidologie21, 89-97(1990)。
雷贝洛,K. S.,费雷拉,A. G. & carvalo - zilse, G. A.亚马逊无刺蜂采集花粉的物理化学特征。Ciencia农村46, 927-932(2016)。
Mohammad, s.m., Mahmud-Ab-Rashid, n.k.。& Zawawi, N.无刺蜂采集花粉(蜂面包):化学和微生物特性和健康益处。分子26, 957(2021)。
da Cruz Landim, C.(2009)。Abelhas.Unesp。
罗莎,A. S。et al。无刺蜜蜂饮食中幼虫食物及其花粉含量的定量:毒性生物测定研究的补贴。布拉兹。生物。75(3), 771 - 772。https://doi.org/10.1590/1519-6984.22314(2015)。
Vollet-Neto, A., Maia-Silva, C., Menezes, C. & Imperatriz-Fonseca, V. L.新出现的无刺蜜蜂工人Scaptotrigona等于off。depilis喜欢储存的花粉而不是新鲜的花粉。Apidologie48, 204-210(2017)。
哈特菲尔德,K. &恩格斯,W.无刺蜜蜂幼虫食物的组成:化学系统方法评估营养平衡。昆虫。Soc。36, 1-14(1989)。
Costa, r.a.c. & da Cruz-Landim, C.巴西无刺蜜蜂工蜂、蜂后和雄蜂下咽腺酸性磷酸酶的分布Scaptotrigona posticaLatreille:超微结构细胞化学研究。Histochem。J。33, 653-662(2001)。
de Moraes, R. L. M. S., brochto - braga, M. R. & Azevedo, A.下咽腺蛋白质和幼虫食物的电泳研究Meliponaquadrifasciataanthidioides地蜡。(膜翅目昆虫,Meliponinae)。昆虫。Soc。43, 183-188(1996)。
费南德-达-席尔瓦,P. G., Muccillo, G. & Zucoloto, F. S.花粉最小量的测定及不同碳水化合物的营养价值Scaptotrigona depilisMoure(膜翅目,蚜虫科)。Apidologie24, 73-79(1993)。
Fernandes-da-Silva, P. G. & Serrão, J. e蜜蜂采集和储存花粉在无刺蜜蜂中的营养价值和表观消化率,ScaptotrigonaposticaLatr。(膜翅目,蜂科,小蜂科)。Apidologie31, 39-45(2000)。
crilsheim, K. & Stolberg, E.饮食、年龄和蜂群条件对蜜蜂肠道蛋白水解活性和下咽腺大小的影响(apimelliferal .)。昆虫物理。35, 595-602(1989)。
Oliveira, R. A., Roat, T. C., Carvalho, S. M. & Malaspina, O. thiamethoxam对非洲化蜜蜂大脑和中肠的副作用的蜜蜂(Hymenopptera:蜜蜂科)。环绕。Toxicol。29, 1122-1133(2014)。
Christen, V., Schirrmann, M., Frey, J. E. & Fent, K.蜜蜂大脑中新烟碱类药物clothianidin、吡虫啉和噻虫嗪的环境相关浓度的全球转录组效应(的蜜蜂).环绕。科学。抛光工艺。52, 7534-7544(2018)。
莫雷拉博士。et al。新烟碱噻虫嗪对Scaptotrigona bipunctata小蜂,1836(膜翅目:蜂科)。环绕。Toxicol。33, 463-475(2018)。
Tavares, D. A., Roat, T. C., Silva-Zacarin, E. C. M., Nocelli, R. C. F. & Malaspina, O.幼虫期暴露于thiamethoxam影响蜜蜂大脑中的突触素水平。Ecotoxicol。环绕。Saf。169, 523-528(2019)。
Roat t.c.et al。利用毒理蛋白质组学方法研究噻虫嗪对大鼠脑的影响的蜜蜂.光化层258, 127362(2020)。
凯撒,L。et al。在巴西南部,一种濒临灭绝的无刺蜜蜂每年都会死亡。维罗尔将军。One hundred., 1153-1164(2019)。
Guimaraes-Cestaro, L。et al。田间3种无刺蜂(蜂科:美刺蜂)病毒、微孢子虫和农药残留的发生情况科学。Nat。107, 1-14(2020)。
特谢拉,E。W。et al。巴西无刺蜜蜂的欧洲染污病(蜜蜂科:染污蜂属):旧病,新的威胁。j . Invertebr。病理学研究。172, 107357(2020)。
Alberoni, D, Gaggìa, F., Baffoni, L. & Di Gioia, D.蜜蜂有益微生物:问题与进展。达成。Microbiol。Biotechnol。One hundred., 9469-9482(2016)。
曼利,R., Boots, M. & Wilfert, L.传粉昆虫新出现的病毒疾病风险:生态、进化和人为因素。j:。生态。52, 331-340(2015)。
Manley R。et al。一种新病媒对社区的冲击:新出现的DWV- B从受瓦罗蝇感染的蜜蜂向野生大黄蜂的外溢。生态。列托人。22, 1306-1315(2019)。
Graystock, P., Blane, E. J., McFrederick, Q. S., Goulson, D. & Hughes, W. O. H.受管理的蜜蜂是否推动寄生虫在野生蜜蜂中的传播和出现?Int。j . Parasitol。Parasit。Wildl。5, 64-75(2016)。
Requier F。et al。保护本土蜜蜂至关重要。生态发展趋势。另一个星球。34, 789-798(2019)。
试验编号237:蜜蜂幼虫毒性试验,单次暴露.(2013)。经济合作与发展组织。https://doi.org/10.1787/9789264203723-en
Moral, R. A., Hinde, J. & Demétrio, C. G. R中的半正态图和过分散模型:hnp包。J.统计。81(1), 1 - 23(2017)。
——卡桑巴拉(A.测量员)GitHub库。https://github.com/kassambara/survminer(2020)。
- Therneau, T., Crowson, C., & Atkinson, E.多状态模型和竞争风险。CRAN-Rhttps://cran.r-project.org/web/packages/survival/vignettes/compete(2020)。
确认
我们感谢Gilberto Moraes教授对螨种的鉴定和对手稿的有益评论。我们也感谢国家科学技术发展委员会- cnpq(工艺编号:400540/2018-5和380301/2021-0)和São保罗研究基金会- fapesp(工艺编号2017/21097-3)的财政支持。
作者信息
作者及隶属关系
贡献
A.S.R.F.和ASD设计了研究,进行了生物测定,并撰写了论文,J.B.M.和J.K.S.P.进行了统计分析并对论文进行了修改,R.C.F.N、s.t.和O.M.对论文进行了修改。
相应的作者
道德声明
相互竞争的利益
作者声明没有利益竞争。
额外的信息
出版商的注意
施普林格自然对出版的地图和机构从属关系中的管辖权主张保持中立。
补充信息
补充视频1。
权利和权限
开放获取本文遵循知识共享署名4.0国际许可协议,允许以任何媒介或格式使用、分享、改编、分发和复制,只要您对原作者和来源给予适当的署名,提供知识共享许可协议的链接,并注明是否有更改。本文中的图像或其他第三方材料包含在文章的创作共用许可协议中,除非在材料的信用额度中另有说明。如果材料未包含在文章的创作共用许可协议中,并且您的预期使用不被法定法规所允许或超出了允许的使用范围,您将需要直接获得版权所有者的许可。如欲查看本牌照的副本,请浏览http://creativecommons.org/licenses/by/4.0/.
关于本文
引用本文
罗莎·丰塔纳,a.s.,多里戈,a.s.,马拉奎亚斯,J.B.et al。食真菌螨提高了无刺蜜蜂的生存和发展,即使暴露在杀虫剂中。Sci代表12, 20948(2022)。https://doi.org/10.1038/s41598-022-25482-x
收到了:
接受:
发表:
DOI:https://doi.org/10.1038/s41598-022-25482-x