文摘
锌指转录因子Ikaros1 (Ikzf1)是哺乳动物淋巴发展所需。四个锌指构成它的DNA结合域和两个锌指存在于c端蛋白质交互模块。我们描述斑马鱼为两个截然不同的纯合子突变体的表型ikzf1等位基因。IT325变异缺乏c端两个锌指,而只保留fr105变体的第一个锌指DNA结合域。一个完整的ikzf1幼虫T细胞发育所需的基因,而低水平的成人淋巴发展恢复突变体。相比之下,增加骨髓形成的突变体表现出签名的幼虫和成虫阶段。两种突变刺激红细胞分化在幼虫,表明c端锌指消极调节红细胞生产的程度。意外的微分效应两个突变体在成人红细胞生成建议的直接要求一个完整的DNA结合域的祖细胞进入血红细胞谱系。总的来说,我们的结果加强的幼虫和成虫造血作用之间的生理差异,表明stage-specific功能ikzf1在调节分化的层次分岔,分配不同的功能的DNA结合域和c端锌手指。
介绍
斑马鱼已成为一个有价值的模型来研究脊椎动物造血作用1,2,3,4,5。然而,多少还有待了解硬骨鱼类的血液细胞的遗传监管机构发展为了建立哺乳动物系统的相似性和差异。斑马鱼模型的主要优势的遗传屏幕可以进行;例如,基因的方法6,7导致许多基因的识别编码淋巴发展潜在的监管机构,包括ikzf16,7,8,9,10,11,12,13,14,15,16。
Ikzf1的创始成员伊卡洛斯锌指转录因子家族,由五个氨基酸蛋白质有着高度的相似性17,18。在小鼠模型中,个人Ikaros家庭成员的函数在不同开发阶段的淋巴已经充分证明19;有趣的是,最近的研究表明,至少有一部分这些函数是由人类同行共享20.,21,22,23,24,25,26。Ikzf1被认为主要淋巴造血干细胞(hsc)和转录计划concomittantly抑制转录祖的项目特点和non-lymphoid下游肝星状细胞的造血的血统27。一般来说,Ikaros-like蛋白质拥有六个锌指(ZF)主题;四氨基端ZFs(一个家庭成员,飞马,只有三个ZFs域)的DNA结合模块,而所需的两个c端ZFs是蛋白质相互作用18。蛋白复合物涉及伊卡洛斯家族成员的特点是人类,异形的交互,但也延伸到与非家庭成员的互动,解释这些转录因子的多元功能的积极和消极监管目标基因18。
在我们之前的研究中,斑马鱼突变特征ikzf1基因编码蛋白变体c端ZFs缺乏缺乏9。变异鱼的特点是失败的幼虫T细胞发展;虽然后来复苏,只有少数细胞完成成熟过程,与稳态扩散在周边T细胞克隆9,28。B细胞的成熟是同样的影响,因为寡克隆成熟igμ−B细胞数量igμ+细胞9。集体,我们初步研究突出c端ZFs的重要作用为适当的淋巴发展和显示的进化功能Ikzf1的脊椎动物造血作用。在最近的一项研究中,黄等。29日检查的幼虫表型ikzf1等位基因缺乏DNA结合和相互作用域。他们的结果定义两个关键Ikzf1的下游靶基因,即ccr9a,irf4a;前需要导航而造血的胸腺祖细胞,后者需要启动intrathymic T细胞分化29日。
尽管如此,相关的几个重要问题ikzf1函数仍悬而未决,尤其是对差异的幼虫和成虫在调节造血作用及其作用的分支,erythro-myeloid和淋巴细胞分化。在这里,我们解决这些问题通过比较两个的表型ikzf1突变体,一个缺乏和DNA结合蛋白质交互模块,其他缺乏蛋白质交互模块。
结果
描述一个新的ikzf1等位基因在幼虫造血的发展及其作用
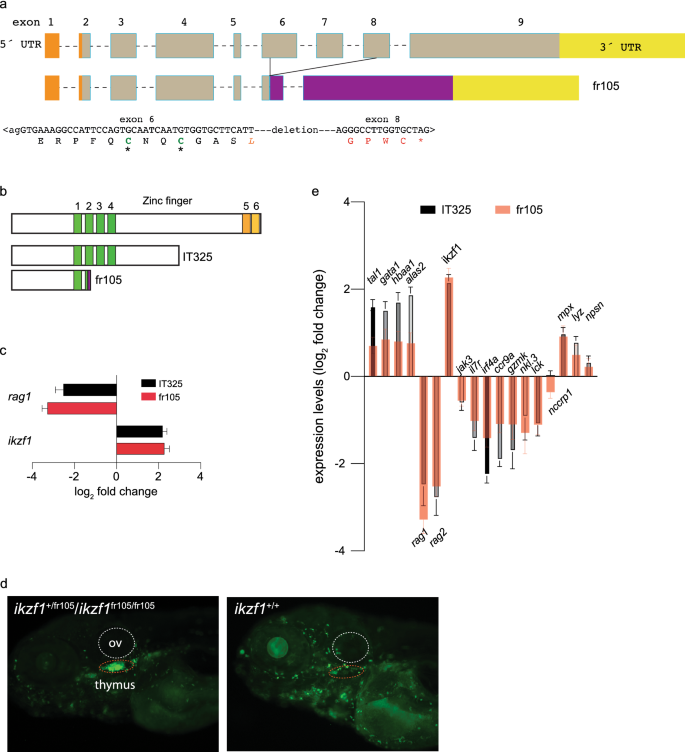
在我们大规模的遗传屏幕6,7隐性突变问题,我们已经确定了两个ENU-induced貌似没有任何意义的ikzf1(ENSDARG00000013539);由突变等位基因变异的蛋白质编码II032 (Ref。6)和IT325 (Ref。9)缺乏两个c端锌指的全部或部分,但保留了四个锌指DNA结合被认为是重要的18。两个突变体导致斑马鱼幼体受损发展淋巴血统。为了检查的作用ikzf1详细造血的分化和比较时尚,我们试图在研究突变等位基因缺乏一个完整的DNA结合域。为此,我们使用了CRISPR / Cas9系统介绍的删除ikzf1跨外显子编码氨基锌指基因。fr105等位基因(ikzf1fr105),一个基因内删除删除部分外显子6日的全部外显子7,和部分外显子8 (p.Phe171LeuX4 c.del513 - 819;ENSDART00000016430.7)(无花果。1),导致截断Ikzf1蛋白质,只保留锌指1(无花果。1b)。如预期IT325等位基因的研究9,28、鱼fr105等位基因的纯合子缺乏幼虫T细胞的发展,所表示的减少10倍以上rag1记录观察到的在RNA-seq受精后5天(5 dpf)(图1c;补充数据1和2)。总的来说,我们的研究结果表明,幼虫淋巴发展的早期阶段在fr105突变体大大受损,兼容之前的一个类似的分析ikzf1突变体缺乏所有六个锌手指29日。我们得出结论,幼虫淋巴发展依赖于一个完整的ikzf1基因9,28。出人意料地,然而,我们发现,在突变体为IT325和fr105等位基因纯合子,的水平ikzf1基因明显调节(图。1c),表明Ikzf1转录因子是一个负反馈回路调节的一部分自己的表达水平。这个结果证实了分析的鱼携带一个ikzf1: eGFP记者转基因28;在缺乏一个完整的ikzf1基因GFP表达水平远高于ikzf1足够的兄弟姐妹(无花果。1d)。这种基因星座也被证明是有用的在建立genotype-phenotype相关的交叉ikzf1+ / fr105杂合的父母。而根据孟德尔基因型隔离比率,3:1的表型隔离模式,对胸腺的大小和GFP的表达水平(无花果。1d),这表明fr105等位基因是隐性的。
描述一个新的ikzf1等位基因。(一个)斑马鱼的结构示意图ikzf1基因。外显子是由盒子和编号和按比例画;内含子是由虚线表示但不按比例画的。5´utr和3´utr橙色和黄色所示。CRISPR / Cas9-induced fr105等位基因显示删除;结的核苷酸序列和由此产生的蛋白质序列显示在单独的字母代码。删除创建一个框移,导致的不相关的氨基酸残基(红色字母)之前过早停止密码(*)。(b)由两个编码的蛋白质的示意图ikzf1等位基因的研究;IT325等位基因被Schorpp et al。9。(c)缺乏纯合子IT325幼虫T细胞发展和fr105突变体由RNA-seq dpf 5点;rag1和ikzf1表达水平相对于野生型显示(平均±s.e.m。n = 3生物复制品)。(d)的分析ikzf1fr105等位基因。在伊卡洛斯:eGFP背景,野生型表型和杂合的鱼不能区分(左面板),而突变体(右面板)缺乏荧光信号在胸腺(虚线红色椭圆形),并呈现出明亮的荧光。机汇,耳泡。e微分IT325基因表达模式,在5 dpf fr105突变体。日志2褶皱的变化表达水平相对于野生型的兄弟姐妹表示(意味着±s.e.m。n = 3生物复制品)。
给定的表达ikzf1在一些造血的血统185日,我们执行RNA-seq dpf幼虫IT325 fr105突变体和研究基因的表达表明淋巴和non-lymphoid血统IT325 fr105突变体。正如所料,表明幼虫T细胞基因开发(rag1,rag2,jak3,il7r在突变体)表达在较低水平。相同的差异是发现的irf4a- - - - - -ccr9a轴30.;其他的表达与淋巴细胞分化相关的基因(lck,gzmk,nkl.3,nccrp1)也减少了(无花果。1e)。有趣的是,IT325突变蛋白,它将保留DNA结合域,但是缺乏两个c端锌手指,有更多的有害影响大多数基因的表达,大概是因为这种变体行为占主导地位的消极的方式。而淋巴发展是在缺乏一个完整的受损ikzf1基因,我们意外发现与红细胞和粒细胞的分化相关的基因血统是调节变异鱼。例如,erythroid-lineage基因tal1,gata1a,alas2,hbaa1是协调调节两种突变体,虽然增加的大小是四倍IT325突变体比fr105突变体(无花果。1e)。分析调节骨髓lineage-related基因(mpx,lyz,nspn(图)也显示allele-specific微分效应。1e)。总的来说,上级non-lymphoid基因表达变异幼虫,兼容Ikzf1的观念抑制non-lymphoid细胞命运18。补充数据1和2汇总5 dpf的差异表达基因突变幼虫IT325和fr105等位基因纯合,分别。提供一个全面的视图的功能后果转录突变体的变化,我们进行了豹31日,32和Reactome33分别调节和表达下调的基因通路分析;表1列出了大大丰富通路有关造血的分化,而补充数据3记录完整的分析。除了haematopoiesis-related通路的改变,神经信号的变化/发展发现,兼容Ikzf1的一个子集的神经元的活动34,35。
肾脏骨髓造血的分化的成人的突变体
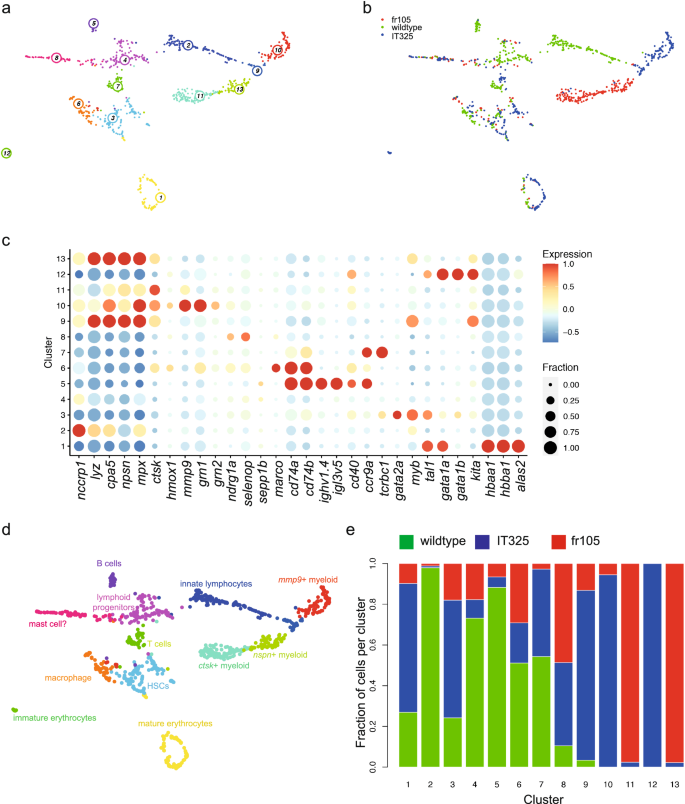
幼虫造血作用的扰动了大部分RNA-seq分析可以解释为基因的失调和/或改变成分的细胞造血的隔间。为了更详细地研究这个,并确定是否改变坚持成年鱼,我们使用scRNA-seq mCEL-Seq2 (Ref。36,37)(补充图。1)检查整个肾脏的细胞异质性骨髓(WKM)细胞在野生型和突变体的鱼。细胞具有类似转录资料被确定使用VarID鲁汶集群38;结果UMAP表示39说明成人造血的隔间的复杂性的基因表达谱和集群大小(图。2a、b)。WKM细胞的结合分析野生型和定义的两个突变导致了13个不同的转录簇(无花果。2a、b)。我们编译列表的差异表达基因在这些集群(补充数据4),用手动策划这些基因生成诊断矩阵的选择基因表达的转录定义细胞集群(无花果。2c;表2)。
整个肾脏的骨髓细胞的转录景观IT325 fr105突变体。(一个)统一多方面的近似和投影(UMAP)转录组的代表相似性由341年野生型相结合的分析方法,331 IT325线的突变细胞,和262年fr105线的突变细胞;各个集群由颜色和数字表示。鱼是3个月的年龄。(b)分布的野生型和突变细胞中转录单元定义集群;细胞的起源色码。(c)基因表达模式的签名(列在底部)所示的单个细胞集群(一个,b)。颜色代表的意思表达基因的z分数在各自的集群和圆点大小代表了一部分细胞集群中表达的基因。z得分高于1,低于1替换为1−1,分别。(d)细胞类型识别基于签名的基因表达模式(见表2和文本的详细信息)。(e)分布的细胞识别不同基因型的细胞集群。
例如,在淋巴血统,一群T细胞集群(7)被co-expression T细胞受体基因(tcrbc1)和ccr9a基因编码一种lymphoid-specific趋化因子受体。B细胞被免疫球蛋白重链的表达(ighv1.4)和轻链(igl3v5)基因除了基因编码co-stimulatory Cd40分子和趋化因子受体Ccr9a(集群5)。高的基因表达水平(cd74a;cd74b)与MHC II级相关通路不仅发现B细胞,但细胞集群上6;的表达马可基因编码一个清道夫受体,表明细胞集群中巨噬细胞40。属于红色的细胞谱系中发现集群1和12。成熟红细胞(集群1)表达高水平的血红蛋白基因(这里以hbaa1,hbba1等)和其他erythrocyte-specific基因alas2,编码5 ' -aminolevulinate合成酶2重要的铁代谢的调节41;更多的不成熟细胞的红细胞血统(集群12)表达高水平的tal1,gata1a和gata1b,编码的关键转录因子家族7,42。造血祖细胞,表达转录因子Myb基因相关的干细胞,Tal1 Gata2a,识别集群3。
几个细胞集群与各种类型的骨髓细胞。例如,细胞表达高水平的mpx髓过氧物酶,编码,主要是发现在集群9,10、13。基于co-expression概要文件,我们建议9港口集群更不成熟的髓细胞(存在显著的水平myb13),而集群可能代表中性粒细胞,表现出高水平的mpx43,npsn一个基因编码一个metalloprotease参与宿主防御细菌感染44,lyz编码溶菌酶、糖苷水解酶表达只在髓细胞也参与抗菌防御45。集群10和11所填充mmp9+集群(10)ctsk+集群(11)neutrophil-like细胞,支持他们的密切关联的任务不成熟的髓细胞集群(9)UMAP表示(无花果。2a)。先天lymphocyte-like细胞集群2中被组合在一起,表现出高水平的nccrp1非特异性细胞毒性细胞受体蛋白基因,编码1同族体46。基于我们的诊断(表表达范式2),细胞集群4和8缺乏明确的血统表达模式,虽然他们可以区分的表达ndrg1a和seleop基因。进一步探讨其潜在的身份,我们受到的列表基因通路富集分析。豹和Reactome算法提示给他们的细胞身份;然而,对于集群4,去分析47返回一个重大打击长链脂肪酸生物合成的过程(去:0042759;调整P= 0.020)。鉴于集群4是由野生型细胞(见下文)和B细胞(集群5)之间的定位和T细胞集群(7),可能是细胞集群4代表不成熟的淋巴细胞。的co-expressionndrg1a,seleop,基塔表明在集群8细胞可能代表肥大细胞谱系的前兆。摘要集群作业投射到UMAP提出了无花果。2d(参见表2)。
有趣的是,细胞的三个基因型差异有助于13细胞集群被合并后的分析。集群为例,B细胞集群(5)是由野生型细胞,而细胞的人口分配给不成熟的红细胞(集群12)主要包括细胞来源于IT325突变(无花果。2e)。总的来说,8/13的细胞簇是由突变细胞,尽管这两个突变体的相对贡献也不同集群,集群(无花果。2e)。这些观察结果表明,对造血的分化的影响这两个突变体大大不同。
一对一的比较ikzf1突变体与野生型的鱼
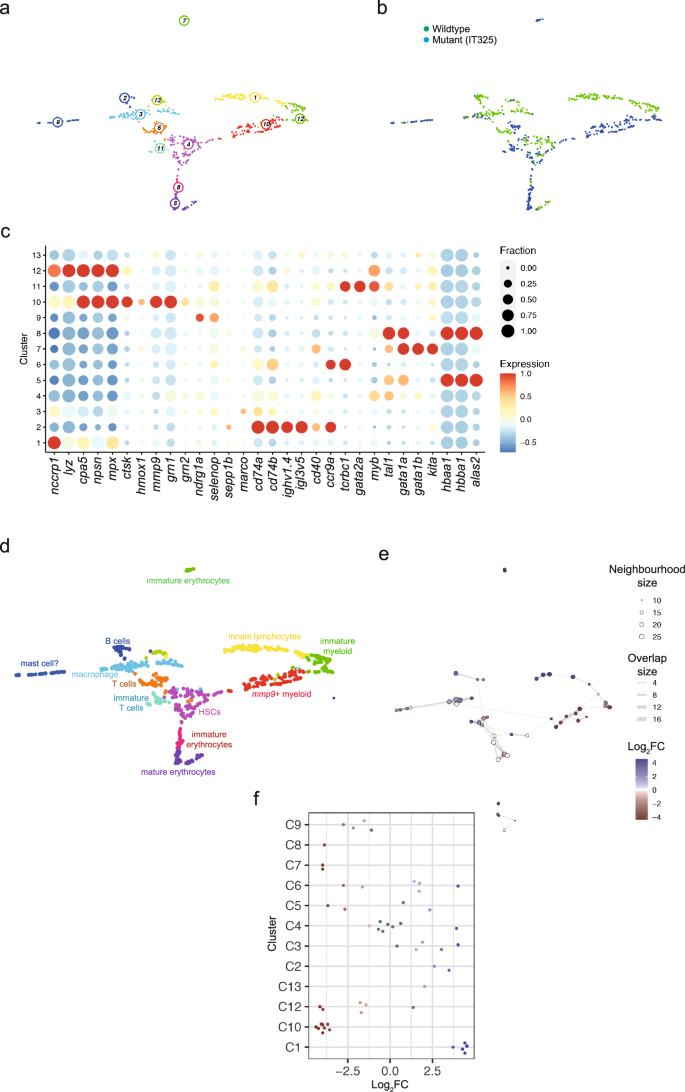
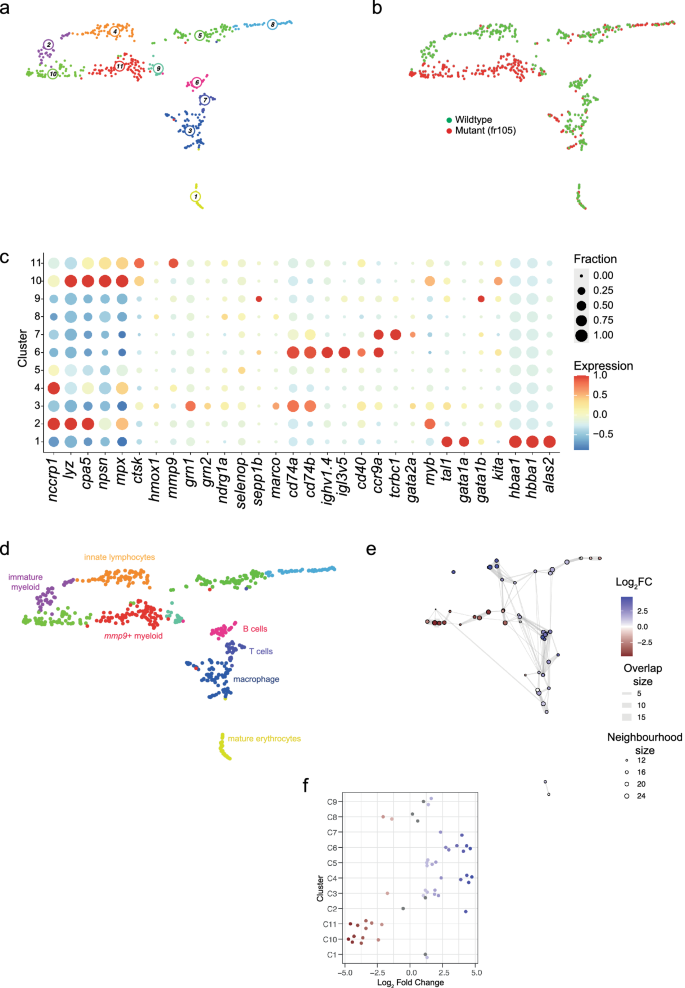
下一个,我们继续解决的影响两个突变体的执行个体比较两个突变体与野生型细胞。在本节中,我们给出一个简短的概述这些分析,之前单独讨论以下部分的两个突变体的特点。基因差异表达的全球模式详细补充数据5(325突变体)和补充数据6(fr105突变)和随后的路径分析的结果总结补充数据7。细粒度的分析,我们计算了UMAP预测后VarID集群(图。3(IT325突变)和无花果。4[fr105突变]),然后确定差异表达基因的表达水平在每个集群的两个分析(补充数据8 (IT325突变)和补充数据9 [fr105突变]);然后执行路径分析每个集群(补充数据10 (IT325突变)和补充数据(fr105突变)11日)以协助和配合血统的任务。在随后的步骤中,我们分析了微分贡献的野生型和突变细胞使用的米洛算法测试微分丰富通过再分配细胞部分重叠社区的邻居图48(无花果。3e, f (IT325突变)和无花果。4e, f [fr105突变])。
整个肾脏的骨髓细胞的转录景观IT325突变体。(一个)统一多方面的近似和投影(UMAP)转录组的代表相似性由综合分析331年341个野生型和突变细胞IT325行;各个集群由颜色和数字表示。(b)分布的野生型和突变细胞中转录单元定义集群;细胞的基因型色码。(c)基因表达模式的签名(列在底部)所示的单个细胞集群(一个,b)。颜色代表的意思表达基因的z分数在各自的集群和圆点大小代表了一部分细胞集群中表达的基因。z得分高于1,低于1替换为1−1,分别。(d)细胞类型识别基于签名的基因表达模式(见表2和文本的详细信息)。(e米洛的社区发现算法)图表示;索引的位置细胞社区投射到他们的位置UMAP表示所示(一个,b)。节点相当于社区;颜色显示他们的野生型和突变细胞和成分差异量化为日志2褶皱的变化在10%罗斯福(颜色代码表示向右);节点的大小表示细胞的数量在这附近;图的边代表细胞的数量在邻近街区之间共享。(f日志)的分布2褶皱变化丰富的野生型和突变细胞之间的街区中确定不同的细胞集群(在左边)bee-swarm图所示;社区展示微分丰富罗斯福10%颜色(红颜色表示更大的大量的突变细胞;蓝颜色表示更大的大量的野生型细胞)。
整个肾脏的骨髓细胞的转录景观fr105突变体。(一个)统一多方面的近似和投影(UMAP)转录组的代表相似性由综合分析262年341个野生型和突变细胞fr105行;各个集群由颜色和数字表示。(b)分布的野生型和突变细胞中转录单元定义集群;细胞的起源色码。(c)基因表达模式的签名(列在底部)所示的单个细胞集群(一个,b)。颜色代表的意思表达基因的z分数在各自的集群和圆点大小代表了一部分细胞集群中表达的基因。z得分高于1,低于1替换为1−1,分别。(d)细胞类型识别基于签名的基因表达模式(见表2和文本的详细信息)。(e米洛的社区发现算法)图表示;见图。3e传说的解释。(f)Bee-swarm情节微分丰度分析;见图。3f传说为进一步解释。
个人比较的结果(见下面的两个部分)强调实质性差异这两个突变体的例证偏向红细胞IT325突变的细胞谱系分化。
扰动造成的ikzf1IT325突变体缺乏二聚作用域
比较肾脏骨髓细胞的野生型和IT325突变导致13集群(图的识别。3a、b)。差异基因表达分析(图。3c)血液系统的主要组件。T细胞被发现在集群6和11中,B细胞集群定义2和erythrocyte-lineage细胞集群5、7和8。先天淋巴细胞被发现在集群1中,肝星状细胞在集群4中,和骨髓在集群3群体,9,10,12(图。3d;表2)。
我们先前已经表明,尽管失败幼虫T细胞的发展,T谱系细胞可以从青少年恢复IT325变异鱼,尽管大多数的这些细胞似乎是不成熟9,28。这里给出的scRNA-seq数据确认和扩展这个结果。转录,集群6,其中包含成熟的T细胞,集群11密切相关,包括不成熟的T细胞(图。311 a)。有趣的是,集群包含主要突变细胞(图。3b);的co-expressiontcrbc1,gata2a和myb表明,这些都是未成熟的细胞,符合我们之前的结论部分块T细胞发展成人IT325突变体9。相比之下,集群6填充野生型和突变体的细胞起源(无花果。3b)。综上所述,这个观察表明存在明显的T细胞成熟IT325突变体块。集群的野生型基因型2是由B细胞表达高水平的免疫球蛋白基因和其他成熟的标记,也表明B细胞突变体发展严重受阻。此外,细胞集群1,通过高水平的杰出nccrp1表达与先天NK-like细胞相关联,完全由野生型细胞。总的来说,这些结果表明,IT325突变体遭受极大损害的发展主要淋巴血统。
与淋巴隔间,野生型细胞只占小比例的红色的血统,表明这个non-lymphoid分化途径大大青睐的突变。事实上,大量的红细胞谱系细胞突变体中肾髓促进两种类型的成熟细胞类型的识别集群(7和8),两者都是由细胞的突变表型。基于祖基因的表达模式(如gata1a和gata1b),我们建议细胞集群7比那些不成熟的集群,其中细胞co-express血红蛋白基因。集群的集群成熟红细胞(5),包含野生型和突变细胞(图3a - c)。
填充髓细胞中,集群10只通过突变细胞,而另一个集群(12)包含野生型和突变细胞的成熟骨髓表达谱,在图中以可观的水平myb。
集群使用VarID算法获得的结果证实了邻居分析使用米洛算法(无花果。3e、f);注意,由于细胞集群的低数字11日他们没有分配给特定的社区。
总之,我们scRNA-seq分析成年鱼标识一个意想不到的血统转移IT325突变。局部块淋巴发展是伴随着强烈的偏向红细胞分化。因此,看来IT325变异表现为幼虫(图类似的血统的偏见。1)和成人(无花果。3)造血作用。
扰动造成的ikzf1fr105突变体缺乏DNA结合和二聚作用域
比较肾脏骨髓细胞的野生型和fr105突变导致11集群(图的识别。4a、b),差异基因表达分析(图。4c)确定血液系统的主要组件(图4d;表2)。有趣的是,在这种情况下,基因表达谱表明,T细胞集群(7)和B细胞集群(6)的成熟的表型,但所有的细胞都来源于野生兄弟姐妹。先天淋巴细胞表达nccrp1在集群4,这是由野生型细胞(图。4e、f)。总之,成人淋巴细胞增殖fr105突变体严重受损。
相比IT325局势突变体,为增强红细胞生成被认为没有证据表明fr105突变体;事实上,集群1,包括红细胞细胞谱系是由野生型细胞。因此,适度提高红细胞分化在幼虫阶段(无花果。1)不持续到成年。
在骨髓细胞中,只有两个集群(集群10和11)主要是由突变细胞填充;有趣的是,而细胞集群10表现出不成熟的髓细胞的转录签名,集群11由细胞表达高水平的ctsk和mmp9在野生型,让人想起集群10 / IT325分析(无花果。3)。在这两种情况下,这些集群是几乎完全由突变细胞组成。我们得出结论,这种独特的类型的骨髓人口,只代表一小部分在野生型肾骨髓,强烈支持在缺乏野生型ikzf1基因。总之,成人fr105 scRNA-seq分析突变体(带一个ikzf1等位基因缺乏完整的DNA结合和激活域)表明淋巴块分化严重,明显受损的红细胞生成,深刻的改变骨髓分化。
讨论
第一个暗示ikzf1参与斑马鱼淋巴发展提供的发现它的表达在斑马鱼haematopietic组织发展49。证实了这一假说的表现型斑马鱼缺乏一个完整的ikzf1基因9。后来的研究表明,Ikzf1调节的表达irf4a29日,进而发现控制ccr9a表达式30.。有趣的是,在幼虫阶段,ikzf1- - - - - -irf4a轴似乎需要有效地抑制pu.1表达式来防止替代T lymphoid-primed祖细胞分化的路径30.。这里给出的结果支持这样的结论,缺乏一个完整的ikzf1基因倾向于骨髓分化相对于淋巴发展;这些改变可能会反映在人类携带突变IKFZ1等位基因的骨髓障碍25,50。有趣的是,一只老鼠hypomorphicIkzf1等位基因包含DNA结合和二聚作用域与更高的中性粒细胞数量有关,由于改变迁徙潜力和中性粒细胞前体的生存51指着Ikzf1蛋白质功能的关键阈值在调节淋巴/ myeloid-erythroid分支点的决定。
有趣的是,我们的结果表明,两个ikzf1突变体分析表现出截然不同的表型在成人造血作用。对T细胞的发展,似乎ΔZF2-6 (fr105)突变体块比ΔZF5分化在早期阶段,6 (IT325)突变,而影响B细胞发育和天生的细胞毒性血统是相似的。突变体也有类似的表现对于myeloid-biased分化特征轨迹的幼虫和成虫造血作用。相比之下,这两个突变不同大幅关于对成人红细胞生成的影响。对幼虫的刺激影响红细胞生成ΔZF5定性相似但更明显,6 (IT325)突变体。我们推测,c端交互模块参与创造一个压抑的环境的一些Ikzf1´s目标基因18;因此,c端截短突变体的主要负面影响电梯红细胞转录镇压的景观。相比之下,成人erythropiesis严重受损的ΔZF2-6 (fr105)突变,而仍在ΔZF5 supraphysiologial水平,6 (IT325)变异。这可能是由于不同的功能Ikzf1的两个锌指模块:在成人阶段,其DNA结合活性是必不可少的有效的红细胞分化,和c端锌手指用来限制excesssive活动以牺牲其他造血的血统。功能区别这两个模块在幼虫红细胞生成似乎不太明确,因为红细胞生成仍然发生在supraphysiological水平即使在突变体没有一个完整的DNA结合域;我们推测,其他因素可以替代Ikzf1函数在这个阶段,低效率的限制进入红细胞分化途径。观察到的表达gata1和be1球蛋白基因是不变的irf4a有缺陷的胚胎30.表明Ikzf1调节红细胞比淋巴发展发展通过一个截然不同的管理模块。
总的来说,目前的结果加强的幼虫和成虫造血作用之间的生理差异,表明stage-specific ikzf1的函数在调节淋巴的层次分岔和non-lymphoid分化轨迹,并分配不同的功能的c端锌指DNA结合域和ikzf1。
方法
动物
斑马鱼(鲐鱼类)应变Tupfel长鳍/ Ekkwill维护动物设施的马克斯普朗克研究所的免疫生物学、表观遗传学和用于这里描述的实验。
道德宣言。所有实验协议经伦理委员会批准的马克斯普朗克研究所的免疫生物学、表观遗传学在许可证颁发的许可证AZ 35 - 9185.81 / G-14/41 Regierungsprasidium弗莱堡,德国。方法和步骤都是按照有关规定和条例。所有方法报告按照到达的指导方针。手稿中给出了以下信息:基因型的动物,动物组相比,样本大小,结果测量、统计方法和相关的实验程序。没有动物被排除在这项研究中,并没有进行随机化,实验者没有蒙蔽。
CRISPR突变体
CRISPR指导rna (5´-GGTGCTTCATTCACTCAGAA成绩单ENSDART00000016430.7][位于外显子6;5´-GGACATGCCTGCATCTGAGA[位于外显子8的成绩单ENSDART00000016430.7])是由孵化重叠的目标序列的引物(5μg /底漆,100毫米MgCl20.1米,三羟甲基氨基甲烷pH值7.5)液在95°C 5分钟,冷却rt,退火引物被绑定到BsaI-digested pDR274向量(50 ng退火引物,10 ng BsaI-digested pDR274, 5 U T4连接酶,1 x T4连接酶缓冲)为2 h 22°C,在65°C反应灭活10分钟。透析了结扎的混合物大肠杆菌DH5α电穿孔。文化转化株,质粒的提取和体外转录指导rna进行了描述52。纯化CRISPR指导rna被体外消化的目标检测特异性DNA (80 ng PCR扩增子包含目标序列,600 ng Cas9蛋白质酿脓链球菌(机构生物),300 ng指导RNA, 1 x CutSmart缓冲区(新英格兰生物学实验室))在37°C 1 h。指导RNA被通过添加4μg核糖核酸酶的反应15分钟前在37°C的可视化乳沟产品通过琼脂糖凝胶电泳。体外消化的程度之间的目标相比,DNA反应有和没有添加指导RNA。CRISPRs滴定和体积的1 - 2问注入野生型胚胎1-cell阶段的解决方案包含(250 ng /μL指导RNA, 500 ng /μL Cas9蛋白质,1%的酚红,Danieau缓冲区)。运营商的遗传病变outcrossed野生鱼,和稳定的载波线路从创建合适的突变。fr105等位基因的结构如下。它龋齿~ 3.6 kb 13号染色体上的删除(核苷酸15962388到15962388;GRCz11)。基因分型进行了如下。检测基因内删除,引物CRISPRikarosMS1: 5“-cctttacctatttatgtggagtg和CRISPRikaros一:5 ' -tgcatattaaacagtgatcgctg(扩增子大小260个基点)使用;野生型等位基因检测用引物的5 ' -acgctctcactggacatctg和5 ' -tgcactgcaagtagttgtgac(扩增子位于删除; size 230 bp). During the establishment of theikzf1fr105等位基因,RNA原位杂交rag1和“大酒店”gene-specific探测器是用来识别纯合突变体在5 d.p.f。(Ref。9);此外,突变体也确定在一个ikzf1: eGFP转基因背景28。鱼的ikzf1+ / +和ikzf1+ / fr105基因型是无法区分基于GFP荧光模式;相比之下,ikzffr105/ fr105突变体易于辨认的GFP fluoresence水平和增加胸腺染色的缺失。
斑马鱼细胞的流式细胞术
流仪分析灯光发散WKM细胞后的特征53(见补充图。1);染色与hydroxystilbamidine(恩佐生命科学;最终浓度1μg /毫升)被用来排除死细胞。细胞分类使用BD Fortessa II仪器从Dako Cytomation-Beckman库尔特。
RNA提取和互补脱氧核糖核酸的合成
斑马鱼胚胎(5 d.p.f。;3每个基因型个体鱼)在100年被单一化的μL三试剂(σ,猫# 93289)和转移到96毫升深孔板包含一个额外的400μL三试剂。RNA-containing水相是储存在−型80°C,直到完成。DNA提取的间期和有机阶段根据制造商的指示。基因分型后,RNA提取纯合突变体和野生型纯合子的兄弟姐妹。已经没有DNA DNA被撤RNA提取使用涡轮细胞工具包(表达载体,猫# AM1907)。RNA是量化使用量子位RNA海关化验工具包(ThermoFisherScientific,猫# Q32852)和量子位4荧光计(ThermoFisherScientific Q33226)。RNA质量检查通过确定18 s / 28 s rRNA率分析仪使用片段RNA工具包(ThermoScientific,猫# dnf - 471 - 0500)和5200年的片段分析仪系统(ThermoScientific,猫# M5310AA)。互补脱氧核糖核酸数据库准备从1μg信使rna多聚腺苷酸后选择使用TruSeq困mRNA库预科(Illumina公司,猫# 20020595)根据制造商的指示。
RNA序列和RNA-seq数据的计算分析
RNA-Seq执行使用斑马鱼突变体和野生型的兄弟姐妹从每一行。库测序在paired-end 75 bp模式的深度2500万读Illumina公司HiSeq 2500/3000的乐器。读取对齐到参考基因组与明星2.5.2b-1 (Ref。54从运用)和参考注释(Zv10.85,http://www.ensembl.org/info/data/ftp/index.html)。由此产生的排列方式量化在基因层面与featureCounts版本1.6.0.1 (Ref。55)和微分表达式使用DESeq2执行版本2.11.40.1 (Ref。56)。分析策划在星系内部版本的服务器基于星系平台57。所有的工具都使用默认参数,除非另有说明。
单细胞RNA扩增和图书馆准备
单细胞RNA序列使用mCEL-Seq2协议执行,一个自动合成和小型版本的CEL-Seq2蚊子nanoliter-scale机器人(TTP LabTech)36,37。WKM细胞3个月大的野生型和突变体鱼排序根据光散射特性(见补充图。1)和并行处理来减少批量效应在后续处理步骤。八库为每个基因型与96细胞测序每车道Illumina公司HiSeq 2500测序系统(pair-end复用运行)的深度~ 130000 - 200000读取每个细胞。序列进行测序设施的马克斯普朗克研究所Immunobiolgy和表观遗传学。
量化的转录丰度
成对读取对齐到转录组使用bwa (0.6.2-r126版)使用默认参数58。每一对读的正确的伴侣是映射到整体改善的斑马鱼基因模型和92套ERCC spike-ins意义的方向59。斑马鱼基因模型是基于运用释放74 (http://www.ensembl.org)和改进的3 ' UTR注释如前所述60。读取映射到多个位点被丢弃。左边读包含条形码信息:前六基地与独特的分子标识符(UMI)紧随其后6个基地代表细胞特定的条形码。左边的其余部分阅读包含polyT伸展。对于每个细胞条形码,每个记录的umi数量统计和汇总所有记录来自同一基因位点。基于二项统计,观察umi被转化成文本项的数量61年。
RNA单细胞测序数据分析
聚类分析和可视化的数据集是由VarID执行算法38。细胞的总数记录< 1500被丢弃,其余细胞的计数数据被降尺度归一化(补充图。1)。修剪资讯矩阵是推断使用pruneKnn VarID的函数使用默认参数α(设置为1)和no_cores除外(设置为10)。联合分析WT fr105突变体,然而参数pruneKnn函数设置为8。统一歧管近似和投影降维(UMAP)表示用于细胞集群可视化39。确定了两个子组之间的差异表达基因的细胞类似于先前发表的方法62年。首先,负二项分布反映了基因表达的变化在每个子群推断基于预期的记录数变化的背景模型计算RaceID3算法36。使用这些分布的假定值观察记录计数两组之间的差异计算和多个测试Benjamini-Hochberg纠正的方法。评估的微分贡献野生型和突变细胞,我们应用米洛算法48,细胞状态模型基于再重叠社区的邻居图作为丰富的基础测试。可视化,邻居图被映射到UMAP坐标VarID生成的算法。每个库的96个细胞被认为是一个样本。此外,前30名的主成分VarID算法被用来构建再邻居图。
路径分析
使用算法提供的途径进行了分析http://pantherdb.org/(Ref。31日,32),https://reactome.org/(Ref。33)。基因本体论分析进行了描述47。
统计和再现性
所有数据分析和策划执行使用R版本4.1.3或GraphPad棱镜9。流式细胞术,BD FACSDiva v8.0.2。是用于数据收集,FlowJo流仪分析设备上装。
数据可用性
scRNA-seq数据可以发现在NCBI基因表达综合(GEO) (GSE200756)。RNA-seq沉积在NCBI基因表达数据综合(GEO) (GSE214955)。
引用
Wattrus, s . j . & Zon l . i血液在水中:最近使用斑马鱼研究骨髓生物学。咕咕叫。当今。内科杂志。2843-49 (2021)。
Pazhakh,诉& Lieschke g . j .造血生长因子:斑马鱼的场景。生长因子36,196 - 212 (2018)。
戈尔,a . V。,Pillay, L. M., Venero Galanternik, M. & Weinstein, B. M. The zebrafish: A fintastic model for hematopoietic development and disease.威利Interdiscip。启Dev,杂志。7e312 (2018)。
架,j . M。,Lim, S. E. & North, T. E. Hematopoietic stem cell development: Using the zebrafish to identify extrinsic and intrinsic mechanisms regulating hematopoiesis.细胞的方法。医学杂志。138年,165 - 192 (2017)。
Iwanami, N。赫斯,我。,Schorpp, M。&Boehm, T。Studying the adaptive immune system in zebrafish by transplantation of hematopoietic precursor cells.细胞的方法。医学杂志。138年,151 - 161 (2017)。
O ' meara, c·P。et al。T细胞的遗传景观标识为T合成杀伤力。Commun。医学杂志。41201 (2021)。
Iwanami, N。et al。向前斑马鱼的遗传屏幕识别pre-mRNA-processing通路调节T细胞的早期发育。细胞的代表。17,2259 - 2270 (2016)。
Boehm, T。,Bleul, C. C. & Schorpp, M. Genetic dissection of thymus development in mouse and zebrafish.Immunol。牧师。195年投(2003)。
Schorpp, M。et al。守恒的伊卡洛斯在脊椎动物淋巴细胞功能开发:遗传学证据不同的T细胞的幼虫和成虫阶段发展和两个血统斑马鱼的B细胞。j . Immunol。177年,2463 - 2476 (2006)。
Iwanami, N。et al。遗传学证据的进化保守IL-7信号在斑马鱼的T细胞的发展。j . Immunol。186年,7060 - 7066 (2011)。
Lawir, d F。et al。进化从退化过渡到nonredundant细胞因子信号网络支持intrathymic T细胞的发展。Proc。国家的。学会科学。美国一个116年,26759 - 26767 (2019)。
Iwanami, N。et al。继代遗传斑马鱼的幼虫T细胞发育受损。Commun Nat。114505 (2020)。
Lawir D.-F。,Iwanami, N。,Schorpp, M。&Boehm, T。A missense mutation inzbtb17块最早的步骤在斑马鱼T细胞分化。科学。代表。744145 (2017)。
Lawir, d F。Sikora, K。,O ' meara, c·P。,Schorpp, M。&Boehm, T。Pervasive changes of mRNA splicing in upf1-deficient zebrafish identify rpl10a as a regulator of T cell development.Proc。国家的。学会科学。美国一个117年,15799 - 15808 (2020)。
Monnich, M。et al。发展中T淋巴细胞异常敏感缺乏拓扑异构酶IIIα。欧元。j . Immunol。40,2379 - 2384 (2010)。
Soza-Ried C。赫斯,我。,Netuschil, N., Schorpp, M. & Boehm, T. Essential role of c-myb in definitive hematopoiesis is evolutionarily conserved.Proc。国家的。学会科学。美国一个107年,17304 - 17308 (2010)。
吉田,t·乔治欧普罗斯& k·伊卡洛斯的手指在淋巴细胞分化。Int。j .内科杂志。One hundred.,220 - 229 (2014)。
阅读,k。,Jones, D. M., Freud, A. G. & Oestreich, K. J. Established and emergent roles for Ikaros transcription factors in lymphoid cell development and function.Immunol。牧师。300年,82 - 99 (2021)。
Heizmann B。,Kastner, P. & Chan, S. The Ikaros family in lymphocyte development.咕咕叫。当今。Immunol。515,(2018)。
Boutboul D。et al。显性负IKZF1突变导致T、B和骨髓细胞免疫缺陷相结合。j .中国。投资。128年,3071 - 3087 (2018)。
萨因,T。et al。识别IKZF2生殖系monoallelic突变的患者免疫失调。血供订购。6,2444 - 2451 (2022)。
Eskandarian, Z。et al。评估的功能相关性变体在伊卡洛斯家族锌指蛋白1 (IKZF1)一群原发性免疫缺陷患者。前面。Immunol。10568 (2019)。
萨哈,S。,P一个ul, D. & Goswami, R. K. Cyclodepsipeptide alveolaride C: Total synthesis and structural assignment.化学。科学。11,11259 - 11265 (2020)。
山下先生,M。et al。人类艾俄洛斯的一个变体损害适应性免疫通过干扰伊卡洛斯。Immunol Nat。22,893 - 903 (2021)。
Nunes-Santos c J。,Kuehn, H. S. & Rosenzweig, S. D. IKAROS family zinc finger 1-associated diseases in primary immunodeficiency patients.Immunol。过敏中国。北。40,461 - 470 (2020)。
星野,一个。et al。功能IKZF1变异在人类导致免疫失调与后期异常T / B细胞分化有关。科学。Immunol。7eabi7160 (2022)。
吉田,T。,Ng, S.Y.-M. & Georgopoulos, K. Awakening lineage potential by Ikaros-mediated transcriptional priming.咕咕叫。当今。Immunol。22,154 - 160 (2010)。
赫斯,即& Boehm t .活体的成像thymopoiesis揭示动态lympho-epithelial交互。免疫力36,298 - 309 (2012)。
黄,Y。et al。Ikzf1调节通过Ccr9和Irf4斑马鱼胚胎T淋巴细胞增殖。生物。化学。294年,16152 - 16163 (2019)。
王的年代。,他问。,妈,D。,Xue, Y. & Liu, F. Irf4 regulates the choice between T lymphoid-primed progenitor and myeloid lineage fates during embryogenesis.Dev。细胞。34,621 - 631 (2015)。
Mi, H。,Muruganujan, A. & Thomas, P. D. PANTHER in 2013: Modeling the evolution of gene function, and other gene attributes, in the context of phylogenetic trees.诊断。酸Res。41D377-D386 (2013)。
托马斯·p·D。et al。黑豹:让公司系统发生学访问。蛋白质科学。31日8-22 (2022)。
Gillespie, M。et al。2022年reactome通路知识库。诊断。酸Res。50D687-D692 (2021)。
Mattar, P。,Ericson, J., Blackshaw, S. & Cayouette, M. A conserved regulatory logic controls temporal identity in mouse neural progenitors.神经元85年,497 - 504 (2015)。
刘,S。et al。Foxn4是授予/在早中期视网膜颞身份因素能力和参与视网膜突触发生。Proc。国家的。学会科学。美国一个117年,5016 - 5027 (2020)。
Hashimshony, T。et al。highly-multiplexed单细胞RNA-Seq CEL-Seq2:敏感。基因组医学杂志。1777 (2016)。
赫尔曼·j·s . & Grun d FateID推断细胞命运的偏见多能祖细胞从单细胞RNA-seq数据。Nat方法。15,379 - 386 (2018)。
Grun, d .揭示基因表达变化在细胞动力学状态空间。Nat方法。1745-49 (2020)。
白克,E。et al。使用UMAP单细胞可视化数据的降维。Nat。3738-44 (2019)。
Areschoug t &戈登,美国清道夫受体:在先天免疫和微生物发病机制中的作用。细胞。Microbiol。11,1160 - 1169 (2009)。
j·d·菲利普斯血红素生物合成和卟啉症。摩尔,麝猫。金属底座。128年,164 - 177 (2019)。
Koury, m . J。,Sawyer, S. T. & Brandt, S. J. New insights into erythropoiesis.咕咕叫。当今。内科杂志。9,93 - 100 (2002)。
克劳赫,m . O。,Layton, J. E. & Lieschke, G. J. Developmental biology of zebrafish myeloid cells.Int。j . Dev。杂志。46,483 - 492 (2002)。
Di, Q。et al。斑马鱼nephrosin帮助宿主防御大肠杆菌感染。开放杂志。7170040 (2017)。
Kitaguchi, T。,Kawakami, K. & Kawahara, A. Transcriptional regulation of a myeloid-lineage specific gene lysozyme C during zebrafish myelopoiesis.动力机械。Dev。126年,314 - 323 (2009)。
沈,L。et al。识别和描述的克隆NK-like细胞通道鲶鱼(Ictalurus毛虫)。Dev, Comp。Immunol。28,139 - 152 (2004)。
Alexa,。,Rahnenführer, J. & Lengauer, T. Improved scoring of functional groups from gene expression data by decorrelating GO graph structure.生物信息学22,1600 - 1607 (2006)。
丹,E。,Henderson, N. C., Teichmann, S. A., Morgan, M. D. & Marioni, J. C. Differential abundance testing on single-cell data using k-nearest neighbor graphs.生物科技Nat。》。40,245 - 253 (2022)。
威利•c . E。川崎,H。,Amemiya, C. T., Lin, S. & Steiner, L. A.伊卡洛斯表达式作为淋巴祖细胞的标记在斑马鱼的发展。Dev,直流发电机。222年,694 - 698 (2001)。
哦,k . S。et al。双重角色的伊卡洛斯调节巨噬细胞染色质状态和炎症基因的表达。j . Immunol。201年,757 - 771 (2018)。
Dumortier,。,Kirstetter, P., Kastner, P. & Chan, S. Ikaros regulates neutrophil differentiation.血101年,2219 - 2226 (2003)。
Iwanami, N。et al。表观遗传保护Dnmt1的脊椎动物淋巴祖细胞。iScience23101260 (2020)。
特拉弗,D。et al。在斑马鱼体内移植和成像的multilineage移植不流血的突变体。Immunol Nat。4,1238 - 1246 (2003)。
多布林,一个。et al。明星:超速普遍RNA-seq对准器。生物信息学29日,15至21 (2013)。
Sinden, j . D。,Allen, Y. S., Rawlins, J. N. & Gray, J. A. The effects of ibotenic acid lesions of the nucleus basalis and cholinergic-rich neural transplants on win-stay/lose-shift and win-shift/lose-stay performance in the rat.Behav。大脑Res。36,229 - 249 (1990)。
爱,我。,Huber, W. & Anders, S. Moderated estimation of fold change and dispersion for RNA-seq data with DESeq2.基因组医学杂志。15550 (2014)。
Afgan E。et al。银河系的访问平台,可再生的和合作的生物医学分析:2018更新。核酸Res。46W537-W544 (2018)。
李,h &杜宾,r .快速和准确的读与burrows - wheeler变换。生物信息学26,589 - 595 (2010)。
贝克,s . C。et al。外部RNA控制的财团:进度报告。Nat方法。2,731 - 734 (2005)。
破车,j . P。et al。全基因组RNA断层在斑马鱼胚胎。细胞159年,662 - 675 (2014)。
Grun D。,Kester, L. & van Oudenaarden, A. Validation of noise models for single-cell transcriptomics.Nat方法。11,637 - 640 (2014)。
安德斯,s & Huber w .微分表达式分析序列计数数据。基因组医学杂志。11R106 (2010)。
确认
这项工作是支持的马克斯·普朗克协会和欧洲研究委员会(ERC)欧盟第七框架计划(fp7/2007 - 2013),伦理委员会授予协议323126 t . b .支持D.G.是由德国研究基金会(DFG)提供(GR4980/3-1)和Behrens-Weise-Foundation。我们还要感谢马克斯普朗克研究所的成员´s鱼内部设施,深度测序设备,成像设备,和奥利弗·托马斯和马吕斯镶嵌地块和生物信息学核心成员的专家建议和支持。
资金
开放获取资金启用并由Projekt交易。
作者信息
作者和联系
贡献
I.H.硕士建立了fr105突变;I.H.,M.S. and C.O´M. characterized the phenotypes ofikzf1突变体。中央局´M。RNA-seq进行实验;美国和分析scRNA-seq实验进行。D.G.监督scRNA-seq实验。所有作者分析数据。结核和修改后的文章中写道的输入所有的合作者。结核病的构思和监督学习和获得资金。
相应的作者
道德声明
相互竞争的利益
作者宣称没有利益冲突。
额外的信息
出版商的注意
施普林格自然保持中立在发表关于司法主权地图和所属机构。
权利和权限
开放获取本文是基于知识共享署名4.0国际许可,允许使用、共享、适应、分布和繁殖在任何媒介或格式,只要你给予适当的信贷原始作者(年代)和来源,提供一个链接到创作共用许可证,并指出如果变化。本文中的图片或其他第三方材料都包含在本文的创作共用许可证,除非另有说明在一个信用额度的材料。如果材料不包括在本文的创作共用许可证和用途是不允许按法定规定或超过允许的使用,您将需要获得直接从版权所有者的许可。查看本许可证的副本,访问http://creativecommons.org/licenses/by/4.0/。
关于这篇文章
引用这篇文章
赫斯,我。,Sagar,O´Meara, C.et al。Stage-specific和细胞特定类型的需求ikzf1在斑马鱼造血的分化。Sci代表1221401 (2022)。https://doi.org/10.1038/s41598 - 022 - 25978 - 6
收到了:
接受:
发表:
DOI:https://doi.org/10.1038/s41598 - 022 - 25978 - 6