摘要
心肌梗死(MI)后,心脏对缺血损伤和相关心肌细胞损失的修复反应包括心肌纤维化,其中受损组织被纤维瘢痕取代。虽然瘢痕对于防止梗死区心室壁破裂是必不可少的,但随着时间的推移,它会扩展到偏远的非梗死区,显著增加纤维化程度并显著改变心脏结构。在这种情况下,心脏功能恶化,从而增加心力衰竭的概率和死亡的风险。最近的研究表明,已知参与纤维化的基质细胞蛋白periostin是mi诱导的纤维化和重塑调节的候选治疗靶点。以往提出了不同的骨膜蛋白基因操纵策略,但这些工作都没有正确地解决骨膜蛋白活性与心脏纤维化之间的时间依赖性。我们的研究旨在填补这一知识空白,并充分阐明梗死心脏中细胞骨膜蛋白上调的明确时间,以使心肌梗死后更安全、更有效地靶向产生骨膜蛋白的细胞。C57BL/6J和BALB/c小鼠通过结扎左冠状动脉前降支进行手术性心肌梗死。来自梗死心脏的细胞的流式细胞术分析和总细胞RNA的定量实时PCR显示,骨膜蛋白的表达在2-7天增加,并在梗死后第7天达到峰值,与小鼠品系无关。心肌梗死后心脏细胞骨膜蛋白表达的既定时间表是发展最佳骨膜蛋白靶向基因治疗的重要里程碑。
介绍
心力衰竭是一种临床综合征,全世界有超过2500万人受到影响1,2。心衰通常由冠状动脉闭塞引起的心肌梗死(MI)引起,导致梗死区域心肌细胞广泛缺氧诱导死亡3.。因为成年人心脏的再生能力有限4,在伤口愈合过程中,因心肌梗死而丢失的细胞被驻留的成纤维细胞所取代。在整个过程中,巨噬细胞通过清除碎片和释放生长因子(GFs)来启动伤口修复。在分泌GFs的间接旁分泌信号的影响下,成纤维细胞被招募到损伤部位,并被激活增殖并向细胞外基质(ECM)分泌I型和III型胶原。激活的成纤维细胞转化为表达α平滑肌肌动蛋白(αSMA)的肌成纤维细胞5,胶原蛋白继续沉积,形成称为纤维化的纤维瘢痕6,7。所谓的置换纤维化过程,即瘢痕形成,是防止缺血损伤后心室壁动脉瘤破裂的必要过程8。然而,由于壁薄导致的机械应力增加,加上特定的激素和旁分泌介质,诱导纤维化进一步扩展到遥远的心脏区域。这种发生在梗死边缘区和远端未损伤心肌的反应性纤维化过程负责组织的重塑。然而,重塑的组织表现出腔室顺应性的改变和心室僵硬度的增加,这降低了心排血量,最终导致心力衰竭和死亡风险的增加7,9。
研究表明,骨膜蛋白是一种90 kda的非结构性基质细胞蛋白10,11,是心肌梗死诱导纤维化的主要效应因子12,13,14。虽然健康心肌中不存在骨膜蛋白,但病理性损伤(如心肌梗死)会刺激被激活的成纤维细胞产生骨膜蛋白,并将其分泌到ECM15。骨膜蛋白与胶原蛋白水平的增加呈正相关13,14,并在纤维化相关肥厚性心肌病小鼠模型中上调2。此外,骨膜蛋白与纤维胶原蛋白的相互作用,无论是直接的还是在特化蛋白的帮助下,都介导了ECM中的胶原交联。这不仅促进了疤痕的沉积和稳定,而且还确保了组织中骨膜的持续存在16。由于这些原因,骨膜蛋白已被标记为调节纤维化的候选治疗药物,以解决病变心脏不良重塑的相关问题17,18。
尽管心肌梗死后骨膜蛋白靶向具有潜在的健康益处,但该技术尚未适当适应伤口愈合的相关阶段。尽管据报道在小鼠中完全去除骨膜蛋白可以减少心肌梗死诱导的纤维化并改善心室功能,但它也与壁破裂发生率的增加有关2,19,危及他们在早期愈合阶段(心肌梗死后的前10天)的生存。这两种混杂的情况都涉及到骨膜蛋白的表达,对比了骨膜蛋白在心肌梗死后短期内的积极作用(促进伤口愈合)和长期的消极作用(刺激反应性纤维化)。12。或选择性消融Postn在心肌梗死后7-14天执行的表达-心肌成纤维细胞(CFs)忽略了反应性纤维化可能更早发生的可能性20.,因为成纤维细胞激活开始于第2天,之后成纤维细胞在第4天转变为肌成纤维细胞21。为了在不损害疤痕稳定性的情况下尽量减少重塑的程度,骨膜蛋白的调节必须精确地进行。
因此,在本研究中,我们旨在阐明心肌梗死后骨膜蛋白表达的时间轴,以最大限度地发挥基于时间的骨膜蛋白操作的治疗效果。本文介绍了心肌梗死后骨膜蛋白产生的有限时期,重点介绍了心肌梗死后骨膜蛋白基因及其蛋白的水平细胞这是骨膜蛋白最初产生的地方,而不是量化其在组织中的水平22,这可能导致估算不准确。在本研究中,C57BL6J和BALB/c小鼠通过左冠状动脉结扎进行手术性心肌梗死。随后,在选定的时间点定量骨膜蛋白,首先通过从组织中提取的mRNA表达进行定量23(包括所有类型的细胞),然后通过细胞蛋白表达,特别是在心脏成纤维细胞中。结果显示,心肌梗死后2 ~ 7天,骨膜蛋白基因和蛋白表达均增加,且在7天达到最大表达量。第14天,骨膜蛋白产量相对较低。心肌梗死后心脏细胞骨膜蛋白表达的既定时间线有助于设计更好的骨膜蛋白靶向基因治疗,这将对应于干预的最佳时间框架。这可能在不影响壁稳定性的情况下改善心脏修复。
材料与方法
有关这些方法的其他详细信息,请参见补充信息。
动物
C57BL/6J和BALB/c雌性小鼠,11-12周龄,体重22-30 g,购自Envigo公司(Jerusalem, Israel)。所有实验都是在内盖夫本-古里安大学动物护理和使用委员会的批准下进行的,并符合arrival指南。这项研究是在两种小鼠品系上进行的:C57BL/6J和BALB/c,这两种品系通常用于心肌梗死研究。虽然C57BL/6经常用于基因操纵模型,但BALB/c雌性小鼠被证明更适合用于心肌梗死后期的研究,因为与雄性和其他小鼠品系相比,它们的梗死破裂率更低,心脏重塑更明显24。
实验性心肌梗死(MI)
采用永久性结扎左前降支(LAD)诱发心肌梗死。异氟醚(3-5%)的混合物2麻醉小鼠,用异氟醚(2-2.5%与O2),如上文所述,使用啮齿动物呼吸机23。通过第四肋间隙左侧开胸手术打开小鼠胸部,取出心包,用8-0聚丙烯壁内缝合永久闭塞左冠状动脉主干。成功的动脉闭塞通过心肌立即变色可见,并在闭塞后24-72小时通过超声心动图进一步验证。超声心动图麻醉时,先用3%异氟醚和0.5 L/min 100% O混合麻醉2后将异氟醚浓度降至1.5%,维持稳态镇静水平。超声心动图使用市售超声心动图系统(Vevo 3100, VisualSonics, Toronto, ON, Canada)进行。心脏首先在左室胸骨旁长轴和短轴视图的2D模式下成像。在乳头肌水平获得m型图像。在测试过程中,要小心避免对老鼠施加过大的压力。然后对胸骨旁长轴图像进行LV TRACE分析。左室射血分数EF (Left Ventricular Ejection Fraction),表示每次收缩时离开心脏的血液百分比,由系统自动计算为EF% = [(LVEDV−LVESV)/LVEDV] × 100,其中LVEDV为左室舒张末期容量,LVESV为左室收缩末期容量。EF测量值为连续三个心脏周期的平均值。表现出可见收缩损伤的C57BL/6J小鼠和EF值低于40%的BALB/c小鼠被批准进行研究。有关这些方法的其他详细信息,请参见补充信息。
组织处理和激光捕获显微解剖(LCM)
如前所述,在心肌梗死后的几个不同时间点,C57BL/6J雌性小鼠在深度麻醉下被处死23,取出的心脏被横向切成两段(顶端和中间部分),立即在冰冷的磷酸盐缓冲盐-二乙基焦碳酸盐(PBS-DEPC, BI, Kibbutz Beit-Haemek,以色列)中清洗,并嵌入最佳切割温度的化合物(OCT, Sakura (Alphenaan den Rijn))中。样品在N液中快速冷冻2在- 80°C保存,直到切片。用Leica 3500S低温恒温器(Leica, Germany)将冷冻的小鼠心脏切成10 μm厚的切片。切片置于PALM Technologies (Bernreid, Germany)预处理过的膜载玻片上,并在24小时内处理。冷冻切片用19甲酚紫染色核,用70%乙醇冷冻2-3分钟,浸在冰冷的DEPC RNase-free水中去除oct。载玻片浸在甲酚紫中15 s;在吸水性表面上去除多余的污渍,用70%和100%乙醇浸泡。样品风干后,使用PALM激光显微解剖系统(蔡司)进行LCM。切割的元件被弹射到位于截面正上方的胶粘帽中。左心室损伤区域(MI区)在第4-7天为核密度较高(由于炎症细胞浸润)的区域,而在第14-28天为疤痕区域边界。
逆转录聚合酶链反应定量分析
LCM样品中总RNA采用miRNeasy Micro Kit (Qiagen)进行分离。逆转录(cDNA合成)使用高容量cDNA逆转录(RT)试剂盒(Applied Biosystems, Foster city, CA)根据制造商的协议进行,初始RNA量为100 ng(由NanoDrop™测量)。qPCR采用Taqman基因表达测定(thermal -fisher, TableS1), qPCR结果采用管家基因(内源性对照:HPRT)归一化。对于基因表达分析,使用StepOnePlus™应用检测系统,根据制造商的比较说明ΔΔCT(应用生物系统公司),通过实时PCR测定mRNA水平。每个10 μl反应含有2 μl cDNA (5 ng)。有关这些方法的其他详细信息,请参见补充信息。
细胞提取和流式细胞术
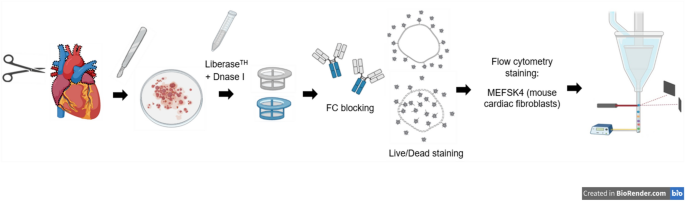
在心肌梗死后不同时间点用异氟醚处死C57BL/6J和BALB/c雌性小鼠。通过以下步骤从提取的心脏中分离出CFs:首先,在冷PBS中洗涤心脏,同时连续按压以去除过多的血液。切除主动脉和心房,每颗心脏切成约2毫米的碎片,悬浮在3ml 1mg /ml Liberase酶液中®高热溶素(Sigma-Aldrich-Merck, Rehovot, Israel)和10 μM氯化钙2在HBSS中,插入DNAse I(40µg/ml, StemCell Technologies)以减少聚集物。使用5ml移液管将全部内容物移液12次,并放入轨道培养器摇床15分钟(85 RPM, 37°C)。移液和摇液重复2次,摇液时间为45分钟。然后用1000 μl的移液器再移液30次。消化后的组织通过70µm细胞过滤器过滤,然后进行低速离心(50 g, 2 min, RT),以排出沉淀的心肌细胞、细胞团块和剩余的未消化组织。通过40 μm过滤器(450 g, 4 min, 4°C)进行第二步过滤后,用PBS洗涤细胞颗粒,并悬浮在EDTA流式细胞仪缓冲液中(PBS (BI)添加2%胎牛血清(FBS, BI)和1 mM EDTA (Sigma-Aldrich-Merck))。从这一刻起,在流式细胞仪样品制备的整个过程中,新鲜分离的细胞被保存在冰上,并避免光照。为了防止FC抗体区域与FC受体的非特异性结合,细胞与FC阻滞剂溶液[抗小鼠CD16/CD32 (1:50;克隆93,Biolegend)在流式细胞仪缓冲液中稀释(PBS添加2%胎牛血清)]5分钟。然后使用LIVE/DEAD™可固定紫色死亡细胞染色试剂盒(Thermofisher Scientific)来区分活细胞/死细胞。为了使MEFSK4表面标记物染色,用apc偶联的MEFSK4大鼠抗体(1:10,130-102-900,Miltenyi Biotec, Bergisch Gladbach, Germany)孵育细胞30分钟。以apc偶联正常IgG1大鼠抗体(1:10,130-102-646,Miltenyi Biotec)为同型对照。 Next, cells were fixed in 3.7% formaldehyde (Sigma-Aldrich-Merck) for 15 min, permeabilized with BD Perm/Wash™ Buffer (1:10, 554714, BD Biosciences, San Jose, CA), and, to stain the periostin, incubated for 30 min with Alexa Fluor®488结合骨膜蛋白小鼠抗体(1:50,sc-398631,圣克鲁斯生物技术,达拉斯,德克萨斯州)。Alexa萤石®以488偶联正常IgG1小鼠抗体(1:50,sc-3890, Santa Cruz)为同型对照。在流式细胞仪缓冲液中重悬,细胞样本使用BD FACSAria™III和BD FACSDiva软件版本8.0.1 (BD Biosciences)进行分析。FlowJo(版本10)用于数据分析:与测试标记之一的同型对照相比,表现出更高荧光水平的活细胞被认为是该标记的阳性。为了验证细胞鉴定的可信度,还通过ImageStreamX Mark II (Amnis, Seattle, WA)对未染色的细胞进行分析。细胞采集和分析使用inpe应用程序,版本6.0。
统计分析
使用GraphPad Prism版本6.01 for Windows (GraphPad Software, San Diego, CA)进行统计分析。定量基因表达结果采用单因素方差分析(one-way ANOVA)与Kruskal-Wallis多元比较检验进行比较,以多次(n≥3次)独立实验的均数±标准差(mean±standard deviation, SD)表示。描述mi后离体数据的直方图以每组n = 3只小鼠的均值±SD表示。P < 0.05为差异有统计学意义。
结果
在初步实验中,活化的CFs首次在细胞培养中观察到骨膜蛋白的表达(补充信息).用TGF-β1刺激健康C57BL/6J雄性小鼠的原发性CFs 24-48小时,TGF-β1与心肌梗死后心脏纤维化相关3.,6,8。结果表明,骨膜蛋白和α-SMA基因表达增加(补充图)。S1-S2).TGF-β1刺激与这些纤维化基因表达之间的相关性表明,它们是缺血性心脏成纤维细胞活化特征的代表性指标3.,6,8。在我们的研究结果中,骨膜蛋白是最显著上调的基因,这促使我们探索其在心肌梗死后心脏纤维化中的相关性。
基因分析鉴定梗死区骨膜蛋白上调的时间轴
作为阐明心肌梗死后骨膜蛋白细胞表达准确时间的第一步,我们对从C57BL/6J雌性小鼠梗死心肌组织获取的细胞进行了qRT-PCR(图5)。1).使用前面描述的LCM系统23在心肌梗死后的几个时间点,我们分别从左心室心肌壁采集了两个组织切片——损伤(梗死)区和远端区。提取RNA,通过qRT-PCR评估骨膜蛋白的基因表达时间轴(以及基于TGF-β1激活的成纤维细胞中的初步结果的纤维化基因Col1a和α-SMA)。在心肌梗死区(MI),骨膜蛋白基因表达水平在心肌梗死后第4天强烈升高(与健康心肌相比增加了200多倍),并持续上升至第7天,之后下降(第14天)。到第28天,骨膜蛋白的基因表达水平恢复到非缺血状态,而在远端心肌(RZ),其在所有时间段的表达水平均可忽略不计(图。1A). Col1a和α-SMA基因表达水平随着时间的推移呈现出更持久的倾斜,一直持续到第28天,最显著的是在心肌梗死区(图1)。1B,C)由于该区域的激活细胞表型。
小鼠心脏成纤维细胞的提取与鉴定
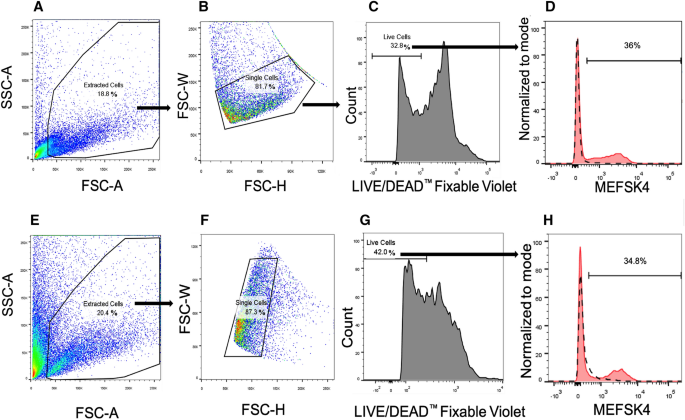
目的探讨成人缺血性心脏骨膜蛋白上调是否主要由活化的成纤维细胞引起5,12,15,25,26,我们旨在加强所描述的心肌梗死后骨膜蛋白表达的时间轴,特别是在CFs中。为此,我们专注于获得一种适合于流式细胞术分析的细胞复合物,从而能够鉴定成纤维细胞并定量其中的骨膜蛋白表达水平。因此,从野生型雌性小鼠的整个心脏(C57BL/6J和BALB/c)中提取CFs的方法得到了优化(图。2):消化后的细胞悬液首先在FSC-A、SSC-A图中进行门控,以排除细胞碎片(图2)。3.A, E)。在FSC-A中,细胞碎片的分类低于50k,为了避免大量的细胞丢失,并验证在该策略下只忽略了碎片,还用成像流式细胞仪观察了原代细胞悬液(图2)。4).亮场(透射)和暗场(侧散射)图像使我们能够分别从大小、形态和粒度上定性地区分孤立细胞和细胞碎片(图。4A、B)。记录和聚焦的事件都按照亮场图像的面积(对应于FSC-A)与亮细节强度(对应于SSC-A)绘制在一起,并应用了所描述的门控策略(在面积轴上,细胞碎片被分类为低于50k)。事实上,超过90%的门控碎片被识别为细胞碎片(数据未显示),从而证明了所提出的方法排除碎片的可行性。在碎片清除后,FSC-H、FSC-W图中的单个细胞被门控以去除细胞簇(图2)。3.B, F)。随后,活细胞被暗淡的live /DEAD™固定信号荧光识别(图2)。3.C、G)。最后,为了鉴定成纤维细胞亚群,对活细胞表面进行MEFSK4染色,MEFSK4是小鼠心脏驻留成纤维细胞的已知标记物,与它们的激活状态无关27,28,29(无花果。3.D, H)。在两种雌性小鼠品系中,约35%的活细胞为MEFSK4阳性,因此,它们被归类为成纤维细胞。
心肌MEFSK4 +代表流式细胞术分析的小鼠心脏成纤维细胞亚群。(模拟C57BL/6J雌性小鼠健康心脏的流式细胞术分析代表图及定量分析(n=3): (一个) FSC-A中低于50 k的细胞碎片在FSC-A和SSC-A中被排除,并且(B) FSC-H和FSC-W的细胞簇均消失;(C)根据相应的直方图,用较弱的live /DEAD™固定紫荧光染色选择活细胞;最后,(D)从活细胞群体中量化MEFSK4+细胞的百分比,心脏MEFSK4+代表小鼠心脏非心肌细胞中的成纤维细胞亚群。(超高频BALB/c小鼠健康心脏的流式细胞术分析代表性图及定量(n=3): (E) FSC-A中低于50k的细胞碎片在FSC-A和SSC-A中被排除,并且(F) FSC-H和FSC-W的细胞簇均消失;(G)根据相应的直方图,用较弱的live /DEAD™固定紫荧光染色选择活细胞;最后,(H)测定心肌MEFSK4+细胞的活细胞百分比(%);心脏MEFSK4+细胞构成小鼠心脏非心肌细胞的成纤维细胞亚群。
流式细胞术检测慢性疲劳患者骨膜蛋白上调时间线
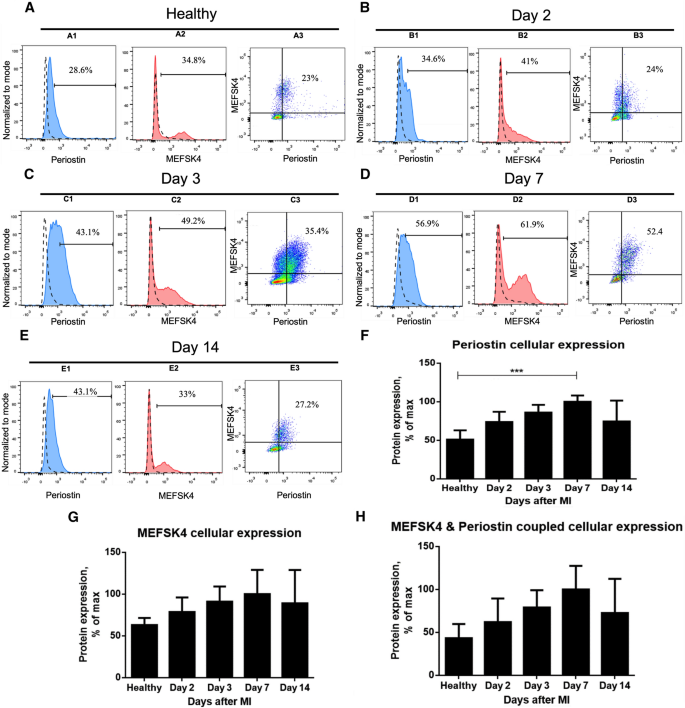
为了建立心肌梗死后CFs中骨膜蛋白上调的代表性时间轴,在心肌梗死后不同时间点从MI诱导的野生型BALB/c雌性小鼠中提取CFs(图2)。5).未接受心肌梗死手术的健康小鼠作为非病理性心脏组织中标准蛋白表达的参考。流式细胞术结果显示,心肌梗死后2天开始,心肌梗死后7天心肌梗死后心肌骨膜蛋白表达水平升高(在产生的活细胞群中,骨膜蛋白表达细胞的相对部分)(图。5A1-D1),表明成纤维细胞活化。根据基因分析报告的时间轴(图;1A), 7 d后骨膜蛋白表达开始下降(图。5E1)。此外,其表达水平在心肌梗死后3 - 7天达到最高水平,并在第7天达到相当高的峰值(图2)。5C1-D1),从而加强梗塞心脏主要骨膜蛋白上调的特定时间框架(图。5F).预期,因为心肌梗死后,骨膜蛋白被认为是由活化的成纤维细胞特异性表达5,12,15,20.,25,26当将骨膜蛋白表达聚焦于同样表达MEFSK4的细胞时,骨膜蛋白表达时间线被保留:心肌梗死后3天,同时表达MEFSK4和骨膜蛋白的细胞数量显著增强(图5)。5C3与图的比较。5A3),继续增长至心肌梗死后7天(图。5D3)。第14天,种群规模也减少了(图2)。5E3),总体上与上述梗死心脏骨膜蛋白上调的时间线相关(图。5H与图的比较。5F).与骨膜蛋白相似,MEFSK4的表达在心肌梗死后的前3天适度升高(图。5A2-C2),随后在第7天出现明显的峰值,达到最大速率(图。5D2)。MEFSK4的表达与细胞活化无关28,事实上,其上调并没有被骨膜蛋白上调所抑制(图。5D1,D2),这种升级最有可能是成纤维细胞增殖的结果,已知成纤维细胞增殖是对侮辱的反应,与骨膜蛋白平行21。心肌梗死后14天,MEFSK4表达再次降低(图2)。5E2),标志着mi后上调趋势的结束(图。5在每个时间点,与骨膜蛋白+相比,更大的MEFSK4+群体也可以通过MEFSK4抗体识别小鼠CFs来解释,而不管它们的激活状态如何,因为细胞最初是从制备好的整个心室提取物中收获的(图。2)和未激活的成纤维细胞(骨膜蛋白阴性)也包括在分析中。心肌梗死后对C57BL/6J小鼠品系的分析推断出的蛋白表达时间线(图;S3G-I)与BALB/c小鼠中描述的相似(图2)。5F-H)。骨膜蛋白继续上升,直到第7天达到峰值,最终在MI后第14天下降,基因和蛋白质分析都显示。在明确心肌梗死后骨膜蛋白的活动期时,这些发现可能意味着一个适当的纤维化调节治疗的干预时间框架。
讨论
在本研究中,我们首次提出梗塞心脏中骨膜蛋白产生上调的明确时间轴。鉴于骨膜蛋白在细胞-基质交叉中的中介作用及其与纤维增生性心肌疾病的关系,骨膜蛋白在试图调节心肌梗死后心脏重塑的研究中引起了广泛关注17,18,30.。尽管骨膜蛋白操作技术已经在各种背景下进行了讨论2,19,20.在美国,骨膜蛋白靶向的正确时机和持续时间尚未得到深入研究。这些参数的阐明构成了骨膜蛋白治疗发展的重要一步30.,研究结果证实,一方面,骨膜蛋白完全缺失导致心肌梗死后心室壁破裂,另一方面,骨膜蛋白过表达加剧了心脏重塑2,19。本研究通过定量估计C57Bl/6J和BALB/c小鼠模型手术后一段特定时间内骨膜蛋白表达的产生,揭示了经常被忽视的骨膜蛋白表达的限时性。
通过测量的水平Postn基因,而不是组织中的蛋白,我们能够排除在ECM中积累的骨膜蛋白22并将结果缩小到只包括细胞合成过程中的骨膜蛋白,以获得更准确的报告。我们发现C57Bl/6J小鼠心肌梗死区periostin mRNA表达在心肌梗死后4-7天显著升高,14天下降。从1型胶原蛋白上调时间和翻倍率与骨膜蛋白基因表达的相容性来看,在所有不同类型的细胞中,观察到的骨膜蛋白基因表达趋势可能代表了胶原蛋白产生细胞,即活化的CFs。在骨膜蛋白下调的14-28天,1型胶原蛋白和α-SMA大量表达,表明肌成纤维细胞来自活化的成纤维细胞5,31,32。这一发现支持了有争议的主张33骨膜蛋白标记激活的成纤维细胞5,12,15,25,26而不是肌成纤维细胞。
流式细胞术分析鉴定了从健康心脏中提取的35%的非心肌细胞为成纤维细胞。这些结果支持了先前的研究结果,即成纤维细胞在非心肌细胞内容物中占少数28,34。然而,有趣的是,研究人员报告称,成纤维细胞占非心肌细胞群的比例甚至更低,约为15%28。考虑到成年小鼠心脏中心肌细胞频率的广泛差异(从所有细胞的25%到35%),这种差异是意料之中的28),而且MEFSK4抗体识别成熟CFs及其胚胎对应物(通常被称为常驻间充质细胞)的能力。使用额外的标记可以增加成纤维细胞的特异性。
在梗死心脏中,MEFSK4在CFs上的表达不受其激活的影响。在每个特定时间点,骨膜蛋白+ MEFSK4 +细胞计数较骨膜蛋白+细胞计数低,部分原因可能是由于瓣膜间质细胞(VICs)的骨膜蛋白表达。虽然vic被归类为成纤维细胞,但它们被认为起源于经历了上皮细胞向间充质转化(EMT)的内皮细胞。15,20.,35,36这使得它们与心肌的常驻成纤维细胞有所不同,后者来源于间充质谱系,并被MEFSK4识别28,37。在心脏健康发育的早期阶段,已经在vic上发现了骨膜蛋白36也可以解释其在MI触发缺失时的表达(图。5A1、A3)。此外,在全心室提取物的CFs中发现的骨膜蛋白表达时间线与相应梗死区域所有细胞的上述基因表达时间线几乎相同。这一观察证实了活化的成纤维细胞是心肌梗死后骨膜蛋白上调的主要驱动力,因此,它们是一种有希望的基于骨膜蛋白的治疗靶点,旨在调节心肌梗死诱导的纤维化和重塑。此外,它验证了这些成纤维细胞的主要位置为梗死区域。尽管如此,心肌梗死后第7天的骨膜蛋白表达在巨噬细胞中也有记录38,因为它们可能具有成纤维细胞样表型,可能标志着它们在这个特定的时间点是骨膜蛋白的潜在靶点。
在两种试验小鼠(C57Bl/6J和BALB/c)中观察到的骨膜蛋白时间线的相似性表明,在这些心肌梗死诱导的小鼠模型中,心脏骨膜蛋白表达具有重要的稳定性,这保证了它们与进一步的心肌梗死后骨膜蛋白研究的相关性。从心室不稳定(主要记录在C57Bl/6J)和心脏重塑(主要是BALB/c模型的特征)两方面探讨和理解骨膜操作可能的医学意义的必要性,强调了这一保证的重要性。24。然而,值得注意的是,我们观察到的两种菌株在初始骨膜蛋白+细胞群大小上的差异预测了它们对骨膜蛋白靶向治疗的个体反应的可能变化,但这些差异的影响如何最终改变个体对治疗的反应仍有待澄清。
在梗死心脏细胞水平上建立骨膜蛋白表达时间轴是没有先例的,因为它不受ECM中骨膜蛋白积累的影响,因此最准确地反映了其上调期。通过简单的流式细胞术方法,我们获得了心肌梗死后骨膜蛋白操作的明确时间框架,并证明它支持Fu等人提出的瘢痕形成下成纤维细胞的四种分化状态。21。基于这个时间框架,骨膜蛋白靶向策略(特别是通过直接细胞靶向20.)可优化设计,以提高治疗的效果,并尽量减少不良后果。然而,时间线的持续时间相对有限,不超过6天(MI后2-7天),可能会使一些拟议的战略变得无关紧要。为此,我们认为siRNA系统非常适合基于骨膜蛋白的基因治疗,因为它可以使骨膜蛋白抑制与心肌梗死后骨膜蛋白表达的时间线很好地保持一致。因此,我们打算在我们正在进行的关于骨膜蛋白在心肌梗死后心脏纤维化中的作用的研究中进一步研究这一选项。由于siRNA系统本身在治疗短期过程中具有治疗效果,有望促进伤口愈合而不发生进行性纤维化,从而为心肌梗死后改善心脏预后奠定基础。与siRNA类似,当干预需要限制在时间或间隔内时,药物特别适合。已知PNDA-3结合骨膜蛋白的FAS1结构域,干扰其功能39因此,在讨论有时间限制的骨膜素抑制时,可能是另一种首选策略。
学习优势与局限
这项研究的结果仅限于使用雌性小鼠。由于女性的存活率更高,这种做法仅限于女性,因为男性在心肌梗死后的前3天已经表现出明显的心室扩张40,41,从而增加了心脏破裂的可能性42,43,44。此外,LAD结扎的可变性可能影响梗死的位置和强度,可能影响纤维化基因的表达水平。然而,这种手术心肌梗死模型的优势在于它能够最恰当地模拟冠状动脉闭塞的临床情况。最后,细胞提取过程产生了心脏中所有的非心肌细胞群,使得成纤维细胞从其他细胞类型中分化相对困难。在这项研究中,我们只使用了一种标记来鉴定成纤维细胞,这不是最佳的。
数据可用性
支持本研究结果的所有数据都可以在文章及其补充信息文件中找到。
缩写
- αSMA:
-
平滑肌肌动蛋白
- 慢性疲劳综合症:
-
心脏成纤维细胞
- ECM:
-
细胞外基质
- 女友:
-
生长因子
- 产生HPRT:
-
次黄嘌呤鸟嘌呤磷酸核糖转移酶
- 工业区:
-
(心肌的)梗死区
- 中国大陆:
-
激光捕获显微解剖
- LV:
-
左心室
- 小姐:
-
心肌梗死
- pcf:
-
原代心脏成纤维细胞
- PDGF:
-
血小板衍生生长因子
- RZ:
-
(心肌的)边远区
- 转化生长因子-β1:
-
转化生长因子β -1
- 维克:
-
瓣膜间质细胞
参考文献
Savarese, G. & Lund, L. H.心力衰竭的全球公共卫生负担。卡。失败。牧师。3., 7-11(2017)。
奥卡河,T。et al。骨膜蛋白表达的基因操纵揭示了心肌肥厚和心室重塑的作用。中国保监会Res。101, 313-321(2007)。
wada H. K. Hwang M. P. Wang Y.心肌梗死后心脏全面修复和再生:考虑的方面和蛋白质传递。生物材料82, 94-112(2016)。
蔡斯伯格,M. & Kalluri, R.组织纤维化的细胞机制。1.与组织纤维化相关的常见和器官特异性机制。点。j .杂志。细胞杂志。304, c216-c225(2013)。
Forte, E., Furtado, M. B. & Rosenthal, N.间质在心脏修复中的作用:免疫-基质细胞相互作用。Nat. Rev. Cardiol。15, 601-616(2018)。
塔尔曼,V. &鲁斯科霍,H.心肌梗死中的心肌纤维化-从修复和重塑到再生。细胞组织测定。365, 563-581(2016)。
心脏纤维化、梗死瘢痕形成和伤口愈合的常见线索。纤维形成组织修复5, 1-11(2012)。
心肌梗死中的成纤维细胞:炎症和修复中的作用。摩尔细胞心脏。70, 74-82(2014)。
韦兰,R. S., Kaplinskiy, V. & Kitsis, R. N.细胞死亡在心脏病的发病机制:机制和意义。为基础。启杂志。72, 19-44(2010)。
Takeshita, S., Kikuno, R., Tezuka, K. & Amann, E.成骨细胞特异性因子2:一种与昆虫蛋白束蛋白同源的骨粘附蛋白的克隆。物化学。J。294, 271-278(1993)。
Horiuchi, K。et al。一种新型蛋白,骨膜蛋白的鉴定和表征,其在骨膜和牙周韧带中受限表达,并通过转化生长因子β增加表达。挖骨者。Res。14, 1239-1249(1999)。
康威,s.j.。et al。骨膜蛋白在健康和疾病组织重塑中的作用。细胞Mol生命科学71, 1279-1288(2014)。
米尼库奇,文学硕士et al。骨膜蛋白作为心肌梗死后慢性心脏重塑的调节剂。诊所68, 1344-1349(2013)。
赵,S。et al。骨膜蛋白表达上调与衰竭心脏心肌纤维化相关。j .心功能杂志。63, 373-378(2014)。
斯奈德,P。et al。心脏成纤维细胞的起源和骨膜蛋白的作用。中国保监会,Res。105, 934-947(2009)。
内夫,l。s。Bradshaw, a。d。你发誓?胶原蛋白在心脏健康和疾病中的交联作用手机信号79, 109889(2021)。
史丹斯菲尔德,安徒生,邓瑞敏,周志强,周志强。骨膜蛋白是衰竭心脏在实验和临床卸荷后心脏重构的新因素。安。Thorac。杂志。88, 1916-1921(2009)。
Teekakirikul, P。et al。肥厚性心肌病小鼠心肌纤维化由非心肌细胞增殖介导,需要Tgf-β。j .中国。Investig。120, 3520-3529(2010)。
Schwanekamp, J。et al。TGFBI的功能类似于骨膜蛋白,但在心脏损伤中是唯一可有可无的。《公共科学图书馆•综合》12, e0181945(2017)。
考尔,H。et al。靶向切除表达骨膜蛋白的活化成纤维细胞可防止小鼠不良心脏重塑。中国保监会,Res。118, 1906-1917(2016)。
傅,X。et al。特化成纤维细胞分化状态是梗死小鼠心脏瘢痕形成的基础。j .中国。Investig。128, 2127-2143(2018)。
Razin, T。et al。心肌梗死后心肌成纤维细胞依赖白细胞介素1α存活与StAR/STARD1表达及心肌重构和功能改善有关。摩尔细胞心脏。155, 125-137(2021)。
Bejerano, T., Etzion, S., Elyagon, S., Etzion, Y. & Cohen, S.纳米颗粒传递mirna-21模拟物到心脏巨噬细胞改善心肌梗死后心肌重构。Nano。18, 5885-5891(2018)。
范登伯恩,s.w.m.。et al。小鼠品系决定心肌梗死后创面愈合效果。Cardiovasc。Res。84, 273-282(2009)。
多普勒美国。et al。心脏成纤维细胞:不仅仅是机械支持。j . Thorac。说。9, s36-s51(2017)。
Hortells, L。et al。一种特殊的表达骨膜蛋白的心脏成纤维细胞有助于出生后心肌细胞的成熟和神经支配。PNAS117, 21469-21479(2020)。
Ivey, m.j. & Tallquist, m.d.定义心脏成纤维细胞。中国保监会。J。80, 2269-2276(2016)。
平托,a。R。et al。回顾心脏细胞组成。中国保监会,Res。118, 400-409(2016)。
陈,G。et al。Sca-1(+)心脏成纤维细胞促进心力衰竭的发展。欧元。j . Immunol。48, 1522-1538(2018)。
兰德里,n.m.,科恩,S.和迪克森,i.m.c.牙周素在心血管疾病和发展:两个不同角色的故事。基本的有氧运动。113, 1(2018)。
Bartold, P. M. & Raben, A.生长因子调节成纤维细胞在模拟伤口愈合。J.牙周治疗。31, 205-216(1996)。
米德伍德,K. S., Valenick, L. W. & Schwarzbauer, J. E.组织修复和细胞外基质的动力学。Int。学生物化学j。细胞生物。36, 1031-1037(2004)。
Kanisicak, O。et al。遗传谱系追踪确定心肌成纤维细胞的起源和功能在受伤心脏。Commun Nat。7, 12260(2016)。
Stellato, M. Czepiel, M. Distler, O. & bzyyszczuk, P.用双色流式细胞术鉴定和分离成年小鼠心脏成纤维细胞。前面。Cardiovasc。地中海。6, 105(2019)。
诺里斯,r.a。et al。骨膜素促进房室瓣膜祖细胞成纤维细胞谱系通路。Dev,直流发电机。238, 1052-1063(2009)。
马克沃尔德,r.r.et al。骨膜蛋白在心脏瓣膜发育中的作用。实验、医学、生物学。1132, 177-191(2019)。
维拉巴,a.r.。et al。单细胞RNA测序分析揭示了心肌梗死后CTHRC1(胶原蛋白三螺旋重复序列含1)心肌成纤维细胞的关键作用。循环142, 1831-1847(2020)。
木桐,a.j.。et al。心肌梗死时间连续体巨噬细胞极化图谱。基本的有氧运动。113, 26(2018)。
刘国祥,席红青,孙晓燕,魏斌。骨膜蛋白及其拮抗剂PNDA-3在胃癌转移中的作用。世界J.胃肠醇。21, 2605-2613(2015)。
陈,Q。et al。心肌梗死后雌性小鼠基因表达与更好的生存之间的关联。摩尔细胞心脏。49, 801-811(2010)。
普伦,A. B., Kain, V., Serhan, C. N. & Halade, G. V.雄性和雌性小鼠心脏修复的分子和细胞差异。j。心脏协会。9, e015672(2020)。
陈晓明,陶志明,杨晓明,杨晓明。小鼠急性心肌梗死早期心肌功能重塑的性别差异。生命科学。75, 2181-2192(2004)。
王,F。et al。雌性小鼠急性心肌梗死增强愈合过程。新闻界。地中海。4, 230-247(2007)。
Shioura, K. M., Geenen, D. L. & Goldspink, P. H.小鼠心肌梗死后与性别相关的心功能变化。点。j .杂志。Regul。中国。广告样稿,杂志。295, r528-r534(2008)。
确认
这项工作部分满足了以色列内盖夫本-古里安大学生物技术工程系Avram and Stella Goldstein-Goren博士学位的要求。科恩教授是克莱尔和哈罗德·奥什里生物技术教授。数字2是使用BioRender设计的。
资金
这项工作得到了AFER医学研究捐赠基金和Jordan Baruch干细胞基金(SC)的资助。
作者信息
作者及隶属关系
贡献
撰写主要稿件文本:G.H.项目管理:C.S., E.Y.监督:C.S.数据收集:G.H., G.M., E.S.数据分析:G.H., G.M., E.S., H.U.统计分析:G.H., G.M.所有作者均对稿件进行了数据解读和评审。
相应的作者
道德声明
相互竞争的利益
作者声明没有利益竞争。
额外的信息
出版商的注意
施普林格自然对出版的地图和机构从属关系中的管辖权主张保持中立。
补充信息
权利和权限
开放获取本文遵循知识共享署名4.0国际许可协议,允许以任何媒介或格式使用、分享、改编、分发和复制,只要您对原作者和来源给予适当的署名,提供知识共享许可协议的链接,并注明是否有更改。本文中的图像或其他第三方材料包含在文章的创作共用许可协议中,除非在材料的信用额度中另有说明。如果材料未包含在文章的创作共用许可协议中,并且您的预期使用不被法定法规所允许或超出了允许的使用范围,您将需要直接获得版权所有者的许可。如欲查看本牌照的副本,请浏览http://creativecommons.org/licenses/by/4.0/。
关于本文
引用本文
吉尔,H.,戈德斯坦,M.,埃齐翁,S。et al。确定小鼠急性心肌梗死后心肌纤维化中骨膜蛋白上调的时间轴。Sci代表12, 21863(2022)。https://doi.org/10.1038/s41598-022-26035-y
收到了:
接受:
发表:
DOI:https://doi.org/10.1038/s41598-022-26035-y