摘要
越来越多的证据表明,性别和内分泌老化对女性患阿尔茨海默病(AD)终身风险更高的大脑生物能量老化的影响。我们进行了31磷磁共振波谱(31P-MRS),以评估性别和更年期对216名认知正常、有AD风险的中年个体(80%为女性)的大脑高能磷酸盐[三磷酸腺苷(ATP)、磷酸肌酸(PCr)、无机磷酸盐(Pi)]和膜磷脂[磷酸单酯/磷酸二酯(PME/PDE)]的影响。97名参与者完成了β淀粉样蛋白(Aβ)11C-PiB宠物。在ad易损的额叶、后扣带、梭状回、内侧和外侧颞叶区域,女性的ATP利用率高于男性(p < 0.001)。这一特征在绝经前和围绝经期的额叶皮层明显,并在绝经后阶段扩展到其他区域(p = 0.001)。在年龄、APOE-4状态、中年健康指标、子宫切除术/卵巢切除术史、使用更年期激素治疗和颅内总容量等多变量调整后,结果显著。虽然ATP/PCr与Aβ负荷之间的相关性不显著,但Aβ负荷最高的个体是ATP/PCr比值较高的绝经后和围绝经期妇女。Pi/PCr、Pi/ATP、PME/PDE均无差异。结果与与女性性别和内分泌老化相关的动态生物能量大脑适应一致。
简介
晚发性阿尔茨海默病(AD)在女性中的患病率高于男性1与年龄和存活率无关2,3.,4.目前,绝经后妇女占所有AD病例的60%以上1.此外,载脂蛋白E-4 (APOE-4)风险等位基因的女性携带者比男性携带者更早受到影响,尽管与非携带者相比,两性都经历了更高的风险5,6.
女性的性别与中年神经内分泌老化过渡的更年期有着千丝万缕的联系7.来自临床前和转化研究的越来越多的证据表明,绝经后雌激素对脑生物能的调节和神经保护作用的剥夺是女性更大的AD终身风险的关键生物学机制2,3..此外,AD的病理始于约20年的症状前阶段8,因此接近更年期过渡,进一步强调了中年内分泌老化和女性AD风险之间的联系7.
临床前研究表明,更年期影响多个神经生物系统,特别是脑生物能学9,10,11,12,13,14.正常情况下,大脑利用葡萄糖作为主要燃料来源,这一过程依赖于17β-雌二醇7.在动物研究中,雌激素对代谢途径的调节在围绝经期出现障碍,引发脑糖代谢(CMRglc)的下降,同时线粒体利用酮体、脂质和氨基酸作为三磷酸腺苷(ATP)生产的替代燃料的增加15,16,17,18.然而,随着时间的推移,这会导致线粒体功能障碍,淀粉样β (Aβ)代谢障碍19以及雌性动物的细胞凋亡16.脑葡萄糖低代谢、线粒体功能障碍和氧化磷酸化降低(OXPHOS)是AD的一致发现20.,21,22,并可能先于AD斑块的形成23.
在转化神经影像学研究中,围绝经期和绝经后妇女的CMRglc水平降低18f -氟脱氧葡萄糖(FDG) PET和较高的Aβ沉积对11C-Pittsburgh化合物B (PiB) PET, AD病理的标志,与绝经前女性和年龄控制男性相比9,10,11,12,13,14.葡萄糖低代谢程度超过Aβ负荷10,进一步确定中年代谢低下是前驱性AD的早期女性特异性指标7.
由于FDG-PET信号是基于在氟脱氧葡萄糖磷酸化成脱氧葡萄糖-6-磷酸(糖酵解的第一步)后捕获氟脱氧葡萄糖,因此该技术不能提供线粒体OXPHOS或ATP产生的直接信息。31磷磁共振波谱(31P-MRS)是目前唯一可用的神经成像技术,通过检测细胞内高能磷酸盐(HEP),如ATP,磷酸肌酸(PCr)和无机磷酸盐(Pi),能够在体内评估大脑线粒体功能。24,25,26.磷酸基在PCr间的化学交换⇄三磷酸腺苷⇄Pi是通过确保电生理活动和脑生物能能的持续能量供应来维持稳定的细胞ATP浓度的关键20..
第一代31P-MRS研究在1.5 特斯拉进行,仅进行表面线圈定位和有限的脑覆盖,报告了增加的混合结果27,28或不变29AD的HEP代谢物水平。最近的研究使用了全脑,多切片31P-MRS报告了与健康对照组相比,AD和轻度认知障碍(MCI)患者HEP代谢物的改变30.,31,32这被解释为神经能量通路的失调33.的变化31p - mrs衍生的磷酸单酯(PME)和磷酸二酯(PDE)组成也在AD中被注意到34,35.目前尚不清楚在无症状个体中HEP或磷脂代谢物是否发生改变处于危险之中以及它们是否与中年时的Aβ沉积有关,而中年时保持认知功能和预防AD的潜力最大。
在此,我们进行了全脑多切片31P-MRS研究旨在检测性别和绝经状态对200多名认知正常的中年男性和女性的HEP代谢物和膜磷脂的影响,这些中年男性和女性携带AD危险因素(如晚发性AD家族史和/或APOE-4基因型)。我们还研究了磷代谢物和Aβ纤维负荷之间的关系11C-PiB PET扫描。
结果
参与者
我们在这项研究中招募了230名参与者。其中14例因MRI偶然发现(n = 5例小血管疾病或腔隙性梗死,n = 2例脑膜瘤,n = 1例轻度脑积水,n = 1例脱髓鞘)、MR伪影(n = 2)或不完整而被排除31P-MRS研究(n = 3)。其余216名参与者在这项研究中进行了检查,包括170名女性和46名男性,完成了临床检查、绝经状态评估和治疗31P-MRS考试。97名(45%)参与者完成了测试11C-PiB PET检查。
参与者特征如表所示1.男性和女性在人口学和临床指标上没有差异。女性组包括39名绝经前妇女,61名围绝经期妇女和70名绝经后妇女。在绝经状态的事后检查中,男性组和绝经后组的高血压病例比绝经前组多(p = 0.05)。高血压在所有的分析中都被作为一个混杂因素,如“方法”。
整体认知和记忆评分没有因性别或更年期状况而有所不同(表2)2).
磷代谢产物的性别差异
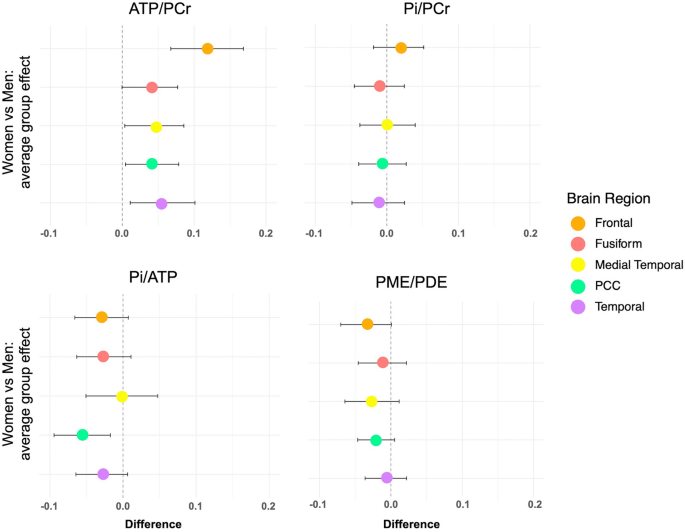
通过调整年龄、APOE-4状态和总颅内容量,观察了ATP/PCr (ATP利用的标志)的主要影响12(p < 0.001)。与男性相比,女性在所有区域都表现出更高的ATP/PCr水平(p = 0.002;表格3.).在对中年健康指标和更年期相关因素进行调整后,这些影响仍然显著,其中额叶皮层的影响最大(图2)。1).
性别对Pi/PCr无主要影响(如能量需求36), Pi/ATP(例如,ATP水解37)或PME/PDE比值(例如磷脂周转率)38)(表3.).描述性地,与男性相比,女性在后扣带(PCC)中表现出较低的Pi/ATP,这无法在多次比较校正中存活(图2)。1).
更年期状况的影响
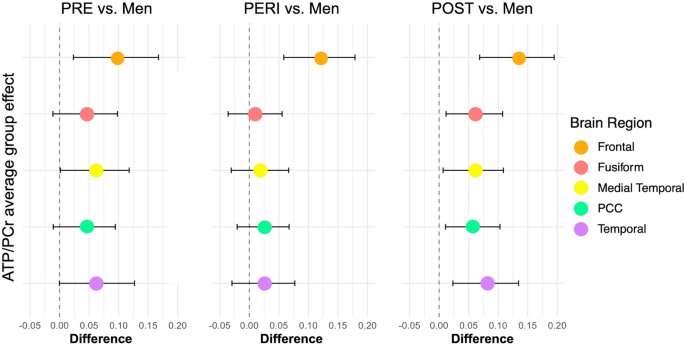
在ATP/PCr测量中观察到更年期状态的影响(p < 0.001),但在其他测量中未观察到,尽管在颞皮质中注意到一个趋势(p = 0.064)。在成对的事后分析中,绝经后组相对于所有地区的男性表现出更高的ATP/PCr (p < 0.001)。在对中年健康指标和更年期相关因素进行调整后,这些影响仍然显著,其中额叶皮层的影响最大(图2)。2).与男性相比,绝经前和围绝经期组额叶皮层也表现出更高的ATP/PCr (p < 0.05),这在其他区域未被观察到(表2)4,无花果。2).
磷代谢产物与认知的关系
额叶ATP/PCr与女性(p = 0.717和p = 0.246)或男性(p = 0.495和p = 0.151)的整体认知或言语记忆得分之间无显著相关性。鉴于额叶ATP/PCr与认知得分之间缺乏关联,以及更年期状态对认知的影响,因此没有进行更年期状态的相关性测试。
磷代谢物与淀粉样负荷的关系
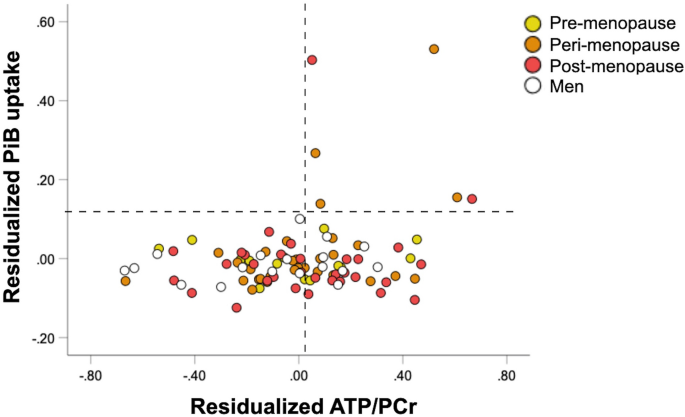
在97名参与者的子集中11C-PiB PET检查,区域ATP/PCr与PiB摄取之间无显著相关性(p = 0.989)。然而,表现出最高PiB SUVR的6名参与者也表现出ATP/PCr比值趋于分布的高端(图2)。3.).这些参与者为绝经后(n = 3)或围绝经期妇女(n = 3),均有AD家族史,67%为APOE-4携带者。
讨论
在这个31认知正常的有AD风险的中年个体的P-MRS研究表明,与年龄控制的男性相比,女性在大脑易患AD的区域表现出更高的大脑ATP再合成(例如ATP利用)。这些影响在绝经后组更为普遍,且与年龄、APOE-4状态、颅内总容量、中年健康指标、绝经类型(手术vs自发)和HT使用史无关。虽然ATP利用和PiB摄取之间的相关性不显著,但Aβ负担最高的参与者是ATP/PCr水平较高的绝经后和围绝经期妇女。
越来越多的证据表明,AD的患病率、症状学和病理生理学因性别而异2,3.,4.重要的是,女性保持临床定义的正常记忆表现的时间比男性长39尽管发病较早9,10,11,12,13,14加速AD病理进展40,41,42,43.有人认为,脑代谢的性别差异可能解释了不同的轨迹,可能抵消了女性临床症状的发作44.
大脑ATP利用的性别差异的证据是有限的。目前只有两家31P-MRS研究已经解决了这个问题。一项关于成人寿命的研究表明,与年龄控制的男性相比,20-85岁女性的额叶、颞叶和枕叶皮质的ATP利用率更高36.另一项研究还报告,与年龄控制的男性相比,绝经后女性额叶和颞叶区域的ATP利用率更高,并控制了年龄和APOE-4状态12.由于两项研究都没有专门针对有AD风险的个体,也没有测试磷代谢物和AD生物标志物之间的关系,因此尚不清楚ATP差异是否与AD有关。
31AD患者HEP代谢物的P-MRS研究受到样本量小、方法学差异以及报告的代谢物结果和所检查的大脑区域差异的限制。总的来说,比较小样本AD患者和老年对照组的老研究报告了不同的PCr升高结果27或ATP28,或无影响29,45.这种差异可能是由于这些研究是在1.5 特斯拉下进行的,只有表面线圈定位,信噪比低于3.0特斯拉,这限制了覆盖范围,并引入了不均匀的自旋激发46.现代系统工作在3特斯拉或更高,体积或相控阵线圈,已经允许改进31P-MRS的覆盖范围和敏感性,这为探索大脑的区域差异提供了机会。最近的多片全脑切片3111例AD、15例失忆性MCI和15例对照组的P-MRS研究报告,与年龄匹配的对照组相比,AD和失忆性MCI患者都表现出更高的ATP利用率30..最近的另一项研究报告,与31名对照组相比,31名AD患者样本中的PCr/Pi水平更高,但γ-或β-ATP浓度没有差异31.然而,有报道称AD中γ-ATP浓度高于对照组28,32.总的来说,虽然需要更多的研究来阐明AD中的HEP动态,但大多数研究都指向ATP利用率的增加33这可能反映了AD大脑中的代谢应激。
本研究的样本包括216名携带已知AD危险因素的个体,结果也显示,与年龄控制的男性相比,中年女性的额叶和颞外侧皮层的ATP利用率更高。此外,本文报道的发现提供了新的证据,更多的ATP利用还涉及PCC、梭状回和内侧颞叶,包括海马、杏仁核、海马旁和内嗅皮层。此外,ATP利用率的性别差异受更年期状况的影响。绝经前组和围绝经期组在额叶皮层均表现出高于男性的ATP/PCr,而绝经后组在已知易受AD早期病理和代谢变化影响的其他区域表现出更高的ATP/PCr,并且比新皮层区域具有更高的AD特异性47,48.由于表现出最高Aβ负担的个体亚群都是围绝经期和绝经后妇女,ATP/PCr水平接近分布的较高端,这进一步表明女性特异性ad对大脑能量代谢的影响始于围绝经期。
在正常有氧条件下,能量需求的增加与线粒体ATP产量的相应增加相匹配,后者通过ATP/PCr比值的比例增加反映出来20..因此,我们的数据表明,与男性相比,女性前额皮质需要付出更多努力来维持稳定的能量生产,并且在绝经后阶段,与ad相关的大脑区域的努力会增加。它还表明,绝经过渡伴随着肌酸激酶平衡代谢产物含量的重新分配,导致在卵巢17β-雌二醇(雌激素)生产停止后,额叶皮层广泛的高ATP利用率。
越来越多的研究为雌激素的神经保护作用提供了证据,并确定终身雌激素暴露是女性认知衰老的调节剂4,7,49.临床前研究表明,更年期过渡期间停用雌二醇会引发大脑葡萄糖利用和生酮途径抑制所需系统的解体15,17.这进而触发代偿机制,包括增加氨基酸、脂肪酸(β-氧化)和线粒体中的酮体的分解,以保持ATP的产生15,16,17,18.对这些途径的持续依赖促使白质分解代谢18, Aβ代谢障碍19,以及雌性动物的神经元退化16,49.在AD的小鼠模型中,卵巢切除术后降低雌二醇水平会加剧神经退行性疾病下的脑损伤50并引发Aβ纤维形成的增加51.值得注意的是,雌激素诱导的神经保护机制聚集在线粒体上,这对维持钙稳态和细胞生存至关重要52,是合成雌二醇的场所53,进一步强调了他们参与了与性和内分泌老化有关的AD风险影响。
脑成像研究还发现,更年期转变是AD发生时间和进展的驱动因素3.,4,7.与绝经前妇女和年龄控制的男性相比,围绝经期和绝经后妇女表现出逐渐降低的CMRglc,较高的Aβ负荷,以及较低的灰质和白质体积9,10,11,12,13,14.根据先前的研究结果,目前大脑ATP利用率较高的结果可能反映了先前报道的更年期过渡期间发生的低糖酵解代谢的代偿反应9,10,11,12,13.这些发现得到了机制分析的支持,这些分析表明,在中年内分泌老化过程中,大脑葡萄糖代谢向脂质代谢转变,导致白质分解代谢作为生成酮体的脂质来源54ATP的恢复15,16,17,18.雌激素控制的葡萄糖代谢的丧失导致CMRglc和线粒体呼吸效率下降20-25%,随后是利用脂质作为辅助燃料的代偿性生物能量适应反应7,16,18,55.因此,高能量脂质燃料的使用与特定大脑区域ATP生成的增加一致,并与临床前女性内分泌衰老模型中观察到的白质完整性和体积的下降一致7,16,18,54,55,即线粒体呼吸从高效到不耦合的转变16,54,55以及中年女性白质体积的减少10,12.在本研究中,经多次比较校正后PME/PDE比值无显著性别差异。然而,描述性地,女性额叶皮层PME/PDE比男性低(表2)3.和无花果。1),这可能与动物模型中观察到的脂肪分解代谢增加或磷脂周转增加有关。PME是在膜脂合成中起重要作用的膜前体,而PDE是磷脂分解的产物。一些31P-MRS研究报告了PME/PDE在AD中的改变34,35,38,56,而其他人则没有表现出差异30.,31,33,45.由于缺乏性别对PME/PDE的主要影响,我们没有进一步测试更年期状态的影响。需要更多的工作来测试ATP利用和PME/PDE周转率之间的关系,作为绝经状态的函数,并检查磷脂周期的性别差异是否在老年或AD诊断后变得显著。
中年女性ATP利用率较高的证据也与PET成像报告显示的成年期女性大脑代谢活动高于男性相一致44,57.FDG-和H2O-PET研究表明,随着大脑年龄的增长,其静息代谢逐渐从葡萄糖的非氧化和氧化结合使用转变为主要的OXPHOS,这种影响似乎在女性身上更为明显57这与Aβ斑块的分布有关58.我们的数据为女性大脑ATP再合成更高提供了新的证据,这可能反映了非氧化代谢(例如,有氧糖酵解)逐渐被OXPHOS取代57.
我们没有观察到Pi/PCr(如能量需求)或Pi/ATP(如ATP水解)的性别差异37),除了女性PCC中的Pi/ATP相对于男性更低,这在多次比较校正中无法存活。另一项调查Pi/ATP性别差异的研究显示,在整个成年寿命期间,女性的颞皮质比男性低,而顶叶皮质比男性高36.虽然之前的研究没有检测PCC,但这些结果为正常衰老过程中ATP水解的性别差异提供了初步证据。之前的研究还报告了女性皮质能量需求较低36,而我们发现这种代谢物比例没有性别差异。考虑到Pi测量的变动性更大,导致更大的标准偏差,我们可能在检测显著影响方面能力不足。一些研究报道了AD患者Pi/ATP或PCr/Pi的变化30.,45但是,这些代谢物比例的性别差异也有可能在年龄较大或存在神经退行性疾病时变得更加显著。另一方面,ATP利用率相对于PCr的性别差异在各个研究中是一致的,支持将这一线粒体功能的生物标志物纳入临床前AD的研究。
优势和局限性
这项研究有几个优点。据我们所知,这是第一次31P-MRS研究旨在调查性别和更年期状态对一大群特征良好、认知正常的有AD风险的中年人的影响。所有参与者都进行了脑部核磁共振检查31P-MRS扫描、临床和认知检查、实验室检查、载脂蛋白e -4状态和更年期评估。我们获得了多层2D-CSI31P-MRS扫描覆盖整个大脑,从而在整个网格上绘制多个体素,而不是大的单个体素,这使我们能够同时评估ad脆弱大脑区域面板中的HEP和磷脂代谢物。在对多重比较进行严格校正后(这限制了假阳性的可能性),以及对年龄、APOE-4状态、中年健康指标、绝经相关因素和颅内容量进行多变量校正后,结果显著。
所有参与者的认知能力都完好无损,认知表现没有因性别或更年期状况而异。ATP/PCr与认知指标的相关性也不显著。虽然我们关注的是已知对雌激素变化敏感的认知测试,但不同的测试可能会产生不同的结果。由于我们的样本受过高等教育,结果可能不适用于不同教育状况的个体。尽管如此,这些结果表明,在检测AD早期症状方面,线粒体功能的变化可能比目前可用的神经心理测试更敏感。
使用XSOS对代谢物峰面积的评估依赖于操作人员,可能会由于相位失真和基线滚动而引入主观误差,尽管所有参与者都应用了相同的一阶相移。虽然这可能是方法偏差的来源,但我们的技术得到了很好的验证59,60所有配件均由具有20多年处理MRS数据(JPD)经验的同一位MRI物理学家进行,从而消除了对评分者之间差异的担忧。正如其他人指出的那样,31P-MRS测量受到许多采集特性的影响,如发射和接收场变化、信噪比和部分体积平均36,61.我们所有的参与者都用相同的双调谐扫描31P /1H鸟笼头线圈具有相同的发射和接收增益。我们的分析集中在代谢物的比例,而不是绝对浓度,因为后者对这些因素更敏感。代谢物水平的绝对定量容易出错,只能计算相对代谢物水平,限制了的可解释性31P-MRS数据。未来的磁化转移实验将确定CK和atp酶反应速率,并测量与AD风险相关的绝对浓度。虽然我们的中年参与者不太可能表现出严重的脑萎缩,部分脑容量矫正31P-MRS数据是无法获得的,这是比较男性和女性的一个限制,特别是在老年参与者中。
另一个限制31P-MRS具有固有的低分辨率,代谢物浓度低(~ 1-10 mM)。为了解决这一限制,我们的方案包括在与我们的手术完全相同的位置获取高分辨率t2加权MRI图像31P-MRS切片,在MRS扫描之前立即进行。然后,我们能够准确地将这个高分辨率T2与3D t1加权图像进行共配准以进行分析。PET与3DT1 MRI的共配准采用最先进的共配准技术62根据公布的协议9,10,11,12,13,14,并在处理后将每个PET叠加在相应的MRI上进行单独验证,以确保配准过程中没有出现差异。
还需要做更多的工作来确定ATP利用率的范围代表生物学上有意义的变化。从临床角度来看,答案可能是多因素的,取决于个体代谢利用、性别、年龄和临床诊断等因素。从统计角度看,区域日间和日间变化系数一般在10%以下63,64.在我们的研究中,女性额叶皮层的ATP/PCr水平比男性高17%(绝经后女性的差异为18%),我们将其解释为统计学和生物学上有意义的差异。
目前,没有31P-MRS研究测试了与AD生物标志物(如Aβ斑块)的相关性。我们需要提醒的是,尽管a β斑块的存在是AD的一个很强的危险因素,但超过20%的健康老年人在没有痴呆症的情况下表现出脑a β负担65大约6%的中年人也检测呈阳性65.与这些估计一致的是,我们队列中8%的接受Aβ PET成像的女性根据来自AD患者的预先临界值表现出较高的脑Aβ负担66,67.虽然其中一些出现Aβ病理的女性最终可能会发展为AD,但Aβ沉积也有可能反映了激素下降引发的生物衰老加速68以及线粒体功能的相关变化。我们谨慎解释我们的结果,因为我们的参与者比那些临床诊断为AD的人更年轻,没有认知障碍,总体健康状况良好。我们也承认,我们的参与者相对年轻的年龄必然导致Aβ水平很大程度上较低,因此保守地降低了检测生物能量老化因子相关性的统计能力。尽管如此,许多研究表明,PiB信号检查作为一种连续的测量方法,足以在无症状的中年高危个体中检测出明显的异常69,70.目前的结果显示,在Aβ分布没有相应改变的情况下,女性特异性ATP利用率显著增加,这表明ATP变化可能先于女性显著的Aβ沉积。在这种情况下,ATP/PCr和纤原性Aβ负荷之间的关联可能在老年或已确诊疾病时变得明显。另外,ATP使用的变化可能是可溶性Aβ的毒性作用的次要原因,而这是PiB-PET检测不到的。线粒体是可溶性Aβ低聚物的细胞内靶点,其导致活性氧(ROS)的过度产生,破坏细胞内钙稳态,并在纤维化之前触发神经元凋亡20..鉴于AD病理的缓慢进展性质,以及在中年进行早期检测调查的需要,可能需要10-20年的随访,以提供关于脑生物能量因子的性别差异如何影响Aβ积累轨迹的明确结论。我们的研究结果为未来的纵向研究结合提供了初步的代谢和解剖靶点31P-MRS用ad特异性生物标志物进行测量,如淀粉样pet和基于血液的Aβ生物标志物。
最后,目前的结果是在健康、受过良好教育、主要是中等或较高社会经济地位的白人个体中发现的,这限制了我们研究结果的泛化性。
结论
目前的31对AD高危中年人的P-MRS研究表明,在中年内分泌老化过程中,AD易发区域的脑代谢功能存在性别差异。这些变化可能会增加女性对AD的易感性,并为基于精准医学的预防策略提供了机会之窗。
方法
参与者和数据
这是一项自然史、非介入性研究,研究对象为年龄在40-65岁、具有晚发性AD家族史和/或APOE-4基因型等危险因素的健康、认知正常的男性和女性。参与者在2018年至2022年期间通过自我推荐、传单和口口相传的方式在威尔康奈尔医学(WCM)阿尔茨海默氏症预防计划中招募。
我们的纳入和排除标准已经在前面描述过9,10,11,12,13,14.简单地说,所有参与者的蒙特利尔认知评估(MoCA)得分≥26,按年龄和教育程度划分的认知测试表现正常9,10,11,12,13,14.排除标准包括可能影响大脑结构或功能的疾病(如中风、任何神经退行性疾病、主要精神疾病、脑积水、脱髓鞘疾病如多发性硬化症、颅内肿块和MRI上的梗死)、精神活性药物的使用以及MRI或PET成像的禁忌症。所有人都接受了医学、神经学、实验室、认知和核磁共振检查,包括容量核磁共振和31P-MRS在6个月之内。97名参与者,包括78名(80%)女性和19名(20%)男性也接受了治疗11在MRI扫描后约3个月内进行C-PiB扫描。
患者的性别是通过自我报告确定的。采用标准qPCR方法测定APOE-4基因型9,10,11,12,13,14.携带一个或两个APOE-4等位基因副本的参与者被归为APOE-4携带者,并与非携带者进行比较。
标准方案批准,注册和病人同意
所有的方法都按照相关的指导方针和规定进行。所有实验方案都得到了WMC机构审查委员会的批准。所有参与者均获得书面知情同意。
更年期状态
绝经状态的确定采用基于生殖衰老阶段研讨会(STRAW)标准的标准化问卷71.以激素实验室评估为支持标准,将参与者分为绝经前(正常月经周期者)、围绝经期(闭经间隔≥60天或≥2个跳过周期的不规则月经周期者)或绝经后(无月经周期12个月或以上)14.通过绝经前妇科手术(子宫切除术和/或卵巢切除术)相关的一系列问题评估绝经类型(自发vs.诱导)14.使用标准化问卷调查绝经激素治疗(HT)14.
认知措施
我们使用了Rey听觉语言学习测试(RAVLT)的延迟回忆和韦氏记忆量表逻辑记忆的延迟回忆,FAS测试,动物命名和Trail Making Test B (TMT-B总分),所有测试都已知对雌激素水平的敏感性12,72,以得出综合的整体认知和记忆分数(见“统计分析”)。
图像采集与分析
磁共振成像和光谱学
所有参与者都接受了3D体积T检查1在3.0 T GE MR 750 Discovery扫描仪上进行加权MRI扫描(通用电气,Waukesha, WI) [BRAVO;1 × 1 × 1mm分辨率,8.2 ms重复时间(TR), 3.2 ms回波时间(TE), 12°翻转角,25.6 cm视场(FOV), 256 × 256矩阵与电弧加速]使用32通道头线圈。的31P-MRS扫描与MRI扫描在同一台扫描仪上进行,通常在同一天,使用双调谐31P /1H正交头线圈(Ralph Hashoian;临床MR解决方案,布鲁克菲尔德,WI)。在MRS扫描之前,使用1H单体素技术放置在整个大脑避免空气组织界面。获得多个2D切片,得到8 × 8x8网格,视野为24厘米。光谱成像参数包括2048个点,5000 Hz扫描宽度,2000 ms TR, 2个平均值,在51.3 MHz的矢状面上55°翻转角。后31P-MRS完整,呈8层矢状T1-流体衰减反演恢复序列[FLAIR;获得2200 ms TR, 12 ms TE, 780 ms反转时间(TI), 24 cm FOV, 0.94 × 0.94 mm],切片厚度5 mm,与每个切片的中心位置完全相同31P MRS切片供参考。
淀粉样β正电子发射断层摄影术
11C-Pittsburgh Compound B (PIB) PET扫描在Siemens BioGraph mCT PET/CT扫描仪上进行,操作模式为3D,遵循标准化程序10,11,13.所有扫描均在清醒、闭眼状态下进行,并在注射15 mCi后60-90分钟内总结活动11C-PiB。对所有图像进行衰减、散射和衰减校正。图像采用PSF和TOF技术重建,分辨率为0.8 × 0.8 × 3.0 mm,共74片。
Multiparametric映射
MRS数据采用XSOS处理59,60(Dikoma Shungu/毛祥玲;Weill Cornell Medicine)用IDL编写(Excelis Visual, Boulder, CO)。原始数据加载到程序中,并使用汉明和费米k-空间滤波器、7.5 mm中心体素位移、20 Hz指数滤波和在时间、x和y域零填充进行3D快速傅里叶变换处理。所有光谱均采用固定的4200°一阶相位,数据自动相位为零阶。PCr峰设置为0.0 ppm,中心谱集作为参考,并在整个数据集进行敏感性校正。基线校正应用于CSI数据集的所有其他体素,由经验丰富的分析师(JPD)。
在补充信息图中确定的七个高分辨共振峰周围进行峰面积积分。1:无机磷酸盐(Pi),磷酸肌酸(PCr), ATP (α-ATP, β-ATP和γ-ATP部分),磷酸二酯(PDE)和磷酸单酯(PME)。这就创建了一个16 × 16的1.5 × 1.5 × 3.0 cm的体素图像,每个体素中的信号强度对应于的峰值区域31P代谢物。计算每个代谢物共振的积分,并表示为相应频谱中总磷信号的百分比面积。然后计算ATP/PCr、Pi/PCr、Pi/ATP和PME/PDE的比值,以便对数据进行归一化。ATP/PCr是衡量能量利用的指标12, Pi/PCr是衡量能源需求的指标36, Pi/ATP是衡量ATP转移酶的指标37, PME/PDE是衡量磷脂周转率的指标38.
3D T1在Centos 7 Linux环境下运行的FreeSurfer 6.0和统计参数映射(SPM12)中自动处理加权BRAVO MRI扫描62(http://www.fil.ion.ucl.ac.uk/spm/)在Matlab 2021 (MathWorks;Natick, MA)使用自动化管道9,10,11,12,13,14.对于每个参与者,MRS扫描的中心4片被联合注册到T上1使用MRS时获得的8层一致图像集进行MRI序列。参数化代谢物MRS图和相应的PiB-PET扫描使用SPM8的归一化互信息例程与颅骨剥离MRI共配准62.体积MRI和PiB-PET扫描被重新采样到256 × 256 × 256矩阵阵列,而参数代谢物MRS图被调整到256 × 256图像,但没有插值超出原始的16 × 16 × 8矩阵。
使用在FreeSurfer 6.0中实现的皮层下灰质和白质分割工具和基于Desikan-Killiany地图集的感兴趣区域(ROIs)对联合注册的MRI、MRS图和PET图像进行量化。73,74应用于对准MRI。roi被叠加在每个联合注册的MRS和PET扫描上,用于区域采样。我们重点研究了对代谢性衰老和AD具有已知代谢易损性的大脑区域,包括:额叶皮层(额中回和上回);扣带回后回和楔前叶;颞皮质(下回、中回、上回);梭状回;内侧颞叶(海马体、杏仁核、内嗅回和海马旁回)47,48.我们还获得了用于归一化的总颅内容积。
为了量化pib衍生的Aβ负荷,我们创建了一个AD掩膜,作为优先受Aβ沉积影响的roi的平均值,包括:下顶叶;颞上回、下回和中回;额上回、中回和内侧回;PCC和楔前叶66,67.同样通过FreeSurfer,将AD-mask和单个roi中的PiB摄取归一化为小脑GM摄取,以获得标准化摄取值比率(SUVR)。9,10,11,12,13,14.PiB摄取作为一个连续的测量。出于描述性目的,根据AD掩模SUVR > 1.42的公布截断值,参与者也被分为表现出高水平或低水平的脑淀粉样变,这来自于对AD患者的研究66,67.
协变量
所有分析均按年龄(年)、APOE-4状态(携带者与非携带者)和颅内总容量(cc)进行调整。认知指标以受教育程度(年限)进一步调整。对于暴露量与结局指标有显著相关性,我们检查了其他混杂因素,包括(i)中年健康指标:吸烟(现在吸烟、过去吸烟和从不吸烟)、高血压(收缩压≥140 mmHg或舒张压≥90 mmHg和/或使用抗高血压药物)、高胆固醇血症(血浆胆固醇≥240 mg/dL)和高胰岛素血症(HOMA-IR > 1.8);(ii)绝经相关因素:绝经类型(自发vs.手术)和HT使用史(使用vs.从未使用)。
统计分析
在R版本4.2.0和SPSS v.25中进行分析。临床测量采用一般线性模型或卡方检验。队列特征用均值(标准差)和n,百分比(%)描述,按绝经暴露组分层。
所有认知结果都是连续的,并被缩放到标准偏差并以0为中心。综合记忆得分是通过对每个延迟记忆测试(RAVLT,逻辑记忆)进行z分,并在各个测量项上平均得来的。TMT-B分数被颠倒,因此在平均之前,正Z分数反映了更好的表现。然后通过对其余测试进行z得分,并将这些得分和综合记忆得分平均,得出整体认知得分。每个认知结果的回归模型首先包含两个水平的暴露变量(水平:男性,女性),其次是四个水平的暴露变量(水平:男性,绝经前,绝经前,绝经前,绝经后),由上面列出的混杂因素进行调整。经Bonferroni校正多重比较后,p < 0.05为显著性。
所有脑成像结果都是连续的,并按标准偏差进行缩放,并以0为中心。虽然一些出版物报道了PCr/Pi比值,但由于Pi测量的幅度小且变异性高(标准差),我们获得了Pi与PCr比值,以便获得更稳定的估计和多变量线性回归建模的置信边界。ATP/PCr比值也用于一致性回归建模。然而,PCr/Pi和PCr/ATP的测量方法在补充信息表中给出1而且2以便与以前的出版物进行比较。
对每种代谢物结果的多变量线性回归模型进行了训练,以考虑两个水平的暴露变量(水平:男性,女性)对所有大脑区域的影响。构建回归模型以获得全局P值,以测试每种代谢物在所有大脑区域的多变量结果。所有分析均按年龄、APOE-4状态和总颅内容量进行调整。在这些调整之后,对显示暴露有显著影响的模型进行了重新评估,包括上面列出的其他混杂因素。在Bonferroni多重比较调整后,各暴露水平之间进行两两比较,p < 0.05。所有结果均提供bonferroni校正p值。对于显示显著主效应的模型,使用森林样地来探索组间的区域差异,其中估计的效应大小超过了中的检验-重测变异性31P-MRS测量(例如差异≥10%)63,64)被认为具有临床和统计学意义。
代谢产物结果显示显著的性别影响(例如ATP/PCr),然后用多元回归模型进行检验,以考虑四个水平的暴露变量对所有大脑区域(水平:男性、绝经前、绝经前、绝经后)ATP/PCr的影响,经混杂因素调整,并经过Bonferroni多重比较调整,p < 0.05。构建回归模型以获得全局P值,以测试每个给定结果变量的任何绝经状态水平的多变量差异。这种方法产生了4级变量作为一个整体在模型中的重要性。然后使用如上所述的森林样地探索区域组的差异。
最后,我们使用线性回归测试在AD口罩中显示显著性别效应的区域代谢物水平与PiB SUVR以及显示最大效应量的区域(如额叶皮层)的相关性,并对混杂因素进行了调整。平滑样条用于估计p < 0.05时的总体拟合。
数据可用性
本研究中分析的数据集可根据合理要求从通讯作者处获得。
参考文献
2021年阿尔茨海默病事实和数据。阿尔茨海默氏痴呆17, 327 - 406。https://doi.org/10.1002/alz.12328(2021)。
密歇根州法拉蒂et al。阿尔茨海默病的性别差异——精准医疗的大门。纳特。神甫。14, 457 - 469。https://doi.org/10.1038/s41582-018-0032-9(2018)。
拉赫曼。et al。阿尔茨海默病的性别和性别驱动因素:跨年龄、种族、医疗和生活方式风险的雌激素控制的作用前面。衰老>。11, 315年。https://doi.org/10.3389/fnagi.2019.00315(2019)。
杰特,S。et al。内源性和外源性雌激素暴露:女性生殖健康如何推动大脑衰老并为阿尔茨海默病的预防提供信息。前面。衰老>。https://doi.org/10.3389/fnagi.2022.831807(2022)。
Altmann, A., Tian, L., Henderson, V. W., Greicius, m.d .,阿尔茨海默病神经成像倡议,I.性别改变apoe相关的阿尔茨海默病发展风险。安。神经。75, 563 - 573。https://doi.org/10.1002/ana.24135(2014)。
洛杉矶法雷尔et al。年龄、性别和种族对载脂蛋白E基因型与阿尔茨海默病相关性的影响一个荟萃分析。APOE和阿尔茨海默病Meta分析联盟。《美国医学会杂志》278, 1349-1356(1997)。
Brinton R. D., Yao, J., Yin, F., Mack, W. J. & Cadenas, E.围绝经期作为神经过渡状态。内分泌。11, 393 - 405。https://doi.org/10.1038/nrendo.2015.82(2015) (Epub 2015年5月26日).
斯珀林,r.a., Karlawish, J. & Johnson, k.a.临床前阿尔茨海默病——未来的挑战。纳特。神甫。9,。https://doi.org/10.1038/nrneurol.2012.241(2013)。
Mosconi, L。et al。更正:围绝经期,大脑和外周出现阿尔茨海默氏症生物能量表型。《公共科学图书馆•综合》13, e0193314。https://doi.org/10.1371/journal.pone.0193314(2018)。
Mosconi, L。et al。阿尔茨海默病风险的性别差异:内分泌脑成像与年龄老化。神经学89, 1382 - 1390。https://doi.org/10.1212/wnl.0000000000004425(2017)。
Mosconi, L。et al。更年期过渡期间阿尔茨海默病风险增加:一项为期3年的纵向脑成像研究《公共科学图书馆•综合》13, e0207885。https://doi.org/10.1371/journal.pone.0207885(2018)。
Mosconi, L。et al。更年期影响人类大脑结构、连通性、能量代谢和淀粉样β沉积。科学。代表。11, 10867年。https://doi.org/10.1038/s41598-021-90084-y(2021)。
拉赫曼。et al。性驱动的阿尔茨海默病风险调节器。神经学95, e166。https://doi.org/10.1212/WNL.0000000000009781(2020)。
Schelbaum E。et al。生殖史与中年痴呆风险的脑MRI生物标志物的关联。神经学https://doi.org/10.1212/WNL.0000000000012941(2021)。
丁芳,姚,J., Rettberg, J. R., Chen, S. & Brinton, R. D.女性衰老和阿尔茨海默氏症小鼠大脑中葡萄糖运输和代谢的早期下降先于生酮系统的转变:生物能量干预的意义。《公共科学图书馆•综合》8, e79977。https://doi.org/10.1371/journal.pone.0079977(2013)。
阴,F。et al。雌性大鼠大脑的围绝经期衰老转变:生物能量系统和突触可塑性的下降。一般人。老化36, 2282 - 2295。https://doi.org/10.1016/j.neurobiolaging.2015.03.013(2015)。
姚俊,陈淑娟,毛志明,陈志强,陈志强,陈志强d-葡萄糖治疗诱导生酮,维持线粒体功能,并降低老年痴呆症雌性小鼠模型的病理。《公共科学图书馆•综合》6, e21788。https://doi.org/10.1371/journal.pone.0021788(2011)。
王,Y。et al。大脑代谢的中年时间和内分泌转变:女性大脑阿尔茨海默病风险增加的系统生物学基础。科学。代表。10, 8528年。https://doi.org/10.1038/s41598-020-65402-5(2020)。
姚明,J。et al。卵巢激素缺失会导致生物能量缺失和线粒体β -淀粉样蛋白。一般人。老化33, 1507 - 1521。https://doi.org/10.1016/j.neurobiolaging.2011.03.001(2012)。
林,M. T. & Beal, M. F.神经退行性疾病的线粒体功能障碍和氧化应激。自然443, 787 - 795。https://doi.org/10.1038/nature05292(2006)。
吉布森,g.e.和Shi Q.阿尔茨海默病的线粒体中心观点建议多方面的治疗。阿尔茨海默病。20., s591(2010)。
阿尔茨海默病中的线粒体和线粒体级联。阿尔茨海默病。62, 1403 - 1416。https://doi.org/10.3233/JAD-170585(2018)。
Pratico, D., Uryu, K., Leight, S., Trojanoswki, J. Q. & Lee, V. M.在阿尔茨海默淀粉样变性动物模型中,脂质过氧化的增加先于淀粉样斑块形成。j . >。21, 4183-4187(2001)。
肖梅尔,m.m。et al。多模态神经成像提供了能量代谢的高度一致的图像,证实31pmrs用于测量大脑ATP合成。Proc。国家的。学会科学。美国106, 3988 - 3993。https://doi.org/10.1073/pnas.0806516106(2009)。
杜峰,朱晓红,乔浩,张晓霞,陈伟,体内高效31用于无创测定人脑ATP代谢的多个动力学参数和代谢通量的P磁化转移方法。粉剂。的原因。地中海。57, 103 - 114。https://doi.org/10.1002/mrm.21107(2007)。
杜,F。et al。紧密耦合的脑活动和脑ATP代谢率。Proc。国家的。学会科学。美国105, 6409 - 6414。https://doi.org/10.1073/pnas.0710766105(2008)。
裴德格鲁,彭查林,K, Klunk, W. E, McClure, R. J. & Muenz, L. R.脑代谢改变在可能的阿尔茨海默病的初步研究。一般人。老化15, 117 - 132。https://doi.org/10.1016/0197 - 4580 (94) 90152 - x(1994)。
Mecheri G。et al。体内海马(31)P NMR代谢产物在阿尔茨海默病和衰老。欧元。精神病学12, 140 - 148。https://doi.org/10.1016/s0924 - 9338 (97) 80203 - 9(1997)。
博顿利p.a.et al。阿尔茨海默痴呆:能量代谢和移动磷酸酯与P-31核磁共振波谱定量。放射学183, 695 - 699。https://doi.org/10.1148/radiology.183.3.1584923(1992)。
Das, N., Ren, J., Spence, J. & Chapman, S. B.磷酸盐脑能量代谢与阿尔茨海默病的认知:在7Tesla使用全脑体积线圈(31)磷磁共振波谱的光谱研究。前面。>。15, 641739年。https://doi.org/10.3389/fnins.2021.641739(2021)。
Rijpma, A., van der Graaf, M., Meulenbroek, O., Olde Rikkert, m.g.m. & Heerschap, A.轻度阿尔茨海默病患者大脑高能磷酸盐代谢改变:三维(31)P MR光谱成像研究。杂志中国。18, 254 - 261。https://doi.org/10.1016/j.nicl.2018.01.031(2018)。
Mandal, P. K., Akolkar, H. & Tripathi, M.海马pH值和神经化学物质在体内多体素的映射31P在健康正常年轻男女、轻度认知障碍和阿尔茨海默病中的研究。阿尔茨海默病。31(补充3),S75-86。https://doi.org/10.3233/JAD-2012-120166(2012)。
歌,T。et al。阿尔茨海默病进展中的线粒体功能障碍、氧化应激、神经炎症和代谢改变:体内磁共振波谱研究的荟萃分析老化决议案72, 101503年。https://doi.org/10.1016/j.arr.2021.101503(2021)。
尼奇,r.m.et al。阿尔茨海默病大脑膜缺陷的证据。Proc。国家的。学会科学。美国89, 1671 - 1675。https://doi.org/10.1073/pnas.89.5.1671(1992)。
潘查林加姆,汉米尔顿,R. L. &麦克卢尔,R. J.脑膜磷脂改变与阿尔茨海默病。Neurochem。Res。26, 771 - 782。https://doi.org/10.1023/a:1011603916962(2001)。
Rietzler,。et al。能量代谢由31P磁共振波谱在健康人大脑中的作用j . Neuroradiol。https://doi.org/10.1016/j.neurad.2021.11.006(2021)。
Chance, B., Eleff, S., Leigh, J. S. Jr., Sokolow, D. & Sapega, A.运动人类肌肉中磷酸肌酸/无机磷酸盐比值的线粒体调节:A门控31核磁共振研究。Proc。国家的。学会科学。美国。78, 6714 - 6718。https://doi.org/10.1073/pnas.78.11.6714(1981)。
福伦扎,o.v.et al。减少阿尔茨海默氏症大脑中的磷脂分解:A31P光谱学研究。精神药理学180, 359 - 365。https://doi.org/10.1007/s00213-005-2168-8(2005)。
桑德曼,E。et al。女性在言语记忆方面的优势是否有助于低估女性相对于男性的阿尔茨海默病病理?阿尔茨海默病。56, 947 - 957。https://doi.org/10.3233/jad-160716(2017)。
Koran, m.e.i., Wagener, M. & Hohman, t.j. AD生物标志物和认知衰退之间的关联的性别差异。大脑成像行为。11, 205 - 213。https://doi.org/10.1007/s11682-016-9523-8(2017)。
巴克利,r.f.et al。性别、淀粉样蛋白和APOE ε4与临床前阿尔茨海默病认知能力下降的风险:来自三个特征明确的队列的发现阿尔茨海默氏痴呆14, 1193 - 1203。https://doi.org/10.1016/j.jalz.2018.04.010(2018)。
华,X。et al。萎缩率的性别和年龄差异:n=1368次MRI扫描的ADNI研究。一般人。老化31, 1463 - 1480。https://doi.org/10.1016/j.neurobiolaging.2010.04.033(2010)。
Skup, M。et al。AD和aMCI患者灰质萎缩模式的性别差异:来自ADNI的结果。科学杂志56, 890 - 906。https://doi.org/10.1016/j.neuroimage.2011.02.060(2011)。
桑德曼,E。et al。女性较高的脑代谢率弥补了早期阿尔茨海默病的病理。阿尔茨海默氏症。评估。Monit说。12, e12121。https://doi.org/10.1002/dad2.12121(2020)。
史密斯,c.d.。et al。老年和阿尔茨海默病的额叶磷代谢与神经心理功能。安。神经。38, 194 - 201。https://doi.org/10.1002/ana.410380211(1995)。
Prasuhn, J., Kunert, L. & Brüggemann, N.神经影像学方法在神经退行性疾病中绘制OXPHOS和氧化应激的体内变化。Int。理学。https://doi.org/10.3390/ijms23137263(2022)。
小c·r·杰克et al。追踪阿尔茨海默病的病理生理过程:动态生物标志物的更新假设模型。《柳叶刀》。神经。12, 207 - 216。https://doi.org/10.1016/s1474 - 4422 (12) 70291 - 0(2013)。
阿尔茨海默病早期和特异性诊断中的脑葡萄糖代谢。FDG-PET在MCI和AD中的研究。欧元。j .诊断。医学、医学、影像学32, 486 - 510。https://doi.org/10.1007/s00259-005-1762-7(2005)。
雌激素作用的健康细胞偏向:线粒体生物能学和神经学意义。趋势>。31, 529 - 537。https://doi.org/10.1016/j.tins.2008.07.003(2008)。
Azcoitia, I., Fernandez-Galaz, C., Sierra, A. & Garcia-Segura, L. M.性腺激素影响神经元对兴奋毒素诱导变性的脆弱性。j . Neurocytol。28, 699 - 710。https://doi.org/10.1023/a:1007025219044(1999)。
悦,X。et al。在阿尔茨海默病动物模型中,大脑雌激素缺乏加速了阿贝塔斑块的形成。Proc。国家的。学会科学。美国102, 19198 - 19203。https://doi.org/10.1073/pnas.0505203102(2005)。
莫里森,J. H.,布林顿,R. D.,施密特,P. J. &戈尔,A. C.雌激素,更年期和衰老的大脑:基础神经科学如何为女性激素治疗提供信息。j . >。26, 10332 - 10348。https://doi.org/10.1523/jneurosci.3369-06.2006(2006)。
莱杰里,我,格林,A. &埃克特,A.线粒体,雌激素和女性大脑衰老。前面。衰老>。https://doi.org/10.3389/fnagi.2018.00124(2018)。
克洛辛斯基,l.p.。et al。白质脂质作为衰老女性大脑的生酮燃料供应:对阿尔茨海默病的影响。EBioMedicine2, 1888 - 1904。https://doi.org/10.1016/j.ebiom.2015.11.002(2015)。
Yao, J., Rettberg, J. R., Klosinski, L. P., Cadenas, E. & Brinton, R. D.晚发型阿尔茨海默病脑代谢的变化:生物标志物和治疗干预的意义。Mol. Aspects Med。32, 247 - 257。https://doi.org/10.1016/j.mam.2011.10.005(2011)。
冈萨雷斯,r.g.。et al。体内定量31阿尔茨海默病的磁共振波谱。阿尔茨海默病协会Disord。10, 46-52(1996)。
Goyal, m.s.校正Goyal等人,持久的代谢青春在衰老的女性大脑。Proc。国家的。学会科学。116, 5198 - 5198。https://doi.org/10.1073/pnas.1902264116(2019)。
弗拉申科,a.g.et al。脑好氧糖酵解与淀粉样蛋白-β (Aβ)沉积的空间相关性。Proc。国家的。学会科学。107, 17763-17767(2010)。
Henchcliffe C。et al。多核磁共振波谱在体内评估帕金森病线粒体功能障碍。安。纽约大学科学学院1147, 206 - 220。https://doi.org/10.1196/annals.1427.037(2008)。
Weiduschat, N。et al。帕金森病脑能量代谢的性别差异:磷磁共振波谱成像研究。帕金森症遗传代数。Disord。20., 545 - 548。https://doi.org/10.1016/j.parkreldis.2014.02.003(2014)。
Meyerspeer, M。et al。(31)骨骼肌P磁共振波谱:专家的共识建议。核磁共振生物医学。https://doi.org/10.1002/nbm.4246(2020)。
Ashburner, J. & Friston, K. J.基于体素的形态测量方法。科学杂志11, 805 - 821。https://doi.org/10.1006/nimg.2000.0582(2000)。
Lagemaat, m.w.。et al。在7 T有和没有核Overhauser效应时(31)P MRSI在人脑中的重复性。核磁共振生物医学。29, 256 - 263。https://doi.org/10.1002/nbm.3455(2016)。
Bogner, W。et al。在活的有机体内31全绝热扩展图像选择在体光谱P光谱:3t和7t的比较。粉剂。的原因。地中海。66, 923 - 930。https://doi.org/10.1002/mrm.22897(2011)。
彼得森,r.c。et al。社区认知正常人群中淀粉样蛋白水平升高与认知和生物标志物的关联。JAMA神经。73, 85 - 92。https://doi.org/10.1001/jamaneurol.2015.3098(2016)。
弗拉申科,a.g.et al。早期临床前阿尔茨海默病的影像学和脑脊液生物标志物。安。神经。80, 379 - 387。https://doi.org/10.1002/ana.24719(2016)。
Mintun, m.a。et al。[11C .非痴呆人群中的PIB:阿尔茨海默病的潜在前兆标志物。神经学67, 446 - 452。https://doi.org/10.1212/01.wnl.0000228230.26044.a4(2006)。
Levine, m.e。et al。更年期加速了生理衰老。Proc。国家的。学会科学。113, 9327 - 9332。https://doi.org/10.1073/pnas.1604558113(2016)。
莱曼,e.m.。et al。认知正常的人在阿尔茨海默病3个遗传风险水平上的β -淀粉样纤维负担。Proc。国家的。学会科学。美国106, 6820 - 6825。https://doi.org/10.1073/pnas.0900345106(2009)。
Mosconi, L。et al。迟发性阿尔茨海默氏症家族史的正常个体纤维淀粉样蛋白- β负担增加。Proc。国家的。学会科学。美国107, 5949 - 5954。https://doi.org/10.1073/pnas.0914141107(2010)。
哈洛,s.d.。et al。生殖老龄化阶段研讨会+ 10的执行摘要:解决未完成的生殖老龄化阶段议程。更年期19, 387 - 395。https://doi.org/10.1097/gme.0b013e31824d8f40(2012)。
Maki, P. M. & Henderson, V. W.认知与更年期过渡。更年期23, 803 - 805。https://doi.org/10.1097/gme.0000000000000681(2016)。
德西坎,r.s.。et al。一种自动标记系统,用于在MRI扫描上将人类大脑皮层细分为感兴趣的脑回区域。科学杂志31, 968 - 980。https://doi.org/10.1016/j.neuroimage.2006.01.021(2006)。
Fischl, B. FreeSurfer。科学杂志62, 774 - 781。https://doi.org/10.1016/j.neuroimage.2012.01.021(2012)。
确认
本研究由NIH/NIA (P01AG026572, R01AG05793, R01AG0755122), NIH/NCATS UL1TR002384,治愈阿尔茨海默病基金,妇女阿尔茨海默病运动;以及对阿尔茨海默病预防项目的慈善支持。
作者信息
作者及隶属关系
贡献
构思并策划研究(JD, RBD, LM);对数据收集有贡献(SJ, JD, ES, GJ, CBY, SP);对实验设计有概念上的贡献(JD, CA, ID, RBD, LM);参与数据分析(SJ, JD, CA, ID, LM)和数据解读(SJ, JD, CA, ID, RBD, LM);写了一个/o修改手稿(SJ, JD, LM)。所有作者都审阅了手稿。
相应的作者
道德声明
相互竞争的利益
作者声明没有利益竞争。
额外的信息
出版商的注意
施普林格自然对出版的地图和机构从属关系中的管辖权主张保持中立。
权利和权限
开放获取本文遵循知识共享署名4.0国际许可协议,允许以任何媒介或格式使用、分享、改编、分发和复制,只要您对原作者和来源给予适当的署名,提供知识共享许可协议的链接,并注明是否有更改。本文中的图像或其他第三方材料包含在文章的创作共用许可协议中,除非在材料的信用额度中另有说明。如果材料未包含在文章的创作共用许可协议中,并且您的预期使用不被法定法规所允许或超出了允许的使用范围,您将需要直接获得版权所有者的许可。如欲查看本牌照的副本,请浏览http://creativecommons.org/licenses/by/4.0/.
关于本文
引用本文
杰特,S,戴克,j。p,安迪,C。et al。性与更年期的影响31p -磁共振波谱与脑线粒体功能相关11C-PiB PET淀粉样蛋白负荷。Sci代表12, 22087(2022)。https://doi.org/10.1038/s41598-022-26573-5
收到了:
接受:
发表:
DOI:https://doi.org/10.1038/s41598-022-26573-5