摘要
在过去的十年中,膜接触位点作为细胞内许多信号的整合、调节和传输的关键角色出现,在多种病理生理环境中具有关键影响。大量的研究因此指出了线粒体-内质网接触(MERCs)在调节衰老中的作用。然而,这种作用背后的驱动细胞机制尚不清楚。最近的证据揭示,MERC调节细胞衰老,一种与促炎分泌体相关的永久增殖抑制状态,这可能介导MERC对衰老的影响。在这里,我们根据支持MERCs、细胞衰老和衰老之间相互作用的最新进展讨论这一想法。
介绍
从20世纪下半叶开始,通过电子显微镜越来越多地使用亚细胞成像已经允许识别多个细胞器和/或质膜(PM)之间的局部物理接触,称为膜接触位点(MCSs),以至于“接触学”领域在过去十年出现1,2,3.,4.事实上,最初的结构观察被扩展到指出这些MCSs在各种病理生理条件下调节细胞反应的多重功能作用4.首先,MCSs构成了细胞器之间交换代谢物(如离子或脂质)的物理桥梁,从而调节细胞内代谢通量。其次,作为动态分子微域,间充质干细胞创建亚细胞信号平台,允许局部蛋白质修饰和相互作用4.
内质网(ER)和线粒体是参与大分子合成和生物能学的两个关键细胞器,同时也参与了应激感应和细胞命运信号的整合。在真核细胞中,它们形成两个独立的网络,占细胞体积的45%5,6ER和线粒体参与多个MCSs,包括ER与PM、高尔基体或过氧化物体之间的接触,线粒体与PM、溶酶体或脂滴之间的接触4.ER和线粒体也能够通过线粒体- ER接触(MERCs)相互作用。7.
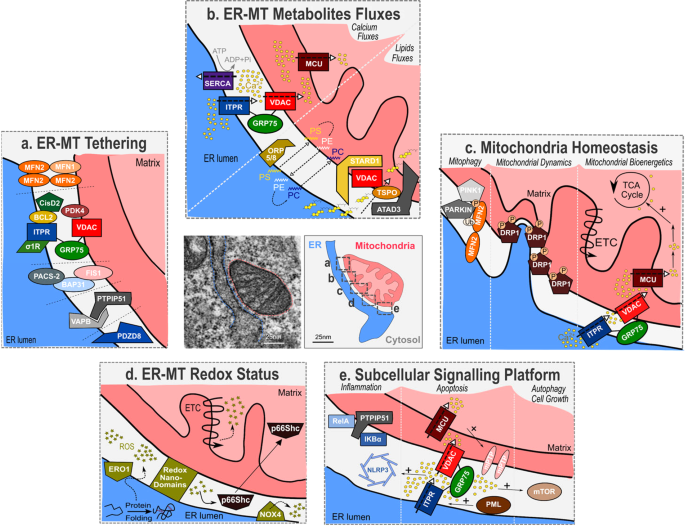
MERCs定义了内质网和线粒体外膜之间距离小于50nm的紧密接触7.MERC结构是已知存在于每一个真核细胞中的动态结构,约占所有线粒体膜的10-15%2.在组织和物种之间高度异质性,MERCs包含多达数百种蛋白质,包括拴系/结构蛋白、离子通道、转运结合蛋白、酶和其他信号蛋白2(无花果。1).首先在脂质生物合成/转移的背景下描述,MERCs的作用已在很大程度上扩展到其他代谢物通量,如钙8,9,10.MERCs参与脂质代谢、钙和氧化还原信号传递,但也调节线粒体动力学11,自噬12、炎症13和细胞凋亡9(无花果。1).
MERCs的电镜图,ER为蓝色,线粒体为红色。一个多重系链允许建立MERCs,包括MFN1/MFN2同源二聚体和异源二聚体,ITPR-GRP75-VDAC络合物,FIS1/BAP31, VAPB/PTPIP51和PDZD8。一些merc相关蛋白,包括CisD2, PACS-2, PDK4和SIGMAR1,与系索相互作用以调节merc。bMERCs处于ER和线粒体之间钙和脂质交换的十字路口。在MERCs中,ITPR、VDAC和MCU钙通道确保从ER转移到线粒体,SERCA泵从细胞质转移到ER。磷脂(PS磷脂酰丝氨酸,PE磷脂酰乙醇胺,PC磷脂酰胆碱)通过MERCs转移,特别是通过ORP5/8蛋白转移,胆固醇在被输入线粒体之前与STARD1/VDAC1/TSPO复合物结合。cMERCs主要通过线粒体自噬、线粒体裂变和线粒体生物能量学调节线粒体稳态。PINK1磷酸化MFN2,在MERCs中招募PARKIN。PARKIN泛素化MFN2启动线粒体自噬。ER将线粒体包裹在裂变起始位点并招募DRP1。钙离子从内质网转移到线粒体,为一些钙激活的TCA循环脱氢酶和转运蛋白提供燃料,以促进氧化磷酸化。dMERCs控制ER和线粒体的氧化还原状态。ERO1与蛋白质折叠氧化偶联并产生ROS (H2O2).在MERCs界面内形成氧化还原纳米畴。NAPDH氧化酶NOX4产生ROS,而p66Shc在重新定位到线粒体之前感知ROS。eMERCs作为亚细胞信号平台。NF-κB通路的成员RelA和IKκBα与PTPIP51相互作用。itpr介导的钙释放允许局部高浓度的钙,并可能参与mTOR和NLRP3的募集和激活。早幼粒细胞白血病蛋白(PML)存在于MERCs部分。
针对MERC成分的基因小鼠模型的使用强调了MERC在控制各种病理生理状况中的重要性,从血管重塑到炎症和代谢障碍13,14,15,16,17.最近,有证据表明,在特定的年龄相关疾病或衰老过程中,MERCs的数量和质量受到调节,这表明MERCs在衰老中的作用18,19,20..而自噬和细胞凋亡被认为介导了MERCs的一些年龄相关效应18,19在美国,是否还涉及其他关键机制尚不清楚。
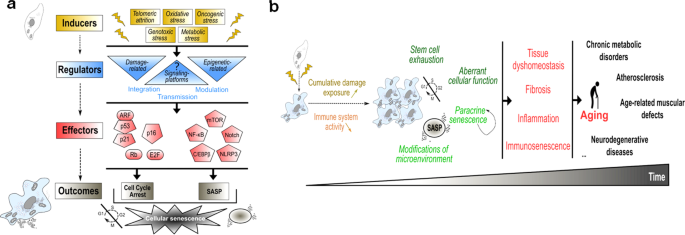
在各种动物模型中,衰老细胞在衰老过程中积累21,22.细胞衰老可以由无数的压力诱导,并定义了一种永久的细胞增殖停滞状态,同时获得衰老相关的分泌表型(SASP),包括促炎因子、促纤维化因子和金属蛋白酶23(无花果。2).机制上,增殖抑制是由周期蛋白依赖性激酶抑制剂(主要是p21和p16)的激活介导的。2).此外,SASP主要由NF-κB和C/EBPβ驱动,Notch、mTOR和NLRP3通路也可正向调控24,25,26,27(无花果。2).虽然这些因素调节细胞周期或SASP,但调节它们的上游分子和亚细胞机制在很大程度上是未知的。值得注意的是,调节应力传感和衰老效应分子激活之间联系的信号平台在很大程度上是未知的。2).
一个来自诱导因子(黄色)的多重应激信号被调控因子(蓝色)感知,包括与损伤相关的调控因子和表观遗传相关的调控因子。信号平台也可以作为主要的监管机构。这些相互连接的调控因子整合、调节并将衰老信号传递给下游效应因子,包括p53、p21、p16、Rb、E2F、NF-κB、C/EBPβ、mTOR、Notch和NLRP3(红色)。这些效应物最终触发细胞衰老的主要结果(细胞周期阻滞和SASP)(灰色)。衰老相关的分泌表型。b随着时间的推移,衰老细胞积聚在组织中,由于累积损伤暴露增加和清除减少(通过降低免疫系统活性)。这种积累导致干细胞衰竭、异常细胞反应、旁分泌衰老(放大衰老细胞积累)和周围微环境的改变。这些细胞改变导致组织平衡障碍、纤维化、全身性炎症和免疫衰老,最终导致衰老和与年龄相关的病理。
细胞衰老在早期就被认为与衰老有关,但其参与衰老的功能证明是最近才发现的。衰老过程中衰老细胞的积累是细胞内损伤增加和衰老免疫监测下降的共同结果28,29,30.(无花果。2 b).而细胞自主效应导致干细胞衰竭31,32以及异常的细胞功能33,通过SASP的非细胞自主效应可以介导旁分泌衰老并改变周围微环境。随后,衰老细胞的慢性和系统性积累有利于组织平衡障碍、纤维化、炎症或免疫衰老,最终导致衰老和年龄相关的病理,包括慢性代谢障碍、动脉粥样硬化、年龄相关的肌肉缺陷和神经退行性疾病(图2)。2 b)34,35,36.因此,寻找靶向并特异性消除衰老细胞或减弱其促炎SASP的策略,即senolytics或senomorphics,已成为衰老研究领域的主要挑战。
从这个角度来看,我们将介绍和讨论最近的进展,表明MERCs和细胞衰老在调节衰老方面的潜在相互作用。基于MERC和细胞衰老都参与衰老和年龄相关病理的事实,我们收集了MERC成分的调节或MERC形成的增加都是促衰老信号的证据。最后,我们提出了未来的研究方向,以阐明MERCs在调节细胞衰老中这一新兴作用背后的分子机制。
MERCs和细胞衰老都能控制与年龄相关的疾病和衰老
而衰老细胞在衰老过程中积累,并参与多种与年龄相关的病理21,37,38在美国,大量的线索表明,MERCs也可能在与年龄相关的疾病中发挥作用。
慢性代谢紊乱
慢性代谢紊乱,如肥胖和2型糖尿病(T2D),是与营养过剩和衰老有关的两种主要当代疾病39.高脂饮食(HFD)和肥胖病理环境促进几种细胞类型和组织的衰老,包括脂肪组织、肝脏、胰腺或大脑,促进胰岛素抵抗和T2D40,41,42,43.值得注意的是,在hfd喂养组和喂养组观察到MERCs的慢性增加ob / ob小鼠,两种模型表现出葡萄糖稳态改变,胰岛素抵抗和脂肪变性44.更引人注目的是,人造MERCs连接器的使用45能诱发这种胰岛素抵抗吗44.相反,在肌醇-三磷酸受体2 (ITPR2)不足的小鼠中,减少的MERCs能够改善葡萄糖稳态,减轻年龄依赖性脂肪变性和纤维化46.因此,降低了MERCs通过Pdk4缺失改善葡萄糖稳态和胰岛素反应47.值得注意的是,肝脏MERCs数量的减少与p16衰老标记物mRNA和蛋白水平的降低相关46已知在衰老过程中会上调37,46.显著且明显矛盾的结果是,使用遗传学和药理学方法靶向亲环素D (CypD)降低的MERCs也会扰乱肝脏和肌肉中的胰岛素反应48,49.综上所述,这些数据表明,精确平衡的MERC数字对于维持葡萄糖稳态是必要的15.
非酒精性脂肪性肝病(NAFLD)以肝脏脂肪沉积为特征,从脂肪变性演变为纤维化、肝硬化和/或肝细胞癌50.由于T2D、肥胖和衰老是NAFLD的三个主要因素,有人提出了细胞衰老的有害作用51.然而,最近的功能研究强调了一些senolytics的有害影响,即达沙替尼和槲皮素,在完全概括的NAFLD的背景下52提示细胞衰老在NAFLD中起着复杂的作用。此外,p16的消除高如果这些衰老细胞没有被替换,衰老细胞会诱导肝纤维化53.此外,肝脏恒星细胞的衰老可以抑制其促纤维化作用28,共同显示了衰老细胞在肝病中的不同作用,这可能取决于衰老细胞的类型和它们的动态54.MERCs在NAFLD中的重要性尚不清楚16.例如,进行Mfn2敲除被认为可以调节MERCs的数量,但其确切作用仍在争论中55在小鼠模型中诱导非酒精性脂肪肝(NAFLD晚期之一)。MERC在NAFLD进展中的重要性仍然需要使用特定的MERC工具进行进一步的测试。
总之,所有这些数据都有力地表明,MERCs的破坏和细胞衰老的调节处于年龄和肥胖相关的糖代谢改变和慢性肝功能障碍的十字路口(表2)1).
动脉粥样硬化
营养过剩和衰老也会促进动脉粥样硬化,是中风和缺血性心力衰竭等心血管疾病并发症的主要原因56.慢性动脉粥样硬化斑块是由内皮细胞功能障碍、氧化低密度脂蛋白(oxLDL)在血管中的积聚以及随后巨噬细胞、泡沫细胞和血管平滑肌细胞(VSMCs)的聚集形成的。动脉粥样硬化斑块中的内皮细胞、泡沫细胞和VSMCs均表现出衰老特征38,57.这些衰老细胞的分泌组抑制了内侧VSMCs的前迁移表型切换及其纤维帽组装的损伤入口58.Senolytics治疗挽救了这种前迁移表型限制性动脉粥样硬化38,58.有趣的是,最近的证据指出,oxLDL治疗VSMCs或内皮细胞会影响MERCs,特别是由于PACS-259,60,线粒体钙积累通过增加MERCs被认为是内皮细胞凋亡的加重60.然而,线粒体钙的亚致死性升高也能促进细胞衰老61,62.综上所述,作为相关性,这些数据表明动脉粥样斑块形成的早期步骤涉及MERCs调节和细胞衰老(表2)1).
与年龄相关的肌肉缺陷
肌肉老化的特征是肌肉纤维的大小和数量减少,与运动神经元的损失有关,最终导致肌肉生长平衡障碍。肌肉衰老至少部分是由肌肉干细胞中自噬缺陷的衰老途径的激活所驱动的63,64还有线粒体功能障碍65.更重要的是,衰老细胞的去除延缓了这种与年龄相关的肌肉功能丧失37.值得注意的是,据报道,衰老肌肉显示er -线粒体钙通量的减少与更高的线粒体氧化应激耦合66.在功能上,潜在的MERCs调制通过进行Mfn2基因敲除55对肌肉有不良影响并导致老年性肌肉减少症67.此外,CisD2基因敲除小鼠也表现出过早的肌肉退化68.由于与年龄相关的肌肉缺陷也可能来自神经肌肉突触的损失,有趣的是注意到神经元进行Mfn2也在衰老过程中减少,其特异性缺失是否足以引发骨骼肌萎缩69.总的来说,MERCs完整性或MERC成分似乎参与了正常的神经肌肉功能,因为MERCs解耦会导致肌肉过早老化(表2)1).
神经退行性疾病
衰老被认为是导致神经退行性疾病的主要危险因素,其中包括阿尔茨海默病(AD)、帕金森病(PD)、原发性进行性多发性硬化症(PPMS)。虽然神经元和神经胶质衰老细胞在衰老过程中积累并导致神经干细胞衰竭,但它们的消除显著改善了AD, PD和PPMS的症状70,71,72,73.MERCs也在神经退行性疾病的背景下进行了研究。在AD患者中,MERCs增强,三种参与淀粉样蛋白β生成的酶(早老素-1、早老素-2和γ-分泌酶)在MERCs上共定位74,75.此外,淀粉样蛋白β的增加诱导多种MERC成分的表达,包括ITPR3和电压依赖通道1 (VDAC1)。75,早老素-2突变体显示增加的MERCs76.重要的是,pdzd8缺失可以降低MERCs,并挽救ad相关的运动机能衰退77.在PD中,MERCs结构发生改变78大部分pd相关蛋白,如α-synuclein、Parkin或PINK1均存在于MERCs中79.此外,α-synuclein增强MERCs和线粒体钙摄取80.综上所述,这些后来的研究表明,MERCs在AD和PD中具有有害作用。值得注意的是,多项研究指出,在PD和ad相关的疾病中,MERCs也减少了,这也是这些MERCs的有益作用。例如,在AD模型中,大鼠神经元最近的活FRET成像显示紧致MERCs的平均长度减少81.在体内使用人工连接器也可以修复AD模型中果蝇的运动缺陷82.在PD背景下,α-synuclein在MERCs形成中发挥相反的作用,因为它也可以减少VAPB-PTPIP51相互作用83.此外,帕金森诱导的MFN2泛素化缺失导致了MERCs的低效耦合,而在果蝇的PD模型中,MERCs的恢复挽救了运动能力缺陷84.虽然尚无共识,但所有这些结果都支持MERCs代谢失调可能导致AD和PD。最后,在弗里德里希共济失调(FA)模型中发现了减少的MERCs,并伴有线粒体钙减少和细胞衰老85,86根据生理基础线粒体钙在维持线粒体生物能学中的重要性87.总的来说,这些数据表明,MERCs失调和细胞衰老可能与神经退行性疾病有关。尽管如此,虽然细胞衰老显示出有害的作用,但由于较少的功能研究,MERCs的作用仍在争论中(表2)1).
系统性衰老和寿命
衰老细胞在衰老过程中积累,尽管其积累的速度和水平存在多因素异质性88.如上所述,去除这些衰老细胞或降低它们的SASP会减少一些与年龄相关的改变。最重要的是,这也会导致延迟衰老,改善寿命和健康寿命37,38,89,90,91,92,93(表1).总之,细胞衰老似乎是一个关键的细胞表型驱动组织功能障碍和衰老(图。2 b).最近的综述描述了MERCs平衡障碍可能与一些与年龄相关的病理和衰老有关18,19.在MERCs代谢障碍背景下研究的遗传小鼠模型中,CypD淘汰赛,最惠国2基因敲除67,94,95,96已被大量研究,而它们在MERCs中的具体作用仍在争论中。有趣的是CypD单倍性不足,但不是CypD基因敲除小鼠的数量比对照组WT小鼠增加94.的使用寿命最惠国2只基因敲除小鼠,尽管表现出过早的肌肉衰老67没有监控。值得注意的,秀丽隐杆线虫基因的敲入延长了寿命Hsp9a,编码GRP75(葡萄糖相关蛋白75)支架蛋白通过ITPR和VDAC通道与ER和线粒体结合97.虽然没有明确的证明,但如前所述,GRP75在该模型中可能增强MERCs,其肌肉本构表达可以抵消肌肉中MERCs破坏所引起的有害影响97.最近,er -线粒体钙通量对小鼠和蠕虫衰老的贡献进行了评估。一方面,小鼠er -钙释放通道ITPR2的缺失减少了MERCs和男性和女性的年龄相关变化,只延长了女性的寿命46.另一方面,蠕虫中atf6功能的丧失导致持续的itpr介导的er -线粒体通量延长寿命98.总之,这些研究表明,MERCs和er -线粒体钙通量的平衡障碍可能促进衰老相关表型。利用针对MERC成分的遗传模型进行的研究面临重大限制。例如,是否进行Mfn2敲除减少或增加MERCs数量仍有争议55,99,One hundred.,101即使它不质疑MFN2对MERCs的贡献能力。此外,由MERC成分缺失驱动的表型在某些情况下可能与MERC无关。作为两个主要的例子,MFN2与线粒体融合有关55GRP75 (mtHsp70/Mortalin/GRP75)作为线粒体伴侣决定因子,对基质导向前体蛋白的线粒体内折叠进行质量控制,这些功能独立于它们在MERCs中的作用102.由于这些原因,未来关于MERC组成部分的工作将需要澄清MERC依赖和独立的作用。为了避免merc独立的角色,另一种选择是使用人工的merc链接器/解耦器2.通过人工连接/解耦器在体内强制或解耦MERCs是否会促进/延缓衰老,以及之前建立的与年龄相关的病理目前仍不清楚。最近的两项研究得出了结论黑腹果蝇在相同的merc相关的年龄相关病理(即AD)上报告了相互矛盾的结果。使用合成连接剂,这两项研究表明要么是一种延伸82或者说是简化77的寿命。根据这些结果,虽然有报道称增加MERCs可以改善认知功能82另一项研究表明,降低MERCs具有类似的效果,增强线粒体自噬77.因此,在体内使用特定的连接子/解耦子来阐明MERCs在生理性或病理性早衰中的功能作用是未来需要探索的一个途径(表2)1).
总的来说,这些研究表明,MERCs和细胞衰老可以控制类似的年龄相关病理,并在调节衰老方面建立了MERCs和细胞衰老的多重相关性(表2)1).这就是为什么最近出现了MERCs在促进细胞衰老中起作用的假设,该假设至少可以部分地调解MERCs对衰老的影响。有趣的是,许多研究报道了关键的MERC成分能够调节细胞衰老的特征。
MERC组件调节关键的衰老特征
MERCs在数量和活动方面是不同的。根据最近的蛋白质组学数据,在不同的细胞类型中,MERCs的组成也是高度可变的2,103,104,105,挑战了它的具体研究。尽管如此,MERCs仍然受到支架蛋白丰度的调控,定义了MERCs的数量,以及其他界面蛋白的调控,它们相互作用,包括钙通道、受体和激酶,奠定了MERCs的活性和功能。值得注意的是,MERCs的数量和活性/功能是相互关联的,因为一些酶和钙通道,如Pyruvate Dehydrogenase Kinase 4 (PDK4)和ITPRs能够调节MERCs的完整性46,47,106.最后,许多MERC成分受到蛋白质相互作用的调控,如ITPR3-TOM70107, VDAC2-CDKAP4108, ITPR2-FUNDC1109也可以通过翻译后修饰,如MAPL/MUL1的DRP1 sumo化110,这进一步增加了merc组织和功能的复杂性。
MERCs支架/栓系蛋白在细胞衰老中的作用
MERCs的建立受多种支架和系绳因子调控,包括MFN2、grp75 - itprs - vdac、FIS1-BAP31、VAPB-PTPIP51、PDZD8、CYPD和SIGMAR12,111(无花果。1).MFN1和MFN2在功能上与衰老有关112.MFN1是泛素连接酶MARCH5的靶点,并在MARCH5缺陷的细胞中积累,这些细胞表现出线粒体过度灌注和衰老特征113.相反,下调Mfn1延长复制寿命114.有关进行Mfn2,其耗竭促进B细胞淋巴瘤细胞系和小鼠胚胎成纤维细胞(mef)的细胞增殖。115.MFN2介导线粒体高灌注,促进间充质干细胞衰老116.关于造血干细胞,相反的结果强调了这一点进行Mfn2缺失导致长期淋巴再生缺陷117尽管没有研究衰老标记物。总的来说,这些数据表明,MFN1和MFN2作为MERCs数量的关键调控因子的改变能够调节衰老相关的表型。然而,MFN1和MFN2独立于MERCs,也参与线粒体融合,它们对衰老的影响是否取决于它们在MERCs中的功能尚不清楚。
关于ITPR-GRP75-VDAC复合物,GRP75过表达通过下调RAS和降低ERK2磷酸化导致复制寿命延长118,119ITPRs促进细胞衰老46,61,62,下文将进一步讨论。
BAP31是一种er驻留的伴侣跨膜蛋白,存在于MERCs部分,与FIS1形成桥接120主要是调节细胞凋亡121.尽管BAP31的功能含义从未在细胞衰老的背景下被研究过,但它的缺失减少了结肠癌细胞的增殖122并且发现它在成纤维细胞的复制和x射线诱导的衰老过程中都被上调123.
总之,关键MERC系链的改变能够驱动细胞衰老的特征。除了这些报道,还需要进一步研究其他的系链,如VAPB, PTPIP51或PDZD8,或参与MERCs结构的蛋白质,如SIGMAR1和CYPD,以确定它们是否也能调节细胞衰老。
MERC组分参与er -线粒体交换在细胞衰老中的作用
MERCs为代谢物(包括钙和脂质)的交换提供了一个特权位点,这些代谢物最近参与了细胞衰老的调节。
MERCs界面的钙交换受到多个钙通道的调控,即ER中的ITPRs (ITPR1、2、3),OMM中的vdac(1、2、3),IMM中的MCU(1、2),ER中的SERCA(1、2)(图。1).在ER界面,一些研究评估了ITPRs在功能调节细胞衰老方面的影响。ITPR2的下调导致人乳腺上皮细胞(hMECs)逃避癌基因诱导的衰老(OiS),但也延迟了正常人成纤维细胞的复制性衰老61.Itpr2敲除mef还显示与传代中线粒体钙积累减少相关的衰老标记物的减少46.更引人注目的是,如上所述,ITPR2的废除减少了一些与年龄相关的变化,增加了小鼠的寿命,也降低了细胞衰老46.对于ITPR1和ITPR3,它们的下调也能延缓衰老61.综上所述,这些数据指出了ITPRs在细胞衰老调控中的关键作用。关于VDAC1/2/3或SERCA ATPases泵,没有研究报道其在细胞衰老中的作用,与MCU相反,IMM线粒体导入钙通道可能通过itpr2释放钙参与OiS61.重要的是,MERCs减少和通过耗尽frataxin导致线粒体钙摄取不足导致成神经细胞瘤细胞衰老,这也突出了MERCs对确保最低er -线粒体钙通量的重要性85,86.
除了钙,MERCs还构成了许多其他分子的交换位点,如磷脂和胆固醇2(无花果。1).固醇结合蛋白相关蛋白5 (ORP5)和8 (ORP8)是er锚定蛋白,参与了MERCs中的磷脂交换。引人注目的是,ORP5管理磷脂和钙的转移,而ORP8的功能仅限于磷脂的转移。ORP5的本构表达促进细胞增殖124,而通过增加线粒体钙摄取,它的抑制会促进衰老125.值得注意的是,唯一的磷脂交换器ORP8的下调并不影响衰老125.
综上所述,这些结果表明,在调节衰老过程中,MERCs钙转移可能在磷脂转移中占主导地位。尽管如此,还需要对参与ER和线粒体之间脂质转移的关键MERCs蛋白进行其他功能研究,以描述它们通过MERCs在调节细胞衰老中的潜在贡献。
除了系索蛋白和转运蛋白,其他多种MERCs蛋白也在功能上参与了细胞衰老的调节,尤其是SASP的调节。在SASP调控因子中,mTOR复合物和炎症小体分别是IL1-α转译和加工所必需的25,26.有趣的是,mTOR复合体和NLRP3都存在于MERCs中126,127.值得注意的是,MERCs是胞质钙信号的热点,mTOR和NLRP3都可以被钙激活128,129.MERCs在钙介导的mTOR和NLRP3激活以及随后的SASP促进中发挥作用的假设仍然需要验证。除了mTOR和NLRP3外,两种经典的MERC定居蛋白PTIPT51和PACS-2也参与了NF-κB通路的调控,从而驱动促炎的SASP。而MERCs系带PTPIP51与RelA和IKBα相互作用130,诱导NF-κB蛋白表达Pacs-2−/−胸腺细胞通过IκBα、IκBβ和RelA的磷酸化钝化而消失131.综上所述,这些数据表明mTOR、NLRP3和NF-κB通路可以通过merc依赖的激活来调节SASP,尽管未来还需要进行更精确的研究来破译这种潜在的作用。
p66Shc主要是在衰老的背景下研究的,也与衰老有关。p66Shc的降低延缓了人类二倍体成纤维细胞的复制性衰老132,其增加促进肝细胞衰老和随后的衰老驱动的脂肪变性133.在衰老的背景下,p66Shc在老年动物的丝氨酸36上以年龄依赖的方式磷酸化,并与增强的ROS产生密切相关134.尽管p66Shc在细胞内的定位仍存在争议,通常在线粒体、merc或pm相关膜中发现,但已有研究表明,p66Shc在重新定位到线粒体之前,随着年龄的增长在merc中积累134.外源性氧化应激能够将p66Shc重新定位到细胞核,在细胞核中整合氧化应激反应以建立衰老反应135,136,137.总的来说,这些研究强调了p66Shc作为细胞衰老和寿命的传感器和调节器的作用135,136,137.
早幼粒细胞白血病蛋白(PML)是PML核体(PML- nbs)的重要组成部分,对细胞衰老有重要的调节作用138.PML不仅存在于PML- nbs中,还存在于细胞质、ER和MERCs中139.PML限制ITPR3的磷酸化,导致er -线粒体钙通量的抑制和随后的凋亡失败139.也可以考虑PML在MERCs中的定位在其促衰老功能中的可能作用。
另外两种MERCs蛋白CisD2和PACS-2也被发现调节细胞增殖抑制,这是细胞衰老的关键特征之一。CisD2是一种ER蛋白,通过Bcl2-IP3R相互作用位于MERCs界面140,是诱导多能干细胞增殖所必需的141.前文提到的PACS-2的下调能够调节NF-κB的激活,也会延迟DNA损伤- p53 - p21轴在胸腺细胞中诱导的细胞增殖阻滞142.应监测其他细胞类型和互补的衰老标记物,以更好地评估CisD2和PACS-2在调节衰老命运中的作用。
综上所述,这些数据表明,一些MERCs成分,包括系索,钙通道和其他,调节细胞衰老的关键特征(表2),但仍需证明这一行为依赖于merc。值得注意的是,一些关键的SASP调节因子被发现与MERCs接口相关并被激活,这似乎特别有趣。总的来说,这些数据有力地表明,MERCs调节衰老命运,这是一个最近已被评估的想法。
MERCs调节细胞衰老
MERCs的促衰老作用:潜在的机制
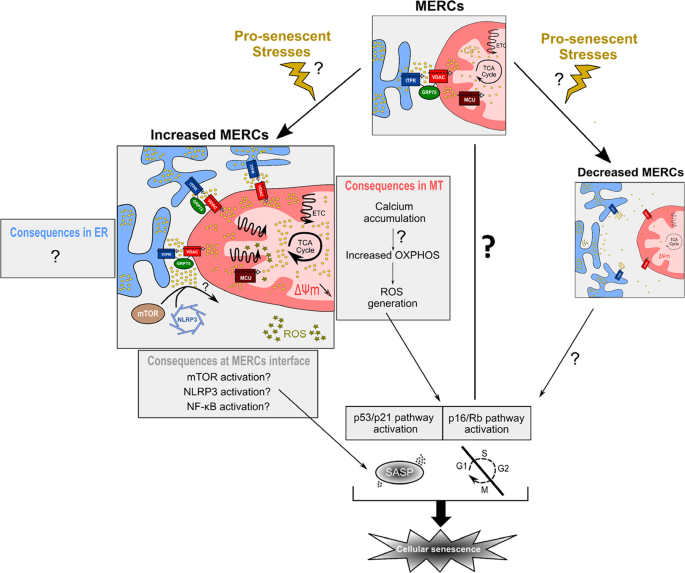
越来越多的证据表明MERCs蛋白在衰老和细胞衰老过程中的作用,提出了MERCs在调节细胞衰老中的重要性的问题。一种人工连接剂收紧ER和线粒体膜的表达45导致正常人成纤维细胞过早衰老,与NF-κ b依赖的SASP46.这种细胞衰老伴随着线粒体钙的增加,并在功能上参与ROS的产生,因为抗氧化治疗挽救了这种过早衰老的发生46.下游,p53是诱导衰老所必需的46.MERCs在已建立的衰老模型(复制性衰老、OiS、氧化应激诱导的衰老)中的重要性应在进一步的研究中得到严格的检验。
值得注意的是,merc相关蛋白(如MFN2, Frataxin或ORP5)的缺失和潜在的merc解耦也被认为是介导衰老表型的原因85,86,113,125但这些影响是否依赖于MERCs尚不清楚。为了正确评估MERCs减少是否也会影响衰老,有必要评估特定MERCs间隔物的影响,如FATE1143在衰老模型中。虽然强制MERCs通过增加线粒体钙摄取诱导ROS-和p53依赖的衰老,但MERCs解耦的相反作用仍然未知(图。3.).
在生理刺激下,MERCs允许适当的钙从ER(蓝色)转移到线粒体(红色)。在促衰老胁迫或其他刺激下,MERCs数可被修改。MERCs数量的增加(左图)导致线粒体钙积累,氧化磷酸化(OXPHOS)的潜在增加,以及ROS的增加,激活p53/p21和p16/Rb通路介导细胞周期阻滞和衰老相关分泌表型(SASP),部分由NF-κB驱动。与此同时,MERCs的增加是否会参与ER相关的表型,如ER应激,目前尚不清楚。在细胞质相关部分,增强的MERCs界面可能激活三种主要的SASP调控因子,包括mTOR、NLRP3或NF-κB亚基。最后,MERCs数量的减少(右图)是否可能调节细胞衰老,以及相关的机制仍有待进一步研究。
MERCs平衡障碍如何机制地驱动细胞衰老仍是一个悬而未决的问题,但必然涉及至少三个MERCs亚区室中的一个,即线粒体、ER和对位细胞质。
线粒体方面:大量研究报道衰老细胞显示线粒体异常,各种线粒体功能障碍促进细胞衰老112.这些线粒体功能障碍主要由非排他机制驱动,包括ETC缺陷、ROS生成过多、异常动力学和线粒体自噬改变112.然而,在细胞衰老过程中驱动这些线粒体功能障碍的上游机制迄今仍难以捉摸。
与越来越多的证据表明细胞内钙通量的作用一致,特别是在ER和线粒体之间46,61,62,144,145,钙信号似乎是介导衰老表型的一个有趣的候选者.在人类内皮细胞和mef中,复制性衰老的特征是MERCs数量的增加和随后线粒体钙的积累46,146.因此,复制性衰老神经元也显示钙从ER到线粒体的转移增加,并伴有MCU表达上调147.通过敲除ITPR2减少线粒体钙积累61,62或单片机61抑制几种细胞模型中细胞衰老的建立,包括hMEC和成纤维细胞61,62.当线粒体钙过度积累时,会导致线粒体膜去极化,产生ROS,进而导致细胞衰老46,61,62,144或细胞凋亡148.值得注意的是,线粒体钙的积累是通过降低线粒体钠来抑制线粒体钙外流+/ Ca2 +交换剂触发超氧化物生成和神经元凋亡,驱动ad相关病理149.
线粒体钙主要通过MERCs转移来调控线粒体生物能87,150,151.的确,线粒体脱氢酶存在ef手钙结合酶活性所必需的152.线粒体钙稳态是维持线粒体生物能的必要条件85,87,151,153在美国,大量的MERCs解耦也可能引发线粒体功能障碍。例如,通过降低MERCsCypD基因敲除48,154导致TCA循环和脂肪酸β氧化失调95而在这些研究中没有监测衰老标记物。有趣的是,平衡er -线粒体钙内流的重要性的双重作用已经在果蝇神经干细胞发育的背景下得到了概括。事实上,缺失Miro,一种OMM GTPase,减少线粒体钙,导致线粒体代谢障碍,而其本构表达引发线粒体钙过载和凋亡155.这两种情况都损害了神经干细胞谱系的进展,但没有研究衰老标记物155.
为了总结merc介导的线粒体钙内流在细胞衰老中的作用,似乎钙从ER转移到线粒体的改变会触发线粒体功能障碍,最终导致细胞衰老。在这一阶段,大多数数据支持细胞衰老过程中钙流入线粒体增强的假设,这可能是由增加的MERCs显著介导的,不排除减少的MERCs也可以引发促衰老信号的假设(图。3.).除了钙之外,MERCs界面的脂质通量是否参与线粒体改变促进细胞衰老仍然是一个悬而未决的问题。
除了代谢物转移,MERCs还通过ER包裹线粒体在未来的裂变位点促进线粒体裂变的早期步骤11.减少线粒体裂变能够诱导正常细胞衰老112,156,157.虽然没有明确的证据建立,但MERC解耦可能导致过度灌注的受损线粒体的裂变和随后的线粒体自噬缺陷的积累,最终介导衰老表型。然而,单独的MERC解耦是否会诱导衰老特征应该被严格地解决(图。3.).
内质网侧内质网应激也是介导衰老表型的有力候选者158.这一作用是由内质网应激在体外衰老的几个模型中观察到的事实提出的,如OiS159,160,161,162以及紫外线或x射线引起的衰老159,163,但也在一些衰老相关的病理背景下,包括淋巴瘤的治疗性衰老(TIS)164,糖尿病肾病165,年龄相关性肌肉减少症166和骨关节炎167.内质网应激可由持续未折叠蛋白反应(UPR)或腔内钙损耗引起168包括三个主要传感器:PERK, ATF6和IRE1168.有趣的是,mef中MFN2的消耗增强了内质网三个应激分支的活性169.此外,PERK与MFN2相互作用,并在MERCs片段中被发现转导ros介导的内质网应激引发的细胞凋亡170.MFN2在正常情况下能够与PERK相互作用,抑制其活性。值得注意的是,另一个er锚定的MERCs系链,即VAPB,与ATF6相互作用,抑制其靶基因的转录171.最后,IRE1调节MERCs中的脂质组成,从而调节随后的钙通量151.综上所述,这些数据表明了MERC组分与内质网应力之间的相互作用169,170.在钙通量方面,MERCs可降低ER钙含量。内质网钙是参与蛋白质折叠的伴侣蛋白(如Calreticulin或BiP/GRP78)的决定因素,内质网钙含量的变化随后导致UPR和内质网应激172.内质网应激是如何通过调节MERCs调节的,以及它是如何参与细胞衰老的,这应该在未来得到解决。
总之,这些数据有力地表明线粒体在参与衰老表型调节中的重要性,而ER的贡献仍然几乎不为人所知。最后,一些调节衰老特征的非er和非线粒体驻留蛋白可以定位在MERCs中,例如NLRP3, mTOR或PML。因此,MERCs可以通过这些蛋白质影响细胞质中的信号通路来调节细胞衰老。
MERCs:整合促衰老信号的动态平台?
MERCs不断被修饰,一些促衰老信号被证明可以影响MERCs蛋白水平。例如,在复制性衰老和x射线诱导的DNA损伤过程中,端粒上的持续DNA损伤反应在mRNA水平上上调了MERC系带BAP31123.值得注意的是,最有效的er -线粒体钙转移通道ITPR2的表达106,会被其他促衰老应激(包括致癌应激)上调61,氧化应激173或者高脂肪饮食44.除了转录和翻译调控外,一些MERCs蛋白被发现重新定位,如前面提到的p66Shc,或在应激诱导细胞衰老时被激活。综上所述,这些数据表明促衰老信号可能会改变MERCs的组成和功能。需要对不同应激诱导的细胞衰老过程中的MERCs进行蛋白质组学分析,以了解MERCs在响应促衰老信号时的组成重排。
MERCs的数量也受诱导衰老应力的影响。在内皮细胞和mef的复制衰老过程中发现了增加的MERCs46,146.MERCs的数量可能受到氧化还原应激的调节,例如,在FA模型中,抗氧化处理可以挽救MERCs的缺陷85,86.重要的是,DNA损伤促进MERCs的形成,通过增强线粒体钙摄取促进固有细胞死亡174.在亚致死剂量下,氧化应激和DNA损伤也介导细胞衰老23.
综上所述,似乎MERCs在响应促衰老信号时高度调节。为了评估MERCs在数量、组成和功能上是如何在衰老过程中进化的,需要进行进一步的研究。在诱导衰老的压力下,MERCs可以作为整合这些信号的平台,并调节信号到其他亚细胞区室,如线粒体,细胞质和细胞核,其中衰老特征受到调控。
观点与结论
综上所述,观察到MERCs和细胞衰老在衰老和年龄相关疾病中起着至关重要的作用,这导致了MERCs可能至少部分地通过细胞衰老来调节衰老的假设,事实上,实验数据支持MERCs是控制细胞衰老的关键平台。这一观点最初是由显示MERC成分在细胞衰老中的作用的研究支持的,并通过观察到用人工连接剂强迫MERC诱导体外衰老而得到加强。MERCs通过ROS的产生和p53的激活来触发这种表型。然而,merc介导的线粒体钙积累如何影响线粒体功能和ROS生成,以及是否涉及其他不依赖钙的过程仍不清楚。
人工连接器是研究MERC功能的强大工具,但也面临一些局限性。通过诱导连接剂的生成,取得了一些改进175,176与本构人工连接器相比45,46.然而,这些连接器并没有反映出MERC复杂性的许多方面。事实上,它们不允许控制ER和线粒体之间的距离(<50 nm但异质)。177.该厚度定义为分离OMM和ER的裂缝的宽度,并将MERCs细分为紧密(~10 nm)和松散(~ 25-40 nm)结构178.例如,据报道,松散的MERCs可以促进er -线粒体钙转移,而紧密的MERCs则被证明会限制它们177.除了ER与线粒体之间的距离外,MERC组成的复杂性和可塑性也决定了MERC的作用。因此,迫切需要开发新的工具来更好地操纵MERCs,以更好地理解MERCs在控制细胞衰老中的作用。
MERC失调是否为细胞衰老的起源,进而导致病理结果,尚需进一步研究。例如,需要在体内监测允许调节MERCs的连接剂和间隔剂对细胞衰老和衰老的影响。进一步的研究必须评估这些模型和体内模型中MERC成分的敲除(进行Mfn2−−/, CisD2−−/, CypD−−/, Pdk4−−/, Pacs-2−−……)如果这些连接蛋白、间隔蛋白和敲除蛋白对衰老相关改变的影响取决于细胞衰老。将这些模型与不容易衰老的模型交叉,或者用能够抑制衰老细胞特征(senomorphics)或消除衰老细胞特征(senolytics)的化合物处理它们,将精确确定MERCs改变诱导的表型中细胞衰老的重要性。
因此,我们提出调节MERCs可能是调节衰老、相关病理改变和健康寿命的新途径。衰老细胞的死亡要么可以通过增加ER与线粒体钙通量来促进,要么可以通过降低这一通量来减少它们的积累。针对MERCs的化合物已经存在179可以测试这些能力。
总之,我们提出并讨论了MERCs在调节细胞衰老中可能参与MERCs对衰老影响的潜在作用的新见解。由于它已被提出用于细胞衰老,我们提出拮抗多效性原理也可以应用于MERCs,它在严格调控时对细胞有有益作用,而在调控异常时可能是有害的,导致细胞衰老和相关后果,如衰老和年龄相关疾病。更广泛地说,这个关于MERCs在细胞衰老和衰老中的作用的新领域的研究强调了不同区域之间通信的重要性,有时通过接触位点,如MERCs进行调节。这将为研究其他MCSs(如PM-ER、PM-MT或溶酶体- mt)在细胞衰老和衰老过程中的作用铺平道路。
参考文献
赫勒,s.c.j等。膜接触位点的组织与功能。Biochim。Biophys。学报1833, 2526-2541(2013)。
Csordás, G., Weaver, D. & Hajnóczky, G.内质网-线粒体接触学:结构和信号功能。细胞生物学趋势。28, 523-540(2018)。
斯科拉诺等人。聚在一起定义膜接触点。Commun Nat。10, 1287(2019)。
Prinz, W. A., Toulmay, A. & Balla, T.膜接触位点的功能宇宙。细胞生物学。21, 7-24(2020)。
Schwarz, d.s. & Blower, m.d.内质网:结构,功能和细胞信号的反应。细胞Mol生命科学73, 79-94(2016)。
Kaasik, A., Safiulina, D., Zharkovsky, A. & Veksler, V.线粒体基质体积的调节。点。j .杂志。细胞杂志。292, c157-c163(2007)。
罗兰,A. A. & Voeltz, G. K.内质网-线粒体接触:连接的功能。细胞生物学。13, 607-615(2012)。
贝尔,巴拉斯,L. M. &科尔曼,R. A.脂质拓扑发生。脂质Res;22, 391-403(1981)。
Marchi, S.等人。线粒体和内质网钙稳态与细胞死亡。细胞钙69, 62-72(2018)。
Elustondo, P., Martin, L. A. & Karten, B.线粒体胆固醇输入。Biochim。Biophys。细胞生物学学报。脂质1862, 90-101(2017)。
弗里德曼,J. R.等。ER小管标志着线粒体分裂的位置。科学334, 358-362(2011)。这项在酵母中的研究证明了MERCs在线粒体裂变过程早期步骤中的重要性.
Yang, M.等。线粒体相关的ER膜——自噬的起源。前面。细胞发育生物学。8, 595(2020)。
密斯罗利,S.等。线粒体相关膜(MAMs)和炎症。细胞死亡。9, 1-14(2018)。
Annunziata, I., Sano, R. & d 'Azzo, A.线粒体相关ER膜(MAMs)和溶酶体储存疾病。细胞死亡。9, 328(2018)。
内质网-线粒体接触位点在葡萄糖稳态控制中的作用:最新进展。细胞死亡。9, 388(2018)。
Hernández-Alvarez, m.i.等。内质网-线粒体磷脂酰丝氨酸转移不足导致肝脏疾病。细胞177, 881 - 895。e17(2019)。
格列斯贝尔,J.等。活性星形胶质细胞中线粒体-内质网接触促进血管重塑。细胞金属底座.https://doi.org/10.1016/j.cmet.2020.03.005(2020)。
Janikiewicz, J.等。衰老和衰老中的线粒体相关膜:结构、功能和动力学。细胞死亡。9, 332(2018)。
Moltedo, O., Remondelli, P. & Amodio, G.线粒体-内质网接触及其在衰老和年龄相关疾病中的关键作用。前面。细胞发育生物学。7, 172(2019)。
佩特科维奇,M, O 'Brien, C. E. & Jan . Y. N.细胞器间通信,衰老和神经退行性变。Dev的基因。35, 449-469(2021)。
赫比格,U,费雷拉,M, Condel, L., Carey, D. & Sedivy, J. M.老化灵长类动物的细胞衰老。科学311, 1257-1257(2006)。
王,C.等。衰老小鼠组织中DNA损伤反应与细胞衰老。衰老细胞8, 311-323(2009)。
Gorgoulis, V.等人。细胞衰老:定义前进的道路。细胞179, 813-827(2019)。
Chien, Y.等。NF-κB对衰老相关分泌表型的控制促进衰老并增强化学敏感性。Dev的基因。25, 2125-2136(2011)。本文首次证实NF-κB通路在促炎SASP调控中的作用.
阿科斯塔,J. C.等。由炎性小体调节的复杂分泌程序控制旁分泌衰老。细胞生物学。15, 978-990(2013)。
Laberge R.-M。et al。MTOR通过促进IL1A翻译来调节促肿瘤性衰老相关的分泌表型。细胞生物学。17, 1049-1061(2015)。
Marín-Aguilar, F.等。抑制NLRP3炎性小体可以延长雄性小鼠的寿命并防止心脏衰老。衰老细胞19, e13050(2020)。
Krizhanovsky, V.等人。活化星状细胞的衰老限制肝纤维化。细胞134, 657-667(2008)。
Kang t.w。et al。癌前肝细胞的衰老监测限制肝癌的发展。自然479, 547-551(2011)。这项原始的研究是首批体内线索之一,证明了细胞衰老作为肿瘤抑制机制的作用.
Lujambio, A.等。p53抑制非细胞自主肿瘤。细胞153, 449-460(2013)。
刘,H.等。Wnt信号在加速衰老的哺乳动物模型中的增强。科学317, 803-806(2007)。
Castilho, r.m, Squarize, c.h., Chodosh, l.a., Williams, b.o. & Gutkind, j.s. mTOR介导wnt诱导的表皮干细胞衰竭和衰老。细胞干细胞5, 279-289(2009)。
Helman, A. et al. p16(Ink4a)诱导的胰腺β细胞衰老增强胰岛素分泌。Nat,地中海。22, 412-420(2016)。
Muñoz-Espín, D. &塞拉诺,M.细胞衰老:从生理学到病理学。细胞生物学。15, 482-496(2014)。
谢弗,M. J.等。细胞衰老介导纤维化肺疾病。Commun Nat。8, 14532(2017)。
苗,等。Wnt/β-catenin/RAS信号通路介导年龄相关肾纤维化,并与线粒体功能障碍相关。衰老细胞18, e13004(2019)。
贝克,D. J.等。清除p16ink4a阳性的衰老细胞可以延缓衰老相关的疾病。自然479, 232-236(2011)。利用转基因INK-ATTAC靶向早老性BubR1早老性小鼠背景中的衰老细胞,这项工作阐明了细胞衰老在衰老和年龄相关改变过程中的有害影响.
蔡尔兹,B. G.等。衰老的内膜泡沫细胞在动脉粥样硬化的所有阶段都是有害的。科学354, 472-477(2016)。
斯皮内利,R.等人。慢性代谢性疾病衰老的分子基础。j .性。投资。43, 1373-1389(2020)。
Ogrodnik等人。细胞衰老驱动年龄依赖性肝脏脂肪变性。Commun Nat。8, 15691(2017)。
Ogrodnik等人。肥胖引起的细胞衰老会导致焦虑并损害神经发生。细胞金属底座。https://doi.org/10.1016/j.cmet.2018.12.008(2019)。
Aguayo-Mazzucato, C.等。β细胞衰老加速决定糖尿病,衰老改善疾病结局。细胞金属底座。30., 129 - 142。e4(2019)。
帕尔默,a.k.等人。靶向衰老细胞缓解肥胖引起的代谢功能障碍。衰老细胞0, e12950(2019)。
阿鲁达,a.p.等。肥胖患者肝脏er -线粒体接触位点的慢性富集导致钙依赖性线粒体功能障碍。地中海Nat。20., 1427-1435(2014)。研究ob / ob本研究首次证实了MERCs升高与葡萄糖代谢障碍之间的相关性。其次,利用体内合成的连接剂,本研究从功能上强调了MERCs和itpr依赖的钙通量在调节葡萄糖稳态中的作用.
Csordás, G.等。内质网与线粒体物理连接的结构功能特征及意义。J.细胞生物学。174, 915-921(2006)。
齐格勒,D. V.等。钙通道ITPR2和线粒体- er接触促进细胞衰老。Commun Nat。12, 720(2021)。
Thoudam, T.等人。肥胖期间,PDK4增强er -线粒体接触抑制骨骼肌胰岛素信号。糖尿病68, 571-586(2019)。
塔布斯,E.等。线粒体相关内质网膜(MAM)的完整性是胰岛素信号传递所必需的,并与肝脏胰岛素抵抗有关。糖尿病63, 3279-3294(2014)。
塔布斯,E.等。线粒体相关内质网膜(MAM)完整性的破坏有助于小鼠和人类的肌肉胰岛素抵抗。糖尿病67, 636-650(2018)。
Musso, G, Gambino, R. & Cassader, M.非酒精性脂肪性肝病(NAFLD)肝脏脂质代谢的最新研究进展。掠夺。脂质物。48, 1-26(2009)。
Papatheodoridi, a m。,Chrysavgis, L., Koutsilieris, M. & Chatzigeorgiou, A. The role of senescence in the development of nonalcoholic fatty liver disease and progression to nonalcoholic steatohepatitis.肝脏病学71, 363-374(2020)。
拉斐尔等人。senolytic鸡尾酒达沙替尼+槲皮素对肥胖和年龄依赖性肝病进展的轻度加重。细胞Commun。信号。19, 44(2021)。本研究首次研究senolytics(达沙替尼+槲皮素)在nafld诱导的HCC模型中的应用。对这种治疗提出质疑,作者证明在年龄相关的nafld诱导的HCC中使用senolytics没有任何影响,甚至是有害的影响.
格罗斯,L.等。高衰老细胞类型是小鼠健康寿命不可或缺的。细胞金属底座。32, 87 - 99。e6(2020)。
胡达,N.等。肝脏衰老,有好有坏。世界J.胃肠醇。25, 5069-5081(2019)。
菲拉迪,R. Pendin, D. & Pizzo, P. Mitofusin 2:从功能到疾病。细胞死亡。9, 330(2018)。
王,J. C. & Bennett, M.衰老和动脉粥样硬化:机制,功能后果,细胞衰老的潜在治疗方法。中国保监会,Res。111, 245-259(2012)。
Gorenne, I., Kavurma, M., Scott, S. & Bennett, M.动脉粥样硬化中的血管平滑肌细胞衰老。Cardiovasc。Res。72, 9-17(2006)。
蔡尔兹,B. G.等。衰老细胞抑制动脉粥样硬化中固有的平滑肌细胞修复功能。Nat老化。1, 698-714(2021)。
穆利斯等人。多功能分选蛋白PACS-2通过线粒体- er接触位点控制人血管平滑肌细胞中线粒体体的形成。细胞8, 638(2019)。
Yu, S.等。PACS2通过调节线粒体相关ER膜的形成和线粒体Ca2+的升高,在ox- ldl诱导的内皮细胞凋亡中是必需的。Exp. Cell Res。379, 191-202(2019)。
Wiel, C.等人。内质网通过ITPR2通道释放钙导致线粒体钙积累和衰老。Commun Nat。5, 3792(2014)。
马,x等人。核受体RXRA通过调节钙信号来控制细胞衰老。衰老细胞17, e12831(2018)。
索萨-维克多,P.等人。老年肌肉干细胞将可逆的静止转变为衰老。自然506, 316-321(2014)。
García-Prat, L.等。自噬通过防止衰老来维持茎干。自然529, 37-42(2016)。
Habiballa, L., Salmonowicz, H. & Passos, J. F.线粒体和细胞衰老:对肌肉骨骼衰老的影响。自由·拉迪奇。医学杂志。地中海。132, 3-10(2019)。
Fernandez-Sanz, C.等人。老年小鼠心肌肌浆网-线粒体钙交换缺陷。细胞死亡。5, e1573(2014)。
Sebastián, D.等。Mfn2缺乏将年龄相关的肌肉减少症和自噬受损与自适应自噬途径的激活联系起来。EMBO J。35, 1677-1693(2016)。
陈,Y.-F。et al。Cisd2缺乏导致小鼠过早衰老,并导致线粒体介导的缺陷。Dev的基因。23, 1183-1194(2009)。
王,L.等。Mitofusin 2调节calpastatin的轴突转运以防止骨骼肌神经肌肉突触消除。细胞金属底座。28, 400 - 414。e8(2018)。
Bussian, T. J.等。清除衰老的神经胶质细胞可以防止tau依赖性病理和认知能力下降。自然562, 578(2018)。
钦塔,S. J.等。细胞衰老是由环境神经毒素百草枯引起的,并有助于与帕金森病相关的神经病理。细胞的代表。22, 930-940(2018)。
Nicaise, a.m.等。在进行性多发性硬化症中,祖细胞的衰老有助于减少脱髓鞘潜能。国家科学院学报美国116, 9030-9039(2019)。
张,P.等。Senolytic治疗缓解a β相关少突胶质细胞祖细胞衰老和阿尔茨海默病模型的认知缺陷。Nat。>。22, 719(2019)。
Area-Gomez, E.等人。阿尔茨海默病中线粒体相关ER膜功能上调。EMBO J。31, 4106-4123(2012)。这项原创工作首次关注了MERCs在神经退行性疾病中的重要性,并为其他多项研究铺平了道路.
Hedskog, L.等人。阿尔茨海默病内质网-线粒体界面的调节及其相关模型。国家科学院学报美国110, 7916-7921(2013)。
Filadi, R.等。早衰素2通过调节Mitofusin 2的拮抗作用调节内质网-线粒体耦合。细胞的代表。15, 2226-2238(2016)。
休伊特,V. L.等。在神经元中减少pdzd8介导的线粒体- er接触可以通过增加线粒体自噬来改善适应性。预印在bioRxivhttps://doi.org/10.1101/2020.11.14.382861(2020)。
李,K.-S。et al。改变er -线粒体接触影响线粒体钙稳态,并在疾病模型中导致体内神经退行性变。国家科学院学报美国115, e8844-e8853(2018)。
Gómez-Suaga, P.佩德罗,j.m.b.s。,González-Polo, R. A., Fuentes, J. M. & Niso-Santano, M. ER–mitochondria signaling in Parkinson’s disease.细胞死亡。9, 1-12 (2018)
Calì, T., Ottolini, D., Negro, A. & Brini, M. α-突触核蛋白通过增强内质网-线粒体相互作用控制线粒体钙稳态。生物。化学。287, 17914-17929(2012)。
马蒂诺·阿达米,P. V.等。在模拟阿尔茨海默病淀粉样蛋白病理的活神经元中,紊乱的线粒体- er接触。细胞科学。132(2019)。
garrito - maraver, J., Loh, s.h.y. & Martins, L. M.在阿尔茨海默病果蝇模型中,强迫线粒体和内质网之间的接触延长寿命。医学杂志。开放9, bio047530(2020)。这项在果蝇中使用合成连接物的体内工作,在阿尔茨海默病模型中构成了MERCs在寿命中有益作用的第一个证据.
Paillusson, S.等。突触核蛋白结合er -线粒体系结蛋白VAPB,破坏Ca2+稳态和线粒体ATP的产生。Acta Neuropathol。134, 129-149(2017)。
巴索,V.等。Parkin通过Mfn2调控er -线粒体接触。杂志。Res。138, 43-56(2018)。
Bolinches-Amorós, A., Mollá, B., Pla-Martín, D., Palau, F. & González-Cabo, P.由frataxin缺乏症引起的线粒体功能障碍与细胞衰老和钙代谢异常有关。前细胞神经科学8124(2014)。
Rodríguez, L. R.等。在弗里德里希共济失调模型中,氧化应激调节内质网-线粒体接触的重排和钙的失调。氧化还原杂志。37, 101762(2020)。
Cárdenas, C.等。组成型InsP3受体Ca2+转移到线粒体对细胞生物能的基本调节。细胞142, 270-283(2010)。这项研究强调了最低限度的er -线粒体钙通量对维持足够的线粒体生物能量的作用.
塔特尔,c.s.l.等。各种人体组织中的细胞衰老和年龄:系统回顾和荟萃分析。衰老细胞19, e13083(2020)。这篇综述构成了第一个将各种组织中年龄和衰老标记物相关的荟萃分析,这些标记物是衰老细胞积累的组织特异性。
法尔,J. N.等人。靶向细胞衰老可以防止小鼠与年龄相关的骨质流失。地中海Nat。23, 1072-1079(2017)。
杜尔森,j·m·范。健康长寿的Senolytic疗法。科学364, 636-637(2019)。
Griveau, A, Wiel, C, Ziegler, D. V, Bergo, M. O. & Bernard, D. JAK1/2抑制剂ruxolitinib延缓过早衰老表型。衰老细胞19, e13122(2020)。
Beaulieu, D.等人。磷脂酶a2受体1促进阻塞性肺病肺细胞衰老和肺气肿欧元。和。J.2000752https://doi.org/10.1183/13993003.00752-2020(2021)。
张艳,张娟,王生。雷帕霉素通过延缓器官衰老延长健康寿命的作用。老化决议案70, 101376(2021)。
Vereczki, V.等。亲环素D调节小鼠大脑中衰老标记物的寿命和蛋白表达。线粒体34, 115-126(2017)。
Tavecchio, M., Lisanti, S., Bennett, M. J., Languino, L. R. & Altieri, D. C.亲环素D缺失损害β-氧化并促进葡萄糖代谢。科学。代表.5, 15981(2015)。
Shum, L. C.等。亲环素D敲除的小鼠对骨质疏松症和衰老骨骼中观察到的代谢变化表现出增强的抵抗能力。《公共科学图书馆•综合》11, e0155709(2016)。
横山,K.等。通过敲入额外的hsp70F拷贝来延长秀丽隐杆线虫的寿命,hsp70F是mot-2 (mortalin)/mthsp70/Grp75的同源物。2月。516, 53-57(2002)。
Burkewitz, K.等人。Atf-6通过er -线粒体钙稳态调节寿命。细胞的代表。32, 108125(2020)。
de Brito, o.m. & Scorrano, L. Mitofusin 2将内质网拴在线粒体上。自然456, 605-610(2008)。
Filadi, R.等。Mitofusin 2消融增加内质网-线粒体耦合。国家科学院学报美国112, e2174-e2181(2015)。
Leal, n.s.等人。Mitofusin-2敲除增加er -线粒体接触,减少淀粉样β-肽的产生。j .细胞。摩尔。地中海。20., 1686-1695(2016)。
Srivastava, S., Vishwanathan, V., Birje, A., Sinha, D. & D 'Silva, P.线粒体Hsp70伴侣系统在细胞存活和衰老中相互作用的演化范式。暴击。学生物化学启。摩尔。杂志。54, 517-536(2019)。
曹,I.-T。et al。抗坏血酸过氧化物酶接近标记结合生化分类学鉴定内质网-线粒体接触启动子。生物。化学。292, 16382-16392(2017)。
Cho, K. F.等。Split-TurboID能够在细胞中实现依赖于接触的接近标记。国家科学院学报美国117, 12143-12154(2020)。
Kwak, C.等。contact - id是一种分析细胞器接触位点的工具,揭示了线粒体相关膜形成的调节蛋白。国家科学院学报美国117, 12109-12120(2020)。
巴托克等人。ip3受体异构体以不同方式调节er -线粒体接触和局部钙转移。Commun Nat。10, 1-14(2019)。
Filadi, R.等。TOM70通过促进ip3r3介导的ER向线粒体Ca2+转移来维持细胞生物能。咕咕叫。医学杂志。28, 369 - 382。e6(2018)。
原田,T.等。棕榈酰化的CKAP4通过与VDAC2在er -线粒体接触位点的相互作用调节线粒体功能。细胞科学。133, jcs249045(2020)。
吴,S.等。FUN14含1结构域与线粒体相关内质网膜肌醇1,4,5-三磷酸受体结合,在体内维持心脏线粒体动力学和功能。循环136, 2248-2266(2017)。
审慎,J.等人。Drp1的MAPL sumo化稳定了细胞死亡所需的ER/线粒体平台。摩尔。细胞59, 941-955(2015)。
平林,Y.等人。PDZD8的er -线粒体拴系调节哺乳动物神经元中的Ca2+动态。科学358, 623-630(2017)。
齐格勒,d.v.,威利,c.d.和维拉德,m.c.细胞衰老的线粒体效应:超越衰老的自由基理论。衰老细胞14, 1-7(2015)。
公园,y y。et al。MARCH5线粒体E3泛素连接酶的缺失通过动力相关蛋白1和丝裂蛋白1诱导细胞衰老。j .细胞。科学。123, 619-626(2010)。
儿子,J. M.等。衰老过程中线粒体蛋白1和视神经萎缩1将代谢转变为线粒体呼吸。衰老细胞16, 1136-1145(2017)。
陈,K.-H。et al。丝裂蛋白2 (Mfn2)在控制细胞增殖中的作用。美国实验生物学学会联合会J。28, 382-394(2014)。
李,X.等。FGF21通过调节线粒体动力学介导间充质干细胞衰老。氧化物。医学,龙格夫细胞。2019, 4915149(2019)。
卢奇辛格,L. L.,德·阿尔梅达,M. J.,科里根,D. J.,穆莫,M. &斯诺克,H.-W.。Mitofusin 2维持具有广泛淋巴潜能的造血干细胞。自然529, 528-531(2016)。
Kaul, S. C., Yaguchi, T., Taira, K., Reddel, R. R. & Wadhwa, R.过表达mortalin (mot-2)/mthsp70/GRP75和hTERT合作延长人成纤维细胞的体外寿命。Exp. Cell Res。286, 96-101(2003)。
Wadhwa, R., Yaguchi, T., Hasan, M. K., Taira, K. & Kaul, S. C. Mortalin-MPD(甲戊酸焦磷酸脱羧酶)的相互作用及其在控制细胞增殖中的作用。物化学。Biophys。Commun >,302, 735-742(2003)。
Iwasawa, R., Mahul-Mellier, A.-L。,Datler, C., Pazarentzos, E. & Grimm, S. Fis1 and Bap31 bridge the mitochondria-ER interface to establish a platform for apoptosis induction.EMBO J。30., 556-568(2011)。
奎斯特加德,e.m. BAP31:疾病中的生理功能和作用。Biochimie186中国农业科学,2015,29(2021)。
徐,K.等。MiR-451a抑制BAP31可通过诱导大肠癌内质网应激抑制增殖,增加凋亡。细胞死亡。10, 1-16(2019)。
Tang, H.等。单个衰老细胞测序揭示了端粒侵蚀引起的衰老细胞的异质性。蛋白细胞10, 370-375(2019)。
Du, x等。oxy固醇结合蛋白相关蛋白5 (ORP5)通过激活mTORC1信号通路促进细胞增殖。生物。化学。293, 3806-3818(2018)。
Rochin, L.等人。ORP5在内质网-线粒体膜接触位点调控脂质和钙向线粒体的运输。预印在bioRxivhttps://doi.org/10.1101/695577(2019)。
Zhou, R., Yazdi, a.s., Menu, P. & Tschopp, J.线粒体在NLRP3炎性小体激活中的作用。自然469, 221-225(2011)。
Betz, C. et al. mTOR复合物2-Akt信号通路在线粒体相关内质网膜(MAM)调控线粒体生理。国家科学院学报美国110, 1226 - 12534(2013)。本研究强调了mTOR复合物的MERCs定位,及其通过akt依赖的IP3R、己糖激酶2和磷酸呋喃酸簇分选蛋白2磷酸化调节MERCs生理的作用.
村上,T.等。钙动员在NLRP3炎性小体激活中的关键作用。国家科学院学报美国109, 11282-11287(2012)。
Ito, N, Ruegg, U. T. & Takeda, S. atp诱导的细胞内钙水平的增加和mTOR的随后激活作为骨骼肌肥大的调节因子。Int。理学。19, 2804(2018)。
Brobeil, A.等。ptpip51与NFκB信号通路的新关系。生物分子5, 485-504(2015)。
Barroso-González, J.等。PACS-2介导ATM和NF-κ b依赖的抗凋亡Bcl-xL对DNA损伤的响应。细胞死亡不同。23, 1448-1457(2016)。
Xu, F.等人let-7- repressed Shc翻译延迟复制性衰老。衰老细胞13, 185-192(2014)。
张,J.等。p66shc介导的肝细胞衰老调控对非酒精性脂肪性肝病肝脏脂肪变性的影响医学科学。Monit。26, e921887(2020)。
Lebiedzinska, M., Duszynski, J., Rizzuto, R., Pinton, P. & Wieckowski, m.r.器官和小鼠组织中p66Shc和丝氨酸36-磷酸化p66Shc水平的年龄相关变化。拱门。物化学。Biophys。486, 73-80(2009)。
Migliaccio, E.等人。p66shc适配蛋白控制哺乳动物的氧化应激反应和寿命。自然402, 309-313(1999)。
Trinei, M.等人。p53-p66Shc信号通路控制细胞内氧化还原状态、氧化损伤DNA水平和氧化应激诱导的细胞凋亡。致癌基因21, 3872-3878(2002)。
平顿等人。蛋白激酶C β和脯氨酸异构酶1调节寿命决定因素p66Shc的线粒体效应。科学315, 659-663(2007)。
皮尔逊等人。PML可调节致癌Ras诱导的p53乙酰化和过早衰老。自然406, 207-210(2000)。
乔吉,C.等人。PML通过调节钙释放调节内质网细胞凋亡。科学330, 1247-1251(2010)。这项工作证明了PML在MERCs中介导ipr3r磷酸化和钙介导的细胞凋亡的重要性.
Chang N. C, Nguyen M., Germain, M. & Shore, g.c . BCL-2在内质网拮抗Beclin 1依赖的自噬需要naf1。EMBO J。29, 606-618(2010)。
蔡,林志信。et al。cisd2缺陷小鼠诱导多能干细胞中线粒体功能失调和成骨分化。干细胞开发。24, 2561-2576(2015)。
阿特金斯,k.m.等人。多功能分选蛋白PACS-2调节sirt1介导的p53去乙酰化,以调节p21依赖的细胞周期阻滞。细胞的代表。8, 1545-1557(2014)。
Doghman‐Bouguerra,等人。FATE1通过解耦ER和线粒体拮抗钙和药物诱导的细胞凋亡。EMBO代表。17, 1264-1280(2016)。
马丁,N. &伯纳德,D.钙信号与细胞衰老。细胞钙70, 16-23(2018)。
Farfariello, V., Iamshanova, O., Germain, E., Fliniaux, I. & Prevarskaya, N.癌症中的钙稳态:衰老的焦点。Biochim。Biophys。学报1853, 1974-1979(2015)。
Madreiter-Sokolowski, C. T.等。衰老过程中增强的室间Ca2+通量调节线粒体代谢和凋亡阈值。氧化还原杂志。20., 458-466(2018)。
Calvo-Rodríguez, M., García-Durillo, M., Villalobos, C. & Núñez, L.体外衰老促进内质网(ER)-线粒体Ca2+相声和大鼠海马神经元中存储操作Ca2+入口(SOCE)的损失。Biochim。Biophys。学报1863, 2637-2649(2016)。
Kerkhofs等人。化疗中的新兴分子机制:线粒体相关内质网膜上ca2 +信号通路。细胞死亡。9, 1-15 (2018)
Jadiya, P.等。在阿尔茨海默病模型中,受损的线粒体钙外排有助于疾病进展。Commun Nat。10, 3885(2019)。
Rizzuto, R., De Stefani, D., Raffaello, A. & Mammucari, C.线粒体作为钙信号的传感器和调节器。细胞生物学。13, 566-578(2012)。
Carreras-Sureda, A.等。IRE1α的非典型功能决定线粒体相关内质网组成,以控制钙转移和生物能学。细胞生物学。21, 755-767(2019)。
钙离子对线粒体脱氢酶的调控。Biochim。Biophys。学报1787, 1309-1316(2009)。
好极了,r等人。ER-线粒体耦合的增加促进了ER应激早期阶段的线粒体呼吸和生物能量学。j .细胞。科学。124, 2143-2152(2011)。
Rieusset, J.等人。钙从内质网转移到线粒体的中断将线粒体相关内质网膜完整性的改变与肝脏胰岛素抵抗联系起来。Diabetologia59, 614-623(2016)。
李,S.等。Polo激酶磷酸化Miro以控制神经干细胞发育中的er -线粒体接触位点和线粒体Ca(2+)稳态。Dev细胞。37, 174-189(2016)。
尹,Y.-S。et al。dfo诱导的细胞衰老中细长巨型线粒体的形成:通过调节Fis1参与增强的融合过程。j .细胞。杂志。209, 468-480(2006)。
李,S.等。线粒体裂变和融合介质hFis1和OPA1调节细胞衰老。生物。化学。282, 22977-22983(2007)。
Abbadie, C. & Pluquet, O.未折叠蛋白反应(UPR)控制主要衰老特征。学生物化学的发展趋势。科学。45, 371-374(2020)。
金,H. S.等人。p38激活的内质网应激- atf6 α轴介导细胞衰老。美国实验生物学学会联合会J。33, 2422-2434(2019)。
陈,H.等。MacroH2A1和ATM在旁分泌衰老和衰老相关的分泌表型中起相反的作用。摩尔。细胞59, 719-731(2015)。
Blazanin, N.等人。内质网应激和不同输出的IRE1α RNase控制增殖和衰老响应致癌Ras。国家科学院学报美国114, 9900-9905(2017)。
Drullion, C.等。通过衰老逃避的恶性转化被未折叠蛋白反应的PERK和ATF6alpha分支阻止。癌症。438, 187-196(2018)。
Panganiban, R. A. M., Mungunsukh, O. & Day, R. M. x射线照射诱导内质网应激、凋亡和肺动脉内皮细胞衰老。Int。j . Radiat。医学杂志。89, 656-667(2013)。
Dörr, J. R.等。肿瘤治疗中细胞衰老的合成致死性代谢靶点。自然501, 421-425(2013)。这项原创工作阐明了衰老细胞与非衰老细胞相比代谢活性变化的重要性,并可进一步用作潜在的未来治疗靶点.
刘,J.等。内质网应激调节的ATF4/p16信号通路对糖尿病肾病肾小管上皮细胞早衰老的影响点。j .杂志。细胞杂志。308, c621-c630(2015)。
泰兹,C.等人。肌肉中与年龄相关的OPA1缺失会影响肌肉质量、代谢稳态、全身炎症和上皮细胞衰老。细胞金属底座。25, 1374 - 1389。e6(2017)。
刘,Y.等。内质网应激参与骨关节炎软骨细胞的衰老和凋亡过程。物化学。Biophys。Commun >,491, 368-373(2017)。
Hetz, C.未折叠蛋白反应:在内质网应激及应激后控制细胞命运的决定。细胞生物学。13, 89-102(2012)。
Muñoz, J. P.等。Mfn2通过抑制PERK调节UPR和线粒体功能。EMBO J。32, 2348-2361(2013)。
Verfaillie, T.等。基于ros的内质网应激后,ER-线粒体接触位点需要PERK来传递细胞凋亡。细胞死亡不同。19, 1880-1891(2012)。
Gkogkas, C.等。VAPB与ATF6相互作用并调节其活性。嗡嗡声。摩尔,麝猫。17, 1517-1526(2008)。
Krebs, J., Agellon, L. B. & Michalak, M. Ca(2+)稳态和内质网(ER)应激:钙信号的综合观点。物化学。Biophys。Commun >,460, 114-121(2015)。
Bánsághi, S.等。活性氧对肌醇1,4,5-三磷酸(IP3)受体的异构体和物种特异性控制。生物。化学。289, 8170-8181(2014)。
郑,P.等。DNA损伤触发管状内质网延伸,通过促进er -线粒体信号通路促进细胞凋亡。细胞Res。28, 833-854(2018)。
Csordás, G.等。er -线粒体界面的细胞器间接触和局部钙动力学成像。摩尔。细胞39, 121-132(2010)。
Booth, D. M., Enyedi, B., Geiszt, M., Várnai, P. & Hajnóczky, G.氧化还原纳米域是由er -线粒体界面的钙信号诱导和控制的。摩尔。细胞63, 240-248(2016)。
Giacomello, M. & Pellegrini, L.线粒体- er接触的成熟:厚度的问题。细胞死亡不同。23, 1417-1427(2016)。
Cieri, D.等人。SPLICS:一种用于窄和宽异型细胞器并置的分裂绿色荧光蛋白接触位点传感器。细胞死亡不同。25, 1131-1145(2018)。
Magalhães雷贝洛,a.p.等。线粒体-内质网接触位点的化学调节。细胞9, 1637(2020)。本文综述了可药靶点在调节MERCs功能中的重要性,为进一步研究MERCs的重要性开辟了新的视角.
尤瑟夫扎德,m.j.等人。非塞丁是一种sentherapy,可以延长健康和寿命。EBioMedicine36, 18-28(2018)。
徐,M.等。Senolytics的用法和样例:Senolytics的用法和样例:Nat,地中海。24, 1246-1256(2018)。
确认
我们感谢ARC基金会和研究基金会Médicale (FRM)的支持。
作者信息
作者及隶属关系
贡献
D.V.Z、N.M.和D.B.从这个角度构想了这些概念。D.V.Z.在N.M.和D.B.的协助下绘制了图表,并撰写了引言部分和主要主题部分,N.M.和D.B.在D.V.Z.的协助下撰写了展望/结论部分
相应的作者
道德声明
相互竞争的利益
作者声明没有利益竞争。
额外的信息
同行评审信息通信生物学感谢J. Cesar Cardenas和其他匿名审稿人对本工作的同行评审所作的贡献。主要处理编辑:Eve Rogers。
出版商的注意施普林格自然对出版的地图和机构从属关系中的管辖权主张保持中立。
权利和权限
开放获取本文遵循知识共享署名4.0国际许可协议(Creative Commons Attribution 4.0 International License),允许以任何媒介或格式使用、分享、改编、分发和复制,只要您对原作者和来源给予适当的署名,提供知识共享许可协议的链接,并注明是否有更改。本文中的图像或其他第三方材料包含在文章的创作共用许可中,除非在材料的信用额度中另有说明。如果内容未包含在文章的创作共用许可协议中,并且您的预期使用不被法定法规所允许或超出了允许的使用范围,您将需要直接获得版权所有者的许可。要查看此许可证的副本,请访问http://creativecommons.org/licenses/by/4.0/.
关于本文
引用本文
齐格勒,d.v.,马丁,N. &伯纳德,D.细胞衰老联系线粒体-内质网接触和衰老。Commun杂志4, 1323(2021)。https://doi.org/10.1038/s42003-021-02840-5
收到了:
接受:
发表:
DOI:https://doi.org/10.1038/s42003-021-02840-5