摘要
肌萎缩蛋白是骨骼肌和心肌细胞中肌萎缩蛋白-糖蛋白复合物(DGC)的中心蛋白。肌萎缩蛋白连接肌动蛋白骨架和细胞外基质(ECM)。切断ECM和细胞内细胞骨架之间的联系对骨骼肌细胞的稳态有毁灭性的影响,导致一系列肌肉营养不良。此外,DGC功能缺失可导致进行性扩张型心肌病和过早死亡。Dystrophin作为分子弹簧,DGC在维持肌膜的完整性方面起着关键作用。此外,越来越多的证据表明DGC与机械信号传导有关,尽管这一作用尚不清楚。本文旨在提供DGC及其在机械传导中的作用的最新观点。我们首先讨论肌肉细胞力学和功能之间的复杂关系,然后检查肌营养不良蛋白糖蛋白复合体在机械传导和维持肌肉细胞生物力学完整性中的作用的最新研究。最后,我们回顾了目前的文献,以绘制出DGC信号通路如何与机械信号通路交叉,以突出潜在的未来干预点,特别是关注心肌病。
简介
细胞与微环境保持着持续的交流,两者之间的双向对话对于生物力学信息的解释和整合至关重要。生物力学控制关键的下游事件(例如,细胞骨架重排),在空间和时间上指导整体细胞表型。在心肌细胞中,这一过程的中心是肋间区,即肌膜与肌节连接的区域,由整合素-他林-温库素和肌营养不良蛋白-糖蛋白复合物(DGC)组成。这些离散灶性粘连(FA)连接到细胞内的细胞骨架,传播一系列生物力学和生化细胞变化,控制分化、增殖、器官发生、迁移、疾病进展等。将生物力学力转化为生物化学和/或(表观)遗传变化称为机械转导1.
整合素跨膜受体2一直被认为是ECM的锚定细胞,以及介导由内而外和由外而内的信号传递。与整合素平行,DGC将ECM连接到细胞骨架,从而在细胞外部和内部之间建立关键连接3..全长肌萎缩蛋白(Dp427)主要在心脏和骨骼肌中表达,但也在中枢神经系统组织中观察到,包括视网膜和浦肯野病组织4.整合素和DGC的突变已被证实是肌肉营养不良症和进行性扩张型心肌病(DCM)的原因(表2)1)5,6.具体来说,基因突变DMD它编码DGC的中心蛋白质,dystrophin,导致杜氏肌营养不良症(DMD)7.DGC由几个亚复合物组成,包括α-,和β-营养不良聚糖(α/β-DG),肌聚糖-肌膜,合营养蛋白,以及营养不良蛋白8.
营养不良蛋白是一种细胞骨架蛋白DMD(Xp21.1-Xp22),在维护DGC方面发挥核心作用。DGC维持肌膜(横纹肌组织的质膜)的完整性。肌萎缩蛋白通过分子弹簧和分子支架的作用进一步减轻收缩性损伤9,10.全长dystrophin的分子量为427 kDa,但由于其内部存在多个启动子DMD,包括Dp71在内的几种自然截断亚型存在11.
辅助蛋白已被证明定位于肌萎缩蛋白,包括真正的机械传感器,如神经元一氧化氮合酶(nNOS), yes相关蛋白(YAP)和小穴蛋白-3,因此代表了细胞信号传递的重要联系12,13,14.除了粘连体,与细胞-基质相互作用相关的细胞机制,由整合素及其下游靶标形成,这两个复合物代表了细胞“内部”和“外部”之间的关键界面。这些局灶性粘连不被异常破坏对于细胞的行为和存活是至关重要的。此外,有证据支持营养不良蛋白作为机械敏感离子通道的调节器,包括拉伸激活通道,特别是l型钙2 +通道和TRPC通道15.
虽然肌营养不良蛋白对横纹肌细胞的稳态功能很重要,但其确切的基础机制尚不明显,尤其是肌营养不良蛋白的作用及其作为机械传感器和机械保护者的能力。与肌萎缩蛋白缺失相关的几个悬而未决的问题已经出现,包括:细胞骨架结构的改变可能导致细胞粘弹性的改变,这可能与细胞抑制对抗ECM的收缩力的能力有关10;是肌膜上定位错误的机械敏感蛋白,例如YAP和AMPK;是否与整合素存在交叉信号,可能导致肌萎缩蛋白缺失时机械传导异常?所有这些特征可能有助于在DMD患者中观察到严重的DCM表型。
此外,将细胞生物力学的变化与DMD的整体疾病表型联系起来具有重要的临床价值。DMD是一种x连锁肌营养不良症,男性发病率为1:35 - 5000,其特征是早期失去行走能力(<5年)和进行性DCM,与其他病因的DCM相比,预后明显较差16,17,18.
肌萎缩蛋白损失的生物力学还没有得到充分的描述,在这里我们回顾了支持这一概念的证据,即肌萎缩蛋白确实具有机械保护者的能力-即维持肌层的完整性-并且在机械传导中至关重要。此外,我们还研究了与整合素(尤其是层合蛋白结合α7β1D)在横纹肌细胞中的重要交叉对话的证据。
DMD背景下的进行性扩张型心肌病
插入和缺失是基因突变的重要原因DMD72%的突变是由这种突变引起的19.临床上,DMD出现在婴儿期(≤5岁),患者表现为低张力、高尔氏征阳性、里程碑进展延迟、智力障碍和骨骼肌萎缩8.从历史上看,呼吸窘迫是DMD患者死亡的主要原因,但改进的支持性护理(皮质类固醇、持续气道正压)延长了这些患者的寿命,1990年以后出生的DMD患者的中位年龄为28.1岁20.,21.然而,随着患者生存期的增加,与其他心肌病相比,进行性DCM的预后明显较差16导致终末期心力衰竭已成为死亡的主要原因,约占DMD死亡的50%17,18.
进行性DCM的特征是左室扩张和顺应性增加,心室变薄,纤维脂肪浸润增加,收缩功能下降,心律失常发生率增加8.DMD患者的DCM范围在青少年晚期几乎无处不在(18岁时为90%),但在10岁时约有59%的患者存在DCM8,22.解决这一问题至关重要,因为左心室射血分数每年以1.6%的速度稳步下降每年23.
心律失常在DMD患者中很常见,尤其是窦性心动过速和室性心动过速,是心源性猝死的一个原因22.心律失常是纤维脂肪浸润的结果,特别是在左心室的基底下部分,它破坏了再入回路,并伴有功能障碍[Ca2 +]我离子通道处理与失调功能24,25.认识到临床心脏图像是至关重要的,因为早期的治疗策略可能推迟严重DCM的发病。
一项有趣的研究证明了治疗心功能障碍和骨骼肌发病率的重要性,该研究检查了改善骨骼肌组织的影响,而没有解决DMD中存在的潜在心脏问题,使用DMD小鼠模型mdx26.在这里,作者证明了骨骼肌改善后心脏功能障碍增加了5倍,这似乎是自相矛盾的,小鼠的射血分数显著降低26.骨骼肌功能的改善使更高的体力活动成为可能,这加剧了心肌的负荷,使其更容易受到整体功能障碍的影响26.这强调了整体治疗DMD患者的重要性,并警告不要单独使用骨骼肌治疗。
dystrophin糖蛋白复合物(DGC)的结构
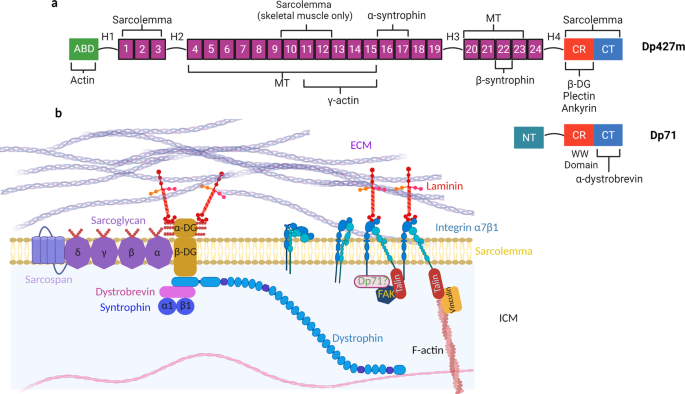
DGC有几个互补的功能,即为肌膜提供结构稳定性;成为发挥信号连接作用的分子支架;机械敏离子通道的调控;在costamere机械传导的中心;并与沿岸区域的侧向力传递有关(图。1 b).Dystrophin在这种能力中起着核心作用,由于多个内部启动子,有几种不同的异构体,每种异构体在不同的组织中具有不同的作用。不同的肌萎缩蛋白异构体的不同组织表达支持每个异构体发挥独特作用的概念。例如,心脏组织表达全长(Dp427m)以及较短的抗肌萎缩蛋白亚型(Dp71m),而骨骼组织只表达前者11.观察每一种亚型的作用,不仅可以揭示其生理功能,还可以揭示肌肉营养不良症的发病机制。
DMD是最常见的肌肉萎缩症,由基因突变引起DMD.然而,为了充分理解我们目前对营养不良蛋白所起作用的理解,将其置于DGC的整体背景中是很重要的。因此,其他组成蛋白质将简要概述。DGC的蛋白质组成在20世纪80年代末开始被解开,特别是对营养不良蛋白的关注。Koenig在鉴别营养不良蛋白方面有重大发现27,28,霍夫曼29和埃尔瓦斯蒂30.结果显示,肌营养不良蛋白是横纹肌组织中的一种427 kDa蛋白质31.
随后,其他亚复合物被证明与肌萎缩蛋白相关,包括肌聚糖、肌胞、肌聚糖亚复合物、肌球蛋白和复合营养因子8,共同形成了目前的DGC模型。本节将首先传播DGC在机械感测中的作用的证据,同时详细介绍各个组成部分。
肌营养不良蛋白
横纹肌组织中存在的全长肌萎缩蛋白亚型为Dp427m(例如,“m”表示肌肉,以与大脑区分),是一种大棒蛋白,具有四个功能域,位于心肌细胞的肌膜下,特别是在肋肌区29,32.Dp427m在Xp21.1上被编码DMD基因由由2.2兆酶产生的79个外显子组成,因此是我们基因组中最大的基因8.
几个内部启动子DMD产生多种截断的肌萎缩蛋白异构体,其中一些表现出组织特异性。与Dp427m相比,Dp71m明显被截断,没有spectrin重复结构域和n端ABD结构域。然而,Dp71m仍然保持c端结合结构。在心肌细胞中,Dp71m的作用尚不清楚,但它已被证明定位于t小管,这表明它可能用于调节兴奋-收缩耦合33,34,35.据我们所知,心脏组织中Dp71m的检测最近没有引起广泛关注,但一些研究表明它参与了拉伸激活的离子通道,Masubuchi认为它可能在调节nNOS中发挥作用33,36.话虽如此,Dp71在神经生理学和血小板研究中获得了极大的关注,这些领域可能会为其在心肌细胞中的作用提供见解37,38,39.
在神经组织中,Dp71b是主要表达的亚型,有14个亚亚型被报道38.Dp71b是中枢神经系统中水通道蛋白-4和Kir4.1钾离子通道的重要调节因子,其缺失已被证明会导致血脑屏障渗透性的改变40.鉴于Dp71b在调节离子通道中的作用,Dp71m可能在心肌细胞中具有类似的作用。
DGC在costameres的存在立即表明了它在机械传导中的作用,事实上,它已被证明与整合素-talin-vinculin复合物共同定位41.此外,考虑到沿海体是横向机械力转导的焦点,Dp427m在这里的定位强调了它在保护细胞免受收缩诱导损伤中的作用。Dp427m在下游与肌动蛋白和微管骨架相互作用,完成细胞内的连接环境到ECM。
在结构上,Dp427m是一个由四个区域组成的丝状棒蛋白(图427m)。1):
含有肌动蛋白结合结构域1 (ABD1)的n端,由两个钙钙蛋白同源结构域(CH)组成,对与f -肌动蛋白的相互作用和将γ-肌动蛋白亚型固定在肌膜下至关重要42,43.通过连接到肌层下细胞骨架,肌萎缩蛋白可能有助于心肌细胞的整体粘弹性,其在costameres的定位支持了它参与机械转导以及机械保护的概念44,45.
一个由24个谱样重复蛋白组成的中心棒结构域,每个重复蛋白长度约为100个氨基酸残基8.光谱蛋白重复序列由四个铰链结构域穿插,赋予蛋白质灵活性和很大程度的延展性。dystrophin的spectrin重复序列可以在生理力范围(15-30 pN)内(肌凝蛋白收缩所能达到的力)从21 nm延伸到84 nm46.这些在spectrin重复序列域内的特征允许dystrophin充当分子减震器10.
Dp427m的中心棒通过与磷脂酰丝氨酸的疏水和静电相互作用将其定位于肌膜47,48.有趣的是,肌萎缩蛋白的中心杆在骨骼和心脏组织中与肌膜磷脂的相互作用不同,可能反映了不同的“弹簧”样形态49.在心肌细胞中,频谱蛋白重复序列R1-R3和富c端/半胱氨酸(CT/CR)结构域至关重要,而骨骼肌也通过R10-R12结合49.
与γ-actin细胞骨架的结合需要ABD2的11-17重复区,这些重复区由碱性氨基酸残基组成,与F-actin结合CH结构域不同。微管直接与dystrophin的杆状结构域相互作用,这种相互作用所必需的spectrin重复残基为4-15和20-23,并且需要锚蛋白- b的存在来防止微管在该位点的丢失50,51,52.微管和肌萎缩蛋白之间的破坏已被证明会增加活性氧(X-ROS),从而加剧DMD病理53.
一种CR结构域,通过锚蛋白b,是肌膜磷脂的另一个锚52.锚蛋白b和锚蛋白g是营养不良蛋白/DGC的协同定位所必需的,它们的缺失导致DGC的弥漫性肌样模式52.
CR结构域包含一个WW结合域,直接与β-DG的PPxY结合基序相互作用。通过连接到肌营养不良聚糖复合物,肌营养不良蛋白完成了细胞内外的连接54.这种连接对于横纹肌至关重要,事实证明,破坏ECM和细胞内部之间的联系会导致限制生命的肌肉营养不良症。
最后,CT结构域是高度保守的区域,形成螺旋状线圈,对与α-dystrobrevin和α1-, β1-syntrophins结合至关重要55,56.α-dystrobrevin结合到dystrophin的CT结构域,提供额外的肌层稳定57.
拉到
在胚胎和胎儿发育过程中,Utrophin广泛表达于内皮细胞、神经元组织、横纹肌组织等各种组织中58.Utrophin,由UTRN位于6q染色体,是dystrophin的自体同源体,蛋白同源性80%。在发育过程中,肌营养蛋白定位于肌膜,但出生后在横纹肌组织中显著下调,被肌营养不良蛋白取代56.出生后,肌营养蛋白的定位局限于骨骼肌的肌腱和神经肌肉连接58,59.
尽管已经描述了一些关键的区别,但肌营养蛋白的结合伙伴通常与营养不良蛋白的结合伙伴相似。例如,营养不良蛋白通过其WW结构域与β-DG相互作用,而WW结构域是由其CT区域内的ZZ结构域(以其结合两个锌离子的能力而命名)稳定的,其中半胱氨酸残基3307-3354对这种相互作用特别重要60,61.肌营养蛋白也通过WW/ZZ结构域与β-DG结合,但支撑这种相互作用的确切残基与肌营养蛋白的残基不同(肌营养蛋白的3307-3345 vs肌营养蛋白的3064-3102)60,61.重要的是,与营养不良蛋白相比,营养不良蛋白与β-DG的结合大约低2倍61.据报道,营养不良蛋白通过spectrin重复序列11-17与F-actin结合,而在utrophin中的类似区域即使在高浓度时也不能与F-actin结合,但可以通过其CH结构域相互作用62,63,64.最后,与营养不良蛋白不同的是,utrophin不能与微管结合51.
在生物力学上,与营养不良蛋白相比,营养不良蛋白的光谱重复序列具有明显的展开模式65.与肌萎缩蛋白相比,肌萎缩蛋白光谱重复序列以更高的力量展开65.这与它在肌腱连接处的定位和刚性弹性力传导的作用是一致的,但这可能会使utrophin不太适合作为分子弹簧来缓冲收缩诱导的力65.综上所述,这些数据表明,在超表达的情况下,可能存在机械转导和机械缓冲能力的改变,特别是考虑到不同的结合伙伴/机制,然而,这需要进一步的实验检验。
在功能上,营养蛋白被认为具有与肌营养不良蛋白相似的作用,这一事实使其成为潜在治疗DMD的目标66,67.事实上,已有研究表明,一些DMD患者会重新表达肌营养素,这可能是一种代偿机制,并且在肌营养素过表达的小鼠模型中成功地实现了表型挽救68.虽然上调肌营养蛋白是一种可行的治疗策略,但考虑到肌营养蛋白与肌营养不良蛋白在形式和功能上的区别,以及沿肌膜适当定位诱导这种过表达的实用性,目前尚不清楚长期的肌营养蛋白治疗策略。值得注意的是,女性携带者确实表现出一种营养不良蛋白和营养不良蛋白之间的比例可能影响这类患者DCM的程度69,尽管小鼠载体模型显示出与WT相当的心脏顺应性70这表明嵌合体比纯合子患者受影响更小。
反糖聚糖亚复合体
dystroglycan亚复合体由两种蛋白组成,α-和β-dystroglycan (α-, β-DG),它们都转录自DAG1基因,然后在翻译后分裂成两个组成蛋白质71.α-DG在DGC的细胞外高度糖基化,并直接与层粘连蛋白α2和agrin相互作用72和pikachurin73,以及肌萎缩蛋白CT/CR区脯氨酸残基73,74,75,76.的O-连接的糖基化,特别是丝氨酸残基的糖基化,对于其与ECM的相互作用至关重要。糖基化途径涉及几种酶,这些酶的突变会导致肌营养不良症(见表)1).这些包括o -甘露糖基转移酶POMT2,福豆苷和福豆苷相关蛋白(FKRP),这两种核糖醇-磷酸转移酶都将串联的核糖醇磷酸添加到核心聚糖中,以及蛋白LARGE1,它将木糖和葡萄糖醛酸盐的线性多糖(也称为基质聚糖)添加到聚糖的末端77.FKRP还参与ECM的发展和维持,突变导致层粘连蛋白α2和α-DG表达降低77,78,79.此外,FKRP还可能通过糖基化纤维连接蛋白来指导基底膜的形成和心脏ECM80.
β-DG含有一个PPxY结合基序,可直接定位和隔离YAP12.这是一个有趣的发现,因为它暗示了DGC在调节心肌细胞的细胞周期。新生儿心肌细胞中的α-DG与agrin相互作用,以细胞成熟为代价促进心脏再生,并促进DGC的溶解76.随着心肌细胞成熟,agin的表达减少,而层粘连蛋白被认为可以促进细胞周期阻滞76.Morikawa说道12进一步表明,双重敲除肌营养不良蛋白和萨尔瓦多(YAP的一种负调节因子)会导致心肌细胞在梗死产生的疤痕处过度增殖。这导致了令人兴奋的概念,即YAP的操作可能在临床上有价值,以防止心肌梗死后的组织损失。因此,由agrin诱导的DGC溶解可能代表了一条允许YAP激活的轴,是心脏再生的潜在途径。
机械上,α-和β-DG是维持纤维膜和基底膜相互作用的必要条件81.α-DG和α7整合素都有助于同体的力的产生,α-DG的缺失导致肌膜与基膜的分离81使骨骼肌组织容易受到收缩引起的损伤。如前所述,反糖基复合物调节DGC的整体翻转,其中与同源配体层粘连蛋白的接合导致β-DG的PPPY结合基序的酪氨酸磷酸化89282.酪氨酸磷酸化在这里促进反肌萎缩蛋白的分解,允许DGC复合物被翻转。从生理上讲,这一过程是高度调控的,而肌肉营养不良症则失去了这一特征82,尽管控制这一过程的潜在机制还不完全清楚。
循环拉伸已被证明通过反糖聚糖复合物和相关蛋白,果胶激活ERK1/2和AMPK通路83.同时,需要果胶和反糖聚糖不仅充当支架,而且参与机械传导,果胶的抑制导致ERK1/2和AMPK活性降低83.在DMD小鼠双敲除模型中,过表达的细胞骨架中间丝desmin被证明可以改善疾病表型mdx:肌间线蛋白而且mdx老鼠84.通过与β-DG相互作用,果胶将DGC间接连接到细胞骨架的这一组成部分。此外,反糖聚糖与已知参与细胞骨架重排的生长因子受体结合蛋白2 (Grb2)相互作用85.整合素Ras的激活被证明是通过Grb2介导的,这可能为整合素和DGC之间的交叉对话提供了一个潜在的途径86.
参与α-DG糖基化的基因突变导致所谓的糖退化症。糖营养不良症表现出临床异质性,但从根本上都是由破坏α-DG和层粘连蛋白α2之间的相互作用引起的77.由原发性突变引起的糖营养不良症DAG1通常情况下,是否非常罕见,可能是因为它们在胚胎上是致命的87,证明了细胞与ECM结合的必要性。这意味着大多数糖营养不良症是由与糖基化相关的蛋白质的继发性突变引起的。例如,突变POMT1会导致极其严重的沃克-瓦伯格综合征,其特征是无脑畸形,寿命显著缩短,不到3年88.然而,FKRP主要表现为肢带性肌肉营养不良(LGMDs),通常是相对温和的,但并不总是如此。突变FKRP是引起WWS的罕见原因吗89.在FKRP创始人突变(c.826>A)最常导致LGMD2I90.
LGMD2I是一种相对温和的肌肉萎缩症,其发病机制是ECM与细胞内细胞骨架之间的破坏。目前尚不清楚的是这些基因突变患者的基因型和表型之间的关系,实际上这一概念适用于DGC的其他蛋白质。为什么有些患者会发生突变FKRP表现出与WWS一致的疾病表型,而其他人有LGMD2I?这个问题的答案可能在于i)突变破坏糖基化途径的哪个阶段,或者ii)任何给定阶段的糖基化程度。α-DG的低糖基化仍可能与ECM发生一定程度的相互作用,导致总体上较温和的表型,而与基底层分离则增加了疾病表型的严重程度。LGMD2I患者也会发生DCM,尽管与DMD相比,这方面的记录较少,因此迫切需要了解心肌细胞中的这些突变。
肌聚糖-肌聚糖亚复合物
肌聚糖-肌聚糖亚复合物有助于DGC的形成,并直接与β-DG相互作用。在心脏组织中,存在四种单通道肌聚糖:α, β, γ和δ91.最近,在该基因的第3外显子上发现了c.218C>T错义突变,并在第7-8外显子上发现了部分杂合缺失SGCA基因被描述为导致LGMD2D的原因92.然而,作者没有评估这种情况下的心脏表型。
其他组织已经确认SGCD在两种猪中93和小鼠94这些模型导致糖聚糖亚复合体蛋白表达降低,从而破坏DGC的整体结构,导致DCM。此外,据报道,19%的患者携带突变SGCA, SGCB,或SGCG显示DCM, 25%的患者还需要呼吸支持95.
肌聚糖(SG) δ的隐性突变导致心肌组织中肌聚糖复合物的减少或完全缺失,随后是DGC,是LGMD伴DCM的原因之一96.有趣的是,SG-δ的显性阴性突变是心血管特异性的,是家族性扩张型心肌病的原因之一97.SG-δ显性阴性突变R97Q和R71T在大鼠心肌细胞中稳定表达,而不会对DGC整体造成显著破坏98.然而,在机械应激下,携带这些突变的心肌细胞更容易发生肌膜损伤和通透性以及机械功能障碍,这与DCM表型一致98.
Sarcospan (SSPN)是一种25 kDa的四胱甘肽蛋白,定位于肌聚糖亚复合物,被认为是蛋白质支架99,One hundred..SSPN作为蛋白质支架,稳定α-DG的定位和糖基化99,101.在小鼠模型中,过度表达SSPN可增加肌肉和层粘连蛋白之间的结合102.此外,SSPN也被证明与整合素相互作用,这提供了证据,在两个肋聚灶黏附位点,DGC和整合素-talin-vinculin糖蛋白结构之间存在一定程度的串音One hundred.,101,102.SSPN的下调也导致小鼠骨骼肌中α7β1的升高。
最近的一项研究表明,肌跨的过表达独立于半乳糖氨基转移酶2 (Galgt2)击倒的mdx小鼠DMD模型,从而减轻疾病表型101.糖基化的增加可能会加强与ECM的相互作用,从而减轻疾病。此外,他们还发现,肌间隙过表达降低了整合素β1D与DGC的相互作用,强调了肌间隙在调节整合素复合物中的可能作用101.
的syntrophins
合营养因子是定位于DGC的小蛋白质家族(58kDa),它们自己没有内在的酶活性,充当分子适配器103,104.已鉴定出5种亚型(α-1、β-1、β-2、γ-1和γ-2),表现出组织特异性表达,其中α-1亚型主要在横纹肌组织中表达105.复合营养因子是促进肌营养不良蛋白与信号分子(包括骨骼肌中的神经元一氧化氮合酶(nNOS))之间联系的重要接头蛋白106.α-复合营养因子直接与营养不良蛋白的spectrin重复序列16-17结构域相互作用,进而与nNOS的PDZ结合基序结合106,107.
合成营养因子也通过PH2和SU结合域与肌动蛋白相互作用,这些也与肌动蛋白细胞骨架相互作用108.事实上,由于α和β异构体能够直接与f -肌动蛋白相互作用,合成因子似乎在调节细胞骨架动力学方面具有特别关键的作用108,因此可能在调节细胞的张拉整体和生物力学中起作用。此外,合成营养素已被证明通过Rac1调节细胞骨架109.
最近的一项研究表明,调节复合营养蛋白水平可以恢复功能,该研究研究了使用微抗肌萎缩蛋白,并发现ΔR4-R23/ΔCT结构能够将α-复合营养蛋白以及其他DGC蛋白恢复到与WT相当的水平mdx心肌细胞110.
除了它们在调节细胞骨架方面的作用外,在离子通道调节方面也有很好的记录111,112,113.复合营养因子的PDZ结合基序调节心脏电压门控通道,Nav1.5111在建立心脏兴奋性和传导方面起着关键作用。有趣的是,在mdx小鼠模型v1.5通道下调,动物出现心律失常111.此外,机械敏感离子通道家族,即瞬时受体电位通道(TRPC)也被证实在心脏组织中受α1-复合营养因子的调控113TRPC6抑制可改善DMD小鼠模型中的心律失常112.据报道,DMD中TRPC6活性增加导致心律失常,当PKG结合时心律失常被逆转112.在机制上,营养不良蛋白的缺失促进了拉伸诱导的[Ca2 +i内流作用于TRPC6的上游,从而在心肌细胞和血管平滑肌细胞中激活它112,114.TRPC6对拉伸的过度激活使其成为DMD的主要机械感测器和潜在的治疗靶点112,114.
整个DGC复合体具有协同作用:总和大于单个组件
dystrophin的缺失可导致整个DGC复合物的溶解或显著下调,许多机械保护和机械传导特征随后丧失,导致DMD中横纹肌组织中观察到的灾难性表型。因此,考虑到DGC是协同工作的,并且各个组成部分依赖于其他组成部分的存在和功能,这也许是谨慎的。这尤其适用于肌营养不良蛋白,它似乎在心肌细胞肌膜复合物的组装和定位中至关重要。每一种成分都有其独特的作用,有助于肌膜的整体稳定、关键辅助蛋白的定位、离子通道的调节和基因表达,DGC的一种蛋白缺失会导致整个心肌功能障碍。
DGC被定位为一个真正的机械传感器,对心肌细胞的健康至关重要
如上所示,DGC的许多蛋白质参与机械转导和信号传递,其中营养不良蛋白特别为这一角色启动。如果DGC位于costameres,则支持它与整合素一起参与机械转导的概念。因此,DGC在物理上接受各向异性力传递,并参与细胞内对微环境的力学感知和细胞骨架重排,与张拉整体模型一致115.此外,Dp427m作为机械保护器,通过在其中心棒域内扩展spectrin重复序列来缓冲传入的生物力学力,在800 nm的延伸范围内保持25 pN的展开力10.通过分解,肌萎缩蛋白能够“缓冲”心肌细胞产生的收缩-松弛力10.考虑到与spectrin重复结构域相互作用的蛋白质和磷脂的多样性,推测spectrin重复序列的解开是否以类似于talin的方式改变了机械敏感蛋白的结合动力学是有趣的116,117,118.然而,这一点目前尚未确定,需要进一步研究。
dystrophin的n端直接与γ-actin和F-actin细胞骨架相互作用43,119,因此生物物理力可能通过该区域传递到细胞内基质(ICM),再次与张拉整体一致,然后可能调节细胞骨架结构和动力学。此外,细胞骨架可以通过核骨架和细胞骨架(LINC)复合物将这些力传播到细胞核120.研究表明,机械传导比可溶性信号传导快40倍以上,而可溶性信号传导反过来调节染色质和基因表达装置120,121,122,123,124.肌萎缩蛋白与微管相互作用,正是这两者的相互作用使肌萎缩蛋白在心肌细胞的张拉整体中发挥关键作用51,125.事实上,已经证明肌萎缩蛋白对维持γ-肌动蛋白和在肌膜下形成微管晶格至关重要43,125.
有初步证据表明在DMD中细胞骨架动力学和核力学转导之间存在联系。最近,一项研究揭示了DMD中基因调控和细胞骨架之间的联系126.在这里,他们显示了组蛋白去乙酰化酶8 (HDAC8)的有害上调,他们选择性地抑制,改善骨骼肌功能。有趣的是,抑制HDAC8导致α-微管蛋白乙酰化增加,从而恢复了DMD患者肌管中的细胞骨架结构126.
最后,辅助蛋白定位于DGC,包括ERK1/2、Grb和nNOS,其中一些特别容易接受机械转导,如AMPK13.营养不良蛋白被认为是通过中间蛋白与AMPK相互作用,包括肌膜营养不良蛋白127.有趣的是,与骨骼肌不同,nNOS并不直接定位于心脏组织中的DGC,尽管在AMPK机械激活时被磷酸化。这是对拉伸的反应,形成肌萎缩蛋白- ampk - nnos轴13如前所述直接与α-复合营养因子相互作用106.在mdx模型中,肌萎缩蛋白- ampk -nNOS轴被破坏,并可在药理学上恢复,这表明力是心肌细胞中nNOS激活的主要驱动力——药物绕过了力的需要。这些数据支持了这样一种观点,即肌营养不良蛋白和DGC作为一个整体,在外力作用下上调辅助蛋白,连接到细胞骨架,并有助于心肌细胞的整体粘弹性。
整合素和DGC之间的串扰
整合素是跨膜蛋白的一个超家族,负责黏附形成,ECM的机械感应和机械转导1.有24个不同的整合素形成的异二聚体从18 α-和8 β-亚基显示组织特异性的表达模式128,129.此外,整合素在同一组织中的表达受时空变化的影响,例如,在心肌细胞中,随着组织成熟,从胚胎时期的纤维连接蛋白整合素(如α5β1)转变为结合层纤连蛋白的α7β1D整合素130,131.
在心肌细胞中,整合素定位于同质区域,参与机械转导、肌动蛋白细胞骨架的调节和调控细胞过程(例如迁移)。重要的是,考虑到它们与细胞骨架的相互作用,它们与维持细胞的粘弹性密切相关,正如张拉整体模型所描述的那样132,133,134.这超出了这篇综述的范围,详细介绍整合素激活和特定的下游靶标,然而,以下参考文献允许进一步探索这一领域1,128,135,136.简而言之,整合素具有刚性感知能力,其中通过ECM的力的增加加强了整合素(以及额外整合素单位的招募)与ECM之间的结合,这种行为称为捕捉键137.整合素在局部黏附形成和成熟的背景下被广泛描述,允许细胞感知它们的微环境和评估ECM刚性,并沿预应力肌动蛋白索传递这种生物力学“信息”122,138,139.
证据支持DGC和整合素之间的串音,考虑到它们相似的区域和协同功能,这可能并不特别令人惊讶41,140,141.主要是,这些见解来自于使用DGC或整合素蛋白突变导致各种肌肉营养不良的研究;双敲除研究揭示了比单独敲除更严重的疾病表型,即加速肌病和过早致死;以及整合素在缺乏肌萎缩蛋白时的代偿性表达5,142,143.综合来看,这三个事实强烈暗示了相互干扰和共同监管。
先前的研究表明,整合素α7 (ITGA7)是否是先天性肌肉萎缩症的病因,其疾病表型与DMD并不完全不同6,144.在这里,迈耶144表明α7缺失导致肌纤维坏死,细胞核集中,肌肉结构紊乱,这些都与后来在人体内发现的α7突变相一致ITGA7145.有趣的是,在这种情况下,DGC似乎没有补偿α7的损失144.
另一方面,dystrophin的缺失,如DMD或mdx模型-一直揭示了α7整合素的上调,这被认为是一种代偿机制,尽管这种代偿在DMD患者中似乎长期不足144,145,146,147.也就是说,在药理学上α7的过表达或腺相关病毒的传递显示了骨骼和心脏组织中DMD疾病表型的衰减148.
特别有希望的是舒尼替尼,一种fda批准的酪氨酸激酶抑制剂,可以增加α7β1的表达,减轻心脏纤维化,改善对基底膜的附着,并降低心脏纤维化的启动剂STAT3143.类似的化合物SU9516也被使用,其结果与舒尼替尼大致相似149.有趣的是,DMD治疗的标准成分糖皮质类固醇强的松也能增加DMD患者和金毛模型GRMD骨骼肌中的α7β1150.然而,尚不完全确定这种机制在心脏组织中是否具有类似的功能。
相反,肌跨的过表达已被证明在肌营养不良蛋白-营养不良蛋白双敲除中上调了β1D在心脏组织中的表达mdx: utn+/-该模型同时改善了肌膜稳定性,有助于支持相声151.最后,一个dag1基因敲除建模糖退化症显示α7表达升高,能够减弱,但不能完全挽救健康的表型152.在这里,作者认为补偿有利于减弱疾病表型,但不足以长期预防疾病,这一观察结果与DMD患者一致152.所提供的证据确实表明,整合素和DGC之间存在一定程度的互补、协同作用。
据报道,短亚型Dp71f可直接与神经元组织中的β1整合素以及包括FAK在内的下游机械传导蛋白相互作用153.此外,Dp71f定位于星形胶质细胞的局灶性粘连,并与β1整合素、温库素和肌动素共免疫沉淀154.据我们所知,这还没有在心肌细胞中得到证实,但这些研究让我们得以一瞥dp71 -整合素串谈在心肌细胞中的假定作用。
其他研究表明,对整合素和DGC成分(如肌营养不良蛋白或肌肉瘤)的双重敲除比单独敲除导致疾病表型恶化,迅速发展,这表明由一个或另一个组进行的补偿确实减弱了疾病表型102,148,151.例如,mdx:β1双敲除显示心功能障碍恶化,与敲除相比更迅速地发展为心衰表型mdx或β1独自一人142.
总的来说,这些数据表明,DGC和整合素复合物不仅共同定位,而且当其中任何一个被破坏时,都会发生互补的协同补偿。这是合理的,因为促进适当的附着到ECM的基底层以及维持机械传导和肌层完整性已被证明是最佳纹状组织肌肉健康所必需的。然而,从患者的发病机制可以清楚地看出,随着时间的推移,代偿不足以延缓终末期心力衰竭,但也许这些复合物的药理学操作可能能够延迟重大病理的发生。无论如何,这是一个有前途的领域,需要进一步的探索,为不同类型的肌肉萎缩症患者提供更多的治疗策略。
为了了解表面细胞受体的功能,有必要讨论它们结合的相关底物。心脏细胞外基质(ECM)是一个多样的,可塑的,三维的结构网,维持心脏的几何形状155.心肌细胞、心脏成纤维细胞、内皮细胞和巨噬细胞都嵌入在这个网络中,它们都有助于心脏的整体稳态。ECM远非一个惰性和被动的实体,它与调节心肌细胞功能密切相关,包括力传递、细胞骨架动力学、增殖,以及作为细胞因子、金属蛋白酶和其他信号蛋白的储存库155,156.ECM响应心肌细胞的生化和生物力学作用,并串联促进最适合容纳心肌细胞的时空调节基质。在器官尺度上,这意味着心脏能够执行对生命至关重要的舒张和收缩功能。
心脏细胞外基质对心脏(病理)生理至关重要
健康的心脏细胞外基质
心脏ECM的生化和生物力学特征在发育和疾病过程中发生改变156.胚胎心脏ECM表达I型胶原、硫酸软骨素、腓骨蛋白和纤维连接蛋白,以及其他成分155.纤维连接蛋白通过促进细胞迁移、黏附和极性,在心肌发育的初始阶段起重要作用156特别是胚胎亚型EIIIA和EIIIB的表达157,158.纤维连接蛋白的表达对新生心脏的发育至关重要,突变已被证明是胚胎致命的,支持心脏ECM的关键作用159,160.
在心肌ECM中,主要蛋白聚糖发生表型转换,α-DG的糖基化标志着新生/胚胎期富含纤维连接蛋白的心脏ECM向结合层纤连蛋白211的成熟心脏ECM的转变80.这一过程也建立了DGC-ECM轴,建立了允许机械转导的肋间和局灶黏附区域的成熟80.
除了层粘连蛋白,成人心脏还表达I型胶原蛋白(80%)和III型胶原蛋白(10%),这两种胶原蛋白之间的比例尤为重要161.I型胶原蛋白是抗拉强度和刚度的决定因素,而III型胶原蛋白赋予ECM弹性。两者都有助于ECM的整体粘弹性,使其杨氏模量为~10 kPa162.其余的心脏ECM由几种糖胺聚糖和蛋白聚糖组成156.
鉴于DGC和层粘连蛋白相互作用的重要性,本文提供了关于层粘连蛋白的更多细节。层纤蛋白是位于心脏ECM基底膜室的一个由三个肽链(α、β和γ)组成的异质三聚体蛋白大家庭,在细胞粘附、机械传导和交联其他蛋白质中起关键作用161,163.层粘连蛋白α2在肌营养不良的情况下是一个特别重要的心脏ECM成分,因为它是DGC的直接结合伙伴,特别是通过α-DG,以及参与高表达的心脏整合素α7β1D164.切断DGC和层粘连蛋白α2之间的相互作用会导致杜氏肌营养不良症(DMD)、贝克尔肌营养不良症(BMD)和2I型肢带肌营养不良症(LGMD2I)观察到的表型。8,165,166.如前所述,突变ITGA7编码α7β1D的基因会导致先天性肌肉萎缩症,其表型与DMD相似5,144.
虽然导致ECM和细胞内部之间中断的确切突变不同,但总体概念是,破坏连接会促进横纹肌组织的肌肉营养不良。通过破坏与ECM的链接,生物力学力丢失,从而破坏了关键的下游机械传导和机械信号。此外,这种连接的缺失足以破坏细胞骨架,降低其对ECM机制的响应性167.
DMD伴DCM的心脏ECM
虽然成人心肌细胞确实能够增殖到一个小的程度(1%的比率)每年)这通常被认为不足以取代任何失去的组织集体因此,心力衰竭成为全球发病率和死亡率的主要原因168.此外,患有DMD和其他肌肉营养不良症的患者会发展为进行性DCM,这是目前肌肉营养不良疾病类别中死亡的主要原因18.因此,考虑心脏ECM的改变如何影响心肌细胞稳态是很重要的,反之亦然,以阐明驱动肌营养不良发病机制的基础机制。
在对损伤性刺激、衰老和疾病的反应中,心脏ECM在一个称为重塑的过程中发生扩张156,169.重塑导致ECM的生化和生物力学组成的改变,经常加剧任何潜在的病理170.通过这种方式,心肌细胞- ecm相互作用产生正反馈轴,推动心力衰竭的发病机制。值得记住的是,心力衰竭是一种多样的、异质性的疾病状态,有许多不同的病因。因此,在DMD的背景下,ECM和心肌细胞之间的特定相互作用具有相当大的意义,特别是作为DMD的标志的纤维化已被证明与不良的临床结果相关22,171.
重塑的初始阶段包括促炎和促纤维细胞因子的激活,包括转化生长因子(TGF) β和赖氨酸氧化酶(LOX),它们通常存在于ECM内171.反过来,这些促进了I型胶原蛋白沉积的增加,从而改变了I型胶原蛋白和III型胶原蛋白之间的比例,从而增加了ECM的硬度155,172.交联I型胶原沉积增加促进舒张功能障碍,因为ECM硬度增加导致心脏顺应性降低173以及通过破坏再入电路而促进心律失常174.此外,选择性剪接的纤维连接蛋白异构体,如III型重复外结构域A (EDA),表达促进肌成纤维细胞和单核细胞的募集,导致心脏纤维化增加175,176,177.抑制纤维连接蛋白过表达被证明可以减弱与心力衰竭相关的纤维化,并在缺血后4周内改善心功能175.TGF-β还被发现降低基质金属蛋白酶的活性,同时增加前纤维化酶的表达,如金属蛋白酶的组织抑制剂178.最后,纤连蛋白EDA还促进核因子κB (NFκB)的激活,共同促进不良的心脏重构176.总之,这些数据强调了心脏ECM在维持适当的生物力学中所起的重要和动态作用,在肌肉营养不良症中,细胞和ECM之间的相互作用是发病的核心驱动因素。
心脏ECM力学
ECM在DMD中发生了显著的改变,包括纤维化、炎症浸润升高和心肌细胞坏死,因此在本节中我们将研究这些变化。由于心脏ECM在维持细胞水平的生理力传递以及调节舒张和收缩功能方面具有关键作用,任何生物力学特征的改变都可能扭曲机械传导155.
健康心肌的粘弹性报告为~ 10kpa179在纤维化心肌中增加到50 - 130kpa162,169.这是I型胶原蛋白和纤维连接蛋白沉积增加的直接后果155,158,175有几个研究小组报告称,患病心脏僵硬程度增加173,180,181,182.底物刚度的增加导致细胞形态异常、肌体结构中断、机电耦合异常、机械传导异常、细胞骨架的翻译后修饰(尤其是微管)和基因表达改变173,183,184,185.
相邻区域心肌细胞的机械感应装置允许通过细胞骨架- dgc - ecm轴与整合素进行双向通信,因此影响底物刚性169,186.心脏被动僵硬是由肌小节的肌肽和微管网络的相互作用决定的169翻译后修饰去酪氨酸化介导这种相互作用187,188.去酪氨酸化微管在DMD中增加,并通过促进X-ROS、改变细胞硬度和钙失调来推动心脏发病机制2 +处理53,189,190.微管去酪氨酸化减少mdx模型通过减少收缩性损伤和心律失常发生率来改善整体心功能,突出了细胞骨架的重要性53.
中断的DGC导致机械感觉改变与心脏纤维化之间的相互作用,进而导致机械感觉的进一步改变尚不明确,但已知DMD表现出改变的生物力学反应53.通过激活受体相互作用激酶3 (RIPK3),心肌重构已被证明是引起坏死的原因之一。191.在小鼠骨骼肌中显示了RIPK3的激活mdx模型,与之前的研究一致192.最近研究表明,心肌纤维化激活RIPK1-RIPK3复合物,促进心功能障碍和减少自噬,导致细胞死亡增加193.此外,纤维硬化可对DMD心肌细胞的基因组产生有害影响,其中硬度的增加可导致端粒缩短,并促进p53和p21的激活194.
DGC在心肌细胞机械传导中的作用
机械传导概述
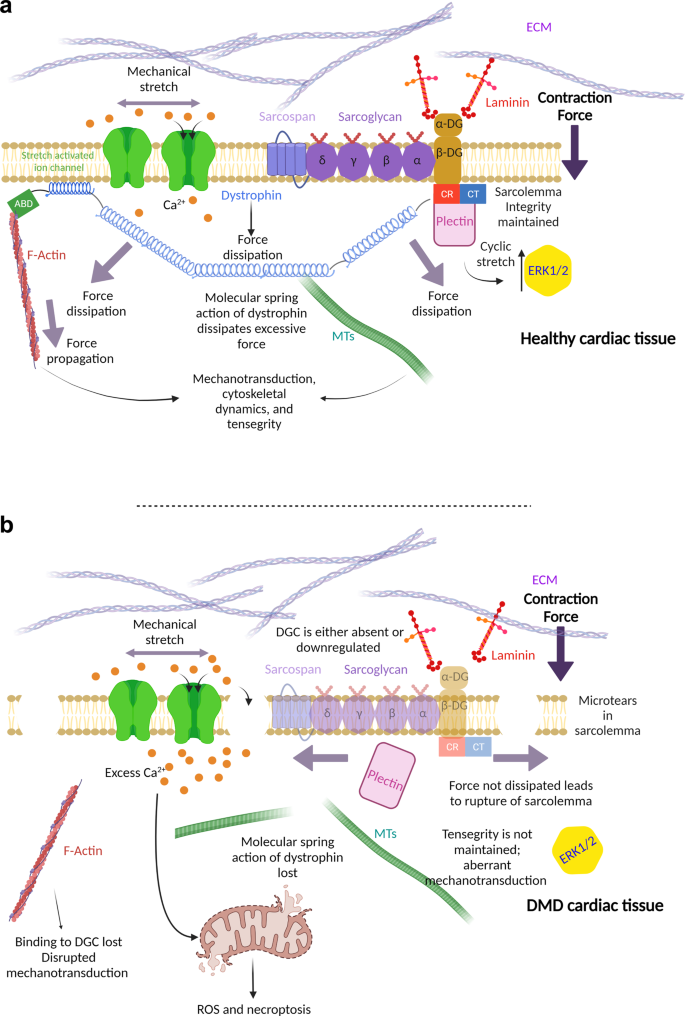
虽然生物化学和遗传线索长期以来一直被认为是细胞生物学的调节器,但人们越来越认识到物理力量也是如此。细胞在分化、胚胎发生、黏附形成、细胞迁移、增殖、存活、细胞形态和基因调控等方面对生物力学力有反应,而DGC是这一过程的核心(图2)。2).细胞骨架在维持细胞的粘弹性和细胞的ECM和ICM之间生物物理力的双向通信方面起着核心作用。响应生物物理信号而改变细胞骨架以及随后的细胞粘弹性是维持细胞内稳态的关键决定因素,ICM-ECM连接的中断会影响这些过程。一个令人兴奋的研究领域将是将机械线索与导致更高阶细胞反应的化学和遗传变化结合起来;这些力量是如何影响细胞行为和“决策”的?目前,这些问题仍然难以捉摸。
一个营养不良蛋白是健康心脏组织机械传导的核心。生物力学力沿预张力肌动蛋白和微管(MT)电缆传播,然后可以传输到细胞核。此外,该机制允许心肌细胞保持张拉整体并对ECM的变化作出反应,可能涉及刚性感知。拉伸激活的离子通道由抗肌萎缩蛋白介导适当的钙调节2 +离子进入,对激缩耦合和信号传递很重要。果胶与β-DG结合,调控ERK1/2活性。b在DMD心脏组织中,肌萎缩蛋白的缺乏导致肌膜的收缩性微撕裂,允许过量的Ca进入2 +离子,导致线粒体功能障碍和细胞死亡。此外,生物力学信号不再沿肌动蛋白和MT索传播,导致机械传导异常。在缺乏抗肌萎缩蛋白的情况下,整个DGC可能会缺失或严重下调,从而进一步破坏下游信号。由Biorender.com创建。
DGC在维持心肌细胞张拉整体中起作用
张拉整体是一种描述预应力结构如何能够物理上支持自己使用压缩和拉伸元件的连接系统的模型195.施加在压缩元件和拉伸元件上的力处于平衡状态,而施加外力会引起结构的重塑,以保持力的平衡。
对于心肌细胞,张拉整体描述了预应力细胞骨架如何很好地将机械力转导和传播到细胞中。张力由肌动蛋白骨架产生,微管网络形成系统的压缩元件115,195.拉伸和压缩元素之间的平衡导致了细胞的整体预应力状态,是心肌细胞整体粘弹性的重要贡献者。因此,细胞骨架的改变,特别是皮层肌动蛋白,它是细胞表面张力的关键调节器,可以通过测量细胞的杨氏模量来评估196.
细胞的预应力状态使它们对机械力的外部变化作出反应,导致细胞骨架成分的重排和再分配。适应新的机械力包括肌动蛋白索的形成以及微管的屈曲和重组115.力沿预应力肌动蛋白电缆的传播已被证明比可溶性配体相互作用快40多倍120,122这表明机械力会强烈地影响细胞行为,并且可以在更长的时间尺度上这样做。因此,这种机制使心肌细胞能够感知ECM的变化,例如ECM硬度的变化,并对其做出适当而快速的细胞反应。
细胞通过适应机械力变化、细胞粘弹性和细胞迁移对ECM组成的改变做出反应197,扩散197、分化198,局部黏附形成199,也是驱动疾病病理的核心。最近,dystrophin缺乏的C2C12成肌细胞表现出明显的局部粘连中断和YAP定位改变,这表明dystrophin在机械转导和将ECM传递到细胞内具有重要作用环境200.事实上,局灶性黏附破坏使细胞骨架- dgc - ecm轴功能障碍,并足以导致心脏扩张和依从性增加mdx模型70.有趣的是,在女性携带者中mdx其中50%的心肌细胞表达有功能的DGC,在机械拉伸反应中没有表现出这种增加的依从性70.作者通过敲除包括β-SG在内的其他肋区蛋白,证明了这种效应不同于肌膜损伤,并与心肌细胞- ecm之间的破坏有关70.
DGC是横纹肌组织横向力传递的关键焦点,通过z -disc连接下游的肌节41.肌节- ecm连接允许机械力的交流和转导为生化和遗传改变,最终控制横纹肌的行为。一项研究表明,使用磁性微操作,与未处理的具有完整肌动蛋白细胞骨架的细胞相比,刺激α-DG时,肌动蛋白细胞骨架的破坏导致细胞硬度降低201.这表明DGC在一定程度上参与调节横纹肌组织的粘弹性,尽管这需要进一步的阐明,特别是对于心肌细胞。
DMD患者心脏功能障碍的分子机制
支持dmd相关DCM的分子发病机制可归结为几个关键阶段:i)心肌细胞肌膜的结构完整性受损9, ii) Ca2 +由肌膜微撕裂内流和离子通道失调引起的调节失调202iii)肌动蛋白和微管细胞骨架均被破坏,导致机械传导异常125iv) X-ROS的生成53, v)线粒体功能障碍导致细胞坏死203.这些功能失调的分子通路以协同的方式促进了整体DMD心脏表型,每一种都加剧了下一种。
DMD的心肌肌膜受损
除了作为信号枢纽外,抗肌萎缩蛋白的主要作用是缓冲细胞- ecm界面上的生物力学力,并在细胞内重新分配这些力10.Le等人证明了这一点,他们表明营养不良蛋白的中心棒状结构域作为分子弹簧,在800纳米的长度上保持力低于25 pN10.这提供了强有力的证据,证明肌萎缩蛋白缓冲过度的力量,以维持肌膜的完整性,并支持其在机械传导中的作用。
支持肌膜脆弱和肌营养不良蛋白如何作为心脏肌膜的机械保护者的证据来自于使用通常不渗透到完整膜的染料的研究。例如,对膜片进行压力测试mdx模型显示,与WT相比,肌膜不渗透染料porcion orange的吸光度增加,突出了肌膜的脆弱性9.类似地,肌萎缩蛋白缺乏心肌的体外生物力学应激mdx模型显示埃文蓝染料的摄取增加,这种染料只对存在肌层损伤的心肌细胞具有渗透性204.综上所述,这些数据表明心肌在mdx与人类患者的情况一样,模型不太能够承受肌肉运动产生的收缩-松弛力10,205.减少体内后负荷减弱了心肌细胞中观察到的破坏,如Evan的蓝色染料摄取减少所示,加强了生物力学应力是DMD细胞损伤的原因这一概念204.
人工膜密封剂poloxamer的使用进一步支持了肌萎缩蛋白作为机械保护者的作用。两犬心肌纤维化程度均降低206和小鼠207当给予泊洛沙姆188 (P188)时,DMD模型,支持肌萎缩蛋白缓冲肌膜对抗过度生物力学力的概念。此外,当给予P188时,左心室重构减少,血清cTNI和BNP生物标志物减少,并且没有摄取Evan的蓝色染料208.这些研究强调,在缺乏肌营养不良蛋白的情况下,心肌细胞的肌膜是不稳定的,容易受到生物力学应力的影响。然而,正如Townsend报道的那样,从犬类模型中分离的心肌细胞的依从性并没有改善206.这就提出了关于P188治疗人类的真正疗效和机制的问题。P188已获FDA批准短期使用,但临床试验仍在研究其治疗进行性DCM和DMD患者骨骼肌功能障碍的疗效,但与其他药物疗法联合使用,P188可能能够减弱疾病表型209.
然而,除了肌膜脆弱外,越来越多的证据支持肌营养不良症中肌膜的生理修复失调203,210.DMD的肌膜损伤可能是多因素的,不仅是肌膜结构减弱,其次是钙含量升高引起的肌膜修复机制功能障碍2 +涌入211.在对肌膜损伤的反应中,线粒体已被证明可移位并与肌膜中的微撕裂结合,从而启动修复212.有人认为,线粒体定位到受损的肌膜部位是为了“吸收”多余的钙2 +.事实上,它已经在肌肉营养不良症,持续性钙2 +超负荷导致线粒体功能障碍,导致肌层损伤修复不良212.
持续的Ca2 +超载促进线粒体的渗透性转变,导致这些形成一个大孔复合物,促进线粒体的自噬和细胞死亡203.与线粒体通透性转变相关的关键成分是亲环素D,如果不能迅速逆转,则会导致线粒体破裂。亲环素D的遗传和药理学抑制减轻了线粒体对Ca的敏感性2 +过载,防止肿胀203.总的来说,作者表明这足以防止线粒体驱动的坏死。
Ca2 +是否是DMD发病的有效次要机制
越来越多的证据支持在DGC复合物功能缺失的情况下钙稳态失调202,213.不仅仅是Ca2 +在心肌细胞兴奋-收缩耦合中起关键作用,但作为次级信号离子也起重要作用;因此,[Ca .2 +]我在心肌细胞中被严格控制。有大量证据支持钙含量增加2 +DMD中进入心肌细胞引起蛋白酶激活214,线粒体功能障碍215,216,生成X-ROS53,217,促进坏死192,218,以及异常的机械传导167.
关于Ca2 +进入细胞有两个主要的,不相互排斥的命题:i)细胞外钙的流入2 +顺着浓度梯度通过肌膜的微撕裂进入心肌细胞219, ii) Ca机械敏性失调2 +离子通道(包括TRPC, LTCC和拉伸激活通道),可通过微管细胞骨架调节15,53.然而,显而易见的是,一旦Ca2 +超负荷在心肌细胞中建立,它推动了在DMD中观察到的心脏表型202,220,221.
Ca特异表达2 +通量影响敏感的离子通道,包括位于肌/内质网Ca的ryanodine受体(RyR2)2 +心肌细胞的atp酶(SERCA)。RyR2被触发释放额外的Ca2 +Ca的响应2 +这一过程称为钙诱导钙释放(CICR)。在mdx在小鼠中,RyR1受体被显示为高亚硝基化,并容易增加钙2 +火花222.心肌细胞的RyR2在DMD中也高亚硝基化,与失调的Ca有关2 +抑制ROS的产生,进一步加剧其活性223.心肌细胞中RyR2通道的不稳定导致其“渗漏”,表现为心律失常。Fauconnier表明,RyR2受体的稳定足以防止体内心律失常223.最后,P188可以使Ca归一化2 +这提供了令人信服的证据,证明肌膜破坏是Ca真正的进入机制2 +CICR异常是DMD致命心律失常的触发因素207.
机械敏性拉伸激活钙通道,如阳离子通道的TRPC家族,在DMD中功能不全220;对压力刺激的收缩(SSC)高度敏感,对收缩产生增强反应,这对DMD的发病机制至关重要112.TRPC6被认为是机械敏感的,它的活性可以被蛋白激酶G (PKG)下调,这反过来又警告了SSC反应112.过度活跃的SSC与DMD中的心律失常有关,这是由TRPC6激活所支持的112.这项研究很好地将力敏Ca2 +DMD患者心律失常和心源性猝死的调节异常。此外,TRPC6失调与心肌细胞s-亚硝基化升高有关,包括SERCA上的半胱氨酸残基113.TRPC6基因在双敲除小鼠模型中的缺失mdx: utrn+/-通过降低超亚硝基化,降低钙2 +以及改善心脏重塑113.
使用机械敏离子通道抑制剂GsMTx-4对DMD血管平滑肌细胞中的TRPC6和TRPC3进行药理抑制,减弱了升高的,病理性的,[Ca2 +]我114.作者证明了NADPH氧化酶2 (NOX2)活性的降低伴随着ROS的降低,这归因于GsMTx-4活性,然而,确切的机制尚未完全描述224.在其他地方,已经证明GsMTx-4可以保护心脏,因此这可能代表一种针对DMD的药理学机械敏性治疗策略225.
细胞骨架在DMD中功能失调,是心肌细胞机械发病的关键因素
如前所述,细胞骨架在维持心肌细胞的稳态中起着重要作用,机械传导在许多细胞过程中起着中心作用1,195,226.因此,细胞骨架的破坏可能会显著影响细胞的整体功能,在DMD中确实如此。
特别是,微管细胞骨架在DMD的背景下产生了广泛的兴趣53,125,227.Dystrophin直接与微管相互作用,特别是在spectrin重复24和WW结构域125.营养不良蛋白的缺失会破坏微管晶格mdx小鼠的α-和β-微管蛋白单体增加了2.5倍,这表明微管出现了紊乱125.有趣的是,微管蛋白单体在mdx与微管平衡的改变无关,而是微管的长期稳定被破坏了125.
据报道,在DMD中,微管细胞骨架与WT对照相比更加坚硬53,立即建议改变力学生物学,特别是考虑到张拉整体模型。据报道,在功能上,机械拉伸增加了NOX2产生的X-ROS以及Ca的升高2 +在mdx但在WT肌肉中没有228.微管网络在连接轴向应力时与NOX2和Ca的作用2 +尤其重要,因为它关系到DMD的所有核心病理特征。作者认为,Piezo 1/2或TRPC1拉伸激活通道是钙流入的原因2 +观察到,如前所述,这是DMD发病的重要因素228.
细胞骨架的翻译后修饰已被证实是支撑DMD的另一种机制53.α-微管蛋白的去酪化在DMD中是破坏微管骨架的关键53增加了微管的硬度,破坏了细胞的机械感应和对环境的反应能力53.最终,微管的破坏是一个突出的驱动因素mdx心脏相关死亡53.孤雌内酯可降低α-微管蛋白的脱氨酸作用,显著改善大鼠心脏表型mdx接受异丙肾上腺素治疗的小鼠100%存活,而未接受治疗的小鼠存活率低于10%mdx老鼠53.此外,孤雌酚内酯还能抑制Ca2 +波的反应,强调细胞骨架之间的相互作用Ca2 +监管53.总的来说,这些发现表明细胞骨架的紊乱是DMD发病的关键决定因素。
DMD中的微管共生紊乱也与细胞器定位错误有关,例如高尔基复合体229.高尔基体被证明定位错误,具有明显的形态特征mdx与WT相比,这些特征也与蛋白质的异常翻译后修饰有关229.作者通过转染成功挽救了这种疾病的表型mdx含有微肌营养不良蛋白(ΔR4-R23)的骨骼肌细胞,含有与肌动蛋白和微管的结合基基229.
此外,正如Iyer所报道的,细胞核的定位也可能受到影响,其运动在mdx与WT小鼠相比227.有趣的是,Iyer显示出对LINC复合体的显著破坏mdx大多数中央LINC复合体蛋白(nesprin, SUN1/2, emerin, lamin A/C)下调的小鼠227,从而减少了细胞核和细胞骨架之间的联系,这一特征本身可能是肌肉萎缩症和异常机械传导的原因230,231,232.他们还观察到LINC复合体蛋白的转录活性下降,尤其是nesprin 1基因,自从1227.综上所述,这些发现表明微管细胞骨架的破坏是DMD机械发病的一个重要因素。大多数的发现已经报道了骨骼肌组织,进一步阐明微管在心肌细胞中的作用是至关重要的。
肌动蛋白细胞骨架也是心肌细胞机械生物学的中心,主要负责细胞刚度和力作为机械波的传播120.hipsc来源的心肌细胞的报告显示,恢复抗肌萎缩蛋白的ABD1/2结合位点显著改善钙2 +处理动力学233提示肌萎缩蛋白和肌动蛋白之间的相互作用在调节钙动力学中起重要作用。为了支持这一观点,细胞骨架基因的突变,包括DGC的突变(Dmd, pdlim3, fktn, SGCG,SSPN)是遗传性DCM房颤的原因吗234,235.致命的快速心律失常是DMD的病理特征,有趣的是,细胞骨架突变似乎与这种表型密切相关。
γ-肌动蛋白肌膜下晶格直接与肌萎缩蛋白相互作用,并被发现增加了10倍mdx与WT对照组小鼠相比236,这可能是一种试图维持肌膜下晶格完整性的代偿机制,然而,与细胞内更深层次的f -肌动蛋白连接被破坏,从而对沿预应力肌动蛋白索的机械传导产生负面影响。γ-actin的上调补充了先前在DMD患者中描述的α7β1表达增加的代偿性147.
最后,研究表明,肌动蛋白细胞骨架和心脏重构的表观遗传调控变化是DMD的另一个关键组成部分237.核oporin (NUP) 153的表达增加mdx模型和发现乙酰化,激活其功能,并驱动心肌细胞的基因转录促进心脏重构237.NUP 153增加了肌动蛋白结合蛋白基因,包括nexilin基因,以及Ca的表达和功能V1.2离子通道,促进心律失常237.NUP 153在人类DMD心脏样本中的表达增加被Nanni验证,这意味着细胞骨架的表观遗传调节被破坏237.
结论
DGC在横纹肌组织维持中的重要性不可低估。如果没有它,患者就会遭受灾难性的、限制生命的肌肉萎缩症,影响他们生活的各个方面。为了缓解疾病表型,以治疗DMD患者为目标,了解和研究其基础机制是很重要的。
心肌必须具有保护机制,以抵御肌肉肌生成的力量,以防止收缩引起的损伤,特别是考虑到心肌从出生到死亡都在收缩。肌萎缩蛋白是一种主要的抗收缩力保护剂,促进肌膜的完整性,同时也是机械敏感蛋白的支架。肌营养不良蛋白和/或DGC的缺失使心肌细胞的肌膜异常脆弱,无法承受收缩性损伤,导致DMD的发病机制。此外,已经发现,潜在的肌层修复机制本身被破坏,进一步加剧了细胞的完整性。
细胞骨架与细胞外基质之间重要连接的中断,会导致细胞水平的机械传导中断和机械功能障碍。这些作用是促进增加对机械刺激的敏感性,进而导致心脏扩张增加和进行性DCM。
检查DGC的中心蛋白及其与细胞骨架、机械敏感蛋白(如YAP)、ECM、细胞核的相互作用对了解疾病至关重要。这些变化如何转化为机械信号通路、基因表达和整体器官功能的中断仍有待充分探索。
对生物力学的研究已经揭示了它在控制细胞和分子过程中特别重要,这些过程决定了更高阶的表型。特别是,我们强调并检查了证据,证明了DMD中生物力学中断的影响,以及它如何成为疾病发病机制的核心驱动因素。总的来说,营养不良蛋白以及DGC的其他成分的缺失削弱了肌膜,使其容易受到收缩诱导的损伤,对细胞机械转导产生负面影响,线粒体功能障碍、促炎和坏死细胞死亡是其特征。此外,离子通道调节失灵,钙含量升高2 +,以及ROS的产生,进一步推动病理,并可解释在患者中观察到的心律失常和心源性猝死。长期的变化被传递到细胞核和异常的机械传导促进改变的基因表达。
总之,考虑生物力学在调节细胞和分子生理学中的重要作用以及它如何成为疾病进展的主要贡献者是至关重要的。在这里,我们已经证明了生物力学在DMD中的重要性,然而,仍然需要做很多工作来更清楚地定义和梳理机制,特别是在整合讨论的不同主题以实现对患者有益的治疗和改变生活的结果方面。
报告总结
有关研究设计的进一步资料,请参阅自然研究报告摘要链接到这篇文章。
参考文献
Iskratsch, T., Wolfenson, H. & Sheetz, M. P.欣赏力与形状——细胞生物学中机械传导的兴起。细胞生物学。15, 825-833(2014)。
整合素:细胞表面受体的一个家族。细胞48, 549-554(1987)。
坎贝尔,k.p.和卡尔,s.d.营养不良蛋白和整体膜糖蛋白的关系。自然338, 259-262(1989)。
Muntoni, F., Torelli, S. & Ferlini, A. Dystrophin和突变:一个基因,几个蛋白质,多种表型。柳叶刀神经。2, 731-740(2003)。
郭,C.等。在营养不良蛋白缺乏的小鼠中,α 7整合素的缺失会导致类似杜氏肌营养不良症的肌病。嗡嗡声。摩尔,麝猫。15, 989-998(2006)。
鲁尼,J. E.等。缺乏抗肌萎缩蛋白和α - 7整合素的小鼠严重肌肉萎缩。细胞科学。119, 2185-2195(2006)。
博尼拉,E.等。杜氏肌营养不良症:肌肉细胞表面缺乏肌营养不良蛋白。细胞54, 447-452(1988)。
高q q & McNally, e。m。肌萎缩蛋白复合物:结构、功能和治疗意义。压缩机。杂志。5, 1223-1239(2015)。
Petrof, B. J., Shragert, J. B., Stedmant, H. H., Kellyt, A. M. & Lee Sweeney, H.肌萎缩蛋白保护肌膜免受肌肉收缩过程中产生的压力(肌肉萎缩症/肌肉损伤/mdx小鼠)。Proc。国家的。学会科学。美国90, 3710-3714(1993)。
Le, S.等。营养不良蛋白作为分子减震器。ACS Nano12, 12140-12148(2018)。
Tadayoni, R., Rendon, A., sria - jasso, L. E. & Cisneros, B. Dystrophin Dp71:杜氏肌营养不良基因最小但多功能的产物。摩尔。一般人。45, 43-60(2012)。
Morikawa Y., Heallen, T., Leach, J., Xiao Y. & Martin, J. F. dystrophin -糖蛋白复合物隔离物Yap抑制心肌细胞增殖。自然547, 227-231(2017)。
Garbincius, J. F. & Michele, D. E.肌营养不良蛋白-糖蛋白复合物通过AMPK信号的机械调节调节肌肉一氧化氮的产生。国家科学院学报美国。112, 13663-13668(2015)。
麦克纳利,e.m.等人。肌萎缩症中的穴蛋白3。嗡嗡声。摩尔,麝猫。7, 871-877(1998)。
米莱,D. P.等。钙内流足以通过trpc依赖机制诱导肌营养不良。国家科学院学报美国。106, 19023-19028(2009)。
麦克纳利,e.m.等人。杜氏肌营养不良的当代心脏问题。循环131, 1590-1598(2015)。
Yasuma, F., Konagaya, M., Sakai, M., Kuru, S. & Kawamura, T.日本杜氏肌营养不良患者的新生活。点。j .地中海。117, 363(2004)。
Meyers, t.a. & Townsend, D.心脏病理生理学和杜氏肌营养不良的心脏治疗的未来。Int。理学.20., 4098(2019)。
Aartsma-Rus, A.等人。通过一个或多个外显子内的双靶向,探索治疗杜氏肌营养不良的外显子跳跃的前沿。摩尔。其他。14, 401-407(2006)。
Broomfield, J., Hill, M., Guglieri, M., Crowther, M. & Abrams, K. Duchenne型肌肉萎缩症的预期寿命。神经学97, e2304-e2314(2021)。
聂格罗,李,李,李。肌萎缩蛋白基因突变与心肌病的关系。Neuromuscul。Disord。4, 371-379(1994)。
Kamdar, F. & Garry, D. J.肌萎缩蛋白缺乏性心肌病。j。科尔。心功能杂志。67, 2533-2546(2016)。
詹姆斯,K. A.等人。杜氏肌营养不良的左心室功能障碍。心功能杂志。年轻的-。30., 171-176(2020)。
Chenard, A. A., Becane, H. M., Tertrain, F., de Kermadec, J. M. & Weiss, Y. A. Duchenne型肌营养不良患者室性心律失常:患病率、意义和预后。Neuromuscul。Disord。3., 201-206(1993)。
肌营养不良症中的心律失常。听到的。节奏9, 1890-1895(2012)。
汤森德,安田,李,张伯伦,梅茨格,张伯伦,营养不良骨骼肌靶向修复引起的突发性扩张型心肌病。摩尔。其他。16, 832(2008)。
柯尼格等人。杜氏肌营养不良(DMD) cDNA的完全克隆和DMD基因在正常和受影响个体中的初步基因组组织。细胞50, 509-517(1987)。
Koenig, M., Monaco, a.p. & Kunkel, L. M.营养不良蛋白的完整序列预测棒状细胞骨架蛋白。细胞53, 219-228(1988)。
霍夫曼,E. P.布朗,R. H.和Kunkel, L. M.肌营养不良蛋白:杜氏肌营养不良位点的蛋白质产物。细胞51, 919-928(1987)。
埃尔瓦斯提,J. M.卡尔,S. D. &坎贝尔,K. P.骨骼肌中营养不良蛋白的纯化。生物。化学。266, 9161-9165(1991)。
罗伯茨,s.l.等。心肌病仓鼠肌萎缩蛋白-糖蛋白复合物的破坏。生物。化学。268, 11496 - 11499(1993)。
瓦勒拉,i.c.等。肌萎缩蛋白-糖蛋白复合物在不同心脏病理中的重要作用。医学科学66, 52-71(2021)。
Masubuchi, N., Shidoh, Y., Kondo, S., Takatoh, J. & Hanaoka, K.肌萎缩肌蛋白异构体在心肌细胞中的亚细胞定位和肌萎缩肌蛋白缺陷小鼠的表型分析揭示心肌病主要是由全长肌萎缩肌蛋白缺乏引起的。实验动物。62, 211-217(2013)。
法布里齐奥,等人。一个77 kDa与肌萎缩蛋白基因家族相关的蛋白的鉴定和定位。物化学。J。299, 359-365(1994)。
Klietsch, R., Ervasti, J. M., Arnold, W., Campbell, K. P. & Jorgensen, A. O.肌营养不良蛋白-糖蛋白复合物和层粘连蛋白共定位于心肌的肌膜和横小管。中国保监会,Res。72, 349-360(1993)。
Connors, N. C. & Kofuji, P. Dystrophin Dp71对视网膜神经胶质细胞钾通道的聚集定位至关重要。j . >。22, 4321-4327(2002)。
Schorling, d.c.等人。杜氏肌营养不良患者血小板颗粒分泌受损-一项前瞻性诊断研究的结果。Neuromuscul。Disord。31, 35-43(2021)。
奈杜,M.和安东尼,K.抗肌萎缩蛋白Dp71和杜氏肌营养不良的神经病理生理学。摩尔。一般人。57, 1748-1767(2020)。
Karnam, S. & Ponugoti, V. R. dystrophin (Dp71)在晶状体膜组织和力学中的作用。Investig。眼科可见科学。60, 5687(2019)。
Nico, B.等。营养不良MDX小鼠血脑屏障发育的改变。神经科学125, 921-935(2004)。
Anastasi, G.等人。成人心肌中的肌营养不良蛋白-糖蛋白复合物和vinculin-talin-integrin系统。Int。J. Mol. Med。23, 149-159(2009)。
Hemmings, L., Kuhlman, P. a . & Critchley, D. R.通过诱变分析α-肌动蛋白的肌动蛋白结合域,并证明营养不良蛋白包含一个功能同源域。J.细胞生物学。116, 1369-1380(1992)。
Rybakova, i.n, Patel, J. R. & Ervasti, J. M. JCB报告:肌营养不良蛋白复合物在肌膜和Costameric之间形成了机械强联系肌动蛋白。J.细胞生物学。150, 1209-1214(2000)。
Waugh, R. E. & Agre, P.红细胞膜粘弹性系数的降低反映了遗传性球形红细胞增多症中光谱蛋白的缺陷。j .中国。投资。81, 133-141(1988)。
帕斯捷尔纳克,C.,黄,S. &埃尔森,e.l.肌细胞中营养不良蛋白的机械功能。J.细胞生物学。128, 55-61(1995)。
Bhasin, N.等人。微型抗肌萎缩蛋白的分子延展性和抗肌萎缩蛋白棒结构。J. Mol.生物学。352, 795-806(2005)。
DeWolf, C.等人。肌萎缩蛋白片段与模型膜的相互作用。Biophys。J。72, 2599-2604(1997)。
勒·鲁默尔,等人。肌营养不良蛋白棒结构域与膜磷脂的相互作用:色氨酸残基与脂质之间密切接近的证据。生物。化学。278, 5993-6001(2003)。
赵,J.等。Dystrophin包含多个独立的膜结合域。嗡嗡声。摩尔,麝猫。25, 3647-3653(2016)。
纳尔逊等人。表达不同微型化肌营养不良蛋白的mdx肌肉中微管和生理表型的可变挽救。嗡嗡声。摩尔,麝猫。27, 2090-2100(2018)。
贝兰托,J. J.等。微管结合区分营养不良蛋白和营养不良蛋白。国家科学院学报美国。111, 5723-5728(2014)。
Ayalon, G., Davis, J. Q., Scotland, P. B. & Bennett, V.一种基于锚蛋白的抗肌萎缩蛋白和抗糖聚糖功能组织机制。细胞135, 1189-1200(2008)。
科尔,J. P.等。脱酪氨酸微管调节心脏和骨骼肌的机械传导。Commun Nat。6, 1-14(2015)。
抗肌萎缩蛋白复合物可作为信号蛋白的支架☆.Biochim。Biophys。生物学报。1838, 635-642(2014)。
Dwyer, T. M. & Froehner, S. C.鱼雷促营养蛋白与营养不良蛋白和87 kDa营养不良蛋白同源物的直接结合。2月。375, 91-94(1995)。
Dystrophin,它与其他蛋白质的相互作用,以及对肌肉营养不良的影响。生物化学与生物物理。分子基础学报。1772, 108-117(2007)。
Sadoulet-Puccio, H. M. Rajala, M. & Kunkel, L. M. Dystrobrevin和dystrophin:通过线圈图案的相互作用。国家科学院学报美国94, 12413-12418(1997)。
Schofield, J., Houzelstein, D., Davies, K., Buckingham, M. & Edwards, Y. H.小鼠胚胎发生过程中营养不良蛋白相关蛋白(utrophin)基因的表达。Dev,直流发电机。198, 254-264(1993)。
爱,D. R.等人。骨骼肌中与肌萎缩蛋白同源的常染色体转录本。
Vulin, A.等人。DMD中Dystrophin的ZZ结构域:错义突变的意义。嗡嗡声。Mutat。35, 257(2014)。
ishikawawa - sakurai, M., Yoshida, M., Imamura, M., Davies, K. E. & Ozawa, E. ZZ结构域是营养不良蛋白和营养不良蛋白与β-营养不良聚糖生理结合所必需的。嗡嗡声。摩尔,麝猫。13, 693-702(2004)。
安曼,郭建军,郭伟霞,郭建民。营养型营养蛋白缺乏肌萎缩蛋白棒结构域肌动蛋白结合活性。生物。化学。274, 35375-35380(1999)。
Broderick, M. J. F, Bobkov, A. & Winder, S. J. Utrophin ABD以开放构象与F-肌动蛋白结合。FEBS Open Bio2, 6(2012)。
雷巴科娃,胡斯顿,J. L., Sonnemann, K. J. & Ervasti . M. Dystrophin和Utrophin通过不同的接触方式结合肌动蛋白*。(2006)。https://doi.org/10.1074/jbc.M513121200
Rajaganapathy, S.等。在同源谱样重复序列中有明显的机械特性。科学。代表.9, 5210(2019)。
宋,m.h.等。基质细胞蛋白CCN5基因转移通过减少纤维化和上调Utrophin表达改善mdx/utrn(±)单倍不足小鼠的心脏和骨骼功能障碍前面。Cardiovasc。地中海.9, 763544(2022)。
Péladeau, C.等。在营养不良肌肉中靶向eEF1A2和上调utrophin A翻译的治疗方法的鉴定。Nat。Commun.11, 1990(2020)。
廷斯利,J.等。全长utrophin的表达可预防mdx小鼠肌肉营养不良。国立医学院1998 4124, 1441-1444(1998)。
Mizuno, Y., Nonaka, I., Hirai, S. & Ozawa, E. Duchenne肌营养不良患者,女性dmd携带者和对照组肌肉中营养不良蛋白和营养不良蛋白的相互表达。j .神经。科学。119, 43-52(1993)。
Barnabei, M. S. & Metzger, J. M.离体拉伸揭示了离体肌萎缩蛋白缺陷心脏的力学特性的改变。《公共科学图书馆•综合》7, 32880(2012)。
霍尔特,K. H.,克罗斯比,R. H.,文兹克,D. P. &坎贝尔,K. P.营养不良聚糖的生物合成:前体肽的加工。2月。468, 79-83(2000)。
Patthy, L. & Nikolics, K. agrin及其相关蛋白的功能。趋势>。16, 76-81(1993)。
佐藤,S.等。皮卡丘素,一种反糖基配体,是光感受器带状突触形成所必需的。Nat。>。11, 923-931(2008)。
Ervasti, J. M. & Campbell, k.p.肌萎缩蛋白-糖蛋白复合物作为层粘连蛋白和肌动蛋白之间的跨膜连接物的作用。J.细胞生物学。122, 809-823(1993)。
Jung D., Yang B., Meyer, J.,张伯伦,J. S. & Campbell, K. P. β-营养不良聚糖上抗肌萎缩蛋白锚定位点的鉴定和表征。生物。化学。270, 27305-27310(1995)。
Bassat, E.等人。细胞外基质蛋白agrin促进小鼠心脏再生。自然547, 179-184(2017)。
Endo, T.糖基化不良及其在α-糖基病变中的作用。Acta Myologica26, 165-170(2007)。
布罗金顿等人。福库汀相关蛋白基因(FKRP)的突变导致一种先天性肌营养不良症,伴有继发性层粘连蛋白α2缺陷和α-营养不良聚糖的异常糖基化。点。j .的嗡嗡声。麝猫。69, 1198-1209(2001)。
墨丘利,E.等。先天性肌营养不良伴继发性美洛蛋白缺乏与正常脑MRI:一个新实体?小儿神经病学31, 186-189(2000)。
Boyd, A., Montandon, M., Wood, A. J. & Currie, P. D. FKRP指导纤维连接蛋白糖基化:一种新的机制,为肌肉营养不良症提供见解?Bioessays44, e2100270(2022)。
Han, R.等。基底层通过α-反糖聚糖的层粘连蛋白G结构域结合基序加强细胞膜完整性。国家科学院学报美国106, 12573-12579(2009)。
Ilsley, J. L., Sudol, M. & Winder, S. J.营养不良蛋白与β-营养不良聚糖的相互作用受酪氨酸磷酸化调节。细胞。信号。13, 625-632(2001)。
Takawira, D., Budinger, G. R. S., Hopkinson, S. B. & Jones, J. C. R.一个营养不良糖聚糖/果胶支架介导肺上皮细胞的机械通路分叉。生物。化学。286, 6301-6310(2011)。
费里,A.等人。Desmin可以防止营养不良mdx小鼠的肌肉萎缩、过度虚弱和脆弱以及疲劳。j .杂志。598, 3667-3689(2020)。
Carlier, m.f.等。GRB2通过增强神经wiskot - aldrich综合征蛋白(N-WASp)与肌动蛋白相关蛋白(ARP2/3)复合物的相互作用,将信号通路与肌动蛋白组装连接起来。生物。化学。275, 21946-21952(2000)。
Schlaepfer, D. D., Hanks, S. K, Hunter, T. & Van Der Geer, P.整合素介导的信号转导通过GRB2结合到局灶粘附激酶连接到Ras通路。自然372, 786-791(1994)。
威廉森,R. A.等。Dystroglycan对早期胚胎发育至关重要:dag1缺失小鼠Reichert 's膜的破坏。嗡嗡声。摩尔,麝猫。6, 831-841(1997)。
van Reeuwijk, J., Brunner, H. G. & van Bokhoven, H. Walker-Warburg综合征的glyc - o遗传学。中国。麝猫。67, 281-289(2005)。
Beltran-Valero de Bernabé, D.等。FKRP基因突变可导致肌肉眼脑疾病和沃克-瓦伯格综合征。J.医学热内.41, e61(2004)。
沃尔特,m.c.等。FKRP (826C>A)在德国患者中经常引起肢带肌营养不良。杰内.41, 50(2004)。
霍尔特,K. H.和坎贝尔,K. P.肌聚糖复合物的组装洞察肌肉营养不良。生物。化学。273, 34667-34670(1998)。
卢,Y.等。在4种肌聚糖蛋白缺失的肢体带肌营养不良2D病例中发现一种新的SGCA错义突变。神经病理学39, 207-211(2019)。
Matsunari, H.等人。δ-肌聚糖缺乏症猪表现出遗传性心肌病的特征。实验室。Investig。One hundred., 887-899(2020)。
Rutschow, D.等。S151A δ-糖聚糖突变可引起小鼠轻度心肌病表型。欧元。j .的嗡嗡声。麝猫。22, 119-125(2014)。
Alonso-Pérez, J.等。一项大型欧洲肌糖病患者队列研究中新的基因型-表型相关性。大脑143, 2696-2708(2020)。
尼格罗等人。常染色体隐性肢体带肌营养不良症(LGMD2F)是由delta-肌聚糖基因突变引起的。Nat,麝猫。14, 195-198(1996)。
Tsubata, S.等。家族性和散发性扩张型心肌病中人delta-肌聚糖基因突变。j .中国。投资。106, 655-662(2000)。
Campbell, m.d., Witcher, M., Gopal, a . & Michele, D. E.心血管生理学和病理学中的质膜完整性:扩张型心肌病δ-糖聚糖突变对心肌细胞机械稳定性产生显性-负性影响。点。j .杂志。——听到。中国保监会,杂志。310, h1140(2016)。
舒,C.等。高通量筛选确定肌跨调节,稳定肌肉细胞,并在杜氏肌营养不良小鼠模型中表现出活性。Skelet。肌肉10, 1-17(2020)。
Miller, G., Wang, E. L., Nassar, K. L., Peter, A. K. & Crosbie, R. H.肌聚糖-肌跨亚复合物的结构和功能分析。Exp. Cell Res。313, 639-651(2007)。
Mamsa, H., Stark, R. L., Shin, K. M., Beedle, A. M. & Crosbie, R. H. Sarcospan增加α- dysstroglycan的层蛋白结合能力以改善独立于Galgt2的DMD。嗡嗡声。摩尔,麝猫。31, 718-732(2022)。
马歇尔,J. L.等。肌萎缩蛋白和肌营养蛋白的表达需要肌间隙:缺失a7整合素加剧了肌间隙缺失小鼠新发现的肌肉表型。https://doi.org/10.1093/hmg/dds271(2012)。
布伦曼,J. E.等。PDZ结构域介导的一氧化氮合酶与突触后密度蛋白PSD-95和α1-合营养蛋白的相互作用。细胞84, 757-767(1996)。
Bhat, S. S., Ali, R. & Khanday, F. A.纠缠在细胞骨架网中的合成营养素:帮助将其保持在一起。细胞Prolif.52, e12562(2019)。
亚当斯,m.e.等人。两种形式的小鼠syntrophin,一种58 kd的抗肌萎缩蛋白相关蛋白,在初级结构和组织分布上有所不同。神经元11, 531-540(1993)。
Adams, M. E, Odom, G. L., Kim, M. J., Chamberlain, J. S. & Froehner, S. C. Syntrophin直接结合到dystrophin中的多个谱样重复序列,并介导nNOS与重复序列的结合16-17。嗡嗡声。摩尔,麝猫。27, 2978-2985(2018)。
希利尔,B. J., Christopherson, K. S., Prehoda, K. E., Bredt, D. S. & Lim, W. A.由nNOS-syntrophin复合物结构揭示的PDZ结构域脚手架的意外模式。科学。(80 -)。284, 812-815(1999)。
Iwata, Y., Sampaolesi, M., Shigekawa, M. & Wakabayashi, S. Syntrophin是一种肌动蛋白结合蛋白,其细胞定位是通过骨骼肌细胞中的细胞骨架重组来调节的。欧元。J.细胞生物学。83, 555-565(2004)。
Bhat, H. F., Baba, R. A., Adams, M. E. & Khanday, F. A. SNTA1在Rac1激活、调节ROS生成和人类乳腺癌细胞迁移潜能中的作用。Br。j .癌症110, 706-714(2014)。
王,H.等。蛋白质组学分析确定了肌萎缩蛋白和微肌萎缩蛋白心脏相互作用组的关键差异。嗡嗡声。摩尔,麝猫。30., 1321-1336(2021)。
Gavillet, B.等。心脏钠通道Nav1.5由复合营养因子和营养不良蛋白组成的多蛋白复合物调节。中国保监会,Res。99, 407-414(2006)。
Seo, K.等。营养不良心脏过度活跃的不良机械应激反应与瞬时受体电位规范6耦合,并被cgmp-蛋白激酶g调节阻断。中国保监会,Res。114, 823-832(2014)。
钟,H. S.等。瞬态受体电位通道6调节杜氏肌营养不良患者心脏s -亚硝基化异常。国家科学院学报美国114, e10763-e10771(2017)。
Lopez, J. R, Uryash, A., Faury, G., Estève, E. & Adams, J. A. TRPC通道对mdx小鼠平滑肌细胞内Ca2 +平衡障碍的贡献。前面。杂志。11, 126(2020)。
英格伯,D. E.细胞机械传导:把所有的碎片重新组合在一起。美国实验生物学学会联合会J。20., 811-827(2006)。
姚,M.等。α-连环蛋白的力依赖构象开关控制温库素结合。Commun Nat。5, 4525(2014)。
姚,M.等。塔林的力学响应。Commun Nat。7, 1-11(2016)。
Del里约热内卢,A.等。拉伸单个talin棒分子激活vinculin结合。科学323, 638-641(2009)。
Amann, K. J., Renley, B. A. & Ervasti, J. M. dystrophin棒结构域的一簇碱基重复序列通过静电相互作用结合F-actin。生物。化学。273, 28419-28423(1998)。
王宁,泰特尔,J. D. & Ingber, D. E.机械转导在一个距离:机械耦合的细胞外基质与核。细胞生物学。10, 75-82(2009)。
Miroshnikova, Y. A. & Wickström, s.a .核组织中的机械力。冷泉港。教谕。医学杂志。14, a039685(2021)。
不,s等人。活细胞中的快速信号转导是机械转导的一个独特特征。国家科学院学报美国105, 6626-6631(2008)。
威尔逊,D. G. S. & Iskratsch, T.力的分解:eIF6的一个新角色。J.细胞生物学.221, e202201002(2022)。
基恩,A. N.等。真核起始因子6调节内皮细胞的机械反应。J.细胞生物学。221, e202005213(2022)。
普林斯,K. W.等。营养不良蛋白是一种微管相关蛋白。J.细胞生物学。186, 363-369(2009)。
Spreafico, M.等人。靶向HDAC8改善杜氏肌营养不良骨骼肌分化。杂志。Res。170, 105750(2021)。
小野,H.等。AMPK复合物激活促进异常鞘质病变的肌膜修复。摩尔。其他。28, 1133-1153(2020)。
坎贝尔,I. D.和汉弗莱斯,M. J.整合素结构,活化和相互作用。冷泉港。教谕。医学杂志。3., a00494(2002)。
整合素:双向变构信号机。细胞110, 673-687(2002)。
Di Cio, S., Bøggild, T. M. L., Connelly, J., Sutherland, D. S. & Gautrot, J. E.差异整合素表达调节细胞对基质纳米尺度几何结构的感知。Acta Biomater。50, 280-292(2017)。
张志刚,张志刚,张志刚。层纤蛋白-整合素相互作用的分子基础。咕咕叫。上面。会员。76, 197-229(2015)。
孙,Y.等。基质刚度调节人脐带间充质干细胞心肌分化。老化(奥尔巴尼。纽约).12, 2231-2250(2020)。
张淑娟,张秀娟,张秀娟,张秀娟。循环拉伸对β 1d -整合素表达及激活的影响。点。j .杂志。-细胞物理。292, 2057-2069(2007)。
血管生成和心血管生理学中的机械信号和细胞对细胞外基质的反应。循环Res。91, 877-887(2002)。
陈,C.,曼索,a.m.和罗斯,R. S. Talin和kindlin作为整合素激活蛋白:关注心脏。Pediatr。心功能杂志。40, 1401-1409(2019)。
Castillo, E. A., Lane, K. V. & Pruitt, B. L.微机械生物学:专注于心脏细胞-基质界面。安。启生物医学。工程师.22, 257-284(2020)。
Roca-Cusachs, P., Iskratsch, T. & Sheetz, m.p.寻找最薄弱的环节-探索整合素介导的机械分子途径。细胞科学。125, 3025-3038(2012)。
Paul, R., Heil, P., Spatz, J. P. & Schwarz,美国机械应力通过肌动蛋白细胞骨架向局点粘连的传播:模型和实验。Biophys。J。94, 1470(2008)。
Jonas, O. & Duschl, C.细胞中的力传播和力的产生。细胞骨架67, 555-563(2010)。
Paul, a.c., Sheard, P. W., Kaufman, S. J. & Duxson, M. J. α7整合素和营养不良蛋白的定位提示在大型哺乳动物肌肉中张力的横向和纵向传递的潜力。细胞组织决议2002 3082308, 255-265(2002)。
吉田,T.,潘,Y., Hanada, H., Iwata, Y. & Shigekawa, M.培养的L6肌细胞中肌聚糖和整合素粘附系统之间的双向信号。生物。化学。273, 1583-1590(1998)。
Elsherif, L.等。心肌细胞中营养不良蛋白和β1整合素的联合缺乏可引起心肌功能障碍、纤维化和钙化。中国保监会,Res。102, 1109-1117(2008)。
Oliveira-Santos, A, Dagda, M. & Burkin, D. J. Sunitinib抑制心肌中STAT3磷酸化,并预防mdx小鼠Duchenne肌萎缩症模型的心肌病。嗡嗡声。摩尔,麝猫。ddac042, 1-12(2022)。
Mayer, U.等人。整合素α7缺失导致一种新型的肌肉萎缩症。Nat,麝猫。17, 318-323(1997)。
Hayashi, Y. K.等。整合素α7基因突变可导致先天性肌病。Nat,麝猫。19, 94-97(1998)。
Burkin, d.j.等人。在营养不良小鼠中,α7β1整合素的转基因表达维持肌肉完整性,增加再生能力,促进肥厚,减少心肌病。点。j .分册。166, 253(2005)。
霍奇斯,B. L.等。alpha7beta1整合素在人类和小鼠肌肉营养不良中的表达改变。细胞科学。110, 2873-2881(1997)。
海勒,K. N.等。aav介导的人α7整合素过表达导致营养不良小鼠的组织学和功能改善。摩尔。其他。21, 520-525(2013)。
萨拉蒂,A.等人。SU9516增加α7β1整合素并改善Mdx小鼠杜氏肌营养不良模型的疾病进展。摩尔。其他。25, 1395-1407(2017)。
Wuebbles, R. D., Sarathy, A., Kornegay, J. N. & Burkin, D. J.强的松治疗mdx小鼠和GRMD犬杜氏肌营养不良模型后α7整合素和层粘连蛋白-α2水平升高。DMM模型。动力机械。6, 1175-1184(2013)。
Parvatiyar, m.s.等。肌膜稳定心肌肌膜可挽救dmd相关心肌病。江森自控的洞察力4, e123855(2019)。
Côté, P. D., Moukhles, H. & Carbonetto, S. Dystroglycan在肌膜定位dystrophin、syntrophin和神经元一氧化氮合酶时不需要,但调节整合素α 7B的表达和小穴蛋白-3的分布。生物。化学。277, 4672-4679(2002)。
Cerna, J.等人。Dystrophin Dp71f与β1-整合素粘附复合物联合调节PC12细胞粘附。J. Mol.生物学。362, 954-965(2006)。
García-Tovar, C. G.等。Dystrophin isoform Dp71存在于U-373 MG的人星形细胞瘤细胞的瓣足和局灶性复合体中。Acta Histochem。104, 245-254(2002)。
缺血性和非缺血性心衰中的细胞外基质。循环Res。125, 117-146(2019)。
Silva, a.c., Pereira, C., Fonseca, a.c. r.g, pinto -Ó, P. & Nascimento, d.s.《承载我的心:细胞外基质在心脏发育、稳态和损伤反应中的作用》。前面。细胞发育生物学。8, 1705(2021)。
french- constant, C.纤维连接蛋白的选择性剪接-许多不同的蛋白质,但很少不同的功能。Exp. Cell Res。221, 261-271(1995)。
洛哈特,M,威瑞格,E,菲尔普斯,A. &韦塞尔斯,A.细胞外基质与心脏发育。出生缺陷法案。摩尔。Teratol。91, 535(2011)。
米塔尔A.,普利纳M.,侯世勇。纤维连接蛋白和整合素α 5在心脏形态发生中起重要作用。Dev,杂志。381, 73-82(2013)。
George, E. L., George - labouesse, E. N., Patel-King, R. S., Rayburn, H. & Hynes, R. O.缺乏纤维连接蛋白的小鼠胚胎中胚层、神经管和血管发育的缺陷。发展119, 1079-1091(1993)。
Jourdan-LeSaux, C., Zhang J. & Lindsey, m.l.细胞外基质在心脏修复中的作用。生命科学。87, 391(2010)。
Berry, m.f.等人。心肌梗死后注射间充质干细胞改善心肌顺应性。点。j .杂志。心脏循环。物理。290, 2196-2203(2006)。
哈米尔,K. J., kigys, K.,霍普金森,S. B. &琼斯,J. C. R.层粘连蛋白沉积在细胞外基质:一个复杂的图片出现。细胞科学。122, 4409-4417(2009)。
Michele, D. E., Kabaeva, Z., Davis, S. L., Weiss, R. M. & Campbell, K. P.心肌细胞中的营养不良糖基受体功能对于限制活动诱导的心肌损伤很重要。中国保监会,Res。105, 984-993(2009)。
利贝尔,e.m.等人。心肌病与肢带肌营养不良R9、FKRP相关。肌肉神经62, 626-632(2020)。
原发性糖营养不良症的分子概述。j .细胞。摩尔。地中海。23, 3058-3062(2019)。
克利平格,S. R.等。家族性扩张型心肌病的分子和细胞表型的中断力学生物学联系。国家科学院学报美国116, 17831(2019)。
Vardas, P., Maniadakis, N., Bardinet, I. & Pinto, F.欧洲心脏病学会心脏病学地图集:理性、目标和方法。欧元。听到的。J. -质量护理诊所。结果2, 6-15(2016)。
Ward, M. & Iskratsch, T.混合和(错误)匹配-发育中的机械感应机制,健康成人和患病心脏的变化环境。Biochim。Biophys。分子学报。细胞研究。https://doi.org/10.1016/j.bbamcr.2019.01.017(2019)。
陈斌,陈志强,陈志强。免疫细胞在心肌梗死修复中的作用。微循环24, e12305(2017)。
Kharraz, Y., Guerra, J., Pessina, P., Serrano, A. L. & Muñoz-Cánoves, P.了解杜氏肌营养不良的纤维化过程。生物医学研究国际2014, e965631(2014)。
Ignotzs, R. A. & Massague, J.转化生长因子- β刺激纤维连接蛋白和胶原蛋白的表达及其与细胞外基质的结合。生物。化学。261, 4337-4345(1986)。
Bhana, B.等人。底物硬度对心脏细胞表型的影响。Biotechnol。Bioeng。105, 1148-1160(2010)。
Khan, R. & Sheppard, R.心脏病纤维化:理解转化生长因子-β1在心肌病、瓣膜病和心律失常中的作用。免疫学118, 10(2006)。
Valiente-Alandi, I.等人。在心力衰竭模型中,抑制纤维连接蛋白可减弱纤维化并改善心功能。循环138, 1236-1252(2018)。
阿尔斯兰等人。缺乏纤维连接蛋白- eda可促进存活,防止心肌梗死后的不良重塑和心功能恶化。中国保监会,Res。108, 582-592(2011)。
马夫罗根尼,S.等人。杜氏肌营养不良的心肌炎症是心力衰竭的诱发因素:一项前瞻性研究。BMC神经.10, 33(2010)。
袁伟,张晓明。转化生长因子β对皮肤成纤维细胞基质金属蛋白酶-1抑制作用的研究。生物。化学。276, 38502-38510(2001)。
贾戈,麦卡洛克,A. D. & Omens, J. H.底物硬度影响新生大鼠心室肌细胞功能成熟。Biophys。J。95, 3479-3487(2008)。
马祖德,R.等人。在体内磁共振弹性成像估计左心室僵硬在心肌梗死诱导猪模型。j .增效。的原因。成像45, 1024-1033(2017)。
查图维迪,R. R.等。先天性心脏病致心肌被动僵硬及其对舒张的影响。循环121, 979-988(2010)。
Arani, A.等人。心脏MR弹性成像定量评估心脏淀粉样变患者心肌硬度升高。j .增效。的原因。成像46, 1361-1367(2017)。
恩格勒,A. J.等人。胚胎心肌细胞在具有心脏样弹性的基质上搏动最好:疤痕样刚性抑制搏动。细胞科学。121, 3794-3802(2008)。
布斯,S. D.等。底物硬度对心肌细胞动作电位的影响。细胞生物化学。Biophys。74, 527-535(2016)。
Forte, G.等。底物硬度对体外培养的新生儿心肌细胞基因表达和表型的调节。组织中。部分18, 1837-1848(2012)。
Münch, J. & Abdelilah-Seyfried, S.心肌细胞对病变心脏组织刚度变化的感知和响应。前面。细胞发育生物学。9, 642840(2021)。
陈志勇等。抑制去酪氨酸微管改善心力衰竭心肌细胞功能。Nat,地中海。24, 1225-1233(2018)。
罗宾逊等人。脱酪氨酸微管在收缩的心肌细胞中弯曲并承担负荷。科学352, aaf0659(2016)。
Belmadani, S., Poüs, C., Ventura-Clapier, R., Fischmeister, R. & Méry, p.f.慢性心力衰竭大鼠心脏微管蛋白的翻译后修饰。摩尔。细胞。物化学。237, 39-46(2002)。
Caporizzo M. A., Chen C. Y., Bedi, K., Margulies, K. B. & Prosser, B. L.微管增加衰竭的人心肌细胞和心肌的舒张刚度。循环141, 902-915(2020)。
Luedde, M.等人。RIP3是一种促进坏死性细胞死亡的激酶,介导心肌梗死后的不良重塑。Cardiovasc。Res。103, 206-216(2014)。
摩根,j.e.等。坏死介导肌萎缩蛋白缺乏小鼠的肌纤维死亡。Nat。Commun.9, 1-10(2018)。
乔,S.等。RIPK1-RIPK3通过削弱心脏成纤维细胞的自噬通量介导2型糖尿病心肌纤维化细胞死亡.13, 147(2022)。
张,a.c.y.等。在营养不良心肌细胞中,组织硬度的增加引发收缩功能障碍和端粒缩短。干细胞代表16, 2169(2021)。
张拉整体学,I.细胞结构和分级系统生物学。细胞科学。116, 1157-1173(2003)。
丘格,P.等人。肌动蛋白皮层结构调节细胞表面张力。细胞生物学。19, 689-697(2017)。
Park, J. H.等。在组织损伤和疾病中突出的材料和细胞外基质刚性:对生物材料设计和治疗靶点的影响。Bioact。板牙。20., 381-403(2022)。
曹,H.等。基质硬度调节诱导多能干细胞向心脏瓣膜内皮细胞的分化。Acta Biomater。143, 115-126(2022)。
窃贼,I.等人。局部黏附蛋白β-parvin控制心肌细胞形状和肌节组装以响应机械负荷。咕咕叫。医学杂志.https://doi.org/10.1016/J.CUB.2022.05.047(2022)。
拉米雷斯,m.p.等人。肌萎缩蛋白错义突变改变黏附张力和机械转导。Proc。国家的。学会科学。美国.119, e2205536119(2022)。
黄,H.等。细胞硬度和受体:细胞骨架亚网络的证据。点。j .杂志。-细胞物理。288, 57-61(2005)。
马丽萍,王志强,段德华,王志强。杜氏肌营养不良患者钙处理异常的机制及治疗方法。前面。杂志。12, 355(2021)。
米莱,D. P.等。基因和药理学抑制线粒体依赖性坏死减弱肌肉萎缩。Nat,地中海。14, 442-447(2008)。
danalou, G.等人。营养不良蛋白缺陷的心肌细胞异常容易受到机械应力诱导的收缩衰竭和损伤。美国实验生物学学会联合会J。15, 1655-1657(2001)。
达德利,R. W. r。肌营养不良蛋白缺乏中的肌膜损伤是由机械和氧化/亚硝化应激之间的协同相互作用调节的。点。j .分册。168, 1276(2006)。
汤森,D. W.等人。长期服用膜密封胶可防止营养不良犬严重心脏损伤和心室扩张。j .中国。投资。120, 1140-1150(2010)。
安田,S.等。膜密封剂泊洛沙姆阻断营养不良性心力衰竭。自然436, 1025-1029(2005)。
斯普尔尼,c.f.等人。膜密封剂Poloxamer P188保护异丙肾上腺素诱导的肌营养不良小鼠心肌病。BMC Cardiovasc。Disord.11, 20(2011)。
瑞安,T。P-188 NF在DMD患者中的安全性和有效性.(2018).
维拉,m.c.等。线粒体介导细胞膜修复,有助于杜氏肌营养不良。细胞死亡不同。24, 330-342(2016)。
华莱士,G. Q. &麦克纳利,e.m.肌肉退化,再生和修复的机制在肌肉营养不良。为基础。启杂志。71, 37-57(2009)。
夏尔马,N.等。定量膜蛋白质组学的使用确定了线粒体在愈合受伤肌肉中的新作用。生物。化学。287, 30455(2012)。
阿尔塔米拉诺,F.等人。硝苯地平治疗降低静息钙浓度,氧化和凋亡基因表达,并改善营养不良mdx小鼠的肌肉功能。《公共科学图书馆•综合》8, e81222(2013)。
Mázala, D. A. G., Grange, R. W. & Chin, E. R.蛋白酶在肌营养不良患者兴奋-收缩耦合失效中的作用。点。j .杂志。-细胞物理。308, c33-c40(2015)。
休斯,m.c.等。杜氏肌营养不良的早期肌病与氧化磷酸化受损时线粒体H2O2排放升高有关。j .恶病质。Sarcopenia肌肉10, 643-661(2019)。
杜宾宁,m.v.等。杜氏肌营养不良与线粒体中钙单孔的抑制和细胞器对钙诱导的通透性转变的敏感性增加有关。Biochim。Biophys。分子基础学报.1866, 165674(2020)。
Williams, i.a. & Allen, d.g.活性氧在抗肌萎缩蛋白缺陷mdx小鼠心脏中的作用。点。j .杂志。——听到。中国保监会。杂志.293, h1969-h1977(2007)。
Turner, P. R., Westwood, T., Regen, C. M. & Steinhardt, R. A. mdx小鼠肌肉中游离钙水平升高导致蛋白质降解增加。自然335, 735-738(1988)。
Fanchaouy等人。异常应激诱导Ca2+内流进入营养不良mdx心肌细胞的途径。细胞钙46, 114-121(2009)。
Mijares, A., Altamirano, F., Kolster, J., Adams, J. A. & López, J. R.舒张期Ca2+和Na+浓度在营养不良性心肌病中的年龄依赖性变化:Ca2+进入和IP3的作用。物化学。Biophys。Commun >,452, 1054(2014)。
劳,M. L,科恩,H.,马丁,A. A. A., Angulski, A. B. B. & Metzger, J. M.杜氏肌营养不良相关扩张型心肌病钙处理异常:机制和实验治疗策略。j .中国。地中海。9, 520(2020)。
贝林格等人。在营养不良肌中,高亚硝基化赖安定受体钙释放通道存在渗漏。Nat,地中海。15, 325-330(2009)。
福科尼尔,J.等人。RyR2渗漏引发杜氏肌营养不良室性心律失常。国家科学院学报美国107, 1559-1564(2010)。
Ward, c.w, Sachs, F, Bush, E. D. & Suchyna, t.m. GsMTx4-D为D2提供保护。mdx鼠标。Neuromuscul。Disord。28, 868(2018)。
王娟,马勇,Sachs, F., Li J. & Suchyna, T. M. GsMTx4-D是一种抗缺血再灌注心肌梗死的心脏保护剂。J. Mol.细胞。心功能杂志。98, 83-94(2016)。
杨晓燕,杨晓燕,杨晓燕,等。细胞形态学调控途径的研究进展。为基础。启杂志。81, 585-605(2019)。
艾耶,S. R.等人。MDX肌纤维核动力学改变。j:。杂志。122, 470-481(2017)。
Khairallah, R. J.等。微管是杜氏肌营养不良功能障碍的基础。科学。信号.5, ra56(2012)。
Percival, J. M. et al. rAAV6-Microdystrophin拯救mdx骨骼肌中异常高尔基复合体组织。交通8, 1424-1439(2007)。
心肌病中核骨架和细胞骨架复合物蛋白的链接者。Biophys。牧师。10, 1033-1051(2018)。
王,S.等。通过LINC复合物的机械转导调节DNA在肌核中的复制。J.细胞生物学。217, 2005(2018)。
Lammerding, J.等人。层蛋白A/C缺陷导致核力学和机械传导缺陷。j .中国。投资。113, 370-378(2004)。
Kyrychenko, V.等人。基因编辑对肌萎缩蛋白结合域突变的功能校正。江森自控的洞察力2, e95918(2017)。
Vad, o.b.等。细胞骨架基因功能缺失变异与早发性房颤相关。j .中国。地中海。9, 372(2020)。
尼尔森,j.b.等。生物银行驱动的基因组发现为心房颤动生物学提供了新的见解。Nat,麝猫。50, 1234-1239(2018)。
Hanft, L. M., Rybakova, I. N., Patel, J. R., Rafael-Fortney, J. a . & Ervasti, J. M.细胞质γ-肌动蛋白有助于营养不良肌的代偿性重塑反应。国家科学院学报美国。103, 5385-5390(2006)。
南尼,S.等人。核孔蛋白Nup153与染色质结合并调节营养不良mdx心脏的心脏基因表达。Cardiovasc。Res。112, 555-567(2016)。
蒙托尼,F.等人。简要报告:与x连锁扩张型心肌病相关的肌萎缩蛋白肌肉启动子区缺失。心血管病。j .地中海。329, 921-925(1993)。
吉田等人。伴有扩张型心肌病的Becker肌营养不良症患者Duchenne肌营养不良基因的分子分析。肌肉神经16, 1161-1166(1993)。
张杨,等。一种用于单切CRISPR矫正常见杜氏肌营养不良突变的巩固AAV系统。摩尔。其他。中国的方法。Dev。22, 122(2021)。
Saotome, M., Yoshitomi, Y., Kojima, S. & Kuramochi, M.贝克型肌营养不良扩张型心肌病伴外显子4缺失一例报告。血管学52, 343-347(2001)。
甘贝塔,K. E.等。在杜氏肌营养不良的当代队列中,肌营养不良基因突变和疾病进展的多样性。Pediatr。心功能杂志。43, 855-867(2022)。
Walcher, T.等。杜氏肌萎缩症女性携带者心脏受累一例。Int。j .心功能杂志。138, 302-305(2010)。
伊尔马兹,A.等人。心血管医学中的图像。杜氏肌营养不良症携带者及其患病儿子的心肌病:心血管MRI显示相似的模式。循环121, e237-9(2010)。
ortizz - lopez, R., Li, H., Su, J., Goytia, V. & Towbin, J. a .抗肌萎缩蛋白错义突变是x连锁扩张型心肌病的原因。循环95, 2434-2440(1997)。
Duelen, R.等。人类iPSC模型揭示了NOX4和氧化应激在杜氏心肌病中的核心作用。干细胞代表17, 352(2022)。
Bitetti, I., Mautone, C., Bertella, M., Manna, M. R. & Varone, a . 2岁无义突变杜氏营养不良男孩的早期治疗。Acta Myol。40, 184(2021)。
van Reeuwijk, J.等人。LARGE基因的基因内缺失可引起Walker-Warburg综合征。嗡嗡声。麝猫。121, 685(2007)。
Poppe, M.等。四肢肌营养不良2I的心脏和呼吸衰竭。安。神经。56, 738-741(2004)。
Kondo-Lida, E.等。107个福山型先天性肌肉营养不良(FCMD)家族的新突变和基因型-表型关系。嗡嗡声。摩尔,麝猫。8, 2303-2309(1999)。
原,Y.等人。一种与肢体肌营养不良症相关的糖质营养不良突变。心血管病。j .地中海。364, 939-946(2011)。
贝罗,L.等。pomt1相关的先天性和肢带肌营养不良患者的心肌病。欧元。j .的嗡嗡声。麝猫。20., 1234(2012)。
巴雷西,R.等。心脏糖聚糖复合物的破坏和糖聚糖突变引起的严重心肌病。杰内37, 102-107(2000)。
夏,W.等。病例报告:一个男孩从一个近亲家庭诊断为先天性肌肉营养不良引起的整合素alpha 7 (itga7)突变。前面。麝猫。12, 1538(2021)。
确认
DGSW由英国心脏基金会的硕士/博士课程(FS/18/64/34185)资助。TI获得了英国心脏基金会项目拨款(PG/20/6/34835)和BBSRC新研究者奖(BB/S001123/1)的支持。AT得到了美国国家卫生研究所R-01的支持(参考1R01HL146514-01A1)。
作者信息
作者及隶属关系
贡献
D.G.S.W, T.I.和A.T.构思并撰写了手稿。d.g.s.w编制了数字和表格。t。i。和。t。监督这项工作。
相应的作者
道德声明
相互竞争的利益
作者声明没有利益竞争。
同行评审
同行评审信息
通信生物学感谢匿名审稿人对本工作的同行评议所作的贡献。首席处理编辑:George Inglis。
额外的信息
出版商的注意施普林格自然对出版的地图和机构从属关系中的管辖权主张保持中立。
补充信息
权利和权限
开放获取本文遵循知识共享署名4.0国际许可协议(Creative Commons Attribution 4.0 International License),允许以任何媒介或格式使用、分享、改编、分发和复制,只要您对原作者和来源给予适当的署名,提供知识共享许可协议的链接,并注明是否有更改。本文中的图像或其他第三方材料包含在文章的创作共用许可中,除非在材料的信用额度中另有说明。如果内容未包含在文章的创作共用许可协议中,并且您的预期使用不被法定法规所允许或超出了允许的使用范围,您将需要直接获得版权所有者的许可。要查看此许可证的副本,请访问http://creativecommons.org/licenses/by/4.0/.
关于本文
引用本文
Wilson, d.g.s., Tinker, A. & Iskratsch, T.肌营养不良蛋白糖蛋白复合体在肌肉细胞机械传导中的作用。Commun杂志5, 1022(2022)。https://doi.org/10.1038/s42003-022-03980-y
收到了:
接受:
发表:
DOI:https://doi.org/10.1038/s42003-022-03980-y