超小金属纳米团簇(NCs)与蛋白质的结合提供了双重机会:蛋白质可用于保护NCs, NCs的表面配体可与蛋白质相互作用。在这里,作者确定并讨论了围绕生物数控接口的剩余开放问题,这些问题需要未来的研究努力。
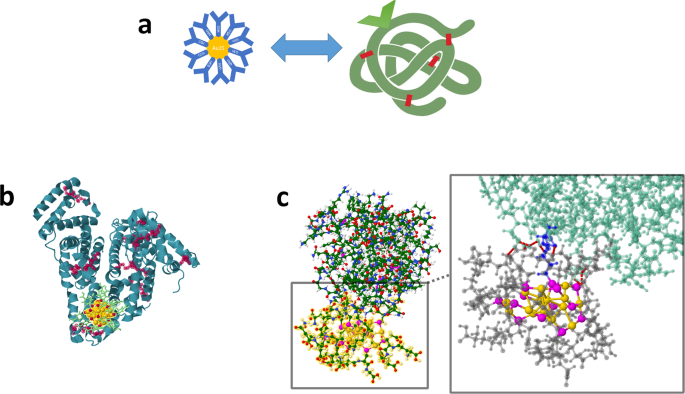
配体保护的金属纳米团簇(NCs)因其独特的物理化学性质,特别是发光特性而受到越来越多的关注1,以及它们在生物医学应用方面的功能。这种能力可以通过将nc与生物分子(特别是蛋白质)连接来实现(bio-NC接口,图。1).bio-NC接口具有双重作用(图2)。1 b, c):一方面,蛋白质可用于保护nc,另一方面,nc的表面配体可能与蛋白质存在某种有意或无意的相互作用。在这里,我们关注由nc与蛋白质相互作用引起的开放问题,考虑体外和体内的情况,并使用硅方法。特别是,我们探索了蛋白质纳米团簇功能化相关的主要问题,以及在活细胞中这些蛋白质与细胞内和细胞外内源性蛋白质的交换反应中发生了什么?生物数控接口的鲁棒性如何?纳米团簇是否有资格成为生物科学中某些荧光染料的替代品?
蛋白质与超小金属nc相互作用
裸金属集群在溶液中不稳定,需要对其进行保护。使用蛋白质作为金属数控合成和功能化的保护模板是数控界使用的一种相当优雅的策略。金属nc与生物分子的结合2,3.如蛋白质,结合金属纳米碳化物独特的光学、电子和催化特性与蛋白质的生物学功能,可以产生一些协同效应3.,4.Xie等报道了一项在生物-数控界面领域的开创性工作,描述了一种优雅而简单的一锅水合成荧光牛血清白蛋白金(BSA-Au)数控4,5.在这项开创性工作的后续,大量的nc被合成与不同的蛋白质用于生物医学目的4,5.然而,由于这种一锅合成同时使用蛋白质作为还原剂和稳定剂,蛋白质宿主结构的一些改变和/或在蛋白质内部不受控制的位置不受控制地形成簇6,限制了这类材料在生物医学研究中的广泛使用。因此,迫切需要新的合成方法来保持蛋白质导向的nc的生物活性以及所包含的原子精确金属簇的结构。这种合成路线可以通过配体交换将蛋白质分子附着在预先形成的原子精确的金属nc上获得。利用计算方法对这种特殊的结合进行了力学研究7我们小组最近在实验和理论上证实了这一点8,其中预成形的Au25通过NC表面配体与BSA半胱氨酸残基之间的配体交换,NC被合并到牛血清白蛋白(BSA)蛋白中(图。1 b).这一策略可以通过半胱氨酸工程蛋白质突变进一步推进,允许更有选择性地控制原子精确的金属nc在蛋白质中的位置和交换配体的数量。
探索生物数控界面的双重作用还包括使用“点击化学”方法将蛋白质分子附着到具有良好结构和光学特性的原子精确金属数控上。例如,使用高度发光的金属nc,可以使用专门设计的靶向连接剂将保护配体交换为蛋白质分子。我们开发了这样一种策略,以增强光学方法对蛋白质羰基的检测。谷胱甘肽(SG)保护金NCs (Au15SG13)很容易通过配体交换过程通过硫代氨基酰基功能化。制备的功能化氨基ooxy- au15nc与羰基化蛋白反应(见图。1 c).然后用单光子或双光子荧光检测目标羰基化蛋白9,这种功能化的nc可能是细胞成像应用的有用方法10.其他靶向连接剂可以通过叠氮化物-炔环加成反应偶联11.在糖生物学和碳水化合物-蛋白质相互作用分析中加入一个活性叠氮化物基团对开发功能性nc提出了挑战。
体外蛋白质与nc相互作用的开放性问题
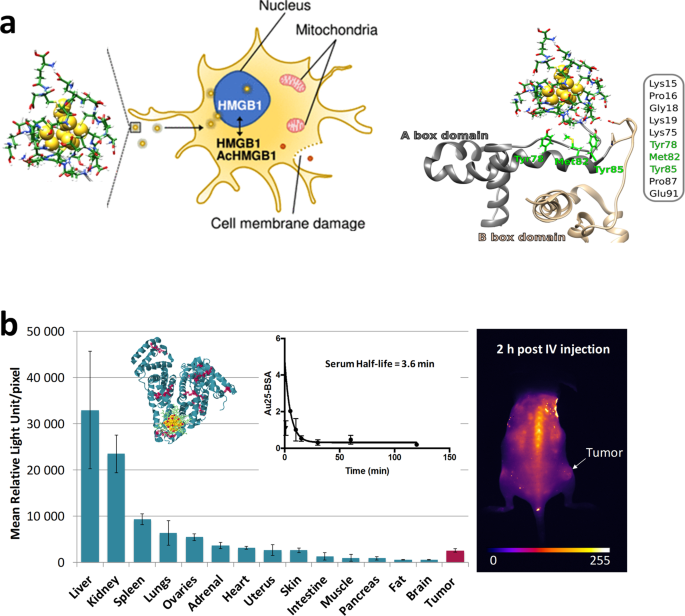
目前,关于金属纳米碳化物的细胞毒性性质存在着相互矛盾的结果。许多因素,如不同的实验设计,大小和使用的配体,不同类型的肿瘤细胞或未转化的原代培养可以解释这种不一致。因此,在考虑任何临床应用之前,必须评估nc的体外和体内毒性。尽管近年来神经网络在生物学上有许多应用,但关于它们在复杂生物环境,特别是细胞介质中的相互作用的知识仍然有限。例如,目前尚不清楚细胞蛋白与nc之间的表面相互作用如何影响生物活性。NCs的吸收机制也仍未得到系统的探索。考虑到不同类型的细胞具有不同的表面蛋白和膜性质,存在于不同的状态(如生理、病理、激活、刺激等),考虑到不同形状和大小的纳米团簇上配体排列的复杂性,系统研究摄取机制是一项巨大而艰巨的任务。虽然许多报道表明一些nc具有良好的生物相容性,但对影响其体外毒性的关键成分的深入研究值得进一步研究。需要对生存和细胞死亡机制进行全面检查,特别是在人类细胞中。我们最近证明配体保护金(Au) NCs在人原代星形胶质细胞中不是惰性的,但在AuNC处理后显示出细胞器重组,以及关键的细胞保护转录因子的激活。 Size and ligand effects are definitely playing a key role12.再一次,这种效应可能与aunc通过配体交换反应与蛋白质反应的能力有关。此外,与较大的aunc类似,nc产生的细胞内活性氧(ROS)是毒性机制的重要贡献者之一13,14.然而,以原子精度生产纳米团簇的优势允许明确地建立连接纳米团簇的结构与其在氧化应激下几个生物分子的变化的性质的链接,就像金的例子一样10SG10(见图。2).通过清除ROS和增加保护性配体的稳定性,可以至少部分地缓解一些不良影响。
一个金纳米团簇的影响说明10SG10关于人类小胶质细胞。用于确定Au的不同端点参数10SG10小胶质细胞的毒性。HMGB1的还原形式(redHMGB1:灰色带表示redHMGB1的A盒域,米色带表示B盒域)与Au表面的谷胱甘肽配体相互作用10SG10(表示)。b非盟25NCs附着于BSA(如图。1 b)在SWIR中具有令人印象深刻的发光特性(即发射1064-1700 nm),可用于体内成像,但停留时间极短(血清半衰期= 3.6分钟),生物分布和药代动力学研究显示癌症靶向潜力非常低。误差条表示测量的标准偏差。
在体内蛋白质与nc相互作用的开放性问题
关于NCs在临床应用中的实际应用,特别是癌症治疗,在循环中的停留时间和细胞摄取之间经常存在权衡15,16.再一次,大小和配体的影响会影响金属nc的生物分布、靶向潜能、肾脏消除、肿瘤摄取和生物降解性。例如,预成型硫酸化保护金25附着在牛血清白蛋白上的nc在短波红外成像中表现出令人印象深刻的发光特性(即>1000 nm),但停留时间极短,癌症靶向潜力极低,正如金纳米团簇通常观察到的那样(图2)。2 b)15,16.在为特定的生物医学应用及其可能的临床转化设计nc时,必须仔细考虑这些参数。它们在人体组织中的表现和命运仍有改善的空间,包括它们在血液中的循环和从体内的清除。特别地,我们证明了在蛋白质模板中通过配体交换策略连接aunc可以对其在NIR-II区域的线性和非线性光学发光特性有很强的增强作用8.后功能化策略可以实现更长的循环时间和更深的肿瘤内积累,配体保护的金属nc被发现是理想的模板。配体保护的NC的主要优势之一是有可能创建一个NC平台,其功能部分附加到每个表面配体上,极大地提高了对癌症材料的靶向敏感性。
关于蛋白质与nc相互作用的计算机方法的开放性问题
如前所述,具有原子精度的纳米团簇的生产允许在几种生物分子环境的变化中明确地建立连接纳米团簇结构与其特性的链接。大型系统的计算化学和混合计算的进展,例如量子力学(密度泛函)/分子力学QM/MM17对于包含1000个原子的系统的处理,也应该对理解蛋白质分子中nc最可能的结合位点产生影响14以及蛋白质残基在控制NC大小和结构中的作用(在硅方法中)8.这种混合方法可以解决蛋白质数控系统中的光物理过程(线性和非线性光学状态下的发光)。结合实验和理论的方法,包括计算模拟工具,可以提供一个整体描述的相互作用的性质存在于蛋白质数控界面。这将允许建立预测最佳蛋白质- nc相互作用的规则,以启动专注于应用的新实验。
今后应实现的目标是在实际应用中优化蛋白质-数控相互作用的效率。目前的研究成果是基于对连接的贵金属纳米团簇的一般表征,这些纳米团簇代表了一类具有独特结构和光学性质的超小纳米材料,但尚未扩展到原理证明之外。这意味着NCs的最佳尺寸和配体的选择必须设计成与蛋白质有效相互作用的环境,以提高所需的光学特性,如医疗诊断和医疗中许多应用所需的高亮度和光稳定性。配体在NIR体系中还发挥着重要作用,因为它们参与了配体NCs的非线性光学性质(NLO)的显著增强18.此外,可以通过配体交换实现功能化。一个例子是功能化氨基羟基金15SG13NCs(通过配体交换获得)与羰基化蛋白相互作用。通过计算化学研究了模型溶菌酶分子水平上的蛋白质羰基化,以确定NCs和蛋白质羰基之间的结合性质(见图。1 c).总之,这证明了功能化配体aunc可以用于羰基化位点的检测,并且可能比有机染料更有效。这种具有可控表面化学性质的新型功能性硫酸盐保护金属nc的合理设计,可以为许多其他实际应用开辟新的途径,特别是在生物成像和早期医学诊断方面。
前景
上述研究表明了进一步研究生物数控界面的性质和稳定性的可能性和必要性。用于结构表征的电子/ x射线技术的进步对于更好地理解复杂生物介质中的蛋白质- nc相互作用是绝对必要的,而且还可以探测原位和实时发生的结构和化学变化。质谱分析还应弥补表征日益复杂的连接金属纳米团簇(使用两性离子配体、蛋白质、多壳配体)的差距。19.原位光谱测量的进步将有助于更好地理解蛋白质- nc在生物环境和条件下的表现,并有助于改进其预期应用的设计,包括加强AuNC和蛋白质之间的联系,以获得更长的生物稳定性。
具有终生成像的超分辨率显微镜和先进的电子显微镜方法允许活细胞的3D重建,这将增加我们对不同细胞类型及其生理和病理状况的纳米团簇命运仍然有限的知识。显示纳米团簇在不同细胞器中停留时间的动力学参数目前还没有。这些将需要具有挑战性的实验方案,但它们可以提供非常必要的信息,从而更好地了解细胞器相关蛋白及其在与纳米团簇相互作用中的作用。人类细胞类器官是在更复杂的细胞环境中探索纳米簇的有价值的模型系统,补充了单层培养和共培养中的纳米簇。
在建立设计蛋白质和纳米团簇之间适当相互作用的规则方面的计算贡献有助于激发新的适当的实验。物理化学家和理论化学家、材料科学家和生物学家的共同努力有望推动蛋白质保护的nc在生物学应用中取得更大的成就。这些共同努力将有助于在未来进一步开发具有优化性能的新型纳米团簇。
参考文献
康晓霞,朱敏。原子精确纳米团簇的光致发光剪裁。化学。Soc。牧师。48, 2422-2457(2019)。
Tabarin, T.等人。小银簇对多肽的吸收增强和构象控制。理论物理。启。101, 213001(2008)。
郑凯,谢杰。生物纳米碳化物-超小金属纳米团簇与生物分子的结合。纳米级6, 13328-13347(2014)。
谢建军,郑勇,应建勇。蛋白质定向合成高荧光金纳米团簇。j。化学。Soc。131, 888-889(2009)。
扎雷,我,等人。蛋白质保护的金属纳米团簇作为生物医学应用的诊断和治疗平台。材料今天https://doi.org/10.1016/j.mattod.2020.10.027(2021)。
索利哈克,A., Bertorelle, F. & Antoine, R.用时间分辨荧光各向异性衰减测量测定蛋白质模板金纳米团簇的大小。分子生物分子光谱。193, 283-288(2018)。
roja - cervellera, V., Raich, L., Akola, J. & Rovira, C.抗谷胱甘肽包被金簇抗体的配体交换反应的分子机制。纳米级9, 3121-3127(2017)。
Bertorelle, F.等人。通过与蛋白质的选择性结合来定制单个硫代化Au25纳米团簇的NIR-II光致发光。研究方https://doi.org/10.21203/rs.3.rs-958149/v1(2022)。
库姆斯,g.f.等。功能化Au15纳米团簇用于蛋白质羰基化检测的发光探针。Commun化学.4, 69(2021)。
Bonačić-Koutecký, V. & Antoine, R.结扎银和金纳米团簇增强双光子吸收:理论和实验评估。纳米级11, 12436-12448(2019)。
Gunawardene, P. N., Corrigan, J. F. & Workentin, M. S.黄金机会:用于界面表面修饰的可点击叠氮化物功能化[Au25(SR)18]−纳米团簇平台。j。化学。Soc。141, 11781-11785(2019)。
Gran, E. R.等。金纳米团簇在人原代星形胶质细胞细胞器状态改变和转录因子易位中的大小和配体效应。纳米级13, 3173-3183(2021)。
董,L.等。bsa稳定金纳米团簇的细胞毒性:体内外研究。小11, 2571-2581(2015)。
梅辛格,D.等人。金纳米团簇Au10SG10对人类小胶质细胞的影响ACS化学。>。13, 464-476(2022)。
Colombé, C.等。金纳米团簇作为头颈部肿瘤成像引导手术的造影剂。纳米级。Nanotechnol。、生物。地中海。20., 102011(2019)。
沈,D.等。两性离子功能化金纳米团簇用于多模态近红外荧光和光声成像。APL板牙。5, 053404(2017)。
佩里克,M.等。配体壳尺寸对两性离子功能化金纳米团簇单光子激发和双光子激发荧光的影响。理论物理。化学。化学。理论物理。21, 23916-23921(2019)。
安东尼·波纳奇-库特基配位银和金量子团簇。一类新型非线性光学纳米材料的研究.斯普林格简报材料。(施普林格,Cham, 2018)。https://doi.org/10.1007/978-3-319-64743-2_1.
Comby-Zerbino, C., Dagany, X., Chirot, F., Dugourd, P. & Antoine, R.质谱表征纳米材料的出现。原子精确的纳米团簇及更多。板牙。睡觉。2, 4896-4913(2021)。
确认
这篇手稿的想法是在所有四位合著者参加克罗地亚斯普利特大学卓越科学技术中心-地中海区域、研究、创新、教育(STIM-REI)主任h. c. Vlasta教授Bonačić-Koutecký组织的“纳米尺度、水和环境技术的跨学科努力”研究讲习班(2019年10月9-11日)时提出的。(合同编号:KK.01.1.1.01.0003,由欧盟通过欧洲区域发展基金资助的项目——2014-2020年业务计划竞争力和凝聚力(KK.01.1.1.01))。“新型生物传感材料的设计及其在生物医学医学诊断中的应用”活动中的贡献扩展了现有的理论和实验网络(柏林-斯普利特-里昂),开辟了体外医学应用(蒙特利尔)和体内医学应用(格勒诺布尔)的跨学科途径。这些研究方向为纳米团簇与蛋白质的相互作用提供了一种新的方法。作为科学的连锁反应,这种方法在未来提出了新的问题。共同作者想要表达他们对合作者的感激之情:Franck Bertorelle, Martina periic bakuliic, Željka Sanader marovic和Evan Rizel Gran。
作者信息
作者及隶属关系
贡献
r.a., d.m., L.S.和v.b.k。对手稿有同样的贡献。
相应的作者
道德声明
相互竞争的利益
作者声明没有利益竞争。
额外的信息
出版商的注意施普林格自然对出版的地图和机构从属关系中的管辖权主张保持中立。
权利和权限
开放获取本文遵循知识共享署名4.0国际许可协议(Creative Commons Attribution 4.0 International License),允许以任何媒介或格式使用、分享、改编、分发和复制,只要您对原作者和来源给予适当的署名,提供知识共享许可协议的链接,并注明是否有更改。本文中的图像或其他第三方材料包含在文章的创作共用许可中,除非在材料的信用额度中另有说明。如果内容未包含在文章的创作共用许可协议中,并且您的预期使用不被法定法规所允许或超出了允许的使用范围,您将需要直接获得版权所有者的许可。要查看此许可证的副本,请访问http://creativecommons.org/licenses/by/4.0/.
关于本文
引用本文
安东尼,R,梅辛格,D,桑西,L。et al。关于蛋白质与纳米团簇相互作用的未决问题。Commun化学5, 47(2022)。https://doi.org/10.1038/s42004-022-00665-9
收到了:
接受:
发表:
DOI:https://doi.org/10.1038/s42004-022-00665-9