摘要
小檗碱是从植物中提取的一种广泛使用的药用苄基异喹啉生物碱。微生物制造已经成为一种有前途的方法来获取有价值的偏差。在这里,我们演示了小檗碱的完全生物合成酿酒酵母通过工程设计19个基因,其中12个来自植物和细菌的异源基因。过表达瓶颈酶、发酵放大和发酵后加热处理可使小檗碱滴度提高643倍至1.08 mg L-1。该途径在结合卤化酪氨酸合成具有较高治疗潜力的非天然BIA衍生物方面也表现出较高的效率。我们首次通过9种酶促反应在体内合成了11-氟四氢columbamine。我们的途径的效率和杂乱性也允许两个氟取代酪氨酸衍生物同时并入8,3 ' -二氟共克劳利。这项工作强调了酵母作为一种多功能微生物生物合成平台的潜力,可以加强当前的药物供应链并促进药物开发。
简介
小檗碱是一种具有多种药用活性的植物源苯基异喹啉生物碱。它对致病菌有广泛的抗菌和抗病毒作用结核分枝杆菌而且金黄色葡萄球菌1,以及流感和疱疹等病毒2,3.,4.最近,小檗碱被发现具有治疗肥胖的药物潜力5,调节肠道菌群,治疗动脉粥样硬化6或改善帕金森氏症7.全世界已经有超过80个临床试验来研究小檗碱在这些疾病中的药用价值,以及它的抗癌、保护心脏和抗炎潜力1,8.
小檗碱的生产主要依赖于从药用植物中提取和分离。各种药用植物,如金凤花(黄连碱黄花)、小檗(小檗属植物寻常的)和金丝(黄连属)可合成小檗碱作为一种重要的特化代谢物。这些药用植物已广泛用于阿育吠陀,中国和中东传统药物9治疗伤口感染、腹泻等疾病。然而,从植物中提取9完全依赖耗时的农业过程,易受环境变化的影响。同时,由于小檗碱结构的复杂性,化学合成小檗碱的工艺并不环保,具有挑战性。虽然有几种化学合成小檗碱的方法被报道10,11,12在美国,复杂的步骤和重金属的使用阻碍了未来的制造业。
微生物制造为应对植物或化学方法的挑战提供了一种新的策略。在易于处理的微生物宿主中发酵,例如酿酒酵母(面包酵母)更快速,成本效益高,高效,环保13,14,15.酵母已被证明是生产有价值和复杂的植物天然产物(PNPs)的强大平台,如青蒿素16,大麻类17,莨菪碱18和长春碱19.酵母作为模式真核微生物,为植物膜结合酶(如细胞色素P450s)的功能表达提供了内膜系统20..对酵母内源性代谢的深入研究和先进的遗传工具使酵母的异源通路得以重建和工程21.此外,酵母体内生物合成过程使得生产具有更高生物活性和生物利用度的定制PNP衍生物成为可能。酵母中修饰的小分子底物的酶转化允许合成非天然PNPs;在已建立的PNP生物合成途径中添加剪裁酶,如卤化酶,可以在PNP支架的基础上进行新的结构修饰15.这些策略已经导致合成了几种卤化药物BIAs22和单萜吲哚生物碱(MIAs)23,24,25.该策略特别适用于改善小檗碱和其他偏丁酸的药代动力学特性。尽管小檗碱具有广泛的治疗用途,但其膜渗透性使口服小檗碱的生物利用度低于5%26.卤化是药物发现和开发中提高PNP生物利用度和生物活性的重要策略27.特别是,氟化在药物化学中具有独特的重要性,因为氟取代可以显著提高先导化合物的结合效果和选择性28.可以预见,在酵母中制造BIAs的卤化衍生物将对药物的开发和发现做出重大贡献。几种具有经典苄基异喹啉结构的卤化BIAs已经通过体内或体外方法合成。据报道,体外酶的方法,以产生各种各样的衍生物去甲壳子醛和甲壳子醛29,30.,31.这两种化学物质下游卤化BIAs的体外合成尚未实现,可能是由于难以表达必需的膜结合细胞色素P450酶。使用已建立的BIA生物合成途径的体内方法允许合成更复杂的BIAs,如网状结构22然而,生物合成更复杂的结构,如卤化原小檗碱仍然具有挑战性。
小檗碱的生物合成途径已在酵母中被部分阐明和重建,小檗碱滴度为39µg L−1从底物norlauaudanosoline32.然而,有限的滴度和底物norlauaudanosoline的使用阻碍了进一步的工业应用。随着植物基因组学、生物信息学和合成生物学的发展,新的生物合成途径被揭示出来33与小檗碱具有相似合成途径的药物,如网碱、诺scapine和血碱,已通过其原生生产者被鉴定出来34,35,36在酵母中重建22,33,37,38,39.这些开创性的研究证明了重新设计一种高效的小檗碱生产菌株的可行性。
在本研究中,我们重建了黄连素在酵母中的完整生物合成途径。初始菌株经15种酶改造,其中12种来自植物和细菌的异源酶,产酶量为1.68µg L−1葡萄糖中的小檗碱。限制性酶工程使小檗碱滴度提高了20倍,达到35.1 μ g L−1.在0.75 L的生物反应器中分批发酵,然后加热处理以帮助转化,最终将小檗碱滴度提高到1.08 mg L−1这是最初产量的643倍。在优化的黄连素生产菌株中,通过饲喂卤化酪氨酸,包括3-氟酪氨酸、3-氯酪氨酸和3-碘酪氨酸,我们还证明了几种新的卤化BIAs的产生。该工程酵母表现出与氟取代酪氨酸衍生物的高度相容性,这导致了氟取代四氢columbamine的产生,这是第一次在体内合成卤化原小檗碱。此外,所设计的BIA生物合成途径允许两种氟取代酪氨酸衍生物缩合和修饰成二氟BIA产品。本研究开发的生产黄连素的酵母菌株和发酵策略将为未来的药物发现和开发提供一个经济、可控和稳健的黄连素供应链,以及一个高效的酵母平台来合成卤化BIAs。
结果
酵母中小檗碱生物合成途径的构建
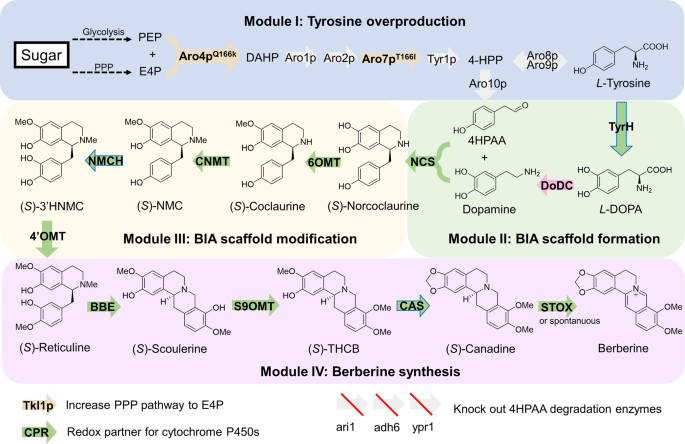
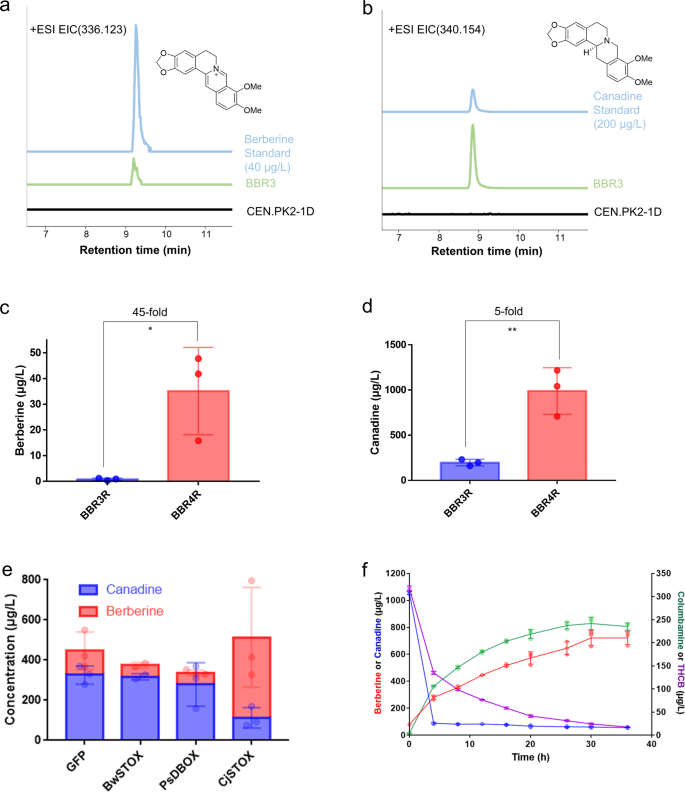
我们构建了新创酵母中小檗碱生物合成途径的四个模块(图;1)共12种异源酶。模块一过度生产l-酪氨酸是通过优化酵母内源性芳香酸生物合成途径得到的,该途径在前期工作中已经构建40.酵母内源性转酮酶1 (TKL1),磷酸-2-脱氢-3-脱氧庚酸醛缩酶变体(ARO4Q166K),以及chorismite mutase variant (ARO7T226I)在该菌株中与一种抗生素湿霉素耐药标记(HygR) ySL14过表达40.模块II导致BIA支架去甲磺酸的形成,它包含四种酶,包括酪氨酸羟化酶(TyrH)、细胞色素P450还原酶(CPR)、二羟基苯丙氨酸脱羧酶(DoDC)和去甲磺酸合酶(NCS)。都是哺乳动物22,37,41,42和植物38,43TyrH在以前的研究中有报道。我们选择了植物源性TyrH,即CYP76AD5甜菜属(甜菜),因为它在之前的研究中报道的高活性43,44.与TyrH一起,细胞色素P450还原酶(CPR)从拟南芥,即ATR1, NCS从黄连粳稻n端35个氨基酸被截断43, DoDC from假单胞菌putida,以及一个His5营养不良标记,被整合到YGL157W (ari1)位点,产生菌株BBR1。的ari1基因编码醛还原酶,导致4-羟基苯乙酸(4HPAA)的降解。43,一种去甲酚的前体,因此在整合过程中被删除。新创高分辨率液相色谱-质谱联用(LC-MS)证实了菌株BBR1中去甲磺酸的产生。S1a),在30℃的YPD培养基中培养3天,LC-MS分析培养基上清液。模块III包含四种酶,可将去甲磺酸转化为网碱,网碱是BIA途径中的一种关键中间体。Norcoclaurine 6 -O-甲基转移酶(6OMT)N-甲基转移酶(CNMT), 3 ' -羟基-N-methylcoclaurine 4 ' -O-甲基转移酶(4'OMT)果实(罂粟),N-甲基coclaurine 3 ' -羟化酶(NMCH)Eschscholzia californica(加利福尼亚罂粟)和一个Leu2营养不良标记,被整合到YMR318C (adh6,编码一种能降解4HPAA的醇脱氢酶43) BBR1位点,得到菌株BBR2,网面生产验证(补充图;印地).模块IV包含四种酶,导致小檗碱的生产。小檗碱桥酶(BBE),小檗碱9-O-甲基转移酶(S9OMT)p .果实,加拿大合成酶(CAS)c .粳稻,四氢原小檗碱氧化酶(STOX)小檗属植物wilsoniae, Ura3标记被集成到YDR368W (ypr1,醛酮还原酶降解4HPAA43) BBR2的地点。合成的产生小檗碱的菌株BBR3含有19个修饰或工程基因,其中15个基因过表达,4个内源基因缺失。该菌株产量为217.61µg L−11.68 μ g L−1小檗碱(无花果。2 a, b),在30°C的YPD培养基中培养3天后。
方柱箭头表示酶催化反应。绿色箭头,植物酶;粉色箭头代表细菌酶;黄色箭头表示过表达和修饰的酵母酶;灰色箭头是未经修饰的酵母菌酶。蓝色箭头表示细胞色素P450酶。红色斜线箭头表示酶被敲除。酶缩写:Aro10p, phenylpyruvate decarboxylase;Aro1p,五功能芳香族酶;Aro2p,双功能chorismate合成酶和黄素还原酶; Aro4pQ166K,突变的磷酸-2-脱氢-3-脱氧庚酸醛缩酶,酪氨酸抑制缓解;Aro7pT226I,突变的chorismate突变酶,酪氨酸抑制缓解;Aro8p,芳香转氨酶I;Aro9p,芳香转氨酶II;BBE,小檗碱桥酶;CAS,加拿大碱合成酶;CNMT, coclaurineN甲基转移酶;CPR,细胞色素P450还原酶;DODC,l多巴脱羧酶;去甲磺酸合酶(NMCH)N-甲基coclaine羟化酶,STOX四氢原小檗碱氧化酶,S9OMT scoulerine 9-O-甲基转移酶,Tkl1p转酮酶,Tyr1p预苯酸脱氢酶,TyrH酪氨酸羟化酶,4'OMT, 3 ' -羟基-N-methylcoclaurine 4 ' -O甲基转移酶;和6OMT去甲磺酸6-O甲基转移酶。复合缩写:DAHP 3-脱氧-D-阿拉伯-2-七氢声酸7-磷酸l二羟基苯丙氨酸l3 4-dihydroxyphenylalanine NMCN-甲基coclaurine, PEP磷酸烯醇丙酮酸,THCB四氢columbamine, 4HPAA 4-羟基苯乙醛;4-HPP 4-hydroxyphenylpyruvate。磷酸戊糖途径。
路径通量优化
由于BBR3中含有His5、Leu2、Ura3三个营养不良标记和一个抗生素标记HygR,我们将这些标记抢救出来,用Cre-LoxP系统进行进一步工程45.获救菌株BBR3R的小檗碱产量与BBR3相同(1.39µg L−1),表明在YPD培养基中标记物不影响BIA的合成。NCS、4'OMT和CAS被报道为瓶颈步骤39,43.我们分别加入了这三种酶的一个额外副本,以及Leu2,以优化途径通量;新的拷贝被整合到YDR541C位点,这是基于之前研究的另一个4hpaa降解基因43,导致BBR4。随后,BBR4中的Leu2标记被拯救出来,导致了一种名为BBR4R的新菌株。优化菌株BBR4R产量为35.10µg L−1黄连素,比原菌株BBR3R高20倍(图;2摄氏度).BBR4R的加拿大产量也增加了5倍,达到989.10µg L−1(无花果。二维).
高浓度的加拿大碱积累和相对较低的小檗碱产量表明,STOX催化的加拿大碱到小檗碱的转化是小檗碱途径中的另一个主要瓶颈。我们首先尝试过表达STOX酶b . wilsoniae(BwSTOX)46使用高复制质粒,包括pAG424和pAG42547,在BBR4R中提高转换。然而,从携带stox表达质粒的菌株中没有检测到小檗碱的积累。由于菌株必须在合成的dropout (SD)培养基中培养以维持质粒,因此缺乏小檗碱的产生可能与SD培养基比YPD培养基的pH值低或营养物质少有关。因此,我们将酵母高拷贝质粒pAG425上原有的营养不良的Leu2标记换成了抗生素潮霉素B抗性标记HygR,从而得到了一个名为pAG42H的新质粒,该质粒允许在含有潮霉素B的YPD培养基中选择性生长。BwSTOX在pAG42H载体上过表达,但并没有改善转化,这表明BwSTOX在酵母中没有活性,这与之前的研究假设是一致的32.
为了弄清楚BwSTOX的不活性是否来自于它与酵母表达系统的不相容性,我们验证了该酶在模型植物中的活性烟草benthamiana通过瞬态表达式48.根癌土壤杆菌GV3101含有BwSTOXn benthamiana叶子。同时,我们也渗透了其他STOX变体c .粳稻(CjSTOX)49而且p .果实(PsDBOX)50筛选更多STOX候选人。基因表达4天后,以加拿大碱为底物进行浸润。24小时后从叶片中提取代谢物,LC-MS分析。只有CjSTOX在测试中表现出活性,具有较高的小檗碱和较低的加拿大碱浓度(图。2 e)与没有STOX的对照组相比。然而,在酵母中过表达CjSTOX仍然没有增加小檗碱的产量。尽管进行了大量的排除困难的工作,包括将CjSTOX与mCherry蛋白融合以确认表达(补充图。S2a),通过信号肽工程将CjSTOX重新定位在ER或液泡上(补充图。开通而且S2c(方法见补充法),再添加高浓度的加拿大碱,我们没有观察到CjSTOX在酵母中将加拿大碱转化为小檗碱的活性。
化学氧化以增加小檗碱的产量
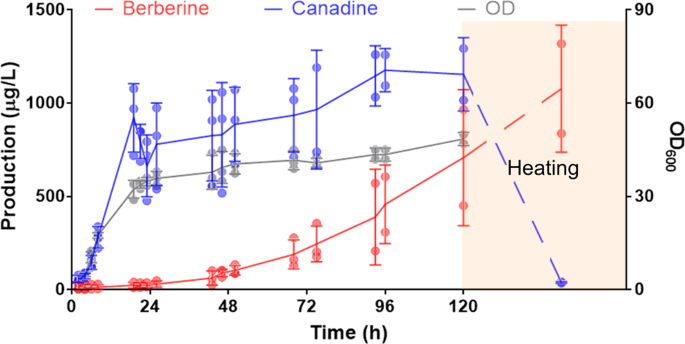
由于酵母系统中缺乏活性STOX,我们假设黄连素是通过自发化学反应产生的,这在之前的研究中也讨论过,以去桃红索林作为饲养底物32.因此,我们继续优化在温和条件下获得更高小檗碱滴度的转化。通过初步试验,发现温度是化学反应的一个重要参数。1 mg L−1在55°C或98°C下加热4小时。在这两种条件下都观察到加拿大碱的消耗和小檗碱的产生,98°C处理的转化率为40.3%,高于55°C下的1.90%(补充图。S3a).然后将菌株BBR4R培养上清液在98℃加热36 h,分别于4、8、12、16、20、26、30、36 h采集样品进行LC-MS分析。含1.06 mg L−149.5µg L−1治疗前上清中黄连素。小檗碱浓度在处理过程中逐渐升高,而加拿大碱浓度下降至88.9µg L−1在最初的四个小时内被持续消耗。加热后,721µg L−1得到了小檗碱,几乎所有的加拿大碱都被消耗掉了(图。2 f).类似于去除4个H原子将加拿大碱氧化转化为小檗碱的过程,我们发现四氢columbamine (THCB, m/z 342.170)转化为假定的columbamine (m/z 338.139)(图2)。2 f).可能的机理和分子结构见补充图。S3b.
生物反应器发酵放大
为了进一步评估黄连素生产菌株的可扩展性和工业潜力,在2.5 l Eppendorf BioFlo 310生物反应器中进行了三批0.75 l规模的发酵。BBR4R在30°C的YPD中培养5 d。708.3µg L−1小檗碱1.15 mg L−1最终OD600为48.5(图2)。3.).与小规模栽培相比,生物反应器中的小檗碱滴度从35.1 μ g L提高到708.3 μ g L,提高了20倍−1.我们推测,改善生物反应器的供气和搅拌增加了氧的转移,有助于加拿大碱的自发化学氧化生成小檗碱。上清液在98°C加热36 h,最终达到1.08 mg L−1当所有的加拿大碱被消耗时,小檗碱的产生(图。3.).与先前报道的小檗碱产量(39µg L−1)来自酵母中的去桃红索林32,我们的工作使滴度提高了26.7倍,达到1.08 mg L−1从酵母中的葡萄糖中提取小檗碱。
卤化BIA衍生物的生产
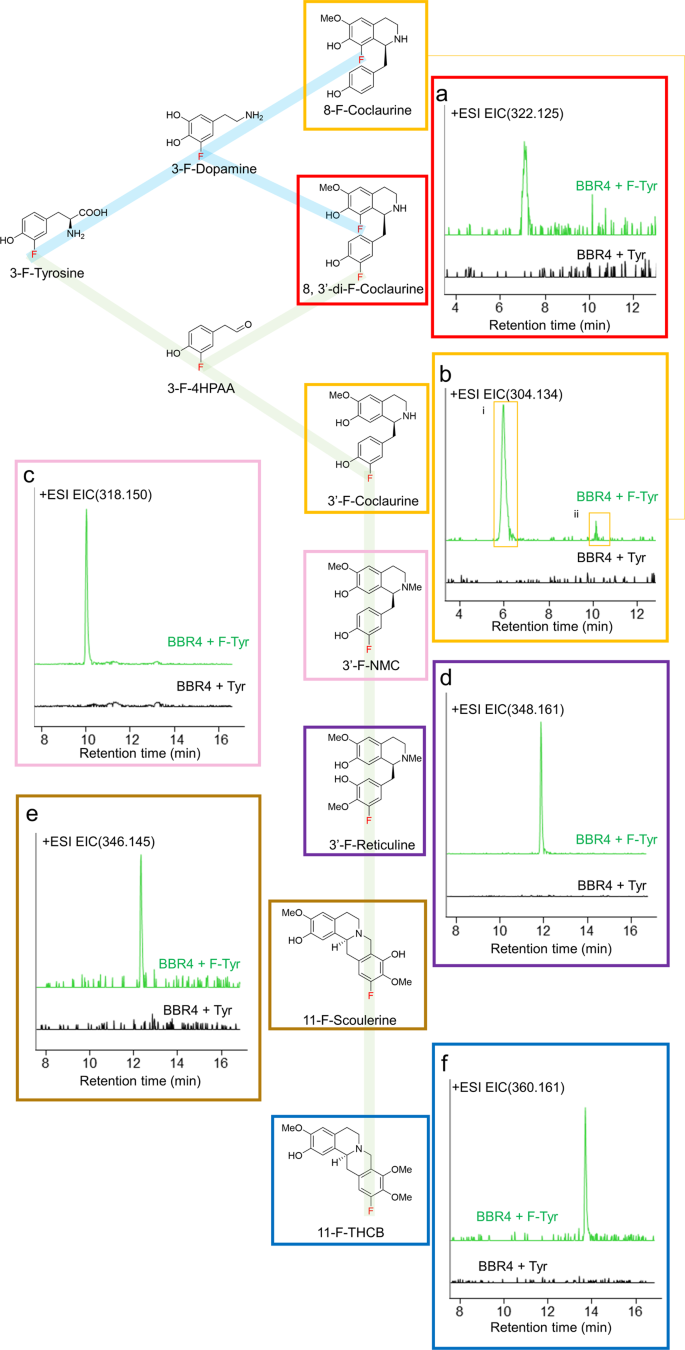
化学修饰,如卤化,可以改变天然产物的生物利用度,提高药物活性27.基于我们的酵母小檗碱生产平台,我们进一步探索了其生产具有更高药用潜力的卤化BIA衍生物的可行性。菌株BBR4R在3 mL添加100 mg L的SD-Tyr培养基中培养−1以3- f -酪氨酸为底物。在30°C的试管中培养3天后,用LC-MS分析培养基。在50ppm浓度下,保留时间分别为6.45 min和10.23 min时,m/z = 304.134,观察到两种具有单一f -取代的coclaurine衍生物,后来被推导为8-F-coclaurine和3 ' -F-coclaurine(图2)。4 b).串联质谱(MS/MS)测定了两个峰呈现不同的破碎谱。对比两种破碎谱和原coclaine的光谱,反映了f - coclaine的两种不同结构(i) f -取代分别在异喹啉环上,或f - coclaine (ii) f -取代分别在苄基环上。S5).结果表明,3- f -酪氨酸分别通过两种前体被纳入BIA骨架,一种是通过3- f -多巴胺到异喹啉环,形成8-F-coclaurine,另一种是通过3- f - 4hpaa到苄基环,形成3 ' -F-coclaurine(图2)。4和补充图。S4).只有3 ' - f - cocline被纳入下游途径,形成3 ' - f - n -甲基cocline (3 ' -F-NMC, m/z 318.150)和3 ' -F-reticuline (m/z 348.161),分别通过50ppm提取离子色谱(EIC)和MS/MS鉴定(图。4 c, d和补充图。S6,S7).这表明,仅次于coclaurine的CNMT酶可能更倾向于由3-F-4HPAA途径产生的F-BIAs。n -甲基coclaurine (NMC)和网状物的3 ' -卤化位点与先前报道的8-位点不同22.本研究构建的BBR4R菌株倾向于3-F-4HPAA途径而不是3- f -多巴胺途径,这可能是由于4个4HPAA降解基因的缺失和酶对底物的偏好b .寻常的TyrH酶。我们发现F-scoulerine (m/z 346.145, 50ppm)和F-THCB (m/z 360.161, 50ppm)的峰值为m/z,推测为11-F-scoulerine和11-F-THCB(图2)。4 e, f和补充图。S8,S9),而之前的研究只观察到卤化网状结构22尽管下游酶BBE在体外有底物混杂的报道51,52.这一发现首次证明了卤化BIAs在体内可被纳入网碱下游的原黄连素通路,且BBE的混杂性能够接受3’- f -网碱合成下游BIAs。所有F-BIAs的保留时间都比其相应的原始BIAs长约1分钟,表明疏水性增加,这支持了这些F-BIAs的鉴定,因为氟碳化合物比碳氢化合物更疏水53,54.F-BIAs的疏水性有助于改善药物在人体内的转运,如增强血脑屏障的通透性55.
令人惊讶的是,我们还观察到一个与8,3 ' -di-F-coclaurine (322.125, 50 ppm)的m/z相匹配的峰值(图2)。4),并通过MS/MS对其结构进行了鉴定,结果表明异喹啉环和苄基环中均有氟(补充图)。S5).结果表明,聚合多巴胺和4HPAA两种前体的酶NCS具有同时聚合3- f -多巴胺和3-F-4HPAA的混乱性,尽管di-F-coclaurine的峰面积仅为单取代BIAs的2%。
我们还测试了3- cl -tyrosine和3- i -tyrosine在该途径中的掺入,并获得了3 ' -Cl-NMC, 3 ' -Cl-reticuline和3 ' -I-NMC(补充图)。S10).Cl和I在途径中的结合效率较低可能是由于空间位阻较大。
最后,我们证实了在0.75 L生物反应器发酵中生产F-BIA的可扩展性。对三种途径最终产物的定量分析表明,在生物反应器中分批发酵显著提高了F-BIA的合成。根据相对EIC峰面积估计,8,3 ' -di-F-coclaurine和8- f -coclaurine(经过四次酶促转化)分别增加了1.6倍和1.9倍。11-F-THCB(经过9次酶促转化)增加了17倍,表明生物反应器发酵最优化这一途径(补充表)S2).这些卤化的BIAs在不同的位点产生不同的卤素基团,突出了酵母中的重建途径作为通过底物饲喂方法制造新型BIA衍生物的平台的能力,为药物发现和开发提供了另一种方法。
讨论
在本研究中,我们证明了小檗碱在酵母中的完全生物合成。该工程酵母菌株含有12种来自植物或细菌的外源酶,同时过表达3种酵母内源酶以增加酪氨酸的供应,并删除4种酵母内源酶以降低对上游前体4HPAA的竞争。经19个基因工程和加热化学转化,小檗碱产量达到1.08 mg L−1在生物反应器发酵方面,突出了酵母发酵作为植物天然产物工业供应链的可行性,并在酶工程、菌株工程和生物工艺优化等方面进行了进一步的改进。值得注意的是,几种新的卤化BIA化合物,包括3 ' -F-scoulerine, 11-F-THCB和8,3 ' -di-F-coclaurine,是由发酵过程中添加的3- f -tyrosine在酵母中产生的,这突出了酵母发酵为药物开发提供量身定制的BIA衍生物的价值。
氧化芳构化是合成小檗碱、血碱和罂粟碱的最后一步,这些都具有药用潜力。体外生化验证已经证明,所有这些反应都是由植物中fad依赖的氧化还原酶家族催化的,包括小檗碱合成中的STOX46血红素中的二氢苯并苯胺氧化酶(DBOX)50还有罂粟碱合成。然而,相应的氧化还原酶的体内活性在异种宿主如酵母中仍然难以验证32,56.特别是CjSTOX的体内活性c .粳稻在酵母中没有观察到小檗碱的合成,大肠杆菌或在加利福尼亚罂粟中(观察到将冰兰花甲啉转化为脱氢冰兰花甲啉和stylopine转化为黄连的副反应)49.在我们的工作中,我们证实了CjSTOX在模型植物中通过瞬时表达将加拿大碱转化为小檗碱的活性n benthamiana.尽管进行了各种工程研究,CjSTOX在酵母系统中仍表现出微弱或无活性。与酵母ER膜、液泡膜或液泡内结合的工程CjSTOX变体不能提高小檗碱的产量,尽管有报道称STOX定位于植物细胞的ER和液泡57,58.辅因子的缺乏曾是阻碍外源植物酶在酵母中功能表达的常见瓶颈,但我们假设FAD在工程酵母中供应充足,因为另一种FAD依赖的氧化还原酶BBE在酵母中仍然活跃。未来对其他可能性的研究可能会解决这一挑战。例如,辅助蛋白的参与或细胞间运输59,60,61植物中BIAs的表达可能对小檗碱的合成至关重要。
化学氧化为解决酵母中STOX的不活性提供了另一种解决方案。由于发酵过程中小檗碱的产生可能是由于自发转化,我们假设并证明了在生物反应器中加热和较高的氧转移可以使35.1 μg L的转化率提高29.8倍−1至1.08 mg L−1.最近发表的一篇罂粟碱生物合成的文章报道了酵母中fad依赖的氧化还原酶DBOX失活的类似瓶颈,并使用类似的策略将四氢罂粟碱通过过氧化物和加热条件转化为罂粟碱56.半生物合成已被证明是生产有价值和具有挑战性的植物天然产物(如青蒿素和长春碱)的可行方法16,19.我们使用加热的化学转化和报道的过氧化氢和加热结合的转化都证明了温和的化学转化可以弥补功能性酶的不足,是一种多功能和方便的方法,适用于未来的工业应用。
对天然产物进行结构修饰(包括卤化)是提高其生物利用度和生物活性的常用方法27,62.由于其广泛的药用特性,近年来已成为一组具有吸引力的靶点。增强卤化BIAs的生物活性,如氯小檗碱对葡萄糖摄取63还有神经递质受体上的氟阿啡64,65,显示了卤化BIAs在药物设计中的巨大潜力。在之前在酵母中合成诺scapine的研究中,3-F/ cl -酪氨酸经7次体内酶转化得到8-F-reticuline和8-Cl-reticuline22.当我们准备提交这篇手稿时,另一个小组报告了一种体外酶法,通过使用不同的底物,在4到5个级联反应中合成了一系列不同的卤化去甲磺酸和去甲磺酸衍生物31.利用一系列不同的植物酶和途径优化策略,使我们能够将3- f -酪氨酸在体内的结合扩展到卤化11-F-THCB(总共9种酶转化)。这一成果显示了在体内结合卤化中间体在较长的途径的能力。进一步关注CAS底物结合位点的酶工程研究将有助于解决最后一个缺失的酶转化,以产生下游的f -加拿大碱和f -小檗碱。
本研究中产生的大多数卤化BIAs经LC-MS/MS鉴定为3 ' -F-BIAs,表明在先前产生诺scapine的菌株中,f -酪氨酸是通过4HPAA途径而不是多巴胺途径结合的22.对4HPAA途径的偏爱可能是由于缺失了4个与4HPAA降解相关的酵母内源基因,并且使用植物来源的TyrH而不是哺乳动物的TyrH。这一差异表明,有可能通过调节4HPAA和多巴胺途径之间的代谢通量平衡来控制卤化位点。4HPAA路径的通量越大,3 ' -F-BIA的比例越高,反之则以8-F-BIA为主。此外,这种平衡可能会影响di-F-BIAs的产生,这需要f -酪氨酸同时通过两种途径结合。在我们的研究中,我们观察到上游化合物coclaurine的3 ' -F和8-F卤化,以及8,3 ' -di-F-coclaurine,这是酵母中合成的第一个二氟BIA化合物。未观察到进一步的8-F和di-F BIAs,这可能是由于缺乏通过多巴胺途径的F-BIA通量。优化后的菌株具有平衡的多巴胺和4HPAA通路上游通量,可以产生更多的di-F-BIAs,这对新药的发现和开发具有重要的贡献。
方法
化学物质、基因、试剂盒和寡核苷酸
酵母氮碱(YNB)和氨基酸混合物购自Sunrise Science Products。硫酸铵、二硫苏糖醇(DTT)、3- f -酪氨酸、3- cl -酪氨酸、3- i -酪氨酸、小檗碱标准品和加拿大碱标准品购自Sigma-Aldrich。所有其他化学品均购自VWR国际公司或Fisher Scientific公司。
异源基因编码序列(见补充资料)2)进行了密码子优化酿酒酵母TWIST生物科学公司合成表达。寡核苷酸引物(列于补充数据3.)由生命科技公司合成。
Q5高保真2X Master Mix, Gibson Assembly Master Mix, DNA梯子和凝胶加载染料从New England Biolabs购买。Gateway LR Clonase II酶混合物从Life Technologies购买。质粒微型准备试剂盒,凝胶DNA恢复试剂盒,大肠杆菌酵母基因转化、酵母基因组提取和冷冻- ez酵母转化均购自Zymo Research。
质粒构建
本研究使用的质粒列在补充表中S1.用Gibson组装法将异源基因组装在固定质粒上66使用吉布森组装主混合。用Q5 DNA聚合酶PCR扩增合成的基因。通过PCR扩增了pE系列的启动子和终止子。PCR产物经琼脂糖凝胶电泳验证,并按照制造商说明使用凝胶DNA恢复试剂盒进行纯化。酵母表达质粒(pAG系列47)和植物瞬时表达(pCambia2300系列)用Gateway LR Clonase II酶混合构建。
大肠杆菌实验结果表明,有活性细胞是用免疫球蛋白制备的大肠杆菌转换套件遵循制造商的说明。大肠杆菌含质粒的菌株在37℃、50 μg mL的LB培养基中培养−1卡那霉素或100 μg mL−1适当的卡本西林。根据制造商的说明,使用质粒miniprep试剂盒提取质粒,然后通过NanoDrop One (ThermoFisher Scientific)和Sanger测序(Cornell Institute of Biotechnology or GENEWIZ)测量浓度。
酵母菌株构建
酵母基因组整合是通过先前报道的电穿孔进行的40.从相邻片段重叠30-40 bp的质粒或酵母基因组中,通过PCR扩增途径基因、选择标记和500 bp基因组同源性。扩增的DNA片段经琼脂糖凝胶电泳验证,从琼脂糖凝胶切片中纯化,然后以等摩尔比电穿孔法在540 V、25 μF、无限电阻条件下用Gene Pulser Xcell Total System electroporator (Bio-Rad)转化酵母。然后立即在30°C的1ml YPD中恢复细胞2小时,并在选择板上进行2 - 4天的生长。必要时,通过在质粒上表达Cre重组酶来挽救整合选择标记45,在SD板上选择复制打印,YPD培养48小时,挽救Cre质粒。
对于质粒表达,使用冷冻的ez酵母转化II试剂盒制备化学活性的酵母细胞。按照制造商的说明,每次转化使用200 ng质粒。此外,如果选择标记为HygR,则在30°C下用1 mL YPD生长2小时。将转化后的细胞铺在选择板上生长2-4天。
培养和试管发酵条件
为了生产小檗碱,酵母菌落首先在14 mL猎鹰试管中培养,加入1ml YPD(1%酵母提取物,2%蛋白胨,2%葡萄糖),在30°C下过夜。150 μL培养物加入3 mL新鲜YPD中,培养3 d,分3个重复。必要时,200mg L−1在YPD中添加潮霉素进行筛选。以SD-tyr(0.17%酵母氮基、0.5%硫酸铵和1× -tyr氨基酸滴出混合物)代替培养基,添加2%葡萄糖和100 mg L−1卤代酪氨酸。发酵结束后,各取300 μL, 15,000 rpm离心10 min,上清200 μL转入Agilent 96孔板进行LC-MS分析。
为了通过化学氧化进一步提高小檗碱的产量,培养上清液转移到PCR管中,每管100 μL,并在98°C的温度下在热循环器中加热。
STOX的植物筛选
通过Gateway LR反应在pCambia2300质粒上组装STOX候选序列。然后将确认的构造转换为农GV3101采用冻融法48并在30°C的LB琼脂上涂上适当的抗生素2天。单菌落在4 mL LB、100 μg mL中培养−1卡benicillin, 25 μg mL−1利福霉素30 μg mL−1庆大霉素24小时,然后用100ml稀释24小时。将细胞以4000转/分钟离心成粒15 min,再悬浮于100 mL诱导缓冲液(10 mM MES, pH 5.6, 10 mM MgCl2, 150 μM乙酰丁香酮)中,30°C孵育3 h。将诱导细胞再次制成颗粒,并在诱导缓冲液中稀释至OD600为0.6。然后将悬浮液渗透到背侧n benthamiana使用1毫升无针注射器,每片叶子大约0.5-1毫升。不同植物的三片叶子作为每个结构的重复。4天后进行基因表达,1 mg L−1将溶于水的加拿大大麻作为底物渗透到叶片背面,每叶约0.5-1 mL。1天后切除叶片,放入- 80冰箱进行下游处理。
冷冻叶片被冻干,并称重干质量。采用80% (v/v)甲醇溶液+ 0.1% (v/v)甲酸提取代谢物,提取量为10 μL / mg干重。然后用基准BeadBug 6均质器均质3mm珠。提取的样品经Pall AcroPrep 96孔过滤器过滤至Agilent 96孔板进行LC-MS分析。
生物反应器发酵条件
为了生产小檗碱,在平板上的新鲜单菌落首先在含2ml YPD的试管中培养,在30°C下过夜,作为第一种种子培养。然后用每个培养物1.25 mL接种2*25 mL新鲜YPD于2*250 mL摇瓶中,30℃培养过夜,作为第二次种子培养。随后,将第二个种子培养物接种到0.75 L YPD的2.5 L Eppendorf BioFlo 310容器中。发酵在30°C, 600 rpm下进行。pH值自动调整为7.0,使用1 M NaOH溶液。在每个采样时间点,收集1 mL培养物,Nanodrop测量OD600,然后离心进行LC-MS分析。
代谢物LC-MS和LC-MS/MS分析
代谢物通过高分辨率液相色谱-四极杆飞行时间质谱(Agilent 1260 Infinity II/Agilent G6545B)在正电离质谱模式下进行分析。各取1 μL,在ZORBAX RRHD Eclipse Plus C18色谱柱(2.1 × 50 mm, 1.8 μm) (Agilent)中,以0.1%甲酸水(A)和0.1%甲酸乙腈(B)为流动相进行注射分离。二元泵的梯度程序设置为0-1 min, 95% A;1-11分钟,95-5% A;11-13 min, 5% A;13-14 min, 5-95% A;14-16 min, 95% A,流速0.4 mL min−1.对于卤化化合物的检测,采用较长的梯度程序:0-4 min, 95% a;4-44 min, 95-5% A;44-52 min, 5% A;52-56 min, 5-95% A;56 ~ 60 min, 95% A,流速0.4 mL min−1.[m + H]的m/z值+用ChemDraw软件计算加合物,然后提取离子色谱图(质量误差低于50ppm)进行化合物鉴定和定量。为了鉴定卤化BIAs,采用串联质谱(MS/MS)模式,采用3种不同碰撞能量水平(10、20和40 eV),并将注入量调整为5 μL。
统计数据
对无花果进行了三个独立的生物学重复试验。2氟和补充图。S3a.双尾t-test用于计算p图中的-value2 c, d.误差条表示标准偏差。Fig.的实验。3.,误差柱表示72 h前三个独立发酵点的标准差,或72 h后两个独立发酵点的范围。EIC迹线和质谱如图所示。2A b和4、补充图。S1,S4,S5代表3至5个独立的重复。
软件
数据是通过Prism9 (Graphpad)和PowerPoint 2019(微软)生成的。使用MassHunter工作站(Agilent)收集并分析LC-MS和LC-MS/MS数据。化学结构通过ChemDraw 20.1 (PerkinElmer)生成。
报告总结
有关研究设计的进一步资料,请参阅自然组合报告摘要链接到这篇文章。
参考文献
伊门沙希迪,M.;小檗属植物寻常的和小檗碱:更新审查。Phytother。Res。30., 1745-1764(2016)。
Enkhtaivan, G., Muthuraman, P., Kim, D. H. & Mistry, B.通过阻断神经氨酸酶发现小檗碱衍生物作为抗流感剂。Bioorg。地中海,化学。25, 5185-5193(2017)。
吴,Y.等。黄连素对流感病毒的体内体外抗病毒作用。下巴。j .中国。地中海。17, 444-452(2011)。
张婷,杨,等。小檗碱和其他五种原小檗碱的不同结构影响p -糖蛋白介导的外排能力。Acta制药。罪。40, 133-142(2018)。
王,M.等。共晶体小檗碱-布洛芬通过抑制蛋白激酶TBK1和IKKɛ改善肥胖。Commun。医学杂志。5, 1-18(2022)。
Ma, S. R.等。小檗碱通过降低肠道菌群中胆碱- tma - tmao产生途径的维生素样作用来治疗动脉粥样硬化。钙信号。其他目标。7, 1-13(2022)。
王毅,等。口服小檗碱改善脑多巴胺水平,通过调节肠道菌群改善帕金森病。钙信号。其他目标。6, 1-20(2021)。
王,L.等。小檗碱通过激活凋亡诱导因子诱导结肠肿瘤细胞caspase非依赖性细胞死亡。Nat前https://doi.org/10.1038/npre.2011.6438.1(2011)。
Neag, m.a.等人。小檗碱:植物学上的发生,传统用途,提取方法,在心血管,代谢,肝脏和肾脏疾病中的相关性。前面。杂志。9, 557(2018)。
Tajiri, M., Yamada, R., Hotsumi, M., Makabe, K. & Konno, H.小檗碱和选定类似物的全合成,以及它们作为淀粉样蛋白聚集抑制剂的评估。欧元。医学化学。https://doi.org/10.1016/J.EJMECH.2021.113289(2021)。
杨,Z.等。b -巴马汀和小檗碱衍生物作为p300组蛋白乙酰转移酶抑制剂的全合成与评价。欧元。j . Org。化学。2018, 1041-1052(2018)。
加特兰,A. E., Pilgrim, B. S., Procopiou, P. A. & Donohoe, T. J.使用钯催化烯酸酯芳基化合成原小檗碱生物碱。Angew。化学。Int。艾德。53, 14555-14558(2014)。
拉斯伯恩,D. A.和布鲁斯,N.生物碱的微生物转化。咕咕叫。当今。Microbiol。5, 274-281(2002)。
可持续医药和全球卫生保健。足底地中海。77, 1129-1138(2011)。
克雷文斯,A,佩恩,J. &斯默克,C. D.植物天然产物微生物生物合成的合成生物学策略。Commun Nat。10, 1-12(2019)。
Ro, D. K.等。抗疟药物前体青蒿酸在工程酵母中的生产。自然440, 940-943(2006)。
罗,X.等。酵母中大麻素及其非天然类似物的完全生物合成。自然567, 123-126(2019)。
斯里尼瓦桑,P. &斯默克,C. D.酵母中药用莨菪烷生物碱的生物合成。自然585, 614-619(2020)。
张,J.等。生产抗癌药物长春碱的微生物供应链。自然609, 341-347(2022)。
李松林,李永林,李永林,史摩克。高价值植物化学物质的微生物合成策略。Nat,化学。10, 395-404(2018)。
Redden, H. & Alper, H. S.合成最小酵母启动子的发展和特性。Commun Nat。6, 1-9(2015)。
李,Y.等。诺卡平和卤化生物碱在酵母中的完全生物合成。国家科学院学报美国115, e3922-e3931(2018)。
阮古芬,魏,曲x, O 'Connor, S. E.碳-卤素键形成在药用植物代谢中的应用。自然468, 461-464(2010)。
Runguphan, W., Maresh, J. J. & O 'Connor, S. E.在植物培养中沉默色胺生物合成以生产非天然生物碱。国家科学院学报美国106, 13673-13678(2009)。
伯恩哈特,P., McCoy, E. & O 'Connor, S. E.快速鉴定用于长春花生物碱生物合成的酶变体。化学。医学杂志。14, 888-897(2007)。
华,W.等。液相色谱-电喷雾电离-质谱法测定人血浆中小檗碱。j .制药。生物医学。分析的44, 931-937(2007)。
史密斯,D. R. M., Grüschow, S. & Goss, R. J. M.卤化酶在生物合成应用中的范围和潜力。咕咕叫。当今。化学。医学杂志。17, 276-283(2013)。
Müller, K., Faeh, C. & Diederich, F.药物中的氟:超越直觉。科学(1979)317, 1881-1886(2007)。
Subrizi, F.等人。结合甲基转移酶的多酶一锅级联用于四氢异喹啉生物碱的战略多样化。Angew。Chem.-Int。艾德。60, 18673-18679(2021)。
王毅,等。新型苄基异喹啉生物碱生物合成从头级联的设计与应用。Angew。化学。131, 10226-10231(2019)。
王毅,等。利用平行级联策略和酪氨酸酶变体酶法合成苄基异喹啉生物碱。Commun Nat。13, 5436(2022)。
Galanie, S. & Smolke, C. D.药用小檗碱原生物碱酵母生产的优化。微。细胞的事实。14, 144(2015)。
韩俊,吴勇,周勇,李生酿酒酵母生产植物苄基异喹啉类生物碱。aBIOTECH2, 264-275(2021)。
杨晓明,王晓明,王晓明,等。罂粟碱的生物合成研究。足底240, 19-32(2014)。
辛格,A, Menéndez-Perdomo, I. M. & Facchini, P. J.苯基异喹啉生物碱在罂粟中的生物合成:更新。Phytochem。牧师。18, 1457-1482(2019)。
哈格尔,J. M. &法奇尼,P. J.苄基异喹啉生物碱代谢:一个世纪的发现和一个勇敢的新世界。植物细胞物理。54, 647-672(2013)。
Trenchard, I. J., Siddiqui, M. S., Thodey, K. & Smolke, C. D.酵母中关键分支点苄基异喹啉生物碱网状蛋白的重新生产。金属底座。Eng。31, 74-83(2015)。
德洛奇,W. C.等。酶偶联生物传感器使(年代-葡萄糖在酵母中产生网状蛋白。Nat,化学。医学杂志。11, 465-471(2015)。
Trenchard, i.j. & Smolke, c.d.酵母中植物生物碱发酵生产的工程策略。金属底座。Eng。30., 96-104(2015)。
吴勇,陈明宁,李生。植物源苯乙烯吡啶类化合物的生物合成酿酒酵母.金属底座。Eng。Commun。14, e00195(2022)。
Galanie, S., Thodey, K., Trenchard, I. J., Interrante, M. F. & Smolke, C. D.酵母中阿片类物质的完全生物合成。科学(1979)349, 1095-1100(2015)。
Payne, J. T., Valentic, T. R., Smolke, C. D. Chan, B. & Biohub, Z.双苄基异喹啉生物碱guattegamerine和berbamunine在酵母中的完全生物合成。国家科学院学报美国118, e2112520118(2021)。
派恩,m.e.等人。高水平合成四氢异喹啉生物碱的酵母平台。Commun Nat。11, 3337(2020)。
Sunnadeniya, R.等。甜菜色素生物合成中的酪氨酸羟化作用由细胞色素P450酶完成(甜菜属).《公共科学图书馆•综合》11, e0149417(2016)。
Güldener, U.,赫克,S., Fiedler, T., Beinhauer, J. & Hegemann, J. H.一种新的高效基因破坏盒重复使用在出芽酵母。核酸测定。24, 2519-2524(1996)。
格塞尔,A.等。两种具有(S)-四氢原小檗碱氧化酶活性的fad依赖氧化酶的异源表达Argemone墨西哥而且小檗属植物wilsoniae在昆虫细胞中。足底233, 1185-1197(2011)。
龚凤玲,韩娟,李生。MULTI-SCULPT:通过选择性、crispr介导的超长通路转化在酵母中进行多重整合以合成植物天然产物。ACS合成器。医学杂志。11, 2484-2495(2022)。
奈特,R. S.,刘,W. & Sattely, E. S.秋水仙碱生物合成的发现和工程。自然584, 148-153(2020)。
Matsushima, Y. Minami, H., Hori, K. & Sato, F.在转基因加利福尼亚罂粟细胞中合成苄基异喹啉生物碱的途径工程与四氢小檗碱氧化酶的异位表达黄连粳稻.生物科技植物》。29, 473-481(2012)。
哈格尔,J. M.等人。罂粟黄蛋白氧化酶催化血碱和罂粟碱生物合成的最后步骤的特性。生物。化学。287, 42972-42983(2012)。
Resch, V.等人。通过使用定制的含氟底物逆转小檗碱桥酶的区域选择性。化学。欧元。J。18, 13173-13179(2012)。
罗丹,R.等。甲基化四氢小檗碱原和小檗碱原生物碱的化学酶级联作用。Org。列托人。23, 6342-6347(2021)。
毕芬格,金,H. W.和DiMagno . S. G.氟化化合物的极性疏水性。ChemBioChem5, 622-627(2004)。
刘志强,刘志强,刘志强,等。氟碳化合物疏水性的分子来源。国家科学院学报美国107, 13603-13607(2010)。
田中,F., Fukuse, T., Wada, H. & Fukushima, M.口服5-氟尿嘧啶衍生物化疗药物的历史、机制和临床应用。咕咕叫。制药。Biotechnol。1, 137-164(2000)。
贾米尔,o.k, Cravens, A, Payne, J. T., Kim, C. Y. & Smolke, C. D.四氢罂粟碱的生物合成和酵母中的罂粟碱半合成。国家科学院学报美国https://doi.org/10.1073/pnas(2022)。
Bock, A., Wanner, G. & Zenk, m.h.参与小檗碱生物合成的两种酶的免疫细胞学定位。足底216, 57-63(2002)。
王志强,王志强,王志强,等。人工培养的罂粟细胞中血氨酸生物合成酶的亚细胞定位。Vitr。细胞。发展。Biol.-Plant48, 233-240(2012)。
Ozber, N, Watkins, J. L. & Facchini, P. J.回到植物:克服医药上重要的植物天然产物的微生物生产的障碍。J. Ind.微生物生物技术。47, 815-828(2020)。
杨晓明,杨晓明,杨晓明,等。苯基异喹啉类生物碱在罂粟体内代谢的定位研究。J.植物物理。271, 153641(2022)。
Facchini, P. J. & St-Pierre, B.生物碱生物合成酶的合成和运输。咕咕叫。当今。植物医学杂志。8, 657-666(2005)。
Newman, d.j. & Cragg, g.m.从1981年1月至2019年9月近四十年来,天然产物作为新药的来源。纳特。83, 770-803(2020)。
丁,Y.等。小檗碱生物碱的结构修饰及其降糖活性。j .功能。食物7, 229-237(2014)。
斯罗梅克,A. W.等。氟化aporphine的合成与评价:D2受体的潜在正电子发射断层扫描配体。ACS医学化学。列托人。2, 189-194(2011)。
许艳,史梅,A. W. & Neumeyer, J. L.氟化物的鉴定(R)-(−)-aporphine衍生物作为5-HT2C受体的有效和选择性配体。Bioorg。地中海,化学。列托人。29, 230-233(2019)。
吉布森,d.g.等。DNA分子的酶组装可达几百个碱基。Nat方法。6, 343-345(2009)。
确认
这项工作得到了美国国立卫生研究院耳聋和其他交流障碍研究所的支持,奖金编号为R21DC019206,授予李S.。本材料基于国家科学基金会资助的研究工作。dbi - 2019674。我们感谢Christina Smolke教授(斯坦福大学)和Yanran Li教授(加州大学河滨分校)的慷慨分享质粒,Matthew Paszek教授和Lingting Huang在发酵放大过程中的支持,以及Yinan Wu博士在LC-MS/MS和叶片渗透实验中的帮助。作者要感谢吴一楠博士、Franklin Gong和Chang Liu在手稿准备过程中的宝贵讨论,以及Fima Margovskiy在STOX酶表征过程中的帮助和讨论。
作者信息
作者及隶属关系
贡献
S.L.提出了这个想法并监督实验;J.H.进行了途径设计、菌株构建、发酵、LC-MS或MS/MS、酶工程和化学转化实验;S.L.和J.H.分析了数据并撰写了手稿。
相应的作者
道德声明
相互竞争的利益
一份临时专利申请正在准备中,将J.H.和S.L.列为发明人。
同行评审
同行评审信息
化学通讯感谢匿名审稿人对本工作的同行评议所作的贡献。
额外的信息
出版商的注意施普林格自然对出版的地图和机构从属关系中的管辖权主张保持中立。
权利和权限
开放获取本文遵循知识共享署名4.0国际许可协议(Creative Commons Attribution 4.0 International License),允许以任何媒介或格式使用、分享、改编、分发和复制,只要您对原作者和来源给予适当的署名,提供知识共享许可协议的链接,并注明是否有更改。本文中的图像或其他第三方材料包含在文章的创作共用许可中,除非在材料的信用额度中另有说明。如果内容未包含在文章的创作共用许可协议中,并且您的预期使用不被法定法规所允许或超出了允许的使用范围,您将需要直接获得版权所有者的许可。要查看此许可证的副本,请访问http://creativecommons.org/licenses/by/4.0/.
关于本文
引用本文
韩娟,李生。黄连素和卤化苄基异喹啉类生物碱的从头生物合成酿酒酵母.Commun化学6, 27(2023)。https://doi.org/10.1038/s42004-023-00821-9
收到了:
接受:
发表:
DOI:https://doi.org/10.1038/s42004-023-00821-9