摘要
手性含磷化合物在多个不同的研究领域发挥着越来越重要的作用。在这里,我们展示了手性磷酸催化的3,4-二氢异喹啉与二芳基膦氧化物的对映选择性磷酸化,高效而实用地构建了具有不同官能团范围的手性α-氨基二芳基膦氧化物家族。磷化氢产物可转化为几种手性硫脲,可作为手性配体或催化剂用于不对称催化。对照和核磁共振跟踪实验表明,反应通过叔丁基1-(叔丁基)-3,4-二氢异喹啉-2(1H)-羧酸中间体,随后形成C-P键。此外,计算研究表明,膦酸盐和异喹啉之间的氢键强度决定了磷酸化反应的立体选择性。
简介
手性含磷化合物作为手性配体和不对称反应的有机催化剂受到越来越多的关注1,2 gydF4y2Ba,3.,4,5,6,潜在的生物活性7,8,9,10,11以及材料科学领域的实用工具12,13,14.手性α-氨基二芳基氧化膦是最重要的有机磷化合物之一,一直被直接用作有机催化剂15,16或者被用作手性配体合成的关键组成部分。此外,最近的研究还发现手性α-氨基二芳基膦氧化物可以作为α-氨基膦酸及其膦酸酯的替代品,这可能会导致重要的生物活性发现17,18.手性1,2,3,4-四氢异喹啉(THIQ)是天然产物中最重要的“特权支架”之一19,20.,21,22,生物活性分子23,24,25,26,以及手性催化剂27,28,29,30.,31,32.因此,将α-氨基二芳基膦氧化物的亚结构与THIQ结合成一个单一分子,无论是发现具有潜在生物活性的新化合物,还是开发新的配体和有机催化剂,都具有巨大的应用价值。
亚胺与二芳基膦氧化物的催化对映选择性磷酸化是制备手性α-氨基二芳基膦氧化物的最直接方法(图2)。1).据我们所知,目前关于α-氨基二芳基膦氧化物对映选择性合成的报道只有三篇。Shibasaki等人报道了第一个用杂双金属镧配合物催化二苯基膦氧化物不对称加成环亚胺的例子。在此催化条件下,获得了较高的产率和良好的对映选择性33.在这项开创性的工作之后,Antilla等人报道了手性镁二酚磷酸盐催化取代的无环亚胺与二苯基膦的对映选择性磷酸化,得到了高达96% ee的产品34.不久之后,Gong和同事报道了第一个使用手性方酰胺作为氢键有机催化剂的无环亚胺与二苯基膦氧化物的对映选择性磷化反应,得到了结构多样的α-羊膜膦氧化物,具有良好到优异的对映选择性35.因此,开发新的α-氨基二芳基膦氧化物的对映选择性结构是合成化学家的迫切需要。
此外,在THIQ的C1位置构建手性膦部分的对映选择性方案很少被探索。Mukherjee等人报道了该领域的唯一工作,他们将手性硫脲作为催化剂,用于1,2,3,4-四氢异喹啉-1-基膦酸盐的不对称合成(图2)。1 b)36.然而,该方法需要苛刻的反应条件(−80°C)和预先生成的硅基亚磷酸酯,并且只有四个样品具有中等到良好的对映选择性。在我们最近的工作中,我们通过手性磷酸催化异喹啉的去芳化,成功地实现了对映选择性膦化,用于手性α-氨基二芳基氧化膦的构建37.该方案被发现有明显的局限性,由于困难在于进一步转化的产物归因于其易外消旋化通过热力学上有利于芳构化过程。据我们所知,没有关于3,4-二氢异喹啉不对称磷酸化的报道,利用二芳基膦氧化物作为亲核试剂。
手性磷酸(CPAs)在有机催化研究领域发挥着重要作用38,39,40,41,42,43,44.我们对它在新的不对称反应和有用合成中的应用保持着兴趣45,46,47.在本文中,我们报道了手性磷酸催化3,4-二氢异喹啉的不对称磷酸化反应,利用二级氧化膦在C1位置构建手性thq的支架(图4)。1 c).该催化体系具有良好的官能团容限和广泛的底物范围。通过产品的克级合成和衍生化,很好地阐明了该方案的适用性,形成了不同的取代手性脲(硫),这些脲可能作为不对称催化中的手性有机催化剂或配体。此外,根据实验结果和DFT计算,很好地描述了催化循环。
结果和讨论
我们在环亚胺对映选择性磷酸化合成手性α-氨基膦氧化物的研究中,不断探索手性膦化合物的构建方法。现成的3,4-二氢异喹啉(1)及二苯膦氧化物(2)作为模型底物。经过初步试验,发现首先用Boc处理3,4-二氢异喹啉时,标题磷酸化反应进行顺利2 gydF4y2BaO.为了获得满意的对映体过量,系统地研究了73种手性磷酸(CPA)(见补充表)1)及部分结果汇总于表中1.首先,基于BINOL骨架的一系列手性磷酸(1 - 6),以甲苯为溶剂,在室温下放置24小时(表1(1-6),均能提供优良的对映选择性,但对映选择性最佳的ee仅为27%(条目6)H- binol衍生的手性磷酸7号到9号以9-蒽基取代磷酸为催化剂7在此之后,螺环spinol -磷酸也被评价为对映选择性磷酸化的催化剂,但在对映性控制方面没有得到进一步的改善(条目10-12)。然后对一系列溶剂进行筛选,以提高对映体的选择性7作为催化剂。当用苯代替甲苯作为溶剂时,ee急剧增加到63%,尽管收率只有81%(条目13)。含氯溶剂,如氯化碳4而二氯甲烷对该反应没有表现出积极的影响,分别只有2%和16%的ee提供所需的产品(条目14-15)。非质子溶剂如乙酸乙酯、MeCN、丙酮、醚、1,4-二恶烷和四氢呋喃均给出了较差的对映体控制结果(条目16-21)。让我们惊讶的是,甲基叔-丁基醚(MTBE)作为溶剂时具有最佳的对映选择性(第22项,79% ee)。然后,将四种不同类型的分子筛作为添加剂引入催化体系(条目23-26),其中4 Å MS效率最佳,收率99%,ee 91%(条目24)。最后,在反应优化(温度、催化剂负载、浓度和活化剂)方面的额外努力提供了类似的选择性水平(详情见补充表)1-3.).值得注意的是,使用苯代替MTBE作为溶剂观察到相同水平的对映选择性(条目27)。
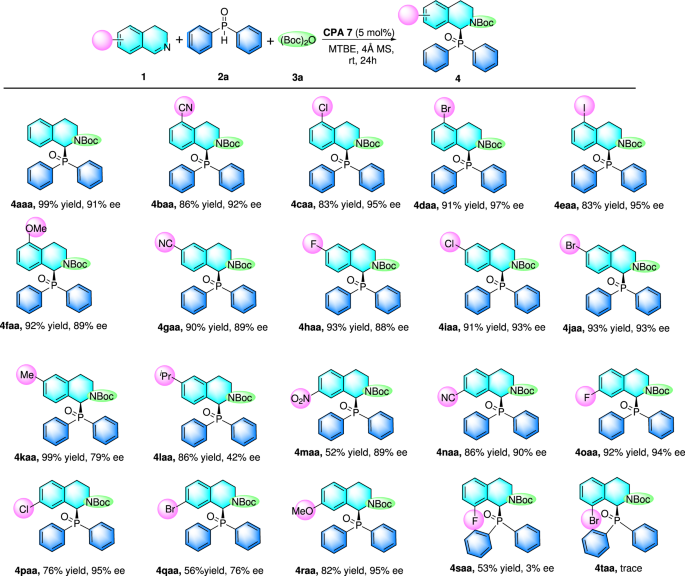
在确定了最佳条件后,我们将注意力转向探索这种催化反应的普遍性(参见补充的方法).首次研究了苯环不同位置上3,4-二氢异喹啉取代基。结果表明,具有吸电子基团或给电子基团的5-取代底物均易于磷酸化,且具有良好的对映选择性(图2)。2 gydF4y2Ba,4 baa-4faa).敏感官能团如CN, Cl, Br和I (1 a e)在催化条件下耐受性很好,提供了93%以上的ee。然后,研究了3,4-二氢异喹啉在C-6位置上不同类型的官能团。缩电子基团(CN, F, Cl, Br)都对这种不对称的磷酸化没有负面影响,提供了理想的α-氨基膦氧化物,具有良好的产量和对映选择性(图。2 gydF4y2Ba4 gaa-4iaa).在C-6位置上含有甲基和异丙基的底物均表现出较差的反应性和对映选择性。2 gydF4y2Ba, 4kaa和4laa).之后还研究了C-7位的取代基,其中底物磷酸化1米,1 n,1阿,1便士而且1 r在最优条件下均易于反应,得到的α-氨基氧化磷产物均具有较好的产率(76~92%)和较好的对映选择性(90~95%,ee)4 qaa(56%产量和77% ee)。值得注意的是,C-8位的取代基似乎对标题催化磷酸化产生了巨大的阻力。底物反应1是迟缓的,给出了想要的产品(4 saa),产量为53%,ee仅为3%。此外,没有转换到所需的产品发生1 t在最佳条件下作为衬底。这些结果可能为理解催化循环甚至对映体控制机制提供线索。
然后,还研究了亲核二氧化膦的范围。首先,研究了取代基电子性质对二氧化膦苯环的影响,其中双(4-(三氟甲基)苯基)氧化膦(2 b)和bis(4-(叔-丁基苯基氧化膦(2 e)均易与6- cl -3,4-二氢异喹啉反应(1我),分别为86% ee和93% ee(图;3.,4 iba而且4国际能源机构).当以3,4-二氢异喹啉代替6- cl -3,4-二氢异喹啉作为底物时,反应转化率和对映选择性均略低(图2)。3.,4阿坝而且4 aea).之后,二([1,1 ' -联苯]-4-基)氧化膦(2摄氏度)和二对甲苯膦氧化物(二维)在标准催化条件下与6- cl -3,4-二氢异喹啉反应(1我)和3,4-二氢异喹啉(1)以提供图中所列的所有具有优良对映体控制的标题产品。3.(4 ica而且4国际开发协会;4 aca而且4 ada).然而,强给电子甲氧基(OMe)显著降低了产率(40%),同时保持了良好的对映选择性(86% ee)。值得注意的是,当我们将溶剂换成苯时,在相同的对映选择性(83% ee)下,收率从40%显著提高到80%(图2)。3.4 ifa).二(萘-1-基)氧化膦(2 f)和二(萘-2-基)氧化膦(2 g)均为合适的亲核试剂,分别以91% ee和96% ee实现6- cl -3,4-二氢异喹啉的磷酸化(图。3.4 ifa而且4 iga).然后,考察了邻位取代基的空间效应,当双(2-甲基苯基)氧化膦(2 j)作为底物,甲氧基对该反应起负作用,只提供了35%的收率和86%的ee(图。3.4 ija).以苯为溶剂,收率可提高到78%。当空间位阻亲核试剂双(3,5-二甲基苯基)氧化膦(2 k)和bis(3,5-di-tBu-phenyl)磷化氢(2 l)氧化物在标准条件下使用。不幸的是,空间位阻更大的双(2,4,6-三甲基苯基)氧化膦(2米)在这样的催化条件下是不反应的。这一结果可能是由于双电极的空间位阻效应昊图公司基的。
为了进一步证明我们的方案的实用性,对映选择性磷酸化进行了克级,提供了产品4 aaa在最优条件下,产率为95%,ee为91%(图;4).经过一次再结晶,ee值提高到99%。在TFA/DCM或TMSCl/MeOH条件下,Boc基团容易被去除而生成5 aaa在近定量产率中,对映体选择性有轻微的侵蚀。然而,5 aaa不稳定,在溶液中容易外消旋。幸运的是,锌盐的外消旋作用5 aaa '(溶液)可以被完全抑制通过的Boc组4 aaa与ZnBr2 gydF4y2Ba,然后与异(硫)氰酸酯化合物缩合,提供了广泛的获得结构多样的手性thq衍生物的途径,这些衍生物含有氧化膦和(硫)脲基团(图。4 b).中,6 aaa收率85%,收率98%通过现配制的冷凝液5 aaa '异硫氰基苯溶液。之后,异氰酸酯也加入到5 aaa '解决方案,提供6艺术展在88%的收率与99%的ee。注意,对映物1-异硫氰基乙苯和1-异氰基乙苯均顺利转化为6 aac格式而且6法含有手性支架,包含氧化膦和(硫脲)脲部分。奎宁衍生异硫氰酸酯也被证实是有效的反应5 aaa ',产率6 aae收率86%,收率99%。这些手性THIQ衍生物可能作为手性配体或有机催化剂,在不对称有机催化和Lewis碱催化领域具有潜在的应用价值。
一个扩大合成,(一)反应条件:4节5号(1 mmol), ZnBr2 gydF4y2Ba(1.2 mmol) DCM (10 mL)室温12小时,见补充笔记.无需进一步的后期处理;b合成转换,b-f加入相关的异(硫)氰酸酯化合物(1.2 mmol),在室温下搅拌24 h。文中给出了分离产率,并用高效液相色谱法测定了ee值。
为了深入了解该反应的催化机理,进行了几个对照实验和核磁共振跟踪实验(图2)。5,见补充图。1- - - - - -7详情)。首先,用Boc处理2,3-二氢异喹啉2 gydF4y2BaO在50°C下作用30分钟形成了一个新物种,其结构被证实为叔丁基1-(叔丁基)-3,4-二氢异喹啉-2(1H)-羧酸酯(1“)1H核磁共振47,48.然后是复合1“在C6D6作为溶剂,其中标题产品4 aaa以90% ee生成率99%,说明该化合物可能是中间体1“在催化循环中(图;5).然后,底物1二苯膦氧化物在CPA7在C语言中6D6在室温下。12 h后,生成二苯基(1,2,3,4-四氢异喹啉-1-基)氧化膦(1 b”)被观察到。然后,异喹啉治疗(1 b”)与Boc2 gydF4y2Ba在注册会计师面前7形成外消旋的标题产物4 aaa99%产率(图;5 b).这些结果表明,不对称反应过程不通过中间体进行1 b”.最后,实验说明1在Boc存在下直接与二苯膦氧化物反应2 gydF4y2BaO在磷酸的催化下进行,得到所需的产物4 aaa提供了99%的产量,而只有40%的ee(图;5度).结果表明,磷酸基化反应是逐步进行的,并形成干净的1“在对映体控制步骤中起关键作用。
并进行了DFT计算,以了解该反应的机制和对映选择性的起源。催化剂CPA7和基质1在我们的DFT计算中被考虑。在上述机理讨论的基础上,我们计算了如图所示路径的能量分布。5.如图所示。6机械循环由三个主要阶段组成。第一阶段(1→1 a - 1)与(Boc)亲电加成有关。2 gydF4y2BaO1能量势垒为16.6千卡/摩尔。在第二阶段,脱羧1 a - 1给1“是否决定整个途径的速率,其整体活化自由能势垒为30.4千卡/摩尔(能量为TS3有关1“).第三阶段(1→4 aaa)对应于的对映选择性磷酸化1“通过异喹啉中间体的逐步亲核取代机制。在第三阶段,二苯膦氧化物与CPA成键7提高CPA的酸度7.二苯基膦键合CPA7然后使质子化1“然后释放一个分子或者tBuOH生成异喹啉1“1.异喹啉的磷酸化是对映体决定步骤。这种催化模式与之前密切相关的工作是一致的49,50,51.对映决定过渡态之间的能量差TS-5 (年代)而且TS-5 (R)计算为2.9千卡/摩尔(98% ee),这正确地再现了实验观察到的对映体偏好(91% ee年代4 aaa).
通过仔细检查的结构TS5(R),TS5(年代)(图。7),我们发现注册会计师7-膦酸盐在有利过渡态下与异喹啉有较强的氢键相互作用TS5(年代)比在TS5(R).异喹啉C-8位的氢随C8-H与CPA的距离而参与氢键相互作用7膦酸酯在TS5(年代)的2.31 Å,比TS5(R) (2.45 Å)。这一发现表明,C-8位的芳基氢也决定了该反应的立体选择性,与图中实验观察结果一致。2 gydF4y2Ba取代基在C-8位(4 saa)对映选择性差。
结论
综上所述,我们首次开发了一种高效温和的方法,利用二次氧化膦对3,4-二氢异喹啉进行不对称磷酸化(收率高达99%,ee为97%)。该协议的适用性得到了很好的证明通过通过产品的衍生化,克级合成并制备几种潜在的手性有机催化剂或配体。实验研究和DFT计算支持的中介性叔丁1 - (叔丁氧基)3,4-dihydroisoquinoline-2 (1H)羧酸盐。此外,实验研究和DFT计算表明,膦酸盐与异喹啉之间的氢键强度是决定该反应立体选择性的关键因素。
方法
cpa催化3,4-二氢异喹啉酰化的一般程序
3,4-二氢异喹啉(0.2 mmol)、CPA催化剂(5 mol%)和Boc的混合物2 gydF4y2BaO (0.3 mmol)在50°C搅拌0.5 h。然后加入4 Å MS (50 mg)、MTBE或苯(2 mL)和二芳基氧化膦(0.24 mmol),室温搅拌反应24 h。反应混合物在减压下浓缩。用PE/EA(2/1)闪柱层析法对其进行纯化叔(-butyl-1) - diphenylphosphoryl 3, 4 - dihydroisoquinoline-2 (1 h)羧化物。
参考文献
唐,W.-J。&张晓明新型手性磷配体用于对映选择性氢化反应。化学。牧师。103, 3029-3070(2003)。
手性单齿膦配体MOP用于过渡金属催化的不对称反应。Acc。化学。Res。33, 354-362(2000)。
倪,H.,陈,w - l。卢永明,杨晓明,杨晓明。磷化氢催化的不对称有机反应。化学。牧师。118, 9344-9411(2018)。
万福安,唐伟杰。张实验室的磷配体:设计、不对称氢化和工业应用。下巴。j .化学。39, 954-968(2021)。
Carmona, Rodríguez-Franco, C., Fernández, R., Hornillos, V. & Lassaletta, J. M.轴向手性(异)联芳基的Atroposelective转化。从去对称性到现代解析策略。化学。Soc。牧师。50, 2968-2983(2021)。
刘,L.等。铜催化的分子间对映选择性自由基氧化C(sp3)−H/C(sp)−H与合理设计的恶唑啉衍生N,N,P(O)-配体的交叉偶联Angew。化学。Int。艾德。133, 26914-26717(2021)。
作为天然磷酸盐类似物的磷酸盐。化学。牧师。77, 349-367(1977)。
罗曼年科,V. D. & Kukhar, V. P.氟化磷酸盐:合成和生物医学应用。化学。牧师。106, 3868-3935(2006)。
Galezowska, J. & Gumienna-Kontecka, E.膦酸盐,它们的配合物和生物应用:令人惊讶的多样性光谱。Coord化学。牧师。256, 105-124(2012)。
霍斯曼,G. P. & Zechel, D. L.磷酸盐生物化学。化学。牧师。117, 5704-5783(2017)。
帕金森,E. I.,艾略特,A. C.,朱,K.-S.。Fosmidomycin生物合成与相关的磷酸盐天然产物不同。Nat,化学。医学杂志。15, 1049-1056(2019)。
鲍姆加特纳,T. & Réau, R.有机磷π共轭材料。化学。牧师。106, 4681-4727(2006)。
Mallesham, G.等人。氧化膦功能化芘作为有机发光二极管的高效蓝光多功能材料。j .板牙。化学。C。3., 1208(2015)。
张,美国。et al。使用氧化膦和氨基功能化超顺磁复合聚合物吸附剂从高酸性介质中高效去除铀。j .板牙。化学。8, 10925-10934(2020)。
刘,X.-W。et al。手性氧化膦酰吡咯烷的高效合成及其在不对称直接醛醇反应中的应用。Org。Biomol。化学。6, 3997-4003(2008)。
莫里斯,d.j.等。n -二苯膦酰- 1,2 -二苯乙胺(PODPEN)不对称有机催化2-硝基苯乙烯与丙酮的加成。四面体。51, 209-212(2010)。
Turkbey, B., Hoyt, R. F., Agarwal, H. K., Bernardo, M. & Sankineni, S.用gadofosset三钠白蛋白进行前列腺磁共振前哨淋巴结成像:犬模型的初步结果。专科学校Radiol。22, 646-652(2015)。
雷迪,K. R.等人。Pradefovir:一种前药,靶向阿德福韦肝脏治疗乙型肝炎。医学。化学。51, 666-676(2008)。
莱恩,金伟,陈友友。& Williams, R. M.(−)-Jorumycin,(−)-Renieramycin G, 3-epi-Jorumycin和3-epi-Renieramycin G的不对称全合成。j。化学。Soc。127, 12684-12690(2005)。
Vincent, G. & Williams, r.m.(−)‐Cribrostatin 4 (Renieramycin H)的不对称全合成。Angew。化学。Int。艾德。46, 1517(2007)。
朱,r。et al。下巴。j .化学。32, 1039-1542(2014)。
Chrzanowska, M., Grajewska, A. & Rozwadowska, m.d.异喹啉生物碱的不对称合成:2004-2015。化学。牧师。116, 12369-12465(2016)。
Crestey, F.等人。红檀生物碱类似物神经元烟碱乙酰胆碱受体拮抗剂的设计、合成和生物学评价。医学。化学。56, 9673(2013)。
Vitaku, E., Smith, D. T. & Njardarson, J. T.美国FDA批准的药物中氮杂环的结构多样性、替代模式和频率分析:微观视角。医学。化学。57, 10257-10274(2014)。
张,X.-L。et al。新型PDE4抑制剂四氢异喹啉类化合物的结构辅助鉴定和优化,从而发现一种有效的抗银屑病药物。医学。化学。62, 5579-5593(2019)。
沙玛,英国,兰詹,P.,艾肯,E. V. &尤,s . l .。基于序贯和直接多组分反应(MCR)的脱芳构化策略。化学。Soc。牧师。49, 8721-8748(2020)。
Chakka, s.k., Andersson, G, Maguire, g.e.m, Kruger, H. G. & Govender, T.不对称转移氢化反应中C1取代四氢异喹啉衍生物的合成和筛选。欧元。j . Org。化学。5, 972-980(2010)。
彼得斯等人。用于不对称Diels-Alder反应的新型四氢异喹啉基有机催化剂:使用ROESY NMR和DFT研究对催化模式的洞察。四面体。:不对称。21, 2859(2010)。
Naicker, T., Arvidsson, P. I., Kruger, H. G., Maguire, G. E. M. & Govender, T.四氢异喹啉基N -氧化物作为醛的不对称烯丙化的手性有机催化剂。欧元。j . Org。化学。34, 6923(2011)。
Kawthekar, r.b.等人。四氢异喹啉-恶唑啉配体的合成及其在对映选择性Henry反应中的应用。四面体。:不对称。21, 846(2010)。
Cele, Z. E. D.等。四氢异喹啉(TIQ) N, N’-二氧化氮配体催化不对称碳-碳键形成反应。四面体。:不对称。24, 191-195(2013)。
刘,W.-S。,Liu, S.-S., Jin, R.-W., Guo, H. & Zhao, J.-B. Novel strategies for catalytic asymmetric synthesis of C1-chiral 1, 2, 3, 4-tetrahydroisoquinolines and 3, 4-dihydrotetrahydroisoquinolines.Org。化学。前面。2 gydF4y2Ba, 288-299(2015)。
山木,K.,哈伍德,s.j.,金井,M. &柴崎,M.催化不对称加成二苯基膦氧化环亚胺。四面体。40, 2565-2568(1999)。
英格尔,G. K.等。手性双酚镁磷酸盐催化亚胺的磷化:获得富对映体α-氨基膦氧化物。Org。列托人。13, 2054-2057(2011)。
香港,L.-P。et al。亚甲亚胺的高对映选择性膦化和氢膦化:使用手性方酰胺作为氢键有机催化剂。Org。Biomol。化学。12, 8656-8670(2014)。
Ray, C. A. & Mukherjee, S.通过阴离子结合催化制备环α-氨基膦酸酯过程中异喹啉的对映选择性脱芳。化学。科学。7, 6940-6945(2016)。
高正,郭艳。手性磷酸催化异喹啉类化合物的对映选择性膦化。化学。Commun。58, 9393-9396(2022)。
秋山,T., Itoh, J., Yokota, K. & Fuchibe, K.手性Brønsted酸催化的对映选择性Mannich‐型反应。Angew。化学。Int。艾德。43, 1566-1594(2004)。
Uraguchi, D. & Terada, M.手性Brønsted酸通过亲电活化催化直接Mannich反应。j。化学。Soc。126, 5356-5357(2004)。
徐峰,等。spinol衍生磷酸:吲哚与亚胺对映选择性Friedel - Crafts反应的合成与应用。j . Org。化学。75, 8677-8680(2010)。
王丽娟,钟娟,林晓辉。磷酸磷酸催化的三组分级联反应:轴向手性N‐芳烯酮的对映选择性合成。Angew。化学。Int。艾德。44, 15824-15828(2019)。
秋山,T.更强的brønsted酸。化学。牧师。107, 5744-5758(2007)。
Parmar, D., Sugiono, E., Raja, S.和Rueping, M.不对称BINOL磷酸盐衍生Brønsted酸和金属催化的完整现场指南:历史和激活模式分类;Brønsted酸度,氢键,离子配对,和金属磷酸盐。化学。牧师。114, 9047-9153(2014)。
林晓霞,王丽娟,韩哲,陈哲。手性螺旋环磷酸及其应用。下巴。j .化学。39, 802-824(2021)。
郭,Y.等。手性磷酸催化脂肪族醛的对映选择性Biginelli反应:克兰贝素a和巴兹拉丁a双环胍核合成的关键一步。合成.12, 2394-2406(2018)。
郭,Y.等。手性螺旋环磷酸催化不对称Biginelli反应合成4-烷基-3,4-二氢嘧啶-2(1H)- 1衍生物。亚洲J. Org。化学。9, 626-630(2020)。
郭,Y.等。手性brønsted酸催化2,3 -二氢醌-唑啉酮的实际催化对映选择性合成。Org。Biomol。化学。19, 4146-4151(2021)。
拉康赛,C. J., Seguin, T. J. & Wheeler, S. E.通过静电相互作用调节立体选择性在spinol -磷酸催化合成2,3 -二氢喹唑啉酮。ACS Catal。10, 12292-12299(2020)。
Sasamoto, N, Dubs, C, Hamashima, Y. & Sodeoka, M. Pd (II)催化丙二酸盐对二氢异喹啉的不对称加成。j。化学。Soc。128, 14010-14011(2006)。
Michael, J., Rishel, M. J., Amarasinghe, K. K. D., Dinn, s.r. & Johnson, B. F.四苯那嗪和二氢四苯那嗪的不对称合成。j . Org。化学。74, 4001-4004(2009)。
张,M.等。异喹啉类化合物的对映选择性脱芳芳基化。ACS Catal。6, 5290-5294(2016)。
确认
Y-N.D。,一个cknowledges the financial support from Chemistry and Chemical Engineering Guangdong Laboratory (Grant nos. 2011006 and 2132013) and the Special Fund for the Sci-tech Innovation Strategy of Guangdong Province (no. 210730166882026).
作者信息
作者及隶属关系
贡献
Y.G Y-N.D。,而且J.X. conceived and directed the project. Y.G., Z.G., N.L., and J.L. performed the experiments. Y-N.D. performed the theoretical calculations. X.B., and Z.G. analyzed the results. Y.G. and J.X. wrote the manuscript.
相应的作者
道德声明
相互竞争的利益
作者声明没有利益竞争。
同行评审
同行评审信息
化学通讯感谢匿名审稿人对本工作的同行评议所作的贡献。同行评审报告是可用的。
额外的信息
出版商的注意施普林格自然对出版的地图和机构从属关系中的管辖权主张保持中立。
权利和权限
开放获取本文遵循知识共享署名4.0国际许可协议(Creative Commons Attribution 4.0 International License),允许以任何媒介或格式使用、分享、改编、分发和复制,只要您对原作者和来源给予适当的署名,提供知识共享许可协议的链接,并注明是否有更改。本文中的图像或其他第三方材料包含在文章的创作共用许可中,除非在材料的信用额度中另有说明。如果内容未包含在文章的创作共用许可协议中,并且您的预期使用不被法定法规所允许或超出了允许的使用范围,您将需要直接获得版权所有者的许可。要查看此许可证的副本,请访问http://creativecommons.org/licenses/by/4.0/.
关于本文
引用本文
李郭,Y。,,N, J。et al。手性磷酸催化3,4-二氢异喹啉与二芳基膦氧化物的对映选择性磷酸化反应。Commun化学6, 26(2023)。https://doi.org/10.1038/s42004-023-00826-4
收到了:
接受:
发表:
DOI:https://doi.org/10.1038/s42004-023-00826-4