摘要gydF4y2Ba
裂殖酵母gydF4y2Ba粟酒裂殖酵母gydF4y2Ba是高等真核生物研究的模式生物。我们结合低温电子显微镜和光谱学技术研究了黄芩亲和纯化呼吸复合物IV (CIV)的结构和功能gydF4y2Ba美国非洲酒gydF4y2Ba.还原酶与OgydF4y2Ba2gydF4y2Ba在µs-ms的时间尺度上进行,类似于哺乳动物的CIV。CIV的低温电镜结构显示出11个亚基以及呼吸超复杂因子2 (Rcf2)的结合缺氧诱导基因1 (Hig1)结构域。这些结果表明,Rcf2的结合不需要CIII-CIV超复合物的存在,gydF4y2Ba即gydF4y2Ba.Rcf2是CIV的一个组件。AlphaFold-Multimer模型表明,Rcf1和Rcf2的Hig1结构域结合在CIV的同一位点,这表明它们的结合是互斥的。此外,Rcf1或Rcf2的差异功能效应可能是由CIV与其不同的非hig1结构域部分相互作用引起的。gydF4y2Ba
简介gydF4y2Ba
在细胞能量转换的最后一步,电子从NADH转移到OgydF4y2Ba2gydF4y2Ba,通过一系列膜结合蛋白复合物,称为呼吸链。在这一过程中释放的能量被用来转运或泵质子穿过膜,从而维持质子电化学梯度,驱动ATP合成以及细胞中的其他运输过程。在需氧细菌中,呼吸复合物在细胞质膜中被发现,而在真核生物中,它们位于线粒体内膜中(回顾,见gydF4y2Ba1gydF4y2Ba).gydF4y2Ba
最后一个OgydF4y2Ba2gydF4y2Ba呼吸链的还原复合体,细胞色素gydF4y2BacgydF4y2Ba氧化酶,也称为复合体IV (CIV),从可溶性细胞色素接收电子gydF4y2BacgydF4y2Ba(cyt。gydF4y2BacgydF4y2Ba),被cyt还原。gydF4y2Ba公元前gydF4y2Ba1gydF4y2Ba复杂,CIII。在CIV中,电子首先转移到初级电子受体CugydF4y2Ba一个gydF4y2Ba,再连续到血红素gydF4y2Ba一个gydF4y2Ba和血红素gydF4y2Ba一个gydF4y2Ba3.gydF4y2Ba铜gydF4y2BaBgydF4y2Ba氧还原为水的催化场所。形成水的质子从线粒体基质转移,即负的(gydF4y2BangydF4y2Ba)的一侧,通过质子通道跨越的距离gydF4y2BangydF4y2Ba-侧溶液和催化位点。此外,每一个电子转移到催化位点与泵送一个质子穿过膜,从gydF4y2BangydF4y2Ba往好的方面看(gydF4y2BapgydF4y2Ba)侧,即线粒体中的膜间隙(回顾,见gydF4y2Ba2gydF4y2Ba).gydF4y2Ba
哺乳动物的第一个高分辨率x射线晶体结构gydF4y2Ba3.gydF4y2Ba和细菌gydF4y2Ba4gydF4y2Ba《文明》出版于20多年前。他们显示了一个由亚基I-III(酵母中的Cox1-3)组成的保守的催化核心,包括保守的脂质位点gydF4y2Ba5gydF4y2Ba,gydF4y2Ba6gydF4y2Ba.亚基I含有氧化还原辅助因子血红素gydF4y2Ba一个gydF4y2Ba,血红素gydF4y2Ba一个gydF4y2Ba3.gydF4y2Ba和铜gydF4y2BaBgydF4y2Ba,亚基II结合初级电子受体CugydF4y2Ba一个gydF4y2Ba.此外,线粒体CIV由几个额外的亚基组成。的gydF4y2Ba酿酒gydF4y2Ba(gydF4y2Ba年代gydF4y2Ba.)gydF4y2Ba酵母gydF4y2Ba作为哺乳动物CIV研究的模型gydF4y2Ba7gydF4y2Ba,由9个多余的亚单位组成,8个原来确定gydF4y2Ba8gydF4y2Ba以及最近发现的酵母特异性Cox26gydF4y2Ba9gydF4y2Ba,gydF4y2Ba10gydF4y2Ba,gydF4y2Ba11gydF4y2Ba,gydF4y2Ba12gydF4y2Ba.低温电子显微镜结构gydF4y2Ba酿酒酵母gydF4y2Ba作为CIII超级综合体的一部分gydF4y2Ba2gydF4y2Ba(CIIIgydF4y2Ba2gydF4y2Ba文明gydF4y2Ba1/2gydF4y2Ba)已呈现gydF4y2Ba11gydF4y2Ba,gydF4y2Ba12gydF4y2Ba,gydF4y2Ba13gydF4y2Ba,gydF4y2Ba14gydF4y2Ba,gydF4y2Ba15gydF4y2Ba并描述了一个孤立的CIV结构,没有典型亚基Cox12、Cox13和Cox26gydF4y2Ba16gydF4y2Ba.gydF4y2Ba
裂殖酵母gydF4y2Ba裂殖酵母gydF4y2Ba(gydF4y2Ba年代gydF4y2Ba.)gydF4y2Ba非洲酒gydF4y2Ba作为哺乳动物呼吸链研究的另一种模式生物gydF4y2Ba17gydF4y2Ba.遗传操作程序已经建立,广泛的分子工具可用于这种真菌的研究gydF4y2Ba18gydF4y2Ba.gydF4y2Ba美国非洲酒gydF4y2Ba而且gydF4y2Ba酿酒酵母gydF4y2Ba它们在进化上是高度分化的吗?它们中没有一个比另一个更接近哺乳动物吗gydF4y2Ba17gydF4y2Ba,gydF4y2Ba19gydF4y2Ba,gydF4y2Ba20.gydF4y2Ba.尽管如此,gydF4y2Ba美国非洲酒gydF4y2Ba保留了许多共同的古老酵母祖先和特征gydF4y2Ba美国非洲酒gydF4y2Ba因此与高等真核生物相比具有更多的特征gydF4y2Ba酿酒酵母gydF4y2Ba17gydF4y2Ba,gydF4y2Ba21gydF4y2Ba,gydF4y2Ba22gydF4y2Ba,gydF4y2Ba23gydF4y2Ba,gydF4y2Ba24gydF4y2Ba.因此,这种真菌被称为“模型单细胞真核生物”。gydF4y2Ba21gydF4y2Ba.然而,据我们所知,在分子水平上对呼吸链组成部分的结构或机制的研究以前还没有进行过gydF4y2Ba美国非洲酒gydF4y2Ba.gydF4y2Ba
的gydF4y2Ba美国非洲酒gydF4y2BaCIV由11个亚基组成,它们有许多序列相似之处gydF4y2Ba酿酒酵母gydF4y2Ba文明国家对应国家(表gydF4y2Ba1gydF4y2Ba).就像gydF4y2Ba酿酒酵母gydF4y2Ba,gydF4y2Ba美国非洲酒gydF4y2Ba缺乏呼吸性CI,而CIII的膜结合核心亚基基因(gydF4y2Ba结实的矮gydF4y2Ba), civ (gydF4y2Bacox1-3gydF4y2Ba)和三磷酸腺苷合酶(gydF4y2Baatp6, 8 - 9gydF4y2Ba)位于线粒体DNA上gydF4y2Ba22gydF4y2Ba.除了三个核心子单元外,还有gydF4y2Ba美国非洲酒gydF4y2BaCIV已经注释了8个额外核编码亚基的同源物(PomBase, pombase.org),除了Cox26。的gydF4y2Ba美国非洲酒gydF4y2Ba与Cox5a/b两种亚型相比,CIV仅含有一个Cox5亚基基因gydF4y2Ba酿酒酵母gydF4y2Ba7gydF4y2Ba,gydF4y2Ba25gydF4y2Ba.gydF4y2Ba
所谓的呼吸超复杂因子(Rcfs)gydF4y2Ba26gydF4y2Ba,gydF4y2Ba27gydF4y2Ba,gydF4y2Ba28gydF4y2Ba是完整的膜蛋白,位于线粒体内膜内。这些蛋白是保守的缺氧诱导基因1 (Hig1)蛋白家族的成员gydF4y2Ba26gydF4y2Ba并被建议参与CIII的组装gydF4y2Ba2gydF4y2Ba文明gydF4y2Ba1/2gydF4y2Ba超级复杂,以及文明gydF4y2Ba28gydF4y2Ba,gydF4y2Ba29gydF4y2Ba,gydF4y2Ba30.gydF4y2Ba,gydF4y2Ba31gydF4y2Ba.酵母特异性Rcf2gydF4y2Ba酿酒酵母gydF4y2Ba是一个25 kDa的蛋白质,被预测由4个跨膜(TM) α-螺旋组成gydF4y2Ba29gydF4y2Ba,gydF4y2Ba32gydF4y2Ba并在DPC胶束中形成二聚体gydF4y2Ba33gydF4y2Ba.最近的一项低温电子显微镜研究gydF4y2Ba酿酒酵母gydF4y2BaCIIIgydF4y2Ba2gydF4y2Ba文明gydF4y2Ba1/2gydF4y2Ba经鉴定,CIV中的Rcf2含有缺氧诱导的Cox5b亚型超复合体,在CIV的远端与两个TM α-螺旋结合,与Cox3和Cox13亚基相互作用,另一个螺旋与Cox12结合gydF4y2BapgydF4y2Ba文明的侧面gydF4y2Ba13gydF4y2Ba.gydF4y2Ba
在这项工作中,我们在Cox5亚基上添加了c端双链标记,并亲和纯化了gydF4y2Ba美国非洲酒gydF4y2Ba文明。我们研究了配体与酶的结合以及还原后的CIV与OgydF4y2Ba2gydF4y2Ba.数据显示了与之前观察到的其他规范CIV相同的一般反应序列。对CIV的低温em结构的测定确定了11个亚基以及Rcf2,其位置与在CIV的最近结构中发现的相同gydF4y2Ba酿酒酵母gydF4y2Ba文明supercomplexgydF4y2Ba13gydF4y2Ba这表明,无论Cox5a/5b亚型如何,Rcf2都是CIV的组成部分,而不仅仅是在III-IV超复合体中。gydF4y2Ba
结果与讨论gydF4y2Ba
隔离和活动gydF4y2Ba
我们在Cox5亚基上构建了c端双链标记gydF4y2Ba美国非洲酒gydF4y2BaCIV和可溶性膜片段使用洗涤剂糖皂苷元(GDN),然后亲和层析。两个蛋白质群体在尺寸排除柱上分离(补充图。gydF4y2BaS1agydF4y2Ba).这些基团的还原-氧化差谱分析表明,低分子量基团(峰2,红色补充图。gydF4y2Ba印地gydF4y2Ba)在445 nm和607 nm处具有CIV的吸光度最大值。高分子量基团(峰1,黑色)除含有CIV外,还含有CIII(吸光最大值在430 nm, 550 nm和560 nm), CIII:CIV比为gydF4y2Ba∼gydF4y2Ba2:1,与CIII一致gydF4y2Ba2gydF4y2Ba文明gydF4y2Ba1gydF4y2Basupercomplex。gydF4y2Ba
通过测定OgydF4y2Ba2gydF4y2Ba-加入cyt时的还原率。gydF4y2BacgydF4y2Ba,由过量的抗坏血酸和电子介质N,N,N ',N ' -四甲基-维持在还原状态gydF4y2BapgydF4y2Ba苯二胺(TMPD)。pH为6.5时,活性为340±80 egydF4y2Ba- - - - - -gydF4y2Ba年代gydF4y2Ba- - - - - -gydF4y2Ba1gydF4y2Ba(8次测量,3次独立制备),即在相同的范围内gydF4y2Ba酿酒酵母gydF4y2Ba文明gydF4y2Ba34gydF4y2Ba.gydF4y2Ba
gdn纯化的CIV产生了适用于使用低温电镜和稳态氧还原分析进行结构研究的均质制剂。然而,在GDN中,只有一小部分CIV被提取出来,如上所述,它部分地与CIII在超络合物中共纯化。因此,纯CIV的产率不足以使用时间分辨光学吸收光谱进行功能分析。因此,我们转而使用洗涤剂n-十二烷基-β- d -麦芽糖苷(DDM)进行增溶和纯化,DDM通常用于其他物种CIVs的纯化策略。使用DDM纯化CIV,得到不含CIII的制剂(补充图SgydF4y2Ba1德gydF4y2Ba)和足以进行功能研究的产量。DDM的活性略低于GDN,为200±40 egydF4y2Ba−gydF4y2Ba年代gydF4y2Ba−gydF4y2Ba1gydF4y2Ba(gydF4y2BangydF4y2Ba= 8,三个独立的制剂),这可能是由于缺少附属亚基Cox12和Cox13(见下文)。gydF4y2Ba
低温电镜结构测定gydF4y2Ba
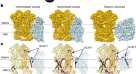
低温电子显微镜gydF4y2Ba美国非洲酒gydF4y2Ba在GDN中纯化的CIV得到了总体分辨率为3.4的图谱Å(图2)。gydF4y2Ba1gydF4y2Ba,补充图。gydF4y2BaS2gydF4y2Ba和表gydF4y2Ba2gydF4y2Ba).该地图允许构建一个原子模型(补充图。gydF4y2BaS3gydF4y2Ba),包含Cox1-9、Cox12和Cox13,整体结构与CIV相似gydF4y2Ba酿酒酵母gydF4y2BaCIII-CIV supercomplexesgydF4y2Ba11gydF4y2Ba,gydF4y2Ba13gydF4y2Ba,gydF4y2Ba14gydF4y2Ba.我们发现了一个额外的密度归因于Rcf2的两个TM α-螺旋(见下文)。质谱BN-PAGE谱带在GDN纯化的CIV中鉴定出Rcf2,而在DDM纯化的CIV中则没有。gydF4y2BaS1gydF4y2Ba).gydF4y2Ba
如补充图所示。gydF4y2BaS4gydF4y2BaCox5a/b的两种异构体gydF4y2Ba酿酒酵母gydF4y2Ba7gydF4y2Ba,gydF4y2Ba25gydF4y2Ba和Cox5的单一异构体gydF4y2Ba美国非洲酒gydF4y2Ba具有相似的结构和高度的序列同源性,除了在C端和n端gydF4y2Ba美国非洲酒gydF4y2BaCox5携带了酶中不存在的额外残基gydF4y2Ba酿酒酵母gydF4y2BaCox5a / b。gydF4y2Ba
低温电镜分析显示,CIV的一个小亚群缺失Cox12、Cox13和Rcf2,这与CIV的Cox12、Cox13和Rcf2相似gydF4y2Ba酿酒酵母gydF4y2Ba在洗洁精n-十一基-β- d -麦芽糖苷(UDM)中分离出CIV的结构模型,并将其交换为amphipolgydF4y2Ba16gydF4y2Ba.这一观察结果表明Cox12、Cox13亚基以及Rcf2在CIV纯化过程中结合松散,可能丢失,这也得到了前人数据的支持gydF4y2Ba26gydF4y2Ba,gydF4y2Ba28gydF4y2Ba,gydF4y2Ba35gydF4y2Ba.gydF4y2Ba
所有氧化还原活性金属辅因子都发现在与其他典型CIVs相同的位置(图。gydF4y2Ba2gydF4y2Ba).如上所述,来自cyt的电子受体。gydF4y2BacgydF4y2BaCugydF4y2Ba一个gydF4y2Ba在Cox2的站点。从铜gydF4y2Ba一个gydF4y2Ba电子被连续地转移到血红素gydF4y2Ba一个gydF4y2Ba血红素gydF4y2Ba一个gydF4y2Ba3.gydF4y2Ba铜gydF4y2BaBgydF4y2Ba在Cox1亚基中发现催化位点。与其他标准CIVs一样,我们在催化位点发现了His247和Tyr251之间的共价连接。通过D和K质子途径参与质子转移的保守可质子残基显示出与其他典型CIV结构相似的位置gydF4y2Ba1gydF4y2Ba,gydF4y2Ba7gydF4y2Ba.gydF4y2Ba
一个gydF4y2Ba四个磷脂酰乙醇胺(PE)分子的密度得到了明确的解决。氧化还原活性金属位点为CugydF4y2Ba一个gydF4y2Ba,血红素gydF4y2Ba一个gydF4y2Ba还有血红素gydF4y2Ba一个gydF4y2Ba3.gydF4y2Ba铜gydF4y2BaBgydF4y2Ba催化部位。Non-redox-active锌gydF4y2Ba2 +gydF4y2Ba、钙gydF4y2Ba2 +gydF4y2Ba和毫克gydF4y2Ba2 +gydF4y2Ba网站的模型在文本中讨论。gydF4y2BabgydF4y2BaCox3 v型裂中的三种PE脂质(见正文)。gydF4y2Ba
除了氧化还原活性辅因子外,还观察到几种非氧化还原活性蛋白结合金属离子的密度(图2)。gydF4y2Ba2gydF4y2Ba),与先前对哺乳动物和细菌CIV的观察结果一致。一种锰gydF4y2Ba2 +gydF4y2Ba/毫克gydF4y2Ba2 +gydF4y2Ba(取决于生长介质的金属含量),这里用Mg表示gydF4y2Ba2 +gydF4y2Ba,在催化位点附近被识别gydF4y2Ba3.gydF4y2Ba,gydF4y2Ba11gydF4y2Ba,gydF4y2Ba36gydF4y2Ba,gydF4y2Ba37gydF4y2Ba.CagydF4y2Ba2 +gydF4y2Ba/ NagydF4y2Ba+gydF4y2Ba站点,在这里被建模为CagydF4y2Ba2 +gydF4y2Ba,在Cox1亚基中发现gydF4y2Ba3.gydF4y2Ba,gydF4y2Ba11gydF4y2Ba,gydF4y2Ba37gydF4y2Ba,gydF4y2Ba38gydF4y2Ba.另外,一个ZngydF4y2Ba2 +gydF4y2Ba离子在Cox4中建模gydF4y2Ba3.gydF4y2Ba,gydF4y2Ba11gydF4y2Ba.gydF4y2Ba
就像gydF4y2Ba酿酒酵母gydF4y2Ba和许多其他文明,在gydF4y2Ba美国非洲酒gydF4y2BaCox 3亚基由7个TM α-螺旋组成,分别形成由2螺旋束和5螺旋束定义的v型裂缝。裂缝中含有紧密结合的脂质分子,在晶体和低温电镜结构中分解。gydF4y2Bab .金牛座gydF4y2Ba,gydF4y2Bap . denitrificansgydF4y2Ba,gydF4y2Bar . sphaeroidesgydF4y2Ba或gydF4y2Ba酿酒酵母gydF4y2Ba6gydF4y2Ba,gydF4y2Ba11gydF4y2Ba,gydF4y2Ba13gydF4y2Ba.在当前gydF4y2Ba美国非洲酒gydF4y2Ba结构模型基于图谱解释和与先前结构的相似性,将Cox3中的三种脂质建模为磷脂酰乙醇胺(PE)。gydF4y2Ba2 bgydF4y2Ba).在Cox2的两个跨膜螺旋之间发现了一个额外PE分子的密度,其位置与先前在gydF4y2Ba酿酒酵母gydF4y2Ba文明gydF4y2Ba11gydF4y2Ba,gydF4y2Ba13gydF4y2Ba.在研究中gydF4y2Ba酿酒酵母gydF4y2Ba在Cox1和Cox5上也发现了一些脂质,在与CIII的界面附近或附近。在gydF4y2Ba美国非洲酒gydF4y2BaCIV中,我们发现弥散的脂质密度在相似的位置,即在Cox1和Cox5的表面。然而,这些密度并不占相同的位置,在gydF4y2Ba酿酒酵母gydF4y2Ba超级复杂,它们太弱了,无法令人满意地建模。gydF4y2Ba
的低温电镜结构gydF4y2Ba酿酒酵母gydF4y2Ba超复合体也鉴定出Cox26亚基gydF4y2Ba11gydF4y2Ba,gydF4y2Ba12gydF4y2Ba.然而,在gydF4y2Ba美国非洲酒gydF4y2Ba在我们的CIV结构中没有注释的同源蛋白,相应位置也没有密度。此外,先前被认为是复合体I亚基的蛋白NDUFA4被认为是CIV亚基gydF4y2Ba39gydF4y2Ba,gydF4y2Ba40gydF4y2Ba(但请参阅参考文献。gydF4y2Ba41gydF4y2Ba).在gydF4y2Ba美国非洲酒gydF4y2Ba基因SPCC417.16被注释为Ndufa4A蛋白的同源蛋白,然而,没有观察到可以解释该蛋白的密度。gydF4y2Ba
呼吸超复杂因子的结合gydF4y2Ba
三种Rcf变体,Rcf1-3已经被鉴定出来,最初被认为参与了CIII-CIV超复合体的形成gydF4y2Ba酿酒酵母gydF4y2Ba26gydF4y2Ba,gydF4y2Ba27gydF4y2Ba,gydF4y2Ba28gydF4y2Ba,gydF4y2Ba29gydF4y2Ba,gydF4y2Ba42gydF4y2Ba,gydF4y2Ba43gydF4y2Ba,gydF4y2Ba44gydF4y2Ba.然而,最近的数据表明,Rcf1参与了CIV的组装和调节gydF4y2Ba30.gydF4y2Ba,gydF4y2Ba45gydF4y2Ba,gydF4y2Ba46gydF4y2Ba,gydF4y2Ba47gydF4y2Ba.gydF4y2Ba
Rcf1和Rcf2含有一个保守的缺氧诱导基因结构域1 (HIG1)gydF4y2Ba26gydF4y2Ba,gydF4y2Ba48gydF4y2Ba,gydF4y2Ba49gydF4y2Ba,gydF4y2Ba50gydF4y2Ba,gydF4y2Ba51gydF4y2Ba(补充图。gydF4y2BaS5gydF4y2Ba).Rcf2是一种真菌特异性蛋白,其HIG1结构域位于c端。此外,Rcf2含有一个约100个氨基酸残基组成的子结构域,在n端形成两个TM α-螺旋gydF4y2Ba32gydF4y2Ba,gydF4y2Ba33gydF4y2Ba.最近确定的低温电子显微镜结构gydF4y2Ba酿酒酵母gydF4y2Ba含有cox5b的超络合物发现,Rcf2的两个hig1结构域TM α-螺旋主要与Cox3结合,但也与Cox13相互作用gydF4y2Ba13gydF4y2Ba这与生化研究的结果一致gydF4y2Ba26gydF4y2Ba,gydF4y2Ba28gydF4y2Ba,gydF4y2Ba30.gydF4y2Ba,gydF4y2Ba52gydF4y2Ba,gydF4y2Ba53gydF4y2Ba.Rcf2的另一个c端部分形成了一个α-螺旋,与Cox12结合gydF4y2BapgydF4y2Ba膜的-侧(膜间隙)。gydF4y2Ba
我们发现了一个密度归因于两个TM α-螺旋gydF4y2Ba美国非洲酒gydF4y2Ba在同一位置的文明gydF4y2Ba酿酒酵母gydF4y2BaCIIIgydF4y2Ba2gydF4y2Ba文明gydF4y2Ba1/2gydF4y2Basupercomplex。这一密度可以令人信服地模拟为Rcf2的两个HIG1 TM α-螺旋。α-螺旋在Cox12附近的密度gydF4y2BapgydF4y2Ba我们认为是Rcf2的膜的-侧也可见于gydF4y2Ba美国非洲酒gydF4y2Ba文明。然而,它缺乏足够的分辨率来识别氨基酸侧链,因此被建模为聚丙氨酸肽。这个螺旋和Rcf2的跨膜部分之间的连接没有被解决。的gydF4y2Ba美国非洲酒gydF4y2BaRcf2包含一个额外的21个残基环(补充图。gydF4y2BaS5gydF4y2Ba),不存在于gydF4y2Ba酿酒酵母gydF4y2Ba在跨膜HIG1结构域和Cox12附近的α螺旋之间。这个额外的环在低温电镜图中没有看到,因此可能是灵活的。的结构gydF4y2Ba酿酒酵母gydF4y2Ba具有束缚Rcf2的超络合物gydF4y2Ba美国非洲酒gydF4y2BaRcf2的n端域未解析。这一观察结果表明,它是经过加工的Rcf2的c端形式gydF4y2Ba13gydF4y2Ba,gydF4y2Ba29gydF4y2Ba形成成熟文明的一部分。此外,这些数据表明,Rcf2的c端HIG1结构域不仅与CIII-CIV超复合物有关,而且与单体CIV有关gydF4y2Ba13gydF4y2Ba,gydF4y2Ba29gydF4y2Ba,gydF4y2Ba51gydF4y2Ba).gydF4y2Ba
Hig1家族可以分为两个亚群,1型和2型,其中Rcf1和Rcf2都是Hig1 2型亚群的一部分。该亚组的特征是存在所谓的QRRQ基序(补充图。gydF4y2BaS5gydF4y2Ba).基序中的第一个Q和R不是完全保守的,但最后两个残基R和Q在所有Hig1 2型成员中都是完全保守的gydF4y2Ba30.gydF4y2Ba.gydF4y2Ba
的gydF4y2Ba美国非洲酒gydF4y2BaCIV结构模型显示,完全保守的QRRQ基序的第二个R (R143)和Q (Q147)与Cox3的Asp254之间存在特定的相互作用(图2)。gydF4y2Ba3gydF4y2Ba),在《文明》中是高度保守的残留物。之前讨论过与Cox13的相互作用gydF4y2Ba16gydF4y2Ba在我们的结构模型中看不清楚。Rcf1中的等效QRRQ基序被证明参与了与CIV的调控相互作用gydF4y2Ba30.gydF4y2Ba.为了测试Rcf1是否会与Rcf2在同一位置绑定到CIV,我们创建了一个AlphaFold-Multimer (AF-M)模型gydF4y2Ba54gydF4y2Ba,gydF4y2Ba55gydF4y2BaCox3, Cox13和Rcf1。作为对照,我们还建立了Cox3、Cox13和Rcf2的Hig1结构域的AF-M模型。后一种模型基本上与低温电磁结构模型相同。对比Rcf1-Cox3-Cox13和Rcf2-Cox3-Cox13 AF-M模型可以发现,两种rcf蛋白的两个HIG1 TM α-螺旋结合在相同的位置(图2)。gydF4y2Ba3 bgydF4y2Ba), QRRQ motif相对于Asp254的定位相同(图。gydF4y2Ba3 cgydF4y2Ba).所有跨膜区均显示plDDT >90,预测准确率较高。有趣的是,保守的HIG1片段出现在Rcf1的n端,而在Rcf2的c端。因此,在与CIV相关时,两个Rcf蛋白的额外部分将暴露在相对于HIG1结构域的不同位置gydF4y2Ba33gydF4y2Ba).因此,我们的数据表明Rcf1或Rcf2不能同时与CIV结合,并解释了分别与Rcf1或Rcf2结合时功能效应的差异。gydF4y2Ba15gydF4y2Ba).gydF4y2Ba
Rcf1或Rcf2与Cox3的相互作用是静电起源的一部分(图3)。gydF4y2Ba3 dgydF4y2Ba),通过Cox3保守的Asp254和Rcf2 QRRQ基序的Arg143/Gln147介导。gydF4y2BaS5gydF4y2Ba).我们还注意到Rcf2而不是Rcf1被绑定到完全组装和活动的CIV上gydF4y2Ba酿酒酵母gydF4y2Ba13gydF4y2Ba而且gydF4y2Ba美国非洲酒gydF4y2Ba.我们认为,在CIV组装后期,Rcf2在Cox3位点的结合可能涉及Rcf1组装因子与成熟CIV的分离。在同一位置结合Rcf2可以保护Cox3带电的膜暴露表面。gydF4y2Ba
Hayashi等人。gydF4y2Ba56gydF4y2Ba鉴定Higd1a为牛心脏CIV的调控成分。然而,Higd1a属于缺氧诱导基因结构域的1型亚群,不含QRRQ基序。模拟研究将Higd1a结构域置于与Rcf2不同的位置。此外,哺乳动物CIV通常以二聚体形式分离gydF4y2Ba57gydF4y2Ba单体-单体界面位于本工作中确定的Rcf2的等效位置。gydF4y2Ba
配体结合完全还原gydF4y2Ba美国非洲酒gydF4y2Ba文明gydF4y2Ba
减少血红素gydF4y2Ba一个gydF4y2Ba3.gydF4y2Ba在没有氧的情况下与CO结合gydF4y2Ba2gydF4y2Ba.的CO-FegydF4y2Ba2 +gydF4y2Ba键是光敏的,在脉冲照明CO解离(在吸光度增加gydF4y2BatgydF4y2Ba= 0,图。gydF4y2Ba4gydF4y2Ba),其次是重组(吸光度降低)。co重组动力学反映了催化位点的完整性。在gydF4y2Ba美国非洲酒gydF4y2BaCIV这种重组动力学是单相的,时间常数为6.9±0.2 ms(平均25迹),这表明制备是均匀的。时间常数与从其他物种的CIVs中观察到的时间常数相似gydF4y2Ba58gydF4y2Ba,gydF4y2Ba59gydF4y2Ba,gydF4y2Ba60gydF4y2Ba.gydF4y2Ba
一个gydF4y2Ba在闪光诱导CO从完全还原的酶解离后,在445 nm处监测吸光度变化。gydF4y2BabgydF4y2Baco重组组分的动力学差谱(闭圆)gydF4y2Ba一个gydF4y2Ba)和用分光光度计记录的还原-还原一氧化碳状态的差谱。实验条件:50 mM KHgydF4y2Ba2gydF4y2Ba阿宝gydF4y2Ba4gydF4y2Ba, pH 8, 150 mM KCl, 0.05% DDM, 2 mM抗坏血酸盐和1µM PMS(氧化还原介质),1.2 mM CO。CIV浓度为~1µM,所有痕量均缩放为1µM反应酶。运动轨迹在(gydF4y2Ba一个gydF4y2Ba)平均有25条痕迹。gydF4y2Ba
数字gydF4y2Ba4 bgydF4y2Ba显示了co -重组动力学差异谱,即co -重组吸光度振幅随波长变化的曲线。这一动力学差谱与血红素重叠gydF4y2Ba一个gydF4y2Ba3.gydF4y2Ba2 +gydF4y2Ba-minus-hemegydF4y2Ba一个gydF4y2Ba3.gydF4y2Ba2 +gydF4y2Ba-CO吸光度差谱,表明脉冲照射CIV-CO配合物后,CIV中没有发生额外的过程。gydF4y2Ba
早期的研究gydF4y2Ba酿酒酵母gydF4y2BaCIV揭示了co重组动力学中的其他成分,这可以用不同结构的CIV亚群来解释gydF4y2Ba60gydF4y2Ba,gydF4y2Ba61gydF4y2Ba.和哺乳动物文明一样gydF4y2Ba58gydF4y2Ba,gydF4y2Ba59gydF4y2Ba,gydF4y2Ba美国非洲酒gydF4y2BaCIV显示单相CO重组(图;gydF4y2Ba4gydF4y2Ba)和相似的静态和动力学共约减约差谱(图;gydF4y2Ba4 bgydF4y2Ba),说明洗涤剂的增溶性gydF4y2Ba美国非洲酒gydF4y2Ba膜产生的CIV制剂比来自的更均匀gydF4y2Ba酿酒酵母gydF4y2Ba.gydF4y2Ba
完全还原反应gydF4y2Ba美国非洲酒gydF4y2Ba含氧CIVgydF4y2Ba
采用所谓的“流闪”技术研究了还原CIV与OgydF4y2Ba2gydF4y2Ba62gydF4y2Ba,gydF4y2Ba63gydF4y2Ba,gydF4y2Ba64gydF4y2Ba.四电子还原CIV,催化位点被CO阻断在血红素处gydF4y2Ba一个gydF4y2Ba3.gydF4y2Ba与氧饱和缓冲液迅速混合。CIV-CO配合物的脉冲照明导致CO的解离,如图中时间为0时,在445 nm处的吸光度迅速增加。gydF4y2Ba5gydF4y2Ba.CO配体的解离使OgydF4y2Ba2gydF4y2Ba与血红素结合gydF4y2Ba一个gydF4y2Ba3.gydF4y2Ba在1mm O下,时间常数为~10µsgydF4y2Ba2gydF4y2Ba,可见在445 nm处吸光度迅速下降(图;gydF4y2Ba5gydF4y2Ba).O的绑定gydF4y2Ba2gydF4y2Ba血红素的电子转移是否及时跟进gydF4y2Ba一个gydF4y2Ba到达催化位点,导致过氧的形成,gydF4y2BaPgydF4y2BaRgydF4y2Ba在445 nm、580 nm和605 nm处的吸光度进一步下降(图2)。gydF4y2Ba5 a - cgydF4y2Ba).在下一步中,质子从gydF4y2BangydF4y2Ba在形成铁基的催化位点一侧,gydF4y2BaFgydF4y2Ba,当时间常数为~150µs时,在580 nm处吸光度增加(图2)。gydF4y2Ba5 bgydF4y2Ba,吸光度在0.1 ~ 0.3 ms时间范围内增加)。这个反应在时间上与铜的分数电子转移有关gydF4y2Ba一个gydF4y2Ba以血红素gydF4y2Ba一个gydF4y2Ba,可见605 nm处吸光度下降(图;gydF4y2Ba5度gydF4y2Ba).在最后一步中,第四个电子转移到催化位点,时间常数为~ 2ms,形成氧化态,gydF4y2BaOgydF4y2Ba(吸光度在1-5毫秒的时间范围内下降)。这个反应伴随着质子从gydF4y2BangydF4y2Ba一边gydF4y2Ba65gydF4y2Ba.每一个gydF4y2BaPgydF4y2BaRgydF4y2Ba→gydF4y2BaFgydF4y2Ba而且gydF4y2BaFgydF4y2Ba→gydF4y2BaOgydF4y2Ba过渡反应与质子泵穿过膜有关gydF4y2Ba66gydF4y2Ba,gydF4y2Ba67gydF4y2Ba.观察到吸光度的变化gydF4y2Ba美国非洲酒gydF4y2BaCIV与其它特征良好的CIV表现出相同的模式gydF4y2BaRgydF4y2Ba→gydF4y2BaPgydF4y2BaRgydF4y2Ba→gydF4y2BaFgydF4y2Ba→gydF4y2BaOgydF4y2Ba与其他物种的CIV在相同的范围内(表gydF4y2Ba3.gydF4y2Ba).所获得的数据gydF4y2Ba美国非洲酒gydF4y2Ba与哺乳动物的CIV更相似gydF4y2Ba酿酒酵母gydF4y2Ba文明在那gydF4y2BaFgydF4y2Ba→gydF4y2BaOgydF4y2Ba前两者的反应是单相的,而后者的反应是双相的gydF4y2Ba酿酒酵母gydF4y2Ba文明gydF4y2Ba64gydF4y2Ba.gydF4y2Ba
完全还原的CIV与O混合后,CO在闪光光解后吸光度的变化gydF4y2Ba2gydF4y2Ba(在gydF4y2BatgydF4y2Ba= -200 ms)和CO的闪光光解(atgydF4y2BatgydF4y2Ba= 0),测量波长为445 nm (gydF4y2Ba一个gydF4y2Ba), 580纳米(gydF4y2BabgydF4y2Ba)及605纳米(gydF4y2BacgydF4y2Ba).实验条件:25mm KHgydF4y2Ba2gydF4y2Ba阿宝gydF4y2Ba4gydF4y2Ba, pH 7.5, 150 mM KCl, 0.1 mM EDTA, 0.05 % DDM, 0.85 mM OgydF4y2Ba2gydF4y2Ba, 1.4 μ m civ。激光伪影由于激光闪光击中探测器在gydF4y2BatgydF4y2Ba= 0已被截断。数据平均超过3(面板)gydF4y2Ba一个gydF4y2Ba而且gydF4y2BacgydF4y2Ba)或13(面板gydF4y2BabgydF4y2Ba)的痕迹。这些平均值通过5个点的平均值进行平滑处理。所有的痕迹都被缩放到1µM反应酶。gydF4y2Ba
洗涤剂对CIV催化活性的影响gydF4y2Ba
在低温电镜研究中使用的洗涤剂GDN含有类固醇亲脂基团gydF4y2Ba68gydF4y2Ba,可以结合并抑制CIV的活性gydF4y2Ba69gydF4y2Ba,gydF4y2Ba70gydF4y2Ba.最近的一项结合冷冻电镜、动力学和分子模拟研究表明,GDN和胆固醇类似物半琥珀酸胆固醇结合在哺乳动物CIV的K途径附近,并在CIV降低时抑制质子转移gydF4y2Ba71gydF4y2Ba.gydF4y2Ba
当测量缓冲液中存在GDN时,也观察到类似的抑制作用gydF4y2Ba美国非洲酒gydF4y2Ba文明。数字gydF4y2Ba6gydF4y2Ba显示O的测量值gydF4y2Ba2gydF4y2Ba用GDN(灰色)或DDM(蓝色)纯化的样品,浓缩,然后稀释在含有不同浓度的两种洗涤剂的缓冲液中(图中称为“测量”)。gydF4y2Ba6 a、bgydF4y2Ba).在DDM中纯化的CIV在DDM中的活性为200±40 egydF4y2Ba−gydF4y2Ba年代gydF4y2Ba−gydF4y2Ba1gydF4y2Ba(gydF4y2BangydF4y2Ba= 9,三种独立制剂)(图;gydF4y2Ba6 bgydF4y2Ba本次测量使用0.05% DDM代替0.01% DDM,以保持与纯化时使用的洗涤剂浓度相同,然后考察添加GDN的效果)。然而,当ddm纯化酶在GDN(蓝色,0.01% GDN)中稀释时,活性下降到40±5 egydF4y2Ba−gydF4y2Ba年代gydF4y2Ba−gydF4y2Ba1gydF4y2Ba(gydF4y2BangydF4y2Ba= 9,三个独立的制剂),可能是由于GDN的类固醇部分与CIV结合。gdn纯化的CIV比ddm纯化样品的活性高(340±80 e)gydF4y2Ba−gydF4y2Ba年代gydF4y2Ba−gydF4y2Ba1gydF4y2Ba(gydF4y2BangydF4y2Ba= 8, 3个独立制剂)中GDN(灰色,0.01% GDN)。活度增加到440±90 egydF4y2Ba−gydF4y2Ba年代gydF4y2Ba−gydF4y2Ba1gydF4y2Ba(gydF4y2BangydF4y2Ba= 8,三种独立制剂),在DDM缓冲液(灰色,0.01% DDM)中稀释gdn纯化的CIV。这种活性的增加归因于从CIV的一部分中去除结合的GDN。gydF4y2Ba
一个gydF4y2BaO的浓度gydF4y2Ba2gydF4y2Ba作为CIV加入时间的函数(9 nM预孵育于50 mM KHgydF4y2Ba2gydF4y2Ba阿宝gydF4y2Ba4gydF4y2Ba, pH值6.5,在洗涤剂中标记为“纯化在”)到含有10 mM抗坏血酸盐,50 μ M cyt的氧描记室。gydF4y2BacgydF4y2Ba, 0.1毫米TMPD, 50毫米KHgydF4y2Ba2gydF4y2Ba阿宝gydF4y2Ba4gydF4y2BapH值为6.5 (DDM或GDN如“测量”所示)。将加入CIV前记录的背景斜率与加入CIV后测量的背景斜率相减。差异显示在面板上gydF4y2BabgydF4y2Ba.所示为与标准差(gydF4y2BangydF4y2Ba= 8-9,三个独立的制剂)。gydF4y2Ba
图中数据。gydF4y2Ba6gydF4y2Ba结果表明,GDN抑制CIV活性,但在DDM中初始纯化时,这种作用比在GDN中更明显。我们最初推测,如果类固醇结合位点在天然膜中被占据,并且只有在DDM处理后才可被GDN结合,则可以解释这种效应。该位点将继续占据GDN,从而阻止GDN甾体部分的结合。然而,对gdn纯化的CIV的冷冻电镜结构的详细分析没有揭示哺乳动物CIV中发现的类固醇结合位点的任何密度。因此,我们建议在DDM中进行纯化,去除表面脂质,使其能够进入洗涤剂纯化的CIV中的类固醇结合位点。使用较弱的GDN洗涤剂进行纯化,使酶与阻断脂质结合,这允许GDN仅在CIV的一小部分中结合在类固醇结合位点。gydF4y2Ba
用GDN纯化CIV,将DDM浓度从0.01 %增加到0.05 %,OgydF4y2Ba2gydF4y2Ba-还原翻转活性随着时间的增加逐渐降低(补充图;gydF4y2BaS6gydF4y2Ba).我们推测,这种行为是由于Cox12和Cox13亚基的丢失,这些亚基松散结合,并可能在暴露于DDM后解离gydF4y2Ba16gydF4y2Ba.类似的行为,被称为自杀失活,之前观察到与gydF4y2Bar . sphaeroidesgydF4y2BaCIV,在Cox3亚基解离后gydF4y2Ba72gydF4y2Ba和哺乳动物文明gydF4y2Ba73gydF4y2Ba,gydF4y2Ba74gydF4y2Ba这种行为归因于脂质的损失和Cox3的游离。gydF4y2Ba
结论gydF4y2Ba
在这项工作中,我们结合使用低温电子显微镜和光谱学来研究呼吸复合体IV的结构和功能gydF4y2Ba美国非洲酒gydF4y2Ba.数据表明,减少了gydF4y2Ba美国非洲酒gydF4y2Ba文明反应与OgydF4y2Ba2gydF4y2Ba沿着与其他先前研究的CIVs相同的轨迹。CIV的低温电镜结构表明,该酶由11个亚基组成。此外,我们观察到Rcf2的结合域Hig1,即在没有CIII的情况下,Rcf2也能与CIV结合。AF-M模型表明,Rcf1和Rcf2在CIV的Cox3和Cox13的相同位置与它们的Hig1结构域片段结合。该模型表明,Rcf1或Rcf2在CIV上的结合是互斥的,因此Rcf2的结合需要Rcf1组装因子的解离。此外,结果表明,Rcf1和Rcf2的差异功能效应分别是由CIV与Rcf2和Rcf1在n端和c端扩展的独特结构域相互作用引起的。gydF4y2Ba
方法gydF4y2Ba
CIV引入净化标签gydF4y2Ba
在Cox4、Cox5、Cox6或Cox13的c端遗传引入双链球菌标记(表2)gydF4y2BaS1gydF4y2Ba)在亲本品系FY7507 (L972,gydF4y2BahgydF4y2Ba-gydF4y2Ba,由日本NBRP (YGRC)提供),采用改良的两步PCR方法,见参考文献。gydF4y2Ba75gydF4y2Ba,gydF4y2Ba76gydF4y2Ba.在PCR1中使用0.4 μ M的引物生成350-510 bp的侧翼区域gydF4y2BaS2gydF4y2Ba), 225 ng基因组DNA(分离自FY7507株,参考文献。gydF4y2Ba77gydF4y2Ba, 0.2 mM dNTPs和1.25 U pfu聚合酶(Thermo Scientific)。在PCR2;以50 ng质粒pTF277 (pFA6a-TEV-6xGly-2xStrep-KanMX,添加基因质粒44094)为模板,PCR1的产物和外侧边引物用于PCR1。Taq:pfu聚合酶(15:1)与Taq硫酸铵缓冲液和2.5 mM MgCl混合使用gydF4y2Ba2gydF4y2Ba.gydF4y2Ba
根据引用执行转换。gydF4y2Ba75gydF4y2Ba经过以下修改。使用0.7-0.95µg PCR2产物,每次转化使用40µg单链DNA (Sigma, D9156),样品在30℃下孵育2 h,然后加入DMSO,在42℃下热休克15 min。每个反应200µl被镀在YES-4%葡萄糖板上,这些板被复制镀在YES-5%葡萄糖板上,含有150µg mlgydF4y2Ba−gydF4y2Ba1gydF4y2BaG418(σ)。每种结构的6个菌落重新划到新鲜的YES-5%葡萄糖G418板上。使用表中所列引物,通过菌落PCR和测序(Eurofin基因组学)验证标签插入gydF4y2BaS2gydF4y2Ba.gydF4y2Ba
批量生长和膜制备gydF4y2Ba
补充图SgydF4y2Ba7gydF4y2Ba显示生长和呼吸能力,使用含2%葡萄糖或含0.1%葡萄糖的3%甘油的YES板滴稀释系列进行测试,这已被证明可以促进gydF4y2Ba美国非洲酒gydF4y2Ba生长时仍然依赖呼吸gydF4y2Ba78gydF4y2Ba.所有标记的菌株在葡萄糖上生长良好,而Cox6上生长受损gydF4y2Ba2 xstrepgydF4y2Ba在呼吸条件下(补充图gydF4y2BaS7gydF4y2Ba).Cox4gydF4y2Ba2 xstrepgydF4y2Ba和Cox5gydF4y2Ba2 xstrepgydF4y2Ba与Cox13相比,甘油的生长速度略慢gydF4y2Ba2 xstrepgydF4y2Ba.然而,Cox5gydF4y2Ba2 xstrepgydF4y2Ba膜中含有最多的标记CIV。因此,Cox5gydF4y2Ba2 xstrepgydF4y2Ba菌株用于CIV的批量生长和纯化。gydF4y2Ba
用于CIV表达的发酵剂含有0.5%酵母提取物(YE)、2%葡萄糖和100µg mlgydF4y2Ba−gydF4y2Ba1gydF4y2Ba使用氨苄西林。预培养和大规模培养均含有YE-3%甘油和0.1%葡萄糖。所有孵育步骤均在30°C下进行,同时以200转/分钟的速度摇晃。细胞在水中清洗两次,并在−20°C保存为细胞颗粒直到使用。gydF4y2Ba
通过在0.4 M山梨醇,50 mM KH中重新悬浮细胞制备膜gydF4y2Ba2gydF4y2Ba阿宝gydF4y2Ba4gydF4y2Ba, pH 7.4, 5 mM EDTA和1 mM苯甲基磺酰氟。使用细胞干扰剂(Constant系统,38 kpsi)粉碎细胞悬液两次。细胞碎片在5500 x g下制粒12分钟,膜在12万x g下收集,45型钛转子(Beckman Coulter), 4℃下1小时。膜颗粒在50 mM KH中均质gydF4y2Ba2gydF4y2Ba阿宝gydF4y2Ba4gydF4y2Ba采用改良的Lowry法测定,膜和参比样品中SDS含量为1%gydF4y2Ba79gydF4y2Ba.样品在N液中快速冷冻gydF4y2Ba2gydF4y2Ba存储温度为- 80°C。gydF4y2Ba
GDN中CIV的纯化gydF4y2Ba
膜在4°C下以5 mg ml的浓度溶解过夜gydF4y2Ba−1gydF4y2Ba25mm KHgydF4y2Ba2gydF4y2Ba阿宝gydF4y2Ba4gydF4y2Ba, pH 8.0, 150 mM KCl和1% GDN。不溶性物质在120,000 ×超离心下成粒gydF4y2BaggydF4y2Ba, 45型钛转子(贝克曼Coulter)在4°C 30分钟。将上清液浓缩至约10ml,在无洗涤剂缓冲液中稀释五倍,再次浓缩至10ml,然后应用于用25 mM KH预平衡的StrepTactin超流柱(IBA生命科学)gydF4y2Ba2gydF4y2Ba阿宝gydF4y2Ba4gydF4y2Ba, pH 8和150 mM KCl。柱用25mm KH清洗gydF4y2Ba2gydF4y2Ba阿宝gydF4y2Ba4gydF4y2Ba, pH 8, 150 mM KCl和0.01% GDN在相同的缓冲液中洗脱,补充5 mM去硫生物素。分别在280 nm和420 nm对膜上清液、过流、洗涤和洗脱部分进行分光光度分析(Cary100, Agilent),以测定其蛋白质和CIV含量。含有CIV的洗脱组分使用Amicon Ultra, 100 kDa截断(Millipore)进行汇集和浓缩。样品被注入Superose 6增加柱(GE),用25 mM KH预平衡gydF4y2Ba2gydF4y2Ba阿宝gydF4y2Ba4gydF4y2Ba, pH 8.0, 150 mM KCl, 0.01% GDN,流速0.5 ml mingydF4y2Ba- - - - - -gydF4y2Ba1gydF4y2Ba.gydF4y2Ba
CIV的浓度由还原-氧化谱用ε测定gydF4y2Ba607 - 630gydF4y2Ba= 24mmgydF4y2Ba−1gydF4y2Ba厘米gydF4y2Ba−1gydF4y2Ba.纯化后的蛋白质要么立即使用,要么冷冻在氮液中gydF4y2Ba2gydF4y2Ba存储温度为- 80°C。gydF4y2Ba
DDM中CIV的纯化gydF4y2Ba
利用Cox5纯化CIVgydF4y2Ba2 xstrepgydF4y2Ba在n-dodceyl -maltoside (DDM, Glycon)中进行了如下修改。膜被稀释至最终浓度为2 mg mlgydF4y2Ba−1gydF4y2Ba25mm KHgydF4y2Ba2gydF4y2Ba阿宝gydF4y2Ba4gydF4y2Ba, pH 8.0,最终浓度为150 mM KCl,然后滴加DDM至最终浓度为0.5%,在4°C搅拌45分钟时溶解,然后去除不溶物质。所有纯化缓冲液均含有0.05% DDM而非GDN。gydF4y2Ba
网格准备和低温电子显微镜gydF4y2Ba
gdn纯化的CIV (3 μ l),浓度为~4 mg mlgydF4y2Ba−1gydF4y2Ba应用于多孔碳膜涂覆铜电磁栅格(C平2/2 3 C T50),在空气中发光放电(120秒,20 mA使用PELCO easiGlow)。网格在4°C和100%湿度下吸干3秒,然后用Vitrobot Mark IV(赛默飞世尔科学公司)在液态乙烷中快速冷冻。使用300kv的Titan Krios G3电子显微镜(Thermo Fisher Scientific)收集Cryo-EM数据,配备Gatan BioQuantum能量过滤器和K3 Summit直接电子探测器(AMETEK)。自动数据收集由EPU软件包完成(赛默飞世尔科学公司)。收集了9289部电影的数据集,每个电影由40个曝光分数组成,标称放大倍数为105,000倍,对应于校准的像素大小为0.86 Å。相机曝光率和标本总曝光率为13.0 egydF4y2Ba−gydF4y2Ba像素gydF4y2Ba−1gydF4y2Ba年代gydF4y2Ba−1gydF4y2Ba和~49 egydF4y2Ba−gydF4y2Ba一个gydF4y2Ba−2gydF4y2Ba,分别为(表gydF4y2Ba2gydF4y2Ba).gydF4y2Ba
低温电子显微镜图像处理gydF4y2Ba
所有图像分析均采用cryoSPARC v2进行gydF4y2Ba80gydF4y2Ba.在7 × 7网格下,将电影以斑块对齐,并在斑块中估计对比度传递函数(CTF)参数。数据集被手动整理,以删除有去玻璃化、冰中有大裂缝或CTF拟合参数差的电影,将数据集大小减少到8144部电影。对人工选取的粒子图像进行二维分类,生成粒子选择模板。总共选择了2,609,959个粒子,对图像进行了局部运动校正gydF4y2Ba81gydF4y2Ba并在256 × 256像素盒中提取。数据集首先用2D分类清洗,然后进行几轮从头算3D分类和异构细化,每轮之后只取与CIV对应的类。这一过程进一步将数据集的大小减少到127,659个粒子图像,这些图像经过非均匀细化以生成最终的地图。gydF4y2Ba
模型建立gydF4y2Ba
启动模型由AlphaFold蛋白质结构数据库生成gydF4y2Ba82gydF4y2Ba.Cox1的序列和AlphaFold启动模型是来自菌株L972的Uniprot条目P07657,有537个残基。在地图上发现了400号位置上一个额外提尔人的密度。该残基存在于Uniprot条目A0A516IL59、A0A516ILY3、A0A516IKQ3的Cox1序列中,共有538个残基。额外的Tyr400被包括在模型中。对模型进行了改进gydF4y2Ba83gydF4y2Ba.最后在Phenix中对原子位移参数进行了实空间细化和计算gydF4y2Ba84gydF4y2Ba.gydF4y2Ba
凝胶电泳gydF4y2Ba
蓝色原生PAGE (BN)使用NativePAGE 4-16% (Invitrogen),根据制造商的说明进行,在阳极使用NativePAGE 1X运行缓冲液,NativePAGE 1X运行缓冲液补充NativePAGE 1X阴极缓冲添加剂作为阴极缓冲液(Invitrogen)。凝胶在4°C, 150 V下运行60分钟,然后将阴极缓冲液换成阳极缓冲液,在250 V下再运行40分钟。然后用考马斯亮蓝染色凝胶。对BN PAGE中CIV对应的条带进行质谱分析(LC-MS/MS),胰酶消化,梯度35 min。gydF4y2Ba
氧还原活性gydF4y2Ba
使用Clark型氧电极(Hansatech)在50mm KH中测量稳态翻转活性gydF4y2Ba2gydF4y2Ba阿宝gydF4y2Ba4gydF4y2Ba, pH 6.5,补充DDM或GDN(见图例)。马细胞色素gydF4y2BacgydF4y2Ba(Sigma)(50µM), 10 mM抗坏血酸盐和0.1 mM TMPD在加入浓度为9 nM的CIV之前混合。背景耗氧量记录在加入CIV前,从加入CIV后测得的斜率中减去。gydF4y2Ba
CO-recombination动力学gydF4y2Ba
CIV以最终浓度为1µM添加到由50 mM KH组成的缓冲液中gydF4y2Ba2gydF4y2Ba阿宝gydF4y2Ba4gydF4y2Ba(pH 8), 150 mM KCl, 0.05% DDM和1µM PMS(氧化还原介质)在桑伯格比色皿中。在加入2 mM抗坏血酸盐之前,将试管中的大气在真空线上交换为氮气。在交换氮之前,用分光光度法(Cary 4000)监测还原情况gydF4y2Ba2gydF4y2Ba通过使用10 ns激光闪光(Quantel Brilliant B, Nd-YAG, 532 nm)监测CO配体光解时的吸光度变化,使用闪光光解装置(应用光物理)监测CO重组动力学。使用ε将痕量缩放到1 μ M反应酶gydF4y2Ba445gydF4y2Ba67毫米gydF4y2Ba−1gydF4y2Ba厘米gydF4y2Ba−1gydF4y2Ba85gydF4y2Ba.gydF4y2Ba
完全还原的CIV与氧气的反应gydF4y2Ba
CIV样品用于co重组动力学的测量,但有以下例外。酶在25 mM KH中稀释至5µMgydF4y2Ba2gydF4y2Ba阿宝gydF4y2Ba4gydF4y2Ba, pH 7.5, 150 mM KCl, 0.1 mM EDTA和0.05% DDM,并使用2 mM抗坏血酸盐和1µM PMS还原。完全还原的蛋白质以1:2.5的比例与OgydF4y2Ba2gydF4y2Ba饱和缓冲液(25mm KHgydF4y2Ba2gydF4y2Ba阿宝gydF4y2Ba4gydF4y2Ba, pH 7.5, 150 mM KCl, 0.1 mM EDTA, 0.05% DDM)在一个止流装置(应用光物理)。在混合后200 ms, CO配体通过10 ns激光闪光(Quantel Brilliant B, Nd-YAG, 532 nm)解离。如上所示,监测各个波长的吸光度变化(见图中图例)。gydF4y2Ba5gydF4y2Ba).轨迹被平均、平滑(见图图例)并与指数函数的和进行拟合。gydF4y2Ba
报告总结gydF4y2Ba
有关研究设计的进一步资料,请参阅gydF4y2Ba自然组合报告摘要gydF4y2Ba链接到这篇文章。gydF4y2Ba
数据可用性gydF4y2Ba
低温电镜图和原子坐标已存入电子显微镜数据库和蛋白质数据库,登录号为EMD-16491和PDB 8C8Q(也可作为补充数据)gydF4y2Ba1gydF4y2Ba),分别。gydF4y2Ba
参考文献gydF4y2Ba
Rich, P. R. & Maréchal, A.质子动力细胞色素中亲水通道的功能gydF4y2BacgydF4y2Ba氧化酶。gydF4y2BaJ. R. Soc接口。gydF4y2Ba10gydF4y2Ba, 183-196(2013)。gydF4y2Ba
Wikström, M., Sharma, V., Kaila, V. R. I., Hosler, J. P. & Hummer, G.细胞呼吸质子泵的新观点。gydF4y2Ba化学。牧师。gydF4y2Ba115gydF4y2Ba, 2196-2221(2015)。gydF4y2Ba
辻原,T.等人。13亚基氧化细胞色素的整体结构gydF4y2BacgydF4y2Ba氧化酶2.8 Å。gydF4y2Ba科学gydF4y2Ba272gydF4y2Ba, 1136-1144(1996)。gydF4y2Ba
Iwata, S., Ostermeier, C., Ludwig, B.和Michel, H. 2.8 Å分辨率的细胞色素结构gydF4y2BacgydF4y2Ba氧化酶的gydF4y2Ba副球菌denitrificansgydF4y2Ba.gydF4y2Ba自然gydF4y2Ba376gydF4y2Ba, 660-669(1995)。gydF4y2Ba
Shinzawa-Itoh, K.等人。牛心脏细胞色素c氧化酶13个整体脂类的结构及生理作用。gydF4y2BaEMBO J。gydF4y2Ba26gydF4y2Ba, 1713-1725(2007)。gydF4y2Ba
秦,L., Sharpe, M. A., Garavito, R. M. & Ferguson-Miller, S.膜蛋白中保守的脂质结合位点:细胞色素的研究gydF4y2BacgydF4y2Ba氧化酶。gydF4y2Ba咕咕叫。当今。结构体。医学杂志。gydF4y2Ba17gydF4y2Ba, 444-450(2007)。gydF4y2Ba
Maréchal, A.,默尼耶,B.,李,D.,奥伦戈,C. & Rich, p.r.酵母细胞色素gydF4y2BacgydF4y2Ba氧化酶:一个模型系统,以研究线粒体形式的铜氧化酶超家族。gydF4y2BaBiochim。Biophys。学报。gydF4y2Ba1817gydF4y2Ba, 620-628(2012)。gydF4y2Ba
Geier, B. M.等。用一种新的大规模纯化方法从酿酒酵母中分离出的11亚基细胞色素c氧化酶的动力学性质和配体结合。gydF4y2Ba欧元。学生物化学j。gydF4y2Ba227gydF4y2Ba, 296-302(1995)。gydF4y2Ba
Strecker, V.等人。超复合物相关的Cox26蛋白与细胞色素结合gydF4y2BacgydF4y2Ba氧化酶。gydF4y2BaBiochim。Biophys。学报。gydF4y2Ba1863gydF4y2Ba, 1643-1652(2016)。gydF4y2Ba
列夫琴科,等人。Cox26是酵母细胞色素的一个新的化学计量亚基gydF4y2BacgydF4y2Ba氧化酶。gydF4y2BaBiochim。Biophys。学报。gydF4y2Ba1863gydF4y2Ba, 1624-1632(2016)。gydF4y2Ba
哈特利,a.m.等。酵母细胞色素的结构gydF4y2BacgydF4y2Ba氧化酶与细胞色素的超络合物gydF4y2Ba公元前gydF4y2Ba1gydF4y2Ba.gydF4y2BaNat。结构。摩尔。杂志。gydF4y2Ba26gydF4y2Ba, 78-83(2019)。gydF4y2Ba
拉索尔等人。酵母呼吸超复合体的冷冻电镜结构。gydF4y2BaNat。结构。摩尔。杂志。gydF4y2Ba26gydF4y2Ba, 50-57(2019)。gydF4y2Ba
Hartley, a.m., Meunier, B., Pinotsis, N. & Maréchal, A. Rcf2在成熟线粒体III-IV超复合体缺氧异构体的低温电镜结构中显示。gydF4y2Ba国家科学院学报gydF4y2Ba117gydF4y2Ba, 9329-9337(2020)。gydF4y2Ba
Moe, A., Trani, J. D., Rubinstein, J. L. & Brzezinski, P. Cryo-EM结构和动力学揭示了细胞色素二维扩散的电子转移gydF4y2BacgydF4y2Ba在酵母III-IV呼吸超复合体中gydF4y2Ba国家科学院学报gydF4y2Ba118gydF4y2Ba, e2021157118(2021)。2021157111 - e2021157119。gydF4y2Ba
布热津斯基,P., Moe, A. & Ädelroth, P.生物能量膜中呼吸III-IV超复合物的结构和机制。gydF4y2Ba化学。牧师。gydF4y2Ba121gydF4y2Ba, 9644-9673(2021)。gydF4y2Ba
Ing, G., Hartley, a.m, Pinotsis, N. & Maréchal, a .用麦芽糖苷分离的单体酵母S. cerevisiae复合物IV的冷冻电镜结构:超复合物形成的意义。gydF4y2BaBiochim。Biophys。学报。gydF4y2Ba1863gydF4y2Ba, 148591(2022)。gydF4y2Ba
Forsburg, S. L.最好的酵母?gydF4y2Ba趋势麝猫。gydF4y2Ba15gydF4y2Ba, 340-344(1999)。gydF4y2Ba
海尔斯,J.和护士,P.介绍裂变酵母作为模型系统。gydF4y2Ba冷泉港。Protoc。gydF4y2Ba2018gydF4y2Ba, 323-333(2018)。gydF4y2Ba
帕奎因等人。真菌线粒体基因组计划:真菌线粒体基因组的进化及其基因表达。gydF4y2Ba咕咕叫。麝猫。gydF4y2Ba31gydF4y2Ba, 380-395(1997)。gydF4y2Ba
Wainright, P. O., Hinkle, G., Sogin, M. L. & Stickel, S. K.后生动物的单系起源:与真菌的进化联系。gydF4y2Ba科学gydF4y2Ba260gydF4y2Ba, 340-342(1993)。gydF4y2Ba
模型单细胞真核生物,裂糖酵母。gydF4y2Ba基因组医学杂志。gydF4y2Ba3.gydF4y2Ba, 2003.2001-2003.2004(2002)。gydF4y2Ba
Schäfer, B.线粒体的遗传保护与变异性:小阴性酵母裂糖酵母(Schizosaccharomyces pombe)线粒体基因组的结构。gydF4y2Ba咕咕叫。麝猫。gydF4y2Ba43gydF4y2Ba, 311-326(2003)。gydF4y2Ba
伍德,V.等。裂糖酵母的基因组序列。gydF4y2Ba自然gydF4y2Ba415gydF4y2Ba, 871-880(2002)。gydF4y2Ba
霍夫曼,C. S.伍德,V. & Fantes, P. A.年轻遗传学家的古老酵母:庞贝裂糖酵母模型系统的入门。gydF4y2Ba遗传学gydF4y2Ba201gydF4y2Ba, 403-423(2015)。gydF4y2Ba
伯克,P. V.,瑞特,D. C.,艾伦,L. A.,凯洛格,E. A. &波伊顿,R. O.氧浓度对细胞色素表达的影响gydF4y2BacgydF4y2Ba和细胞色素gydF4y2BacgydF4y2Ba酵母中的氧化酶基因。gydF4y2Ba生物。化学。gydF4y2Ba272gydF4y2Ba, 14705-14712(1997)。gydF4y2Ba
Strogolova, V., Furness, A., Micaela, M. R., Garlich, J. & Stuart, R. A. Rcf1和Rcf2是缺氧诱导基因1蛋白家族的成员,是线粒体细胞色素的关键组成部分gydF4y2Ba公元前gydF4y2Ba1gydF4y2Ba细胞色素gydF4y2BacgydF4y2Ba氧化酶supercomplex。gydF4y2Ba摩尔。细胞。医学杂志。gydF4y2Ba32gydF4y2Ba, 1363-1373(2012)。gydF4y2Ba
陈,Y. C.等。一种调节呼吸超复合物稳定性的蛋白的鉴定。gydF4y2Ba细胞。gydF4y2Ba15gydF4y2Ba, 348-360(2012)。gydF4y2Ba
Vukotic, M.等人。Rcf1介导细胞色素氧化酶组装和呼吸小体形成,揭示了酶复合物的异质性。gydF4y2Ba细胞Metabol。gydF4y2Ba15gydF4y2Ba, 336-347(2012)。gydF4y2Ba
Römpler, K.等。呼吸超复杂因子Rcf2及其n端同源物Rcf3在gydF4y2Ba酿酒酵母gydF4y2Ba.gydF4y2Ba生物。化学。gydF4y2Ba291gydF4y2Ba, 23769-23778(2016)。gydF4y2Ba
Garlich, J., Strecker, V., Wittig, I. & Stuart, R. a .酵母hig1 2型蛋白Rcf1中QRRQ motif的突变分析揭示了细胞色素c氧化酶复合物的调节作用。gydF4y2Ba生物。化学。gydF4y2Ba292gydF4y2Ba, 5216-5226(2017)。gydF4y2Ba
Strogolova, V., Hoang, N. H., Hosler, J. & Stuart, R. A.酵母线粒体蛋白Rcf1和Rcf2支持细胞色素的酶学gydF4y2BacgydF4y2Ba氧化酶复合物与质子动力的产生。gydF4y2Ba生物。化学。gydF4y2Ba294gydF4y2Ba, 4867-4877(2019)。gydF4y2Ba
Zhou, S., Pettersson, P., Brzezinski, P., Ädelroth, P. & Mäler, L. Rcf2的NMR研究揭示了洗涤剂胶束中不寻常的二聚体拓扑。gydF4y2BaChemBioChemgydF4y2Ba19gydF4y2Ba, 444-447(2018)。gydF4y2Ba
Zhou, S.等。酵母呼吸超复杂因子2的核磁共振结构及动力学研究。gydF4y2Ba结构gydF4y2Ba29gydF4y2Ba, 275 - 283。e274(2021)。gydF4y2Ba
Smirnova, i.a.等。天然脂质纳米圆盘中酵母复合物IV的分离。gydF4y2BaBiochim。Biophys。学报。gydF4y2Ba858gydF4y2Ba, 2984-2992(2016)。gydF4y2Ba
Zhou, S.等。酵母细胞色素c氧化酶亚基Cox13的核磁共振结构分析及其与ATP的相互作用。gydF4y2BaBMC医学杂志。gydF4y2Ba19gydF4y2Ba, 98(2021)。gydF4y2Ba
Hosler, J. P., Espe, M. P., Zhen, Y., Babcock, G. T. & Ferguson-Miller, S.位点定向突变体分析在细胞色素活性位点附近定位非氧化还原活性金属gydF4y2BacgydF4y2Ba氧化酶的gydF4y2BaRhodobacter sphaeroidesgydF4y2Ba.gydF4y2Ba生物化学gydF4y2Ba34gydF4y2Ba, 7586-7592(1995)。gydF4y2Ba
Ostermeier, C., Harrenga, A., Ermler, U. & Michel, H.结构在2.7 Å分辨率gydF4y2Ba副球菌denitrificansgydF4y2Batwo-subunit细胞色素gydF4y2BacgydF4y2Ba氧化酶与抗体F络合gydF4y2BaVgydF4y2Ba片段。gydF4y2Ba国家科学院学报gydF4y2Ba94gydF4y2Ba, 10547-10553(1997)。gydF4y2Ba
Pfitzner, U.等。Ca突变gydF4y2Ba2 +gydF4y2Ba结合位点gydF4y2Ba副球菌denitrificansgydF4y2Ba细胞色素gydF4y2BacgydF4y2Ba氧化酶。gydF4y2Ba2月。gydF4y2Ba456gydF4y2Ba, 365-369(1999)。gydF4y2Ba
巴尔萨,E.等人。NDUFA4是哺乳动物电子传递链复合体IV的一个亚基。gydF4y2Ba细胞金属底座。gydF4y2Ba16gydF4y2Ba, 378-386(2012)。gydF4y2Ba
Pitceathly, R. D. S. & Taanman, J. W. NDUFA4(更名为COXFA4)是一种细胞色素c氧化酶亚基。gydF4y2Ba性趋势。金属底座。gydF4y2Ba29gydF4y2Ba, 452-454(2018)。gydF4y2Ba
哺乳动物13-亚基细胞色素c氧化酶的调控和其他蛋白质的结合:NDUFA4的作用。gydF4y2Ba性趋势。金属底座。gydF4y2Ba28gydF4y2Ba, 761-770(2017)。gydF4y2Ba
封闭线粒体呼吸小体。gydF4y2Ba摩尔。细胞。医学杂志。gydF4y2Ba32gydF4y2Ba, 2647-2652(2012)。gydF4y2Ba
崔,T. Z., Conte, A., Fox, J. L., Zara, V. & Winge, D. R.酵母中呼吸超复合物的调制:细胞色素氧化酶的增强形成增加了呼吸超复合物的稳定性和丰度。gydF4y2Ba生物。化学。gydF4y2Ba289gydF4y2Ba, 6133-6141(2014)。gydF4y2Ba
Fischer, F., Filippis, C. & Osiewacz, H. D. rcf1依赖的呼吸超复合物是真菌衰老模型中维持寿命不可或缺的。gydF4y2Ba科学。代表。gydF4y2Ba5gydF4y2Ba, 12697(2015)。gydF4y2Ba
Lobo-Jarne, T. & Ugalde, C.呼吸链超复合物:结构,功能和生物发生。gydF4y2Ba扫描电镜。细胞发育生物学。gydF4y2Ba76gydF4y2Ba, 179-190(2018)。gydF4y2Ba
Timón-Gómez, A., Bartley-Dier, E. L., Fontanesi, F. & Barrientos, A. higd驱动的细胞色素调控gydF4y2BacgydF4y2Ba氧化酶的生物发生和功能。gydF4y2Ba细胞gydF4y2Ba9gydF4y2Ba, 2620(2020)。gydF4y2Ba
Rydström Lundin, C., Von Ballmoos, C., Ott, M., Ädelroth, P. &布热津斯基,P.呼吸超复杂因子的调节作用gydF4y2Ba酿酒酵母gydF4y2Ba.gydF4y2Ba国家科学院学报gydF4y2Ba113gydF4y2Ba, e4476-e4485(2016)。gydF4y2Ba
Ameri, K.等人。HIGD1A在葡萄糖剥夺过程中调节氧消耗、ROS产生和AMPK活性,以调节细胞存活和肿瘤生长。gydF4y2Ba细胞的代表。gydF4y2Ba10gydF4y2Ba, 891-899(2015)。gydF4y2Ba
Bedó, G., Vargas, M., Ferreiro, M. J., Chalar, C. & Agrati, D.缺氧诱导基因1的特征:大鼠中枢神经系统成熟过程中的表达和反义RNA表达的证据。gydF4y2BaInt。J.戴夫。比尔。gydF4y2Ba49gydF4y2Ba, 431-436(2005)。gydF4y2Ba
王,J.等。胰腺β细胞缺乏低血糖和OgydF4y2Ba2gydF4y2Ba-可诱导的线粒体蛋白,增强细胞存活。gydF4y2Ba国家科学院学报gydF4y2Ba103gydF4y2Ba, 10636-10641(2006)。gydF4y2Ba
Homberg, B., Römpler, K., Wissel, M., Callegari, S. & Deckers, M. Rcf蛋白及其对呼吸链复合体的差异特异性:Rcf2在氧敏感超复合体中的独特作用?gydF4y2Ba生物化学与生物物理分子学报。gydF4y2Ba1868gydF4y2Ba, 119133(2021)。gydF4y2Ba
Dawitz, H.等人。Rcf1调节细胞色素gydF4y2BacgydF4y2Ba氧化酶的活性,特别是在需要能量的条件下。gydF4y2Ba前面。杂志。gydF4y2Ba10gydF4y2Ba, 1555(2020)。gydF4y2Ba
苏春华,李志强,李志强,等。酵母细胞色素氧化酶Cox3p组装模块的研究。gydF4y2Ba摩尔。杂志。细胞。gydF4y2Ba25gydF4y2Ba, 965-976(2014)。gydF4y2Ba
埃文斯等人。蛋白质复合物预测AlphaFold-Multimer。gydF4y2BabioRxivgydF4y2Ba2021.2010.2004.463034,gydF4y2Bahttps://doi.org/10.1101/2021.10.04.463034gydF4y2Ba(2022)。gydF4y2Ba
米尔迪塔,等人。ColabFold:让所有人都能折叠蛋白质。gydF4y2BaNat。方法。gydF4y2Ba19gydF4y2Ba, 679-682(2022)。gydF4y2Ba
Hayashi, T.等。Higd1a是细胞色素的正向调节因子gydF4y2BacgydF4y2Ba氧化酶。gydF4y2Ba国家科学院学报gydF4y2Ba112gydF4y2Ba, 1553-1558(2015)。gydF4y2Ba
吉川,S., Muramoto, K., Shinzawa-Itoh, K. &望月,M.牛心脏细胞色素c氧化酶的结构研究。gydF4y2Ba生物化学与生物物理学报。gydF4y2Ba1817gydF4y2Ba, 579-589(2012)。gydF4y2Ba
Ädelroth, P.,布热津斯基,P. & Malmström, B. G.球形红杆菌细胞色素c氧化酶的内部电子转移。gydF4y2Ba生物化学gydF4y2Ba34gydF4y2Ba, 2844-2849(1995)。gydF4y2Ba
Namslauer, A, Brändén, M. & Brzezinski, P.细胞色素c氧化酶内血红素-血红素电子转移速率。gydF4y2Ba生物化学gydF4y2Ba41gydF4y2Ba, 10369-10374(2002)。gydF4y2Ba
Schäfer, J., Dawitz, H., Ott, M., Ädelroth, P. &布热津斯基,P.细胞色素的结构和功能异质性gydF4y2BacgydF4y2Ba氧化酶在gydF4y2Ba酿酒酵母gydF4y2Ba.gydF4y2BaBiochim。Biophys。学报。gydF4y2Ba1859gydF4y2Ba, 699-704(2018)。gydF4y2Ba
Schäfer, J., Dawitz, H., Ott, M., Ädelroth, P. &布热津斯基,P.细胞色素c氧化酶活性调控的催化位点调制。gydF4y2Ba科学。代表。gydF4y2Ba8gydF4y2Ba, 11397(2018)。gydF4y2Ba
Verkhovsky, m.i, Morgan, j.e. & Wikström, M.氧结合和激活:氧与细胞色素c氧化酶反应的早期步骤。gydF4y2Ba生物化学gydF4y2Ba33gydF4y2Ba, 3079-3086(1994)。gydF4y2Ba
Ädelroth, P., Ek, M. &布热津斯基,P.在细胞色素c氧化酶中决定电子转移率的因素:在R.球形和牛酶中的氧反应的研究。gydF4y2BaBiochim。Biophys。学报。gydF4y2Ba1367gydF4y2Ba, 107-117(1998)。gydF4y2Ba
Näsvik Öjemyr, L.等。野生型与Glu243Asp变异酵母细胞色素的反应gydF4y2BacgydF4y2Ba氧化酶gydF4y2Ba2gydF4y2Ba.gydF4y2BaBiochim。Biophys。学报。gydF4y2Ba1837gydF4y2Ba, 1012-1018(2014)。gydF4y2Ba
Ädelroth, P., Svensson Ek, M., Mitchell, D. M., Gennis, R. B. &布热津斯基,P.谷氨酸286在细胞色素gydF4y2BaaagydF4y2Ba3.gydF4y2Ba从gydF4y2BaRhodobacter sphaeroidesgydF4y2Ba参与完全还原酶与二氧反应时的质子摄取。gydF4y2Ba生物化学gydF4y2Ba36gydF4y2Ba, 13824-13829(1997)。gydF4y2Ba
Faxén, K.,吉尔德森,G., Ädelroth, P. &布热津斯基,P.细胞色素c氧化酶质子泵浦的机制原理。gydF4y2Ba自然gydF4y2Ba437gydF4y2Ba, 286-289(2005)。gydF4y2Ba
Jasaitis, A., Verkhovsky, m.i, Morgan, j.e., Verkhovskaya, m.l & Wikström, M.细胞色素c氧化酶与二氧反应中主要电生相的分配和电荷易位化学计量学。gydF4y2Ba生物化学gydF4y2Ba38gydF4y2Ba, 2697-2706(1999)。gydF4y2Ba
蔡,P. S.等。一类新的具有刚性疏水基团的双亲分子,用于膜蛋白的增溶和稳定。gydF4y2Ba化学。-欧元。J。gydF4y2Ba18gydF4y2Ba, 9485-9490(2012)。gydF4y2Ba
秦,L., Hiser, C., Mulichak, A., Garavito, R. M. & Ferguson-Miller, S.膜蛋白细胞色素高分辨率结构中保守脂质/洗涤剂结合位点的鉴定gydF4y2BacgydF4y2Ba氧化酶。gydF4y2Ba国家科学院学报gydF4y2Ba103gydF4y2Ba, 16117-16122(2006)。gydF4y2Ba
Hiser, C., Buhrow, L., Liu, J., Kuhn, L. & Ferguson-Miller, S.一个保守的两亲配体结合区影响细胞色素C氧化酶的k路径依赖性活性。gydF4y2Ba生物化学gydF4y2Ba52gydF4y2Ba, 1385-1396(2013)。gydF4y2Ba
迪特拉尼,J. M.等。类固醇抑制哺乳动物复合体IV的结构基础。gydF4y2Ba国家科学院学报gydF4y2Ba119gydF4y2Ba, e2205228119(2022)。gydF4y2Ba
Bratton, m.r., Pressler, m.a. & Hosler, j.p.细胞色素c氧化酶的自杀失活:亚基III缺失的催化翻转改变活性位点。gydF4y2Ba生物化学gydF4y2Ba38gydF4y2Ba, 16236-16245(1999)。gydF4y2Ba
汤普森,D. A.,格雷戈里,L. &弗格森-米勒,S.亚基III的细胞色素c氧化酶耗尽:质子泵浦,呼吸控制,细胞色素A中点电位的pH依赖性。gydF4y2Baj . Inorg。物化学。gydF4y2Ba23gydF4y2Ba, 357-364(1985)。gydF4y2Ba
Thompson, D. A. & Ferguson-Miller, S.用马细胞色素c亲和层析纯化月桂基麦芽糖苷中的脂质和亚基III耗尽细胞色素c氧化酶。gydF4y2Ba生物化学gydF4y2Ba22gydF4y2Ba, 3178-3187(1983)。gydF4y2Ba
陈,J. S.等。通过构建庞氏裂糖酵母缺失菌株,鉴定细胞分裂、DNA损伤反应和形态发生中的新参与者。gydF4y2BaG3:基因,基因组,基因。gydF4y2Ba5gydF4y2Ba, 361-370(2015)。gydF4y2Ba
Krawchuk, m.d. & Wahls, W. P.利用模块化、基于pcr的具有长束侧翼同源性的方法在庞氏裂糖酵母中进行高效基因靶向。gydF4y2Ba酵母gydF4y2Ba15gydF4y2Ba, 1419-1427(1999)。gydF4y2Ba
霍夫曼,C. S.酵母DNA的制备。gydF4y2Ba分子生物学的现行规程/弗雷德里克·m·奥苏贝尔编辑。gydF4y2BaCurr Protoc.[等]。摩尔。杂志。gydF4y2Ba第十三章gydF4y2Ba(2001)。gydF4y2Ba
Takeda, K., Starzynski, C., Mori, A. & Yanagida, M.裂变酵母呼吸不依赖增殖的临界葡萄糖浓度,裂糖酵母pombe。gydF4y2Ba线粒体gydF4y2Ba22gydF4y2Ba, 91-95(2015)。gydF4y2Ba
桑德尔曼,H. Jr. & Strominger, J. L.从金黄色葡萄球菌中纯化c55 -类异戊二烯醇磷酸激酶的性质。gydF4y2Ba生物。化学。gydF4y2Ba247gydF4y2Ba, 523 - 5131(1972)。gydF4y2Ba
Punjani, A., Rubinstein, J. L., Fleet, D. J. & Brubaker, M. A. cryoSPARC:快速无监督冷冻em结构确定的算法。gydF4y2BaNat。方法。gydF4y2Ba14gydF4y2Ba, 290-296(2017)。gydF4y2Ba
鲁宾斯坦,J. L.和布鲁贝克,m.a.通过优化图像翻译的单个粒子的低温em电影对齐。gydF4y2Baj . Struct。医学杂志。gydF4y2Ba192gydF4y2Ba, 188-195(2015)。gydF4y2Ba
Varadi, M.等人。AlphaFold蛋白质结构数据库:通过高精度模型大规模扩展蛋白质序列空间的结构覆盖范围。gydF4y2Ba诊断。酸Res。gydF4y2Ba50gydF4y2Ba, d439-d444(2021)。gydF4y2Ba
Emsley, P., Lohkamp, B., Scott, W. G. & Cowtan, K.白骨顶的特征与发育。gydF4y2BaActa Crystallogr。教派D:生物学。Crystallogr。gydF4y2Ba66gydF4y2Ba, 486-501(2010)。gydF4y2Ba
亚当斯,P. D.等。PHENIX:一个全面的基于python的大分子结构解决方案系统。gydF4y2BaActa Crystallogr。教派D:生物学。Crystallogr。gydF4y2Ba66gydF4y2Ba, 213-221(2010)。gydF4y2Ba
细胞色素c氧化酶中a和a-3组分的化学计量学和吸收光谱。gydF4y2Ba生物化学gydF4y2Ba5gydF4y2Ba, 838-848(1966)。gydF4y2Ba
确认gydF4y2Ba
冷冻电镜数据由克努特和爱丽丝·瓦伦堡、Erling Persson和Kempe基金会、科学实验室、斯德哥尔摩大学和Umeå大学资助的瑞典国家冷冻电镜设施收集。质谱是在乌普萨拉大学基于质谱的蛋白质组学设施完成的。我们要感谢加拿大多伦多病童医院的Justin Di Trani提供的实验建议,以及Tim Formosa提供的pTF277质粒(Addgene质粒# 44094)作为礼物。这项工作得到了克努特和瓦伦堡基金会(p.b., P.Ä.)和瑞典研究委员会(p.b., P.Ä.)的支持。gydF4y2Ba
资金gydF4y2Ba
斯德哥尔摩大学提供的开放获取资金。gydF4y2Ba
作者信息gydF4y2Ba
作者及隶属关系gydF4y2Ba
贡献gydF4y2Ba
P.B。L.N.O.和公共广播设计和监督研究;上午和L.N.Ö。进行研究;点,L.N.O.P.B.对数据进行分析和解释;P.B。L.N.O.A.M.写论文。gydF4y2Ba
相应的作者gydF4y2Ba
道德声明gydF4y2Ba
相互竞争的利益gydF4y2Ba
作者声明没有利益竞争。gydF4y2Ba
同行评审gydF4y2Ba
同行评审信息gydF4y2Ba
化学通讯gydF4y2Ba感谢Janet Vonck和其他匿名评审员对这项工作的同行评审所做的贡献。gydF4y2Ba
额外的信息gydF4y2Ba
出版商的注意gydF4y2Ba施普林格自然对出版的地图和机构从属关系中的管辖权主张保持中立。gydF4y2Ba
补充信息gydF4y2Ba
权利和权限gydF4y2Ba
开放获取gydF4y2Ba本文遵循知识共享署名4.0国际许可协议(Creative Commons Attribution 4.0 International License),允许以任何媒介或格式使用、分享、改编、分发和复制,只要您对原作者和来源给予适当的署名,提供知识共享许可协议的链接,并注明是否有更改。本文中的图像或其他第三方材料包含在文章的创作共用许可中,除非在材料的信用额度中另有说明。如果内容未包含在文章的创作共用许可协议中,并且您的预期使用不被法定法规所允许或超出了允许的使用范围,您将需要直接获得版权所有者的许可。要查看此许可证的副本,请访问gydF4y2Bahttp://creativecommons.org/licenses/by/4.0/gydF4y2Ba.gydF4y2Ba
关于本文gydF4y2Ba
引用本文gydF4y2Ba
莫伊,A, Ädelroth, P.,布热津斯基,P.;gydF4y2Baet al。gydF4y2Ba冷冻电镜结构和功能gydF4y2Ba美国非洲酒gydF4y2Ba结合呼吸超复杂因子的复合体IV。gydF4y2BaCommun化学gydF4y2Ba6gydF4y2Ba, 32(2023)。https://doi.org/10.1038/s42004-023-00827-3gydF4y2Ba
收到了gydF4y2Ba:gydF4y2Ba
接受gydF4y2Ba:gydF4y2Ba
发表gydF4y2Ba:gydF4y2Ba
DOIgydF4y2Ba:gydF4y2Bahttps://doi.org/10.1038/s42004-023-00827-3gydF4y2Ba
评论gydF4y2Ba
通过提交评论,您同意遵守我们的gydF4y2Ba条款gydF4y2Ba而且gydF4y2Ba社区指导原则gydF4y2Ba.如果您发现一些滥用或不符合我们的条款或指导方针,请标记为不适当。gydF4y2Ba