摘要
对病毒感染的代谢适应在很大程度上决定了疾病的病程和表现。在全身水平上,病毒感染和随之而来的炎症的一个显著特征是代谢从合成代谢转向分解代谢。胰岛素抵抗和血脂异常等全身性代谢后遗症是人类免疫缺陷病毒、丙型肝炎病毒和严重急性呼吸系统综合征冠状病毒等多种感染的长期健康后果。长期以来认为外周和组织特异性“免疫反应”是主要的防线,从而调节病毒控制的假设是不完整的。这篇综述的重点是新出现的范式转变,提出在病毒识别后,免疫和非免疫细胞的代谢参与和代谢重构调节病毒感染的自然过程。早期代谢足迹可能影响感染的长期疾病表现。更深入地了解外周和组织的局部生化调整如何影响免疫,最终将导致干预措施,遏制疾病进展,并确定新的和改进的预后生物标志物。
主要
病毒已经发展出各种机制来逃避免疫系统并进行复制。其中一种机制依赖于通过靶向关键代谢节点和破坏关键代谢途径来操纵宿主代谢1.
一种长期存在的观点认为,在应对病毒感染时,先天免疫系统会迅速触发几种干扰素刺激基因(ISGs)的表达,其产物直接限制病毒的复制和传播。代谢相关疾病,如胰岛素抵抗和肝脂肪变性是病毒感染的临床表现,如丙型肝炎病毒(HCV),是在肝脏局部和周围观察到的脂质和糖代谢失调的后果和/或产物2.
在细胞水平上,不同类型的病毒应用不同的机制以有利于病毒复制的方式对细胞进行代谢重编程,通常调节进化上保守的糖酵解/磷酸肌醇苷3-激酶(PI3K) -缺氧诱导因子HIF-1α (HIF-1α)通路3.,4,5.例如,人类感染严重急性呼吸综合征冠状病毒2 (SARS-CoV-2)会破坏线粒体内稳态,而糖酵解的增加会对线粒体内稳态进行补偿6,7,8.同样,人类免疫缺陷病毒(HIV)提高了CD4细胞的糖酵解和线粒体代谢+T细胞和单核/巨噬细胞产生代谢物,这些代谢物可能支持完成HIV生命周期所需的脂质、核苷酸和结构性病毒蛋白的合成,并促进潜伏期9,10,11,12,13,14.免疫细胞的代谢重编程也控制它们的炎症状态,这有助于疾病的发展9,12,13,15.
在对病毒感染的反应中,糖酵解的代谢转变并不必然与氧化磷酸化(OXPHOS)的减少并行,因为糖酵解产生的增加的丙酮酸可能通过丙酮酸羧化酶(PC)依赖的丙酮酸羧化反应维持三羧酸(TCA)循环16.此外,在一些病毒感染期间,谷氨酸盐(一种不依赖pc的无杂合底物)的摄取增加已被记录17.这些无异体交配事件可能部分解释了某些体外HIV感染系统中OXPHOS增加的矛盾现象18,这可能是一种维持足够细胞内ATP、NADH和NADPH水平的补偿机制。谷氨酰胺代谢的增加也可能在不消耗TCA循环的情况下,在ATP生产以外的反应中积累TCA循环的前体中间体。巨噬细胞激活过程中TCA循环的干扰,以及TCA循环向氧化或还原臂倾斜的程度,控制着抗病毒和促炎和抗炎TCA代谢产物的水平19.
宿主已经进化出复杂的过程,以不同的方式调节代谢,以应对特定的嗜组织病毒。例如,嗜肝病毒对SARS-CoV-2和HIV有独特的底物依赖。尽管存在这些内在差异,但在看似不同的病毒之间,一些代谢过程和疾病表现是相同的。SARS-CoV-2和HIV已被证明参与活性氧(ROS)介导的转录因子HIF-1α的稳定作为一种机制,推动CD4的重编程+T细胞和巨噬细胞的糖酵解是复制和诱导产生炎症细胞因子和代谢物所必需的4,20..
除了提供基质支持病毒的代谢劫持外,最近的证据还揭示了应对感染的重要代谢防御机制。由中枢碳代谢激活产生的代谢物已被证明直接干扰病毒生命周期的初始步骤19.这种“先天代谢反应”与免疫系统错综复杂地协调,通过参与isg来产生强大的广谱抗病毒反应。大量令人信服的工作支持了这一猜想,引发了关于宿主对感染的代谢反应的新概念和理论。
在这篇综述中,我简要地强调了代谢是如何影响免疫细胞功能的,并概述了细胞表面蛋白质是如何作为病毒受体和进入因子的,这些蛋白质在历史上一直被研究其代谢作用。我研究了新出现的证据,这些证据表明新陈代谢、炎症小体激活和I型干扰素信号之间的复杂关系,以及这些过程如何处于病毒复制和宿主代谢防御之间战斗的中心。在这篇综述中,我提供了来自不同类型病毒的一般例子,并最终关注两种后果病毒,HIV和SARS-CoV-2,以阐明病毒诱导的代谢重编程和病毒向性的代谢控制的详细概念。在这方面,我讨论了非免疫细胞的分子和生化印记,如肝实质细胞,胰腺β细胞和脂肪细胞,其主要任务历来被视为代谢产物和调节代谢。这篇综述还涵盖了保守的代谢过程如何被用于抗病毒治疗,并减轻宿主细胞损伤。
组织在应对感染时产生的代谢物的内分泌效应直到最近才被研究出来21.我讨论了病毒感染期间功能失调的组织特异性代谢如何可能影响全身代谢稳态和长期疾病,以及代谢标志物如何被探索用于预后目的。
尽管病毒感染的结果可能受到外部环境以及生理和神经内分泌反应的影响,但本综述的重点是支持“代谢反应”在调节病毒控制和疾病结果方面发挥核心作用的证据。
代谢受体,病毒进入因子和传感器
代谢激活概述
现已证实,代谢机制的快速激活发生在CD8中+T细胞在抗原提呈过程中对T细胞受体(TCR)触发的反应。由于TCR没有内在的酶活性,下游的TCR信号是由丙酮酸脱氢酶激酶1 (PDHK1,糖酵解和OXPHOS界面上的一种线粒体酶)和酪氨酸激酶Lck和Zap70之间的联系启动的。22).这种相互作用导致丙酮酸从线粒体氧化转移到乳酸盐生产22.转向生物能量效率较低的有氧糖酵解,确保了细胞生长和分裂的底物可用性,以及对抗病毒和炎症反应至关重要的表观遗传程序的印迹。TCR参与后的代谢重构已在其他地方进行了优雅的回顾23但病毒感染期间的先天代谢反应的概念直到最近才得到重视。
代谢受体介导病毒进入和免疫代谢反应
进入受体在病毒附着和内化中起着重要作用。它们还参与触发细胞内信号和代谢重编程,这可能支持病毒复制和调节抗病毒反应。例如,尽管HIV不使用经典的营养转运蛋白作为其主要受体,但升高的细胞表面葡萄糖转运蛋白-1 (Glut1)对于HIV在CD4中复制的进入后步骤是必要的+T细胞13.Glut1也被认为是delta逆转录病毒人类T淋巴病毒I型和II型T细胞包膜的关键结合受体,同时也增加葡萄糖摄取24,25.
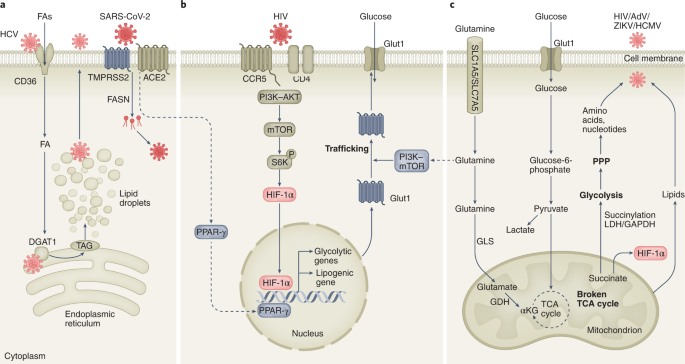
已知HCV包膜糖蛋白E1利用脂肪酸转运体CD36作为潜在的共受体26.此外,HCV核衣壳与甘油三酯合成酶二酰基甘油酰基转移酶1相互作用,这是病毒运输和脂滴形成所必需的相互作用27(无花果。1).病毒,如艾滋病毒,eb病毒,人巨细胞病毒(HCMV)和腺病毒(AdVs)可能通过与细胞表面受体相互作用,激活信号通路和代谢调节转录因子,协调营养转运蛋白的表达,导致宿主细胞对营养的吸收增加12,28,29.
一个HCV和SARS-CoV-2等病毒与进入/代谢因子相互作用,增加脂肪酸合成、甘油三酯和脂滴,这是病毒复制和运输到细胞膜所必需的。bHIV与其入口/代谢因子之间的相互作用触发PI3K-mTOR-HIF-1α激活、糖酵解基因转录、Glut1转运到细胞膜以及葡萄糖摄取和糖酵解的增加。SARS-CoV-2等病毒也可能激活PPAR-γ,促使其转移到细胞核并诱导脂肪生成基因。cHIV、AdV、ZIKV和HCMV等病毒感染会增加谷氨酰胺的摄取和谷氨酰胺的溶解。谷氨酰胺分解是在丙酮酸有限的情况下,谷氨酰胺生成TCA循环中间产物的过程。谷氨酰胺被GLS转化为谷氨酸,谷氨酸被GDH转化为α-酮戊二酸,恢复了TCA的生物能容量。增加的TCA无聚通量也可能诱导“TCA循环断裂”,引起琥珀酸盐等炎症代谢产物的积累,琥珀酸盐可稳定HIF-1α、琥珀酸糖酵解酶,增加糖酵解和PPP,为病毒复制提供底物。副词,腺病毒;CCR5, C-C趋化因子受体5型;DGAT1,甘油二酯O酰基转移酶1;GDH,谷氨酸脱氢酶;gl,谷氨酰胺酶;FA,脂肪酸;α公斤,alpha-ketoglutarate;PPAR-γ,过氧化物酶体增殖物激活受体;S6K, p70核糖体S6激酶;标记,三酰甘油。
在这里,我强调一个模型,其中HIV与其受体的相互作用激活信号通路和代谢途径,导致代谢基因的转录激活和Glut1运输到细胞表面(图2)。1).此外,病毒可以劫持复制所需前体的代谢途径12.hcmv感染的细胞已被证明可以改变营养偏好,例如谷氨酰胺的无重叠使用,以维持复制所需的TCA周期30.,寨卡病毒(ZIKV)可以将糖酵解碳转移到磷酸戊糖途径(PPP)。31(无花果。1).
当乙型肝炎病毒与其受体相互作用时,可以观察到胆汁酸代谢的中断32,钠依赖性中性氨基酸转运体ASCT1和ASCT2是猫RD-114内源性逆转录病毒的功能受体33,34,人内源性逆转录病毒W型35、狒狒内源性逆转录病毒和猿类d型逆转录病毒34.有趣的是,补体受体CD46可以结合并促进HCMV的进入36,腺病毒11型(参考文献。37)和麻疹病毒38已被证明可以调节CD4+T细胞39.此外,CD46的激活增加了CD4所必需的糖酵解和OXPHOS+T细胞效应器功能39.CD46- cyt -1是CD46的c端剪接变体,与麻疹病毒诱导的自噬有关38这是一种高度调控的自我降解机制,调节细胞质内容物的循环,对细胞生存和维持很重要。综上所述,这支持了这样一种观点,即一些病毒受体接触可以传递早期宿主代谢信号,这些信号重新编程代谢,有利于病毒复制。
病毒感染中的先天代谢传感器
有效的宿主对病毒的反应可能是由核酸分子传感器的最佳激活来定义的,这些传感器也可以作为变阻器来微调代谢。这些反应不是通过接触特定的病毒抗原产生的,而是由不相关的病原体编码的无数分子模式产生的。环鸟苷单磷酸腺苷合酶(GMP-AMP合酶;cGAS)由一个n端和非活性的催化结构域组成,通过与胞质病毒DNA和受损线粒体DNA结合而激活40.活化的cGAS产生环二核苷酸2 ',3 ' -环GMP-AMP (2 ',3 ' -cGAMP),激活干扰素基因刺激因子(STING),一种与内质网相关的适配器蛋白40.STING的激活导致干扰素调节因子3 (IRF3)和核因子-κB (NF-κB)的磷酸化和核转位,诱导I型干扰素信号转导和促炎基因的转录,在其他地方进行了全面综述41.从sars - cov -2感染的内皮细胞中释放的线粒体DNA已被证明可以激活cGAS-STING信号,导致细胞死亡和I型干扰素的产生42.
雷帕霉素(mTOR)是一种进化上保守的营养和氧化还原传感器,其机制靶点的激活与sting诱导的I型干扰素产生有关43,44.然而,尽管产生大量的细胞质DNA,引起人类天花和猴痘的痘病毒可以逃避宿主的抗病毒反应,并有效复制。这种逃避可能是由于痘病毒蛋白F17的部署,它将mTOR复合物Raptor和Rictor隔离在高尔基体中,并阻止STING对细胞质的感知45.在HIV复制过程中产生的逆转录DNA和线粒体活性氧(mtROS)可以稳定和激活HIF-1α, HIF-1α是一种异二聚体和缺氧反应转录因子,控制着调节许多糖酵解和炎症过程的基因。但CD4代谢活性增加+体外T细胞对HIV感染的反应与cGAS-STING信号无关4表明钝性STING可能仅由部分病毒构成免疫逃避机制。
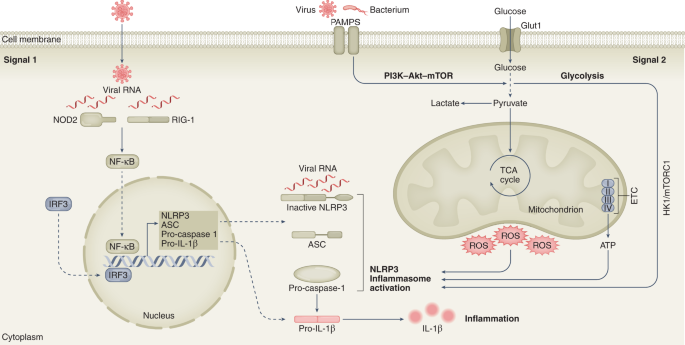
在病毒入侵期间,核苷酸结合寡聚结构域(NOD)-富含亮氨酸的重复pyrin结构域含蛋白3 (NLRP3)等炎性小体可能发挥细胞内代谢感应作用。细菌脂多糖(LPS)诱导的NLRP3炎性小体激活在炎性巨噬细胞中的代谢后果已被很好地描述。己糖激酶-1(HK1)/ mtor依赖的糖酵解对于lps处理的巨噬细胞中的NLRP3炎性小体激活和白细胞介素(IL)-1β成熟很重要46.此外,双链rna依赖性蛋白激酶(PKR)的磷酸化和激活可能受乳酸盐的调节,以及PKR和NLRP3之间的物理相互作用涉及NLRP3炎性小体激活对包括ATP在内的激动剂的反应大肠杆菌炭疽致命毒素和鼠伤寒沙门氏菌感染47,48.含有核苷酸结合寡聚结构域2和维甲酸诱导基因I的病毒RNA感应(信号1)可以诱导编码NLRP3炎性小体成分的基因的转录。然而,TCA循环的中断和OXPHOS产生的ROS和ATP异常水平构成了NLRP3炎症小体激活的重要信号(信号2)(图2)。2).
NLRP3炎性小体的激活需要两个信号。信号1(启动信号):识别病原体相关分子模式(PAMP)激活NF-κB和干扰素信号,触发NLRP3、ASC caspase-1和il -1β的转录。信号2(激活信号):功能异常的线粒体OXPHOS和PAMPs产生的包括线粒体ROS在内的多个DAMPs诱导NLRP3炎性小体组装和激活,导致pro-caspase-1自裂解。然后Caspase-1介导il -1β的蛋白水解过程。HK1/ mtorc1依赖的糖酵解也可能诱导NLRP3炎症小体活化和il -1β前体成熟。ASC,包含一个CARD的凋亡相关斑点样蛋白;DAMPS,损伤相关分子模式;ETC,电子传递链;雷帕霉素复合物1的作用靶点mTORC1;NOD2,核苷酸结合寡聚结构域-含2; PAMPS, pattern-associated molecular patterns; RIG-I, retinoic acid-inducible gene I.
近期工作使用酿酒酵母lps启动的骨髓来源的巨噬细胞显示,线粒体电子传递链来源的ATP通过磷酸肌酸- ATP依赖机制诱导NLRP3炎性小体激活,而不依赖于线粒体ROS49.然而,其他刺激如石棉、二氧化硅和过氧化氢已被证明可在人单核细胞来源的巨噬细胞和THP-1单核细胞系中诱导ros介导的NLRP3炎症小体激活50,51.
病毒感染对炎症小体和代谢机制之间相互作用的影响尚未得到充分研究,但二甲双胍,一种线粒体复合体的抑制剂1(参考文献。52)和依赖于ampk - mtor - hif -1α的NLRP3抑制剂53,54,55在表达人血管紧张素转换酶2 (hACE2)的sars - cov -2感染转基因小鼠中,抑制NLRP3炎症小体激活和IL-1β的产生,同时还可以减轻肺部炎症和急性呼吸窘迫综合征。52.在2019冠状病毒病(COVID-19)患者的外周血单个核细胞和死后肺组织中也报告了NLRP3炎症小体激活56.因为中重度COVID-19疾病的特点是细菌易位增加57因此,NLRP3炎性小体是治疗COVID-19炎症并发症的潜在免疫代谢靶点。
有趣的是,衣康酸的衍生物4-辛酯,是一种抗炎的TCA代谢物,被证明可以抑制NLRP3炎症小体的激活58减少ROS59,可减弱SARS-CoV-2感染患者的气道炎症反应60并抑制肺部炎症和流感病毒感染的死亡率19,59.
代谢反应调节病毒控制和复制
病毒感染期间的代谢重编程
介导抗病毒反应的受体系统与代谢途径交织在一起,这不仅仅是免疫激活的结果,而是一个完整的过程。在病毒感染期间,免疫细胞代谢重编程可能发生,以满足宿主对抗感染所需的新生物能量和生物合成需求,但病毒本身也可以利用它进行复制。感染期间的代谢重编程代表了一种共同进化机制,使病毒和宿主都能生存。尽管增加的合成代谢,如有氧糖酵解通常被认为是病毒感染的标志,但更微妙的代谢配置取决于激活刺激、细胞类型、时间和局部和全身代谢环境。先天抗病毒反应的核心是ISGs、ATP和烟酰胺腺嘌呤二核苷酸(NAD)等代谢因子之间的相互依赖+),以及三羧酸循环代谢产物。讨论了这些因素如何影响病毒-宿主细胞相互作用的结果。
感染过程中干扰素刺激基因与代谢因子的相互依赖
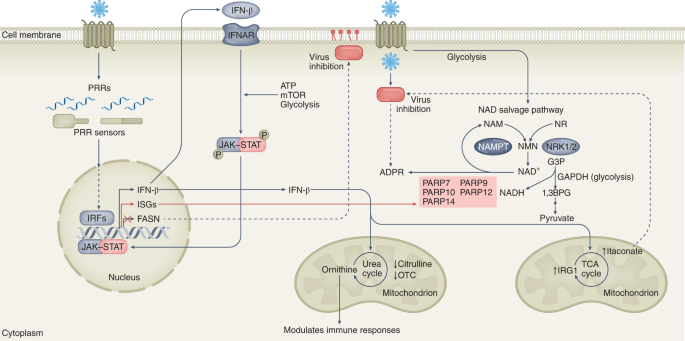
细胞代谢和干扰素反应之间的复杂联系是抗病毒和病毒增强ISGs之间二分法的一种表现。这些基因产物与干扰素受体的自分泌和旁分泌结合激活了Janus酪氨酸激酶(JAK)信号换能器和转录激活因子1 (STAT-1;JAK-STAT-1)通路和isg61,62(无花果。3.).在这些isg中,有5个多聚(adp -核糖)聚合酶(PARP)家族的蛋白质,PARP7, PARP9, PARP10, PARP12和PARP14,它们在响应炎症信号时被转录激活62,63,64.PARP11最近被鉴定为抗ZIKV的ISG,它与PARP12相互作用,增强ZIKV NS1和NS3蛋白的降解65.parp可以使用NAD+由NAD挽救途径作为底物产生,以adp -核糖修饰受体蛋白作为抗病毒反应。河畔+也可以通过接受甘油醛- 3-磷酸脱氢酶(GAPDH)将甘油醛- 3-磷酸转化为1,3-双磷酸甘油酸产生的氢化物并形成NADH来消耗,NADH作为通过OXPHOS合成ATP的中心氢化物供体。然而,NAD挽救途径也可能由乳酸脱氢酶(LDH;无花果。3.).
已知PRRs的病毒识别可刺激糖酵解- mtor - jak - stat依赖的ISGs调节,包括PARP蛋白家族。PARPs可能与GAPDH竞争NAD+,他们将其作为底物,用adp -核糖修饰受体蛋白作为抗病毒反应。I型干扰素可分别调节与尿素循环和TCA循环相关的酶如OTC和IRG1的表达,以调节病毒控制。FASN是一种I型干扰素抑制基因,参与从头脂肪酸合成,并可能限制病毒复制的脂肪酸可用性。1, 3次封盖,1,3-bisphosphoglycerate;G3P,甘油醛3-磷酸;IRF,干扰素调节因子;Irg1,免疫应答基因1;南烟酰胺;烟酰胺磷酸基转移酶;NMN,烟酰胺单核苷酸; NR, nicotinamide riboside; NRK1/2, nicotinamide riboside kinase 1/2; OTC, ornithine transcarbamylase; PRRs, pattern recognition receptors.
河畔+在糖酵解过程中被利用产生NADH, NADH可通过苹果酸/天冬氨酸穿梭运送到线粒体基质,并在电子传递链中被复合物I氧化。NAD细胞下降+是否与衰老相关的线粒体功能损害和药理学上增加的NAD有关+通过sirt1依赖的方式,老年小鼠恢复了与年轻小鼠相当的线粒体功能66,67.超越NAD的核心作用+/NADH系统在细胞线粒体生物发生过程中,血浆中氧化NAD水平显著下降+,和NADP+,在正常衰老过程中,NADH和NADPH的减少形式有所增加68.NAD的关键代谢产物单核苷酸的系统水平+代谢随着COVID-19严重程度的增加而降低69.是否降低NAD+衰老,或者已经存在的影响NAD的疾病+衰竭导致老年人或感染期间有合并症的个人预后较差尚不清楚62,68.
下面将详细讨论,jak - stat调节的I型干扰素系统可以控制中枢代谢途径中编码酶的基因的表达,如脂肪酸合成酶(FASN),尿素循环的鸟氨酸转甲酰基化酶(OTC)和乌头酸脱羧酶1 (ACOD1),也称为IRG1,它催化乌头酸生产衣康酸。抑制FASN和诱导IRG1可以限制病毒的复制,而嗜肝病毒对OTC的异常调节可能会影响血液中尿素循环代谢产物的水平,并引起外周免疫细胞功能的抑制(图2)。3.).
在炎性巨噬细胞中,升高的糖酵解通量增加ATP,这是维持其炎症状态的必要刺激。因此,有氧糖酵解和ATP对于干扰素(IFN) γ-触发的JAK-STAT-1从细胞质到细胞核的激活和转运的扩增和维持至关重要70,这也可能依赖于mtor相关的糖酵解增加71(无花果。3.).除了经典的免疫细胞,脂肪细胞感知IFN-β可以促进脂肪细胞糖酵解,因此肥胖驱动的干扰素-α/β受体(IFNAR)信号通路可能会放大肥胖环境中病毒相关的病理72.最近的一份报告确定FASN是参与从头脂肪酸合成的I型干扰素抑制基因。FASN的过表达或其下游产物棕榈酸酯的补充增强了SARS-CoV-2的复制73.此外,用表没食子儿茶素没食子酸酯(茶叶中的儿茶素)和蓝靛素(抗真菌剂)不可逆地抑制FASN,对包膜病毒表现出广泛的抗病毒活性73.因此,I型干扰素系统代谢基因的下调可能有助于早期抗病毒宿主防御机制,因为许多病毒依赖脂肪酸来完成它们的生命周期。
淋巴细胞性绒毛膜脑膜炎病毒小鼠肝炎模型诱导ifnar1依赖性的肝细胞尿素循环中断和OTC和精氨酸琥珀酸合成酶1的抑制。OTC催化氨甲酰磷酸和鸟氨酸反应生成瓜氨酸,精氨酸琥珀酸合成酶1结合瓜氨酸和天冬氨酸,生成精氨酸琥珀酸。因此,抑制这些基因会导致全身代谢的改变,包括精氨酸的减少,以及全身鸟氨酸和高氨血症的积累,以及T细胞抗病毒反应的减弱74(无花果。3.).从机制的角度来看,还需要更多的工作来破译这些代谢物的变化是否以及如何调节肝损伤,并确定在某些病毒感染期间,差异调节代谢物对其他器官损伤的影响。
代谢物和抗病毒反应之间的相互依赖性
TCA代谢物,如琥珀酸,已通过HIF-1α-IL-1β信号通路参与lps介导的巨噬细胞炎症反应75.此外,通过琥珀酸脱氢酶对琥珀酸的线粒体氧化提高了线粒体膜电位,增加了mtROS的产生,本质上是将线粒体从ATP合成重新利用到ROS的产生,以维持促炎状态76.然而,这可能在激活的巨噬细胞中被积累的衣康酸抵消,这是一种抑制琥珀酸脱氢酶介导的琥珀酸氧化的代谢适应77.与此一致,内源性衣康酸已被证明是长时间LPS启动后炎症耐受的主要诱导物,通过阻止caspase-1的完全激活和延迟NLRP3的激活78.
值得注意的是,琥珀酸已被证明参与更广泛的代谢过程通过琥珀酰化的关键糖酵解酶,包括GAPDH, LDH,苹果酸脱氢酶和谷氨酸载体1(参考文献。75,76).值得注意的是,琥珀酸受体SUCNR1在白色脂肪组织和脂肪细胞中高度丰富。这使得细胞外琥珀酸抑制脂肪分解和甘油三酯积累,表明TCA循环中间产物可能调节全身能量稳态79.
目前尚不清楚病毒是如何调节TCA代谢中心的,但高通量代谢组学分析显示,在中度和重度COVID-19疾病中,血浆琥珀酸升高57,69在甲型流感病毒感染小鼠时,给予衣康酸二甲酯(衣康酸的衍生物)可减少肺部炎症,提高生存率59.另一种衍生物4-衣康酸辛酯和临床批准的富马酸二甲酯(DMF)可有效抑制SARS-CoV-2复制和炎症反应,独立于I型干扰素信号60.这种抑制不仅限于SARS-CoV-2,因为ZIKV和单纯疱疹病毒1号和2号对这些代谢物衍生物敏感60.这些观察结果表明,在病毒感染的代谢反应中,TCA循环的重构是一个不可或缺的过程。
平衡病毒代谢劫持和宿主代谢反应
病毒感染细胞为产生能量和抗病毒代谢副产物而增加的碳代谢可能被解释为宿主对感染的代谢反应。这些代谢中间体可用于病毒复制或用于限制病毒繁殖底物的过程。因此,一些ISG蛋白产生的代谢物可以重塑细胞代谢,以产生广谱抗病毒反应。例如,Viperin,也称为RSAD2,是一个ISG,本质上是一个激进分子年代-腺苷蛋氨酸依赖性酶,将胞苷三磷酸(CTP),一种嘧啶核苷酸三磷酸(RNA合成的底物)转化为其类似物3 ' -脱氧-3 ',4 ' -二脱氢-CTP (ddhCTP),其功能为病毒编码的RNA依赖性RNA聚合酶(RdRp)的链终止子80.已有研究表明,ddhCTP可被登革病毒和西尼罗河病毒的RdRp利用,引起全长病毒RNA的抑制81.同样,ZIKV RdRp和HCV RdRp也容易受到ddhCTP的抑制,导致病毒RNA链过早终止81.
ddhCTP除具有直接抗病毒作用外,还能抑制NAD+GAPDH依赖活性82,通过PPP增加通量,生成合成氨基酸、脂肪酸和核苷酸的前体,这些前体可以支持病毒复制。同样,由PPP产生的NADPH也可能被NADPH氧化酶用来产生抗菌ROS83.NADPH还可以将谷胱甘肽二硫化物还原为抗氧化的谷胱甘肽,作为一种保护宿主的机制来抵消过量的ROS,限制宿主的损伤82.抑制NAD+-依赖的GAPDH活性也可能导致氧化还原代谢和能量产生之间的不平衡,导致细胞死亡和病毒传播的限制。RSAD2是唯一已知的产生代谢物能够直接抑制病毒转录机制的ISG,使其成为宿主抗病毒反应中的关键代谢传感器。
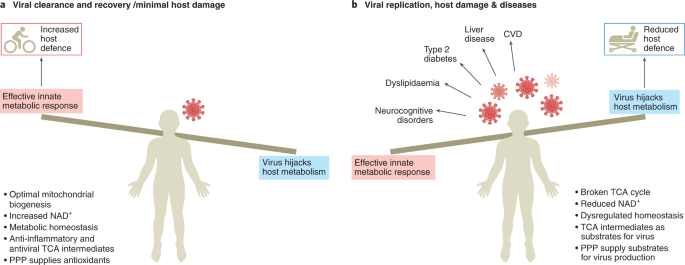
最佳的免疫细胞反应,氧化还原平衡和线粒体生物发生(图。4)创造一种环境,增强宿主对病毒感染的防御能力。然而,当这些过程受到损害时,免疫逃避和病毒持续存在就会导致宿主细胞损伤和疾病。
代谢酶和代谢物:它们在代谢途径之外的作用
传统的想象代谢的方式是一系列的酶反应,其中代谢物作为酶的底物通过线性步骤来产生产物。然而,在病毒感染期间,糖酵解酶的非典型代谢作用可能对病毒和宿主之间的战斗产生重大影响84.另一个例子与一些糖酵解酶对细胞因子表达的“兼职”控制有关。当有氧糖酵解在免疫激活过程中增加时,GAPDH可以解除与编码IFN-γ的mrna的3 '非翻译区域的结合,导致其翻译85.代谢物除了控制各种代谢途径的酶活性外,还具有抗炎作用86,87和炎症75特性和调节病毒复制60,88,89.代谢产物如乙酰辅酶a也可以通过组蛋白的乙酰化重新配置细胞表观基因组,这增加了效应分子如IL-1α,肿瘤坏死因子和IFN-γ的合成90,91.线粒体丙酮酸脱氢酶复合物向细胞核的易位也促进了组蛋白乙酰化所必需的乙酰辅酶a的核生产88.
细胞和全身代谢控制着组织特异性病毒取向和疾病进展
细胞特异性代谢调节病毒趋向性
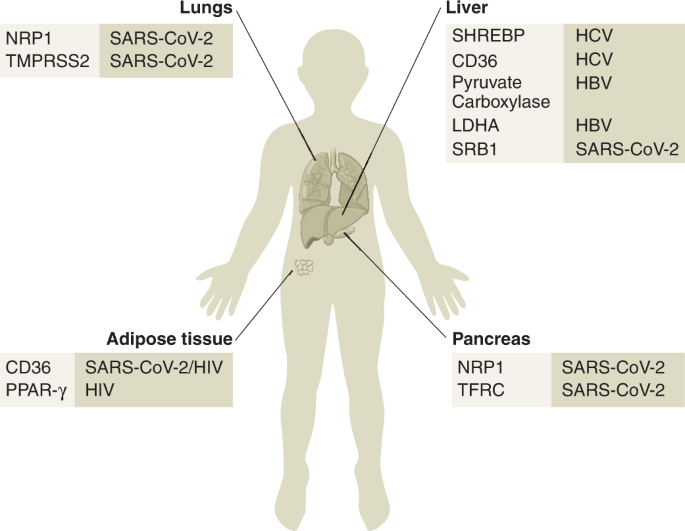
由于嗜肝病毒独特的代谢环境,组织特异性代谢因子可能有助于其嗜肝性(图2)。5).肝脏是一个中枢代谢器官,但它也代表了嗜肝病原体和外周免疫和代谢系统之间的免疫调节枢纽。因此,肝细胞的主要任务是在稳态期间翻转代谢物。然而,肝细胞也是关键的免疫和代谢传感器和反应者;例如,肝PC可以催化丙酮酸羧化生成草酰乙酸,这是TCA循环中间产物被补充以维持脂质生物合成的一个关键的再聚途径92,可以支持病毒复制。有趣的是,在感染单纯疱疹病毒1的成纤维细胞中,观察到通过PC增加的无胸膜性流入TCA循环,这证明了TCA循环在支持氧化和生物合成代谢方面的多功能作用93.
酶异构体的组织特异性分布为更有针对性的抗病毒治疗方法提供了独特的机会。一种这样的可能性是基于观察到LDH的两种主要异构体以组织特异性的方式表达,其中乳酸脱氢酶a (LDHA)在肝脏中高度丰富,乳酸脱氢酶B在心脏中高度表达。已知乙型肝炎病毒通过ldha依赖的乳酸生成激活糖酵解,以阻碍维甲酸诱导的基因i诱导的干扰素生成作为一种免疫逃逸机制94.引人注目的是,在H9c2成肌细胞系中,长链脂肪酸抑制LDHA,这可能至少部分解释了为什么禁食期间脂肪组织释放的脂肪酸抑制乳酸生成并增加肝脏葡萄糖输出95.
其他关键代谢器官,如脂肪组织和胰腺,是局部和全身代谢稳态的中心,不仅塑造了病毒性疾病的自然过程,而且还可以控制影响宿主感染和长期疾病倾向的环境环境(图2)。5).然而,应该注意的是,一些源于TCA循环、糖异生和尿素循环功能受损的代谢缺陷(例如,由于罕见的人类PC缺陷)有时表现为不明显的代谢性疾病,如癫痫和神经系统疾病96.
细胞和全身代谢控制HIV疾病的发病机制
细胞代谢的重编程影响HIV复制机制
HIV倾向于糖酵解CD4+T细胞似乎也依赖于OXPHOS的升高,而不依赖于它们的分化和激活状态11.随着这些代谢过程的增加,生物量的积累为艾滋病毒提供了丰富和必要的大分子用于复制12,15,18,97,98.
尽管在hiv感染的CD4细胞中糖酵解和OXPHOS都升高了+在T细胞中,有氧糖酵解的平衡加强了PPP,使脱氧核苷三磷酸易于用于HIV逆转录12,98.PPP对于维持细胞的氧化还原平衡也很重要,包括抗氧化剂硫氧还蛋白和谷胱甘肽系统的控制,这些系统被证明可以调节CD4中的HIV复制和潜伏期+T细胞和巨噬细胞99,One hundred..有趣的是,糖酵解酶,如GAPDH, α -烯醇化酶和丙酮酸激酶肌2型也被证明直接调节HIV逆转录酶活性,并影响子代病毒的感染性101.
最近的证据表明,艾滋病毒指导线粒体先天免疫受体NLRX1与线粒体蛋白FASTKD5的关联。这种相互作用对于驱动糖酵解、OXPHOS和病毒复制的呼吸链复合物的组装是必不可少的102.使用二甲双胍(美国食品和药物管理局(FDA)批准的抗糖尿病药物)抑制线粒体呼吸链复合体I,抑制HIV在人CD4中的复制+T细胞和人化小鼠102.因此,nlrx1 - fastkd5依赖的OXPHOS诱导为CD4中HIV感染提供了新的机制理解+T细胞。通过线粒体丙酮酸载体抑制剂UK5099减少丙酮酸分配到线粒体可以阻止HIV感染,这表明它不仅更喜欢糖酵解和呼吸活性高的细胞,而且这种代谢环境也支持它的复制102,103.
谷氨酰胺衍生碳已被证明支持TCA循环,以促进CD4中HIV感染的早期步骤+T细胞18.氨基酸转运体在HIV复制和持久性中的影响尚不清楚,但它们可能有助于同步营养供应,为合成代谢反应提供路径,并从本质上转变CD4+T细胞进入生物合成工厂,从而促进HIV感染18,104.同样,脂肪酸代谢对HIV复制的影响也知之甚少;然而,催化脂肪酸合成的酶系统可能参与HIV复制的后期阶段105.除了利用转录和组装的代谢机制,CD4代谢驱动增殖的概念+艾滋病毒储存库中的细胞已被提出,但尚未进行机械研究106.
值得注意的是,绝大多数残留的HIV复制和HIV储存库(包括巨噬细胞)都存在于肠道、脂肪组织和大脑等庇护所中。这些器官代表了独特的代谢环境,CD4+T细胞暴露在不断变化的营养成分中,因此必须适应。这是如何影响CD4细胞容量的+T细胞重新编程代谢,有利于艾滋病毒的复制和持久性是未知的。然而,脂质转运体CD36在静息CD4中上调+T细胞在人类、猴子和小鼠的脂肪组织中表达,而CD4细胞几乎没有表达+血液、脾脏和淋巴结中的T细胞107.同样,在肝脏常驻CD4细胞中也观察到CD36上调+T细胞,这表明这些代谢器官可能会执行独特的代谢重编程,例如更依赖于脂类的常驻CD4+T细胞107.有趣的是,脂肪细胞衍生的可溶性因子脂联素降低了CD4中的IFN-γ和IL-17+来自高脂饮食诱导的肥胖小鼠的T细胞以ampk依赖的方式抑制糖酵解,这表明宿主的营养状况可能是HIV控制的重要因素108.值得注意的是,HIV感染者中细胞毒性T细胞的代谢变化可以影响HIV控制。HIV-specific CD8+来自非控制者的T细胞增加糖酵解并严重依赖葡萄糖代谢,而天然HIV控制者显示出增强的代谢可塑性109.此外,耗尽hiv特异性CD8+T细胞Glut1表达升高,线粒体功能受损,反映了显著的代谢缺陷110.
HIV感染中全身代谢稳态的破坏
尽管单核细胞和巨噬细胞含有艾滋病毒111目前尚不清楚它们对艾滋病毒感染者总库的总体贡献和意义。早期的报道表明,糖酵解代谢和TCA循环在HIV暴露的巨噬细胞中被激活,这可能支持HIV巨噬细胞和小胶质细胞的长期存活和持久性,并导致神经认知功能障碍14,112.
慢性代谢激活的单核细胞和巨噬细胞是持续性炎症的驱动因素,无论其抗逆转录病毒治疗状态如何,都是hiv阳性个体长期代谢合并症的基础,正如其他地方所述113,114,115.hiv感染者循环单核细胞中Glut1表达和糖酵解升高与心血管疾病风险、糖尿病和全身炎症的传统标志物相关116,117.事实上,Glut1表达在患有亚临床心血管疾病的hiv感染妇女的中间单核细胞上增加117.此外,CD4升高+据报道,在感染艾滋病毒并伴有糖尿病的妇女中存在葡萄糖代谢118.
脂质代谢也与单核细胞致动脉粥样硬化有关。从胶原凝胶中提取的hiv阳性个体的转运单核细胞显示泡沫细胞形成增加,这种致动脉粥样硬化原表型与胆固醇外排受损有关119.一种流行的理论认为,微生物产物,如LPS和真菌β-d-葡聚糖通过破坏肠道屏障进入血液,并代表单核细胞和巨噬细胞的关键代谢激活信号120.然而,由hiv感染的CD4分泌的前糖酵解细胞外囊泡+T细胞也被证明诱导糖酵解和促进m1样巨噬细胞炎症反应4.
乳酸被广泛认为是糖酵解的代谢副产物。然而,lps诱导的乳酸刺激m1样巨噬细胞中的组蛋白乳酸化,这是一种在后期激活中诱导m2样特征的表观遗传机制121.有趣的是,在阿尔茨海默病小鼠模型和阿尔茨海默病个体的大脑样本中,糖酵解基因启动子富集的H4K12la上的乳酸依赖性组蛋白乳酸化已在Aβ斑块附近的小胶质细胞中发现122.因此,糖酵解- h4k12a -丙酮酸激酶M2轴与阿尔茨海默病中加剧的小胶质细胞激活和功能障碍有关122.破译这些机制是否可能涉及慢性HIV感染的神经认知疾病将是有趣的。
虽然传统上认为,向有氧糖酵解的转变定义了m1样巨噬细胞,但现在看来,激活刺激也会诱导“断裂”和功能失调的TCA循环。琥珀酸,一种TCA循环代谢物,在lps处理的巨噬细胞中升高,并已被证明可以稳定HIF-1α。然而,在HIV发生的长期代谢合并症(如胰岛素抵抗、肥胖和心血管疾病)中支撑巨噬细胞炎症的机制是多因素的。大量食用西方饮食会增加棕榈酸盐等促炎脂质,这些脂质通过激活NLRP3炎性小体和ROS产生来促进巨噬细胞的氧化分解代谢123.此外,即使单独使用较新的抗逆转录病毒药物也会干扰代谢稳态,如脂肪生成、氧化应激和胰岛素抵抗113,124,125这为长期的hiv相关合并症增加了另一层复杂性。
SARS-CoV-2发病机制由细胞代谢和全身代谢共同决定
细胞代谢重编程影响SARS-CoV-2复制
冠状病毒基因组不编码用于病毒组装的合成ATP和大分子的酶,因此必须利用宿主生物合成程序进行复制。这些程序依赖于辅酶NAD, NADH, NADP和NADPH,它们在脂质,氨基酸和核苷酸生物合成过程中接受和捐赠电子。它们对ROS的产生和解毒也至关重要;然而,这些辅酶在病毒复制和抗病毒反应中的作用直到最近才变得清楚。
PARP是一个消耗nads同工酶的超家族,其中许多是涉及病毒控制的isg。这些酶利用NAD催化单链或链adp核糖与蛋白质的连接。尽管多聚(adp -核糖基化)(PARylating) PARPs以其DNA损伤反应而闻名,但许多非典型的单(adp -核糖基化)(MARylating) PARPs与抗病毒反应有关。在感染sars - cov -2的雪貂和人类的气管和肺部分别观察到具有MARylating活性的非典型PARP同工酶的诱导,以及NAD挽救途径的酶126.因此,与聚合adp -核糖不同,MARylating PARPs将单个adp -核糖单位从NAD转移到蛋白质并修改其功能。有趣的是,冠状病毒具有去除adp核糖修饰的酶活性127,从而抵消这些adp核糖基化抗病毒活性。此外,冠状病毒感染可耗尽细胞NAD+提高NAD水平+与NAD前体结合已被证明能增强PARP同工酶的抗病毒活性126.
可以想象,parp介导的NAD清除可能体现了一种抗病毒反应,剥夺了病毒复制的细胞底物126(无花果。3.).然而,早期诱导parp依赖的(MARylating)干扰素信号可能有利于宿主,因为NAD+也是关键的宿主抗氧化和抗炎反应所必需的62.因此,NAD的治疗强化+该系统被认为是一种潜在的预防SARS-CoV-2感染病毒的方法62.
对COVID-19死亡患者肺部的基因表达分析显示,肺泡2型祖细胞糖酵解和OXPHOS表达上调126.这与轻度和重度COVID-19患者支气管肺泡灌洗的单细胞rna测序数据一致,显示单核细胞糖酵解升高3..最终,这场“拔河比赛”的结果很可能受到宿主营养状况的影响。
代谢因子有助于SARS-CoV-2的组织趋向性和代谢性疾病
COVID-19大流行揭示了内在组织代谢反应和全身代谢稳态的相互调节如何影响病毒感染的结果。尽管最初的研究集中在肺损伤作为COVID-19的主要表现,但也有证据表明,COVID-19患者的代谢并发症(如糖尿病、糖尿病酮症酸中毒、心血管疾病和代谢相关的神经认知障碍)大幅增加(参考文献)。128).
组织嗜性是由宿主细胞表面病毒受体和进入辅助因子的可用性决定的。人们普遍认为SARS-CoV-2主要通过病毒刺突糖蛋白(S)和ACE2受体之间的相互作用与宿主细胞膜结合129.然而,现在很清楚的是,SARS-CoV-2受体的曲目比最初想象的更加多样化。事实上,SARS-CoV-2的进入也可能依赖于跨膜丝氨酸蛋白酶2 (TMPRSS2)129,130, PI3K/Akt激活剂神经素1(参考文献)。131,132,133,134)和转铁蛋白受体135它将循环中的铁输送到细胞中。因此,虽然低丰度ACE2蛋白在胰腺β细胞和α细胞中表达,但在β细胞中SARS-CoV-2入口蛋白神经蛋白酶1和转铁蛋白受体有很强的富集,这一机制可能是其向胰腺趋化的基础135,136.因此,β细胞可能是SARS-CoV-2在上呼吸道和下呼吸道和肺部初次感染后二次扩张的众多机会之一。
目前尚不清楚高危人群(如肥胖和糖尿病患者)中这些进入因素的原有水平是否可以部分解释胰腺对SARS-CoV-2的易感性或COVID-19的严重程度,但2型糖尿病已被确定为SARS-CoV-2急性后遗症(PASC)的重要预测风险因素137.这些入口蛋白可能是感染所必需的更广泛的代谢因子网络中的活跃参与者。另一份研究SARS-CoV-2感染内分泌影响的报告显示,β细胞中ACE2和TMPRSS2的表达高于α胰腺细胞138.这种差异可能是由于这些研究中COVID-19患者的病毒株、实验技术和/或营养状况和人口统计学差异造成的。尽管存在这些潜在的混杂因素,但其他研究已经证实了SARS-CoV-2对胰腺的感染。这会引起深刻的形态变化,并损害葡萄糖刺激的胰腺β细胞胰岛素分泌,导致糖代谢控制异常,导致急性和长期的健康并发症136,139,140.
既往无肝脏病史的新冠病毒感染者肝酶天冬氨酸转氨酶和丙氨酸转氨酶水平经常升高,这增加了新冠病毒直接感染肝脏的可能性。利用原位杂交技术,在死于COVID-19患者肝脏的肝实质细胞中检测到SARS-CoV-2 mRNA。在这些肝脏样本中也容易检测到具有复制能力的SARS-CoV-2,以及刺突蛋白和ACE2蛋白的表达141.此外,在COVID-19死亡患者的肝细胞中检测到假定的SARS-CoV-2入口因子、TMPRSS2、原蛋白酶L和ras相关蛋白rabb -7a的mRNA141.然而,其他入口因子,如高密度脂蛋白清道夫受体B类成员1,与SARS-CoV-2肝脏和肠道趋向性有关142.
sars - cov -2感染的肝脏以明显的I型和II型干扰素反应为主,与未感染的样本相比,干扰素相关的JAK-STAT-1/2信号通路增强,脂质和磷脂代谢较高,氨基酸代谢和OXPHOS水平较低141.越来越多的证据表明,SARS-CoV-2的多器官向性可能至少部分解释了重症COVID-19疾病中报告的肺外表现和多器官损伤143,144.
分析显示,COVID-19患者血浆中胰岛素敏化激素脂联素水平降低(参考文献)。145).此外,与未感染的对照组相比,感染sars - cov -2的仓鼠皮下脂肪组织(SAT)、内脏脂肪组织(VAT)和血清中脂联素蛋白的表达降低145.在感染仓鼠的脂肪中也发现SARS-CoV-2病毒RNA水平升高,并且在体外实验中发现小鼠和人的原代脂肪细胞对SARS-CoV-2感染具有接受性145.在感染后第7天,食蟹猴的SAT中也检测到SARS-CoV-2,而增值税中没有检测到,这可能是由于SAT中ACE2的表达高于增值税146.虽然尚不清楚脂肪细胞是否能支持产生性感染,但这些数据表明,SARS-CoV-2可能引发脂肪组织功能障碍,导致急性SARS-CoV-2感染和长冠状病毒感染(PASC)期间糖代谢紊乱。
在一项针对551名因COVID-19异常住院的意大利患者的队列研究中,在没有既往病史或糖尿病诊断的患者中观察到糖代谢控制(46%高血糖)、胰岛素抵抗和β细胞功能改变。值得注意的是,这些异常在COVID-19发病2个月后仍持续存在139.此外,SARS-CoV-2感染与糖尿病患者发病率和死亡率的增加有关147.对来自Cerner真实世界数据的27,292,879名患者的数据进行的回顾性分析显示,新发1型糖尿病的风险显著增加,在诊断为COVID-19的美国印第安人/阿拉斯加原住民、亚洲/太平洋岛民和黑人人群中比例较高148.尽管普遍承认COVID-19与糖尿病之间存在双向关系,但存在一些争议,可能是由于人口统计学/种族和糖代谢分析方法/时间的差异。事实上,一项研究发现,感染SARS-CoV-2后,糖代谢控制没有长期中断的证据,但该研究没有评估胰岛素水平149.
重要的是,SARS-CoV-2感染导致血糖升高,这与疾病预后不良有关150,151,也可能涉及不直接涉及胰腺或胰岛素敏感性的机制。COVID-19患者全身葡萄糖异常升高与循环GP73增加有关,GP73是一种II型跨膜高尔基蛋白,通过cAMP/ pka依赖机制刺激肝脏糖异生152.即使在“康复”患者中,GP73仍然升高,并与血浆葡萄糖水平呈正相关。因此,GP73可能通过促进肝脏葡萄糖释放到循环中来促进sars - cov -2诱导的高血糖152.
FASN抑制剂(将丙二酰辅酶a转化为棕榈酸盐),如fda批准的抗肥胖药物奥利司他,可能通过降低游离脂肪酸和棕榈酰化蛋白的细胞水平,有效抑制SARS-CoV-2的复制153.此外,对SARS-CoV-2刺突蛋白进行棕榈酰化修饰对于控制膜融合和病毒粒子传染性至关重要。棕榈酰化修饰可以增强S1的疏水性和稳定性,促进与其他蛋白质的相互作用154.实际上,添加bsa偶联棕榈酸部分逆转了奥利司他的抗病毒作用。脂质代谢中的这些生化破坏可能会导致代谢性疾病和PASC的易感性155.
SARS-CoV-2是否能直接感染单核细胞等免疫细胞并在细胞内复制,目前存在争议156.最近的一份报告显示,COVID-19患者约6%的血液单核细胞感染了SARS-CoV-2,这种感染依赖于Fcγ受体的抗体调理病毒157.SARS-CoV-2在单核细胞中的复制似乎是流产的,并触发NLRP3和AIM2炎性小体介导的焦亡157.其他工作表明,代谢过度活跃的单核细胞和CD4亚群的升高+和CD8+T细胞与疾病严重程度呈正相关158.
代谢性疾病使人容易感染SARS-CoV-2
代谢紊乱可能会增加个体对SARS-CoV-2的易感性,恶化疾病预后。在一项对中国湖北省7337例COVID-19病例的回顾性多中心研究中,2型糖尿病患者的COVID-19预后较差,死亡率较高159.脱落机械见解,1,5-无水d-葡糖醇(1,5- ag)是一种葡萄糖样吡喃类多元醇,被认为是一种有效的抗sars - cov -2代代物,在糖尿病患者中减少;1,5- ag与SARS-CoV-2刺突蛋白S2亚基结合,破坏膜融合和细胞进入。因此,在糖尿病患者中,低水平的1,5- ag可能在一定程度上增加SARS-CoV-2感染的风险和疾病的严重程度。事实上,在sars - cov -2感染的糖尿病小鼠中,补充1,5- ag至正常生理水平可显著降低COVID-19相关病理,这表明改善糖尿病患者的1,5- ag高血糖可能会降低COVID-19的发病率和/或严重程度(参考文献)。160).
病毒感染中的进化保守代谢反应
尽管在免疫细胞表型和疾病中存在代谢异质性,但在许多病毒感染中观察到保守的代谢过程,这说明了由代谢功能失调引起的疾病的潜在广义治疗干预。DENV、ZIKV、HIV和SARS-CoV-2等病毒不仅诱导宿主细胞的糖酵解,而且还利用糖酵解环境进行复制161.人腺病毒是一些呼吸系统疾病、胃肠炎和膀胱炎的病原,它增加葡萄糖摄取和糖酵解以及谷氨酰胺分解,以补充病毒核酸和脂肪酸生物合成所需的TCA循环代谢物162.病毒感染中的保守代谢过程在其他地方有很好的讨论161,163.然而,人类和大鼠模型之间的物种特异性代谢已被记录164,因此在研究病毒诱导的不同体内系统的免疫代谢变化时,需要谨慎的解释。除了营养代谢,动物热中性区外的微生物群和饲养温度等其他因素也可能影响对感染的代谢反应。因此,虽然动物模型是询问病毒-宿主关系的强大研究平台,但这些重要因素会影响泛化,在进行临床预测时需要谨慎165.
个体代谢反应的复杂性是人口统计学的功能
还应仔细考虑年龄、性别、种族、肥胖和饮食等人口因素,这些因素可影响对感染的免疫代谢反应。炎症是与艾滋病毒和严重COVID-19相关的合并症的常见易感因素,特别是在老年人中166.此外,衰老与代谢稳态失调和免疫细胞代谢重塑有关167.由于性激素生物学效应的根本差异,男性和女性在免疫代谢和代谢稳态方面也存在显著的性别差异168,169.这些差异可能导致某些代谢和自身免疫性疾病的流行以及治疗反应的性别偏见170.已经观察到与代谢性疾病(如2型糖尿病)相关的代谢物特征的种族差异171.
肥胖已被证明会增加病毒感染的风险、严重程度、免疫反应和治疗反应。高体重指数和低脂联素水平与hcv特异性T细胞反应减少有关172,肝脏损伤加重173对免疫疗法的病毒学反应较差174.最近,肥胖已被证明与甲型H1N1pdm流感的易感性和严重程度有关175.受饮食影响的微生物群176,177也会影响病毒感染的易感性和自然过程。事实上,上呼吸道微生物组中与年龄相关的微生物组组成会影响SARS-CoV-2的易感性和疾病严重程度178.有趣的是,男性在感染HIV之前肠道微生物组组成的致病性变化与HIV感染和艾滋病发展的风险增加有关179.
临床翻译及未来研究方向
调节病毒感染中的代谢
虽然在知识方面取得的重大进展揭示了代谢和病毒之间复杂的相互作用,但病毒-宿主分子相互作用的多效性影响使得很难充分利用这些知识来更好地诊断、预后和治疗疾病。尽管如此,重要的体外、临床前和临床研究开始揭示免疫代谢时代的转化益处。
CD4中糖酵解的次优抑制+来自接受抗逆转录病毒治疗的艾滋病毒感染者的T细胞在体外能有效地阻止病毒的再激活和扩散,并诱导体外预感染细胞的选择性死亡11.靶向PI3K、mTOR、HIF-1-α、mtROS和谷氨酰胺代谢的药物已被证明可以抑制艾滋病毒在初级CD4细胞中的复制+T细胞4,12,18,98,106,180,181.二甲双胍通过靶向线粒体复合物I抑制OXPHOS,减少了HIV在初级CD4细胞中的复制+体外的T细胞,以及用人CD4细胞重建的小鼠+体内T细胞102.雷帕霉素,一种mTOR抑制剂,给猴免疫缺陷病毒(SIV)感染恒河猴治疗长达44周,导致记忆CD4显著降低+血液和组织中的T细胞。然而,在抗逆转录病毒治疗期间,雷帕霉素处理的恒河猴与对照组相比,细胞相关SIV DNA和SIV RNA水平没有显著变化,SIV从抗逆转录病毒治疗中反弹的时间也没有显著差异182.虽然雷帕霉素在本研究中确实调节了代谢相关基因的表达,但其对mTOR转录后活性的影响尚未评估。尽管如此,代谢药物的管理作为一个方案的一部分,以重新激活艾滋病毒库可能限制有害的炎症后果182.总之,这些研究表明,未来需要努力探索在早期抗逆转录病毒治疗期间联合使用代谢药物,以帮助抑制剩余的艾滋病毒复制,并“饥饿患者体内的艾滋病毒库”,以潜在地延迟艾滋病毒反弹,延长抗逆转录病毒治疗的时间15,106.展望未来,研究调节单核细胞和巨噬细胞重要免疫代谢回路的药物是否也可以用于缓解hiv相关的长期代谢并发症也将是有趣的15,114,115,183.
雷帕霉素被证明可以减少SARS-CoV-2在vero肾上皮细胞中的复制16,证实了sars - cov -2感染细胞mTORC1活性增加的观察结果16.有趣的是,接受mTOR抑制剂依维莫司(everolimus)治疗的肾移植受者在mRNA BNT162b2 (Pfizer-BioNTech)接种4-5周后,体液和T细胞介导的免疫反应增加184.
代谢过程可由富马酸酯及其衍生物富马酸单甲基和DMF等代谢物调节,这些代谢物通过改善线粒体功能具有强大的抗氧化和抗炎特性。在一项使用感染SIV的恒河猴的研究中,用DMF治疗被证明可以抵消大脑中的氧化应激185.DMF还诱导代谢抗病毒程序,可有效抑制SARS-CoV-2在细胞系中的复制,并限制与COVID-19气道病理相关的SARS-CoV-2感染的有害宿主炎症反应60.
由于脂质代表了病毒膜的结构基础,针对脂代谢途径提出了早期抗病毒干预的可行方法。奥利司他抑制SARS-CoV-2变体的体外复制153.同样,在K18-hACE2转基因小鼠中,注射奥利司他可以降低肺部的SARS-CoV-2水平,并提高生存率153.奥利司他还对登革热病毒、日本脑炎病毒、ZIKV和基孔肯雅病毒表现出显著的活性186.
新的代谢生物标志物的机会
与病毒感染可以引发系统性生物能量危机的认识一致,对血浆和血清等体液的代谢组学分析为识别能够预测疾病进展和严重程度的新型预后生物标志物提供了新的机会187.低水平的循环NAD+中重度COVID-19患者血浆琥珀酸和犬尿氨酸/色氨酸比值高,瓜氨酸水平低57,69.有趣的是,在接受art治疗的hiv阳性患者中,较高的血浆琥珀酸与较差的神经认知损伤横截面和纵向测量有关188以及血脂谱将虚弱的hiv阳性男性与非虚弱的hiv阳性男性区分开来189.
对接受分析性HIV治疗中断(ATI)的HIV阳性个体的血浆代谢组学和脂质组学分析显示,ATI前甘油磷脂和糖酵解中间产物甘油醛酸-3-磷酸、丙酮酸和乳酸水平显著升高与HIV反弹时间缩短相关,而在延迟病毒反弹的患者中观察到ATI前血浆谷氨酸和α-酮戊二酸显著升高181,190.此外,与持续的HIV控制者相比,短暂的检测到较高的血浆乳酸水平和较低的谷氨酸水平191.
这些研究强调了利用体液中的代谢物组成作为生物标志物来提高诊断和预测疾病结果的稳健性的潜在机会。依赖于宿主代谢反应的生物标志物的发现也将为疾病发病机制提供新的机制见解。
未来研究方向
未来的研究方向应该是认识病毒感染过程中代谢的时空变化。单细胞免疫代谢分析应阐明组织间室内代谢程序的异质性。综合技术,如基于代谢的流式细胞仪9,192,基于流式细胞术的线粒体动力学分析193,质谱联用液相或气相色谱194,195,单细胞RNA测序196,197,海量细胞术198和单细胞能量代谢通过剖析翻译抑制199,200可以用来调查这些问题。跨动物模型代谢反应的比较研究也将提高人类的预测临床意义。
参考文献
谢哈塔,h.m.等人。糖还是脂肪?对病毒感染免疫的代谢需求。Immunol前面。8, 1311(2017)。
Stepanova, M., Lam, B., Younossi, Y., Srishord, M. K. & Younossi, Z. M.美国普通人群中丙型肝炎与胰岛素抵抗和2型糖尿病的关系:肥胖流行的影响。J.病毒肝。19, 341-345(2012)。
科多,a.c.等。葡萄糖水平升高通过HIF-1α/糖酵解依赖轴促进SARS-CoV-2感染和单核细胞反应。细胞金属底座。32, 437-446(2020)。
Duette, G.等人。HIV-1感染诱导CD4细胞HIF-1α+T细胞促进病毒复制并驱动细胞外囊泡介导的炎症。mBiohttps://doi.org/10.1128/mBio.00757-18(2018)。
Lahon, A, Arya, r.p. & Banerjea, a.c.登革热病毒在巨核细胞中调控主转录因子和PI3K/AKT/mTOR信号通路异常。前面。细胞。感染。Microbiol。11, 715208(2021)。
阿贾兹,S.等人。SARS-CoV-2对COVID-19患者外周血单个核细胞线粒体代谢的影响点。j .杂志。细胞杂志。320, c57-c65(2021)。
秦,C.等。SARS-CoV-2夫妇逃避炎症反应激活核苷酸合成。国家科学院学报美国119, e2122897119(2022)。
加森,n.c.等人。sars - cov -2介导的代谢和自噬失调揭示了宿主靶向抗病毒药物。Commun Nat。12, 3818(2021)。
帕默,C. S.等。葡萄糖代谢活性的增加与CD4有关+慢性HIV感染期间T细胞的激活和衰竭。艾滋病28, 297-309(2014)。
帕默,C. S.等。表达Glut1的促炎单核细胞在cart处理和未处理的HIV-1中升高+科目。j . Immunol。193, 5595-5603(2014)。
Valle-Casuso, J. C.等。细胞代谢是CD4中HIV-1储存库播种的主要决定因素+T细胞,并提供了一个解决感染的机会。细胞金属底座。29, 611-626(2019)。
Taylor, h.e.等人mTOR克服了多种代谢限制,使HIV-1逆转录和细胞内运输成为可能。细胞的代表。31, 107810(2020)。
Loisel-Meyer, S.等人。谷氨酸介导的葡萄糖转运调节HIV感染。国家科学院学报美国109, 2549-2554(2012)。
Datta, P. K.等。HIV-1感染巨噬细胞中的谷氨酸代谢:HIV-1 Vpr的作用。细胞周期15, 2288-2298(2016)。
帕尔默,C. S., Cherry, C. L., Sada-Ovalle, I., Singh, A. & Crowe, S. M. T细胞和单核细胞的葡萄糖代谢:艾滋病发病机制的新视角。EBioMedicine6, 31-41(2016)。
马伦,P. J.等。SARS-CoV-2感染重新连接宿主细胞代谢,可能容易受到mTORC1抑制。Commun Nat。12, 1876(2021)。
Hirabara, s.m.等人。宿主细胞谷氨酰胺代谢作为潜在的抗病毒靶点。中国。科学。135, 305-325(2021)。
Clerc I.等人。葡萄糖和谷氨酰胺衍生碳进入柠檬酸循环支持CD4中HIV-1感染的早期步骤+T细胞。Nat。金属底座.1, 717-730(2019)。
Sánchez-García, F. J., Pérez-Hernández, C. A., Rodríguez-Murillo, M. & Moreno-Altamirano, m.m.b .三羧酸循环代谢产物在病毒感染中的作用。前面的细胞。感染。Microbiol。11, 725043(2021)。
科多,a.c.等。葡萄糖水平升高通过HIF-1α/糖酵解依赖轴促进SARS-CoV-2感染和单核细胞反应。细胞金属底座。32, 437-446(2020)。
米尔斯,e.l.等。UCP1控制肝脏细胞外琥珀酸和炎症发病机制。Nat,金属底座。3., 604-617(2021)。
门克,A. V.等人。早期TCR信号传导诱导快速有氧糖酵解,使不同的急性T细胞效应功能。细胞的代表。22, 1509-1521(2018)。
雷纳-坎波斯,M.,沙平,N. E. &戈德拉斯,A. W. CD8+T细胞在感染和癌症中的代谢。Nat. Rev. Immunol.21, 718-738(2021)。
Kinet, S.等人。HTLV-1和HTLV-2包膜分离的受体结合域与激活CD4上的Glut-1结合+和CD8+T细胞。Retrovirology4, 31(2007)。
Manel, N.等人。普遍存在的葡萄糖转运体GLUT-1是HTLV的受体。细胞115, 449-459(2003)。
程,j.j.等。CD36是丙型肝炎病毒E1蛋白附着的共受体。科学。代表。6, 21808(2016)。
赫克尔,E.等人。高效的丙型肝炎病毒颗粒形成需要二酰基甘油酰转移酶-1。Nat,地中海。16, 1295-1298(2010)。
张,J.等。eb病毒编码的潜伏膜蛋白1通过mTORC1/NF-κB信号通路上调葡萄糖转运蛋白1的转录。j .性研究。91, e02168-16(2017)。
Thai, M.等。myc诱导的谷氨酰胺分解代谢重编程支持最佳的病毒复制。Commun Nat。6, 8873(2015)。
钱伯斯,J. W.,马奎尔,T. G. & Alwine, J. C.谷氨酰胺代谢对人类巨细胞病毒感染至关重要。j .性研究。84, 1867-1873(2010)。
Yau, C.等。代谢失调是寨卡病毒感染导致胎儿发育受损的基础。细胞的代表。37, 110118(2021)。
Oehler, N.等。乙型肝炎病毒与其细胞受体的结合改变了胆汁酸代谢基因的表达谱。肝脏病学60, 1483-1493(2014)。
Shimode, S, Nakaoka, R, Shogen, H. & Miyazawa, T.猫ASCT1和ASCT2作为RD-114病毒受体的特征。维罗尔将军。94, 1608-1612(2013)。
Tailor, C. S., Nouri, A., Zhao, Y., Takeuchi, Y. & Kabat, D.钠依赖性中性氨基酸转运体介导猫和狒狒内源性逆转录病毒和猿猴D型逆转录病毒的感染。j .性研究。73, 4470-4474(1999)。
Lavillette, D.等。人内源性逆转录病毒W型的包膜糖蛋白使用不同的氨基酸转运体/细胞表面受体家族。j .性研究。76, 6442-6452(2002)。
斯坦因,K. R.等。CD46促进了人巨细胞病毒的进入和传播。Commun Nat。10, 2699(2019)。
塞格曼,A.等。11型腺病毒使用CD46作为细胞受体。j .性研究。77, 9183-9191(2003)。
朱伯特,p.e.等人。病原体受体CD46诱导自噬。细胞宿主微生物6, 354-366(2009)。
科列夫,M.等人。补体调节T期养分流入和代谢重编程H1细胞反应。免疫力42, 1033-1047(2015)。
孙玲,吴娟,杜峰,陈晓玲,陈志军。环状GMP-AMP合成酶是一种激活I型干扰素通路的细胞质DNA传感器。科学339, 786-791(2013)。
霍夫纳,K. P. & Hornung . cGAS-STING信号的分子机制和细胞功能。细胞生物学。21, 501-521(2020)。
Domizio, J. D.等。cGAS-STING途径驱动COVID-19中I型IFN免疫病理。自然603, 145-151(2022)。
Imanishi, T.等。mTORC1对STING和TCR信号通路的相互调节对T细胞激活和功能的影响生命科学。联盟2, e201800282(2019)。
王,F.等。S6K-STING相互作用调节细胞质dna介导的转录因子IRF3的激活。Immunol Nat。17, 514-522(2016)。
Meade, N., King, M., Munger, J. & Walsh, D.痘苗病毒F17引起的mTOR失调控制多个过程,在感染中具有不同的作用。j .性研究。93, e00784-19(2019)。
Moon, J. S. et . mtorc1诱导的hk1依赖性糖酵解调节NLRP3炎症小体激活。细胞的代表。12, 102-115(2015)。
林,h.c.等。乳酸发酵是NLRP3炎性小体激活所必需的。前面。Immunol。12, 630380(2021)。
Lu, B.等。PKR在炎性小体激活和HMGB1释放中的新作用。自然488, 670-674(2012)。
比林厄姆,L. K.等。线粒体电子传递链是NLRP3炎性小体激活所必需的。Immunol Nat。23, 692-704(2022)。
周,R., Tardivel, A., Thorens, B., Choi, I. & Tschopp, J.硫氧还蛋白相互作用蛋白链接氧化应激与炎症小体激活。Immunol Nat。11, 136-140(2010)。
Dostert, C.等人。通过Nalp3炎性小体感知石棉和二氧化硅的先天免疫激活。科学320, 674-677(2008)。
西安,H.等。二甲双胍抑制线粒体ATP和DNA合成消除NLRP3炎症小体激活和肺部炎症。免疫力54, 1463-1477(2021)。
杨,F.等。在糖尿病心肌病中,二甲双胍通过AMPK/ mtor依赖性作用抑制NLRP3炎性小体。Int。生物。科学。15, 1010-1019(2019)。
al - hashem, F.等人。二甲双胍在硫代乙醯胺诱导的肝组织改变中抑制mTOR-HIF-1α轴、纤维原和炎症生物标志物。j .细胞。杂志。234, 9328-9337(2019)。
克劳,A. S.等。天冬酰胺将线粒体呼吸作用与ATF4活性和肿瘤生长相关联。细胞金属底座。33, 1013-1026(2021)。
罗德里格斯,t.s.等人。炎症小体在SARS-CoV-2感染时被激活,并与患者的COVID-19严重程度相关。实验,医学。218, e20201707(2021)。
吉隆,L. B.等。COVID-19重症患者肠道通透性中断的血浆标志物。前面。Immunol。12, 686240(2021)。
Hooftman, A.等人。免疫调节代谢物衣康酸可修饰NLRP3并抑制炎性小体激活。细胞金属底座。32, 468-478(2020)。
Sohail, A.等人。衣康酸及其衍生物在甲型流感病毒感染中减少干扰素反应和炎症。公共科学图书馆Pathog。18, e1010219(2022)。
奥拉尼耶等人。sars - cov -2介导的NRF2信号通路抑制揭示了4-衣康酸辛酯和富马酸二甲酯强有力的抗病毒和抗炎活性。Commun Nat。11, 4938(2020)。
Schoggins, J. W.等。多种基因产物是I型干扰素抗病毒反应的效应器。自然472, 481-485(2011)。
布伦纳,C.病毒感染为NAD+战场。Nat,金属底座。4, 2-3(2022)。
威尔斯比,我。等人。PARP12,一种干扰素刺激基因,参与蛋白质翻译和炎症的控制。生物。化学。289, 26642-26657(2014)。
卡普拉拉,G.等。PARP14控制I型ifn诱导蛋白亚群的核积累。j . Immunol。200, 2439-2454(2018)。
李,L.等。adp -核糖转移酶PARP11与PARP12协同抑制寨卡病毒细胞Biosci。11, 116(2021)。
戈麦斯,a.p.等。NAD下降+诱导假性缺氧状态,破坏老化过程中的核-线粒体通讯。细胞155, 1624-1638(2013)。
张,H.等。河畔+饱腹改善小鼠线粒体和干细胞功能,延长寿命。科学352, 1436-1443(2016)。
Clement, J., Wong, M., Poljak, A., Sachdev, P. & Braidy, N.等离子体NAD+代谢组在“正常”衰老过程中失调。复兴Res。22, 121-130(2019)。
肖,N.等。整合细胞因子和代谢物分析揭示了COVID-19患者的免疫代谢重编程与治疗意义。Commun Nat。12, 1618(2021)。
王,F.等。干扰素γ诱导M1巨噬细胞可逆代谢重编程,以维持细胞活力和促炎活性。EBioMedicine30., 303-316(2018)。
维戈,T.等。IFN-β通过激活STAT1-3和mtor相关的促进糖代谢来增强间充质基质(干细胞)细胞的免疫调节功能。细胞死亡。10, 85(2019)。
陈,c.c.等人。I型干扰素感应释放休眠脂肪细胞的炎症潜能。Commun Nat。11, 2745(2020)。
Aliyari, S. R.等人。用I型干扰素和化学抑制剂抑制脂肪酸合成酶作为对抗SARS-CoV-2的广谱抗病毒策略。Acta制药。罪。Bhttps://doi.org/10.1016/j.apsb.2022.02.019(2022)。
勒彻,A.等人。I型干扰素信号通路破坏肝脏尿素循环,改变全身代谢以抑制T细胞功能。免疫力51, 1074-1087(2019)。
坦纳希尔,g.m.等。琥珀酸是一种通过HIF-1α诱导IL-1β的炎症信号。自然496, 238-242(2013)。
米尔斯,e.l.等。琥珀酸脱氢酶支持线粒体代谢再利用,以驱动炎性巨噬细胞。细胞167, 457-470(2016)。
Lampropoulou, V.等。衣康酸抑制琥珀酸脱氢酶与巨噬细胞代谢重塑和炎症调节有关。细胞金属底座。24, 158-166(2016)。
Bambouskova等人。衣康酸可耐受晚期NLRP3炎性小体激活。细胞的代表。34, 108756(2021)。
顾,J. B.佐藤,I. T. & Coughlin . R. g蛋白偶联受体表达的解剖学剖析。细胞135, 561-571(2008)。
高希,S. & Marsh, e.n.g.蝰蛇:一种古老的自由基SAM酶在现代细胞代谢和先天免疫中找到了它的位置。生物。化学。295, 11513-11528(2020)。
Gizzi, A. S.等。由人类基因组编码的自然产生的抗病毒核糖核苷酸。自然558, 610-614(2018)。
Honarmand Ebrahimi, K., Vowles, J., Browne, C., McCullagh, J. & James, W. S. RSAD2 (viperin)的自由基sam活性产生的ddhCTP抑制NAD+依赖酶的活性来调节代谢。2月。594, 1631-1644(2020)。
布里特,e.c.等人。切换到环戊糖磷酸途径为活化中性粒细胞的氧化爆发提供动力。Nat,金属底座。4, 389-403(2022)。
Kishimoto, N.等。病毒靶细胞中的α烯醇化酶抑制人类免疫缺陷病毒1型的整合。Retrovirology17, 31(2020)。
张,C. H.等。好氧糖酵解对T细胞效应功能的转录后控制。细胞153, 1239-1251(2013)。
米尔斯,e.l.等。衣康酸是一种抗炎代谢物,通过KEAP1的烷基化激活Nrf2。自然556, 113-117(2018)。
Diskin, C.等。4-衣康酸辛酯和富马酸二甲酯抑制巨噬细胞中COX2的表达和前列腺素的产生。j . Immunol。207, 2561-2569(2021)。
Murray, L. A., Sheng, X. & Cristea, i.m.。蛋白质乙酰化的编排作为细胞防御和病毒复制的一个开关。Commun Nat。9, 4967(2018)。
吉隆,A.等人。宿主琥珀酸通过琥珀酰化和病毒核蛋白的核保留抑制流感病毒感染。EMBO J。41, e108306(2022)。
阿什布鲁克,m.j.等人。柠檬酸调节脂多糖诱导的单核细胞炎症反应。中国。Exp Immunol。180, 520-530(2015)。
Williams, N. C. & O 'Neill, L. A. J.克雷布斯循环中间柠檬酸盐在先天免疫和炎症代谢重编程中的作用。前面。Immunol。9, 141(2018)。
Cappel, d.a.等人。丙酮酸羧化酶介导的再生通过维持肝脏TCA循环和氧化还原代谢促进抗氧化能力。细胞金属底座。29, 1291-1305(2019)。
瓦斯塔格,L., Koyuncu, E.,格雷迪,S. L.,申克,T. E.和Rabinowitz, J. D.人巨细胞病毒和单纯疱疹病毒1对细胞代谢的影响。公共科学图书馆Pathog。7, e1002124(2011)。
周,L.等。乙型肝炎病毒操纵细胞代谢组以避免先天免疫识别。Commun Nat。12, 98(2021)。
希克斯,K. G.等。蛋白质代谢物相互作用组学揭示了碳水化合物代谢的新调控。预印在bioRxivhttps://doi.org/10.1101/2021.08.28.458030(2021)。
加西亚-卡索拉,A.等。丙酮酸羧化酶缺乏症:代谢特征和新的神经学方面。安。神经。59, 121-127(2006)。
泰勒,h.e.等人。磷脂酶D1偶联CD4+T细胞活化到c- myc依赖的脱氧核糖核酸池扩张和HIV-1复制。公共科学图书馆Pathog。11, e1004864(2015)。
泰勒,H. E. &帕尔默,C. S. CD4+T细胞代谢是HIV传染性和储存库持久性的主要因素。Immunometabolism2, e200005(2020)。
辛格,S.等。抗氧化纳米酶通过调节细胞内氧化还原电位来对抗HIV-1。EMBO Mol. Med。13, e13314(2021)。
夏塔吉,i.l.等人。糖酵解下调是HIV-1潜伏期的标志,并使感染细胞对氧化应激敏感。EMBO Mol. Med。13, e13901(2021)。
Kishimoto, N.等。葡萄糖依赖的有氧糖酵解有助于将病毒成分招募到HIV-1颗粒中以保持传染性。物化学。Biophys。Commun >,549, 187-193(2021)。
郭,H.等。多组学分析显示HIV-1改变CD4+T细胞免疫代谢促进病毒复制。Immunol Nat。22, 423-433(2021)。
Valle-Casuso, J. C.等。细胞代谢是CD4中HIV-1储存库播种的主要决定因素+T细胞,并提供了一个解决感染的机会。细胞金属底座。https://doi.org/10.1016/j.cmet.2018.11.015(2018)。
赫格多斯等人。人类免疫缺陷病毒1型感染原发人CD4细胞谷氨酰胺代谢改变的证据+T细胞。AIDS Res.哼。逆转录酶病毒33, 1236-1247(2017)。
Kulkarni, m.m.等人。细胞脂肪酸合成酶是HIV-1复制后期所必需的。Retrovirology14, 45(2017)。
Palmer, c.s., Palchaudhuri, R., Albargy, H., Abdel-Mohsen, M. & Crowe, S. M.利用免疫细胞代谢机制进行功能性HIV治愈和炎症预防。F1000Research7, 125(2018)。
女装设计师,J.等人。脂肪组织和肝脏淋巴细胞上调CD36。脂肪细胞8, 154-163(2019)。
苏伦达尔,J.等。脂联素限制IFN-γ-和il -17产生CD4+T细胞在肥胖中的作用。Immunol前面。10, 2555(2019)。
安金,等人。hiv特异性CD8的代谢可塑性+T细胞与增强抗病毒潜能和HIV-1感染的自然控制有关。Nat,金属底座。1, 704-716(2019)。
Alrubayyi, A.等人。衰竭的CD8功能恢复+T细胞在慢性HIV-1感染中的作用前沿免疫杂志13,908697(2022)。
埃勒里,P. J.等。的CD16+单核细胞亚群更易于感染,并优先在体内庇护HIV-1。j . Immunol.178, 6581-6589(2007)。
巴雷罗,C. A.等。HIV-1 Vpr调节巨噬细胞代谢途径:基于silac的定量分析。《公共科学图书馆•综合》8, e68376(2013)。
戈弗雷,C.等。人类免疫缺陷病毒感染个体的肥胖和脂肪代谢:免疫致病机制和临床意义j .感染。说。220, 420-431(2019)。
Aounallah, M.等。当前HIV发病机制的主题,第2部分:炎症对HIV感染受试者的代谢产生warburg样效应。细胞因子生长因子Rev。28, 1-10(2016)。
巴特菲尔德,T. R.,兰迪,A. L. & Anzinger, J. HIV感染的免疫代谢功能失调:促进因素和对年龄相关共病的影响。咕咕叫。艾滋病毒/艾滋病代表。17, 125-137(2020)。
安青格,J. J.等。hiv感染个体炎症单核细胞Glut1表达水平与心血管疾病风险标志物相关j . Acquir。免疫Defic。Syndr。77, e28-e30(2018)。
巴特菲尔德,T. R.等。亚临床心血管疾病的hiv感染妇女中间单核细胞葡萄糖转运体-1表达增加。艾滋病31, 199-205(2017)。
巴特菲尔德,T. R.等。提升CD4+HIV中的T细胞葡萄糖代谢+患有糖尿病的女性。艾滋病https://doi.org/10.1097/qad.0000000000003272(2022)。
Maisa, A.等。来自hiv感染个体的单核细胞在经内皮细胞迁移后显示出胆固醇外排受损和泡沫细胞形成增加。艾滋病29, 1445-1457(2015)。
Alzahrani, J.等。HIV肠道功能障碍的炎症和免疫代谢后果:与IBD的相似之处以及对宿主持久性和非艾滋病共病的影响。EBioMedicine46, 522-531(2019)。
张,D.等。组蛋白乳糖化对基因表达的代谢调控。自然574, 575-580(2019)。
潘,R. Y.等。组蛋白H4赖氨酸12乳糖化对阿尔茨海默病小胶质细胞糖代谢的正反馈调控细胞金属底座。34, 634-648(2022)。
Wen, H.等。脂肪酸诱导的NLRP3-ASC炎性小体激活干扰胰岛素信号。Immunol Nat。12, 408-415(2011)。
Gorwood, J.等人。整合酶抑制剂多洛替格拉韦(dolutegravir)和雷替格拉韦(raltegravir)在人/猿猴脂肪组织和人脂肪细胞中发挥促脂肪生成和促纤维化作用,并诱导胰岛素抵抗。中国。感染。说。71, e549-e560(2020)。
混蛋,j。p。等人。转换art控制的HIV后皮下脂肪组织参数的改变+患者服用拉替格拉韦/马拉韦洛克。艾滋病35, 1625-1630(2021)。
Heer, c.d.等人。冠状病毒感染和PARP表达失调NAD代谢组:先天性免疫的可作用成分。生物。化学。295, 17986-17996(2020)。
划分的NAD之间的相互作用+合成和消耗:重点关注PARP家族。Dev的基因。34, 254-262(2020)。
Stefan, N, Birkenfeld, A. L. & Schulze, M. B.全球流行病相互关联——肥胖、代谢健康受损和COVID-19。内分泌。17, 135-149(2021)。
霍夫曼,等人。SARS-CoV-2细胞进入依赖于ACE2和TMPRSS2,并被临床证明的蛋白酶抑制剂阻断。细胞181, 271-280(2020)。
Jackson, c.b, Farzan, M, Chen, B. & Choe, H. SARS-CoV-2进入细胞的机制。细胞生物学。23, 3-20(2022)。
王,L.等。Neuropilin-1通过vegfr2依赖的PI3K/Akt通路促进肝窦内皮细胞血管生成,从而加重肝硬化。EBioMedicine43, 525-536(2019)。
曹毅,等。Neuropilin-1通过激活Akt和sonic hedgehog轴维持肾细胞癌细胞的去分化和繁殖表型。癌症Res。68, 8667-8672(2008)。
班纳吉等人。VEGF-A165通过激活neuropilin-1-VEGFR1-PI3K轴诱导人主动脉平滑肌细胞迁移。生物化学47, 3345-3351(2008)。
Cantuti-Castelvetri, L.等。神经蛋白酶1促进SARS-CoV-2细胞进入和感染。科学370, 856-860(2020)。
吴,C. T.等。SARS-CoV-2感染人胰腺β细胞并引起β细胞损伤。细胞金属底座。33, 1565-1576(2021)。
卡迪尔,m.m.f.等。胰腺SARS-CoV-2感染可促进血栓纤维化,并与新发糖尿病有关。江森自控的洞察力6, e151551(2021)。
Su, Y.等。多种早期因素可预测COVID-19急性后后遗症。细胞185, 881-895(2022)。
Müller, J. A.等。SARS-CoV-2在人体内分泌和外分泌胰腺细胞中感染和复制。Nat,金属底座。3., 149-165(2021)。
蒙特弗斯科,L.等。SARS-CoV-2感染后糖代谢控制的急性和长期中断。Nat,金属底座。3., 774-785(2021)。
米塔尔,J.等。2型糖尿病患者COVID-19后疲劳的高患病率:一项病例对照研究糖尿病金属底座。Syndr。15, 102302(2021)。
Wanner, N.等人。SARS-CoV-2肝向性的分子后果。Nat,金属底座。4, 310-319(2022)。
魏,C.等。hdl -清道夫受体B型1可促进SARS-CoV-2进入。Nat,金属底座。2, 1391-1400(2020)。
SARS-CoV-2感染肝细胞。Nat,金属底座。4, 301-302(2022)。
德洛雷,t.m.等人。COVID-19组织图谱揭示了SARS-CoV-2病理和细胞靶点。自然595, 107-113(2021)。
韦勒等人。COVID-19急性高血糖以胰岛素抵抗和SARS-CoV-2脂肪组织感染为特征。细胞金属底座。33, 2174-2188(2021)。
奥利沃等人。在猕猴的皮下脂肪中检测到SARS-CoV-2,而在内脏脂肪中没有检测到,以及两种脂肪组织中脂肪淋巴细胞稳态的破坏。Commun。医学杂志。5, 542(2022)。
奥布霍夫,A. G.等人。SARS-CoV-2感染和ACE2:临床结果与糖尿病患者发病率和死亡率增加有关。糖尿病69, 1875-1886(2020)。
Qeadan, F.等人。COVID-19诊断、1型糖尿病和糖尿病酮症酸中毒风险之间的关联:使用Cerner真实世界数据的美国全国队列研究《公共科学图书馆•综合》17, e0266809(2022)。
劳伦兹,A.等人。没有证据表明SARS-CoV-2感染后糖代谢控制长期中断。j .中国。性。金属底座。107, e1009-e1019(2022)。
王,W.等。血糖水平升高导致COVID-19进展迅速,病死率高。BMC Pulm。地中海。21, 64(2021)。
吴,J.等。一项回顾性队列研究:血糖水平升高预示着COVID-19住院患者预后较差。BMJ开放糖尿病护理8, e001476(2020)。
Wan, L.等。GP73是一种促糖激素,可导致sars - cov -2诱导的高血糖。Nat,金属底座。4, 29-43(2022)。
Chu, J.等。脂肪酸合成的药理抑制阻断了SARS-CoV-2的复制。Nat,金属底座。3., 1466-1475(2021)。
吴,Z.等。SARS-CoV-2 S蛋白的棕榈酰化对病毒的感染性至关重要。钙信号。其他目标。6, 231(2021)。
谢勒,P. E.柯文,J. P. &罗森,C. J. COVID-19急性后后遗症:代谢的角度。eLife11, e78200(2022)。
Zankharia, U., Yadav, A., Yi, Y., Hahn, B. H. & Collman, R. G.高度限制SARS-CoV-2受体表达和原代人单核细胞和单核细胞来源的巨噬细胞对感染的抗性。j . Leukoc。医学杂志。112, 569-576(2022)。
Junqueira, C.等人。fc γ r介导的SARS-CoV-2单核细胞感染激活炎症。自然606, 576-584(2022)。
李,J. W.等。对血浆和单个免疫细胞的综合分析揭示了COVID-19患者的代谢变化。生物科技Nat。》。40, 110-120(2022)。
朱,L.等。COVID-19和已有2型糖尿病患者的血糖控制与结局的关系细胞金属底座。31, 1068-1077(2020)。
童,L.等。糖尿病患者缺乏葡萄糖样代谢物,可抑制SARS-CoV-2的细胞进入。Nat,金属底座。4, 547-558(2022)。
Proal, a.d. & VanElzakker, m.b.病原体劫持宿主细胞代谢:细胞内感染是癌症和其他慢性炎症疾病中warburg效应的驱动因素。Immunometabolism3., e210003(2021)。
普钦基维兹,M. A.和Mymryk . J. s代谢重编程宿主细胞感染人腺病毒。病毒11, 141(2019)。
傅俊杰,黄志刚,李志刚,李志刚。病毒感染过程中线粒体介导的氧化应激。Microbiol趋势。30., 679-692(2022)。
Blais, e.m.等人。调节大鼠和人类代谢网络比较毒理基因组学和生物标志物预测。Commun Nat。8, 14250(2017)。
富勒,K. N. Z. & Thyfault, J. P.将临床前啮齿动物运动代谢发现转化为人类健康的障碍。J.应用物理。130, 182-192(2021)。
Omarjee, L.等人。免疫代谢是COVID-19炎症、免疫衰老和自身免疫的基石。老化12, 26263-26278(2020)。
Quinn, K. M, Palchaudhuri, R., Palmer, C. S. & La Gruta, N. L.时钟在滴答作响:衰老对T细胞代谢的影响。中国。Transl。Immunol。8, e01091(2019)。
Guillot-Sestier, m.v.等。小胶质细胞代谢是阿尔茨海默病性别二态性的关键因素。Commun。医学杂志。4, 711(2021)。
跨性别激素治疗下性别焦虑个体12个月的代谢变化:一项靶向代谢组学研究。科学。代表。6, 37005(2016)。
梁勇。免疫代谢和自身免疫中的性别二态性:对个体化医疗的影响。Autoimmun。牧师。20., 102775(2021)。
van Valkengoed, i.g.m.等人。代谢物特征和2型糖尿病的种族差异:南亚、非洲和欧洲血统人群的嵌套病例对照分析减轻。糖尿病7, 300(2017)。
Palmer, C., Hampartzoumian, T., Lloyd, A. & Zekry, A.脂联素在调节慢性丙型肝炎病毒感染免疫反应中的新作用。肝脏病学48, 374-384(2008)。
Palmer, C.等人。肥胖对慢性丙型肝炎感染肝内细胞因子和趋化因子表达的影响。肠道59, 397-404(2010)。
Bressler, b.l, Guindi, M, Tomlinson, G. & Heathcote, J.高身体质量指数是慢性丙型肝炎抗病毒治疗无应答的独立危险因素。肝脏病学38, 639-644(2003)。
迈尔,H. E.等人。肥胖与甲型流感(H1N1pdm)易感性增加有关,但与H3N2感染无关。中国。感染。说。73, e4345-e4352(2021)。
Tanes, C.等人。膳食纤维在人体肠道微生物群及其代谢组恢复中的作用。细胞宿主微生物29, 394-407(2021)。
加塞萨,R.等人。环境因素对荷兰人群肠道微生物群的影响。自然604, 732-739(2022)。
赫斯特,J. H.等。鼻咽微生物组的年龄相关变化与儿童、青少年和青壮年的SARS-CoV-2感染和症状有关。中国。感染。说.https://doi.org/10.1093/cid/ciac184(2022)。
陈,Y.等。MSM患者肠道微生物群的特征变化与HIV-1感染易感性增加有关。微生物组9, 237(2021)。
帕默,C. S.等。代谢活性CD4+在体外感染过程中,表达Glut1和OX40的T细胞优先庇护HIV。2月。591, 3319-3332(2017)。
吉隆,L. B.等。HIV治疗后控制的非侵入性血糖和代谢生物标志物。Commun Nat。12, 3922(2021)。
Varco-Merth, b.d.等人。雷帕霉素限制CD4+T细胞增殖在猴免疫缺陷病毒感染恒河猴抗逆转录病毒治疗。j .中国。投资。https://doi.org/10.1172/jci156063(2022)。
帕默,C. S.等。免疫代谢的新作用和特征:与HIV发病机制、严重的非艾滋病事件和治疗的相关性。j . Immunol。196, 4437-4444(2016)。
Netti, G. S.等人mTOR抑制剂改善肾移植受者对SARS-CoV-2信使RNA BNT16b2疫苗的体液和细胞反应。点。j . Transpl。22, 1475-1482(2022)。
加西亚-梅萨,Y.等人。富马酸二甲酯,一种被批准的多发性硬化症治疗方法,减少siv感染恒河猴的大脑氧化应激:潜在的治疗目的重新用于HIV神经保护。抗氧化剂10, 416(2021)。
Hitakarun等人。奥利司他(四氢lipstatin)对登革热病毒、日本脑炎病毒、寨卡病毒和基孔肯雅病毒的抗病毒活性评价科学。代表。10, 1499(2020)。
卡普托,A.,古兹曼,C. A.,帕尔默,C. S.和尼科利,F.编辑:系统和细胞代谢对感染易感性和免疫反应的作用。前面。细胞。感染。Microbiol。12, 854241(2022)。
希勒曼,c.o.等人。血浆柠檬酸盐和琥珀酸与老年艾滋病毒感染者的神经认知障碍有关。中国。感染。说。73, e765-e772(2021)。
杨,H. L.等。免疫代谢和脂质组标志物与衰老HIV的脆弱指数和生活质量相关+男性接受抗逆转录病毒治疗。EBioMedicine22, 112-121(2017)。
吉隆,L. B.等。磷脂代谢与治疗中断后HIV反弹的时间有关。mBio12, e03444-20(2021)。
Tarancon-Diez, L.等人。免疫代谢是持续自发控制HIV-1感染的关键因素。EBioMedicine42, 86-96(2019)。
Ahl, P. J.等。Met-Flow是一种单细胞代谢分析策略,强调免疫亚群的动态变化。Commun。医学杂志。3., 305(2020)。
马森,J. J. R.等。低温保存外周血单个核细胞T细胞线粒体动力学的多参数分析。方法分子生物学。2184, 215-224(2020)。
Carbone, F.等。代谢组学,脂质组学和免疫代谢学。方法分子生物学。2285, 319-328(2021)。
Purohit, V., Wagner, A., Yosef, N. & Kuchroo, V. K.基于系统的方法来研究免疫代谢。细胞Mol免疫19, 409-420(2022)。
温斯托克等人。内脏脂肪组织白细胞的单细胞RNA测序显示,肥胖后的热量限制促进了具有吞噬细胞特征的独特巨噬细胞群的积累。Immunometabolism1, e190008(2019)。
戈德堡,e.l.等人。生酮激活内脏脂肪组织中的代谢保护γδ T细胞。Nat,金属底座。2, 50-61(2020)。
莱文,L. S.等。通过大规模细胞术单细胞分析揭示了早期活化CD8的代谢状态+T细胞在初级免疫反应中的作用免疫力54, 829-844(2021)。
维伯克,S. G. S.等。一个集成的工具箱来分析巨噬细胞免疫代谢。单元格代表方法2, 100192(2022)。
Argüello, R. J.等。SCENITH:一种基于流式细胞术的方法,以单细胞分辨率功能分析能量代谢。细胞金属底座。32, 1063-1075(2020)。
确认
作者衷心感谢美国Wistar研究所的M. Abdel-Mohsen的批判性审查和建议,以及美国杜兰大学的L. Burton的重要编辑概述。
作者信息
作者及隶属关系
贡献
C.S.P.构思并撰写了手稿。
相应的作者
道德声明
相互竞争的利益
作者声明没有竞争利益。
同行评审
同行评审信息
自然的新陈代谢感谢Naomi Taylor和其他匿名审稿人对这项工作的同行评审所做的贡献。主要处理编辑:Christoph Schmitt,与自然的新陈代谢团队。
额外的信息
出版商的注意施普林格自然对出版的地图和机构从属关系中的管辖权主张保持中立。
权利和权限
根据与作者或其他权利持有人签订的出版协议,《自然》杂志或其许可方对本文拥有独家权利;作者对这篇文章接受的手稿版本的自我存档仅受此类出版协议的条款和适用法律的约束。
关于本文
引用本文
帕尔默,C.S.对抗病毒感染的先天代谢反应。Nat金属底座4, 1245-1259(2022)。https://doi.org/10.1038/s42255-022-00652-3
收到了:
接受:
发表:
发行日期:
DOI:https://doi.org/10.1038/s42255-022-00652-3