摘要
细胞增殖需要分解代谢过程的整合,以提供能量,氧化还原动力和生物合成前体。在这里,我们展示了如何结合合理的设计,代谢重布线和重组表达使酵母细胞质脱羧循环的建立。这种代谢周期可以通过提供能量和增加细胞质中NADPH或NADH的供应来支持生长,这可以支持高度还原的化学物质的产生,如甘油、琥珀酸盐和游离脂肪酸。利用该方法,游离脂肪酸产量达到理论产量的40%,是目前报道的最高产量酿酒酵母据我们所知。本研究报告了酵母细胞液中合成脱羧循环的实现,及其在细胞工厂中实现有价值化学品高产量的应用。我们的研究还表明,尽管酵母中的分解代谢有广泛的调节,但重新连接能量代谢是可能的,这说明了生物设计的力量。
主要
细胞功能是大量协调的化学反应的总和,最明显的表现是分解代谢过程,碳和能量被转化为吉布斯自由能和细胞增殖所需的积木1,2.在合成代谢过程中,在能量消耗的背景下,积木被转化为大分子。
在这些过程中,细胞还需要处理电子流,以克服基质和形成细胞生物量的各种大分子之间化学成分的化学计量学限制。例如,典型的酵母生物量化学成分是CH1.76N0.17O0.56它的还原程度略高于葡萄糖3.但是一些关键成分,比如脂类,比葡萄糖的降低幅度要大得多。在生物技术领域,生产高度还原的化学物质也是可取的——例如,用作生物燃料。因此,尽管有必要提高还原性代谢的能力,但设计这一代谢成分是非常具有挑战性的4.
细胞已经进化到拥有多种能量产生途径,以维持生长以应对不同的条件5.由于能量代谢对细胞非常重要,能量代谢的分子调节因子在干细胞、核重编程和癌细胞命运中起着至关重要的作用6.在异养型中酿酒酵母ATP的产生有两种机制:底物水平和氧化磷酸化。氧化磷酸化发生在细胞呼吸过程中,这一过程可以利用NADH/FADH的氧化作用2对NAD+/FAD生成ATP/GTP,而NADH/FADH2是由细胞的原生还原代谢产生的,包括糖酵解和三羧酸(TCA)循环7.通过TCA循环和氧化磷酸化,细胞通过生成CO释放葡萄糖中的所有能量2.
代谢反应必须高度协调,以确保不同构建块之间的确定比例,以及能量生成与这些构建块之间的确定比例2.因此,我们想知道是否有可能为细胞创造一种合成能量系统。如果细胞被NADH或NADPH过度充电会发生什么?对于异养生物,TCA循环是所有需氧生物使用的一系列化学反应,通过将乙酰辅酶a氧化为CO,从葡萄糖中释放储存的能量2以及NADH,它进一步为线粒体膜中的电子转移链充电,以产生ATP8.TCA循环进行重复脱羧以产生能量。这个系统是通用的吗,还是可以被取代?从进化的角度来看,细胞的每一个成分或模块,包括能量代谢,都是为了自我繁殖而优化的,而不是为了生产单一的化学物质。因此,是否有可能创建一个合成能源系统,可用于优化化学生产?传统的代谢工程和合成生物学中,基于生物传感器的动态调控、通路的过表达或特定酶的缺失等策略主要集中在生物合成或合成代谢过程上9,10.
在这里,我们报道了一种以重复的单一脱羧反应为特征的细胞质合成还原代谢途径的重建,该反应能够通过替换体内的原生TCA循环来支持细胞生长酿酒酵母.更重要的是,这种合成途径可以被利用来产生高度还原的化学物质。这种合成的还原代谢可以与非氧化糖酵解(NOG)途径结合11优化乙酰辅酶a衍生的化学生产。据我们所知,这也是第一个通过合理的生物设计来支持细胞生长的合成能量系统的例子。基于我们的发现,我们得出结论,尽管经历了数百万年的进化,酵母的新陈代谢是相对具有可塑性的。通过合理的设计和广泛的工程设计,重新设计能量代谢这一生命最基本的部分是可行的。
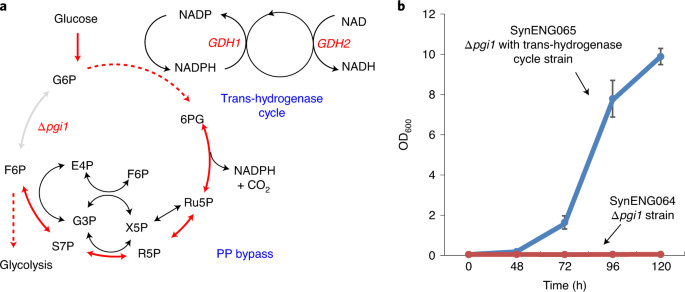
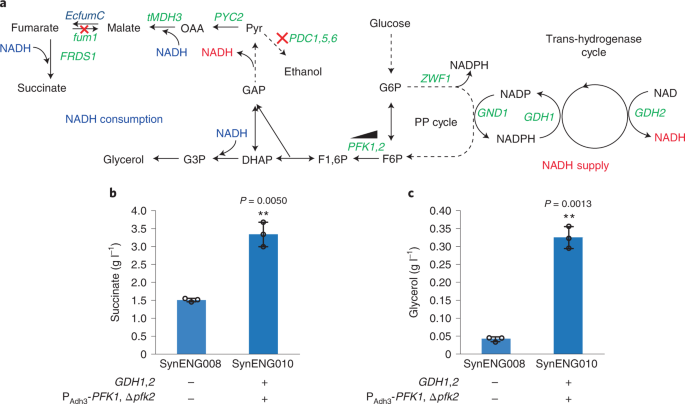
该合成能量系统包含三个模块:模块1,磷酸戊糖(PP)途径循环;模块2,反式氢化酶循环;模块3,外呼吸链(扩展数据图。1).在无花果。1我们介绍了由模块2实现的反式氢化酶反应。然后,我们展示了模块1的重复脱羧和细胞质NADH供应功能,这反映在高度减少的化学过剩生产(图1)。2).最后,我们将三个模块集成在一起,实现了能源供应功能(图2)。3.).
一个,综述了不可逆反式氢化酶循环和PP旁路。GDH1而且GDH2启动一个不可逆的反式氢化酶循环。GDH1辅酶ii (+)依赖谷氨酸脱氢酶,从氨和-酮戊二酸合成谷氨酸。GDH2NAD (+)依赖的谷氨酸脱氢酶,将谷氨酸降解为氨和α -酮戊二酸。氧化性和非氧化性PPs形成代谢旁路pgi1缺失,产生额外的NADPH而不是糖酵解。b,反式氢化酶循环使细胞生长pgi1E1B菌株SynENG064。删除SynENG065pgi1过度表达为GDH1而且GDH2(trans-hydrogenase周期)。
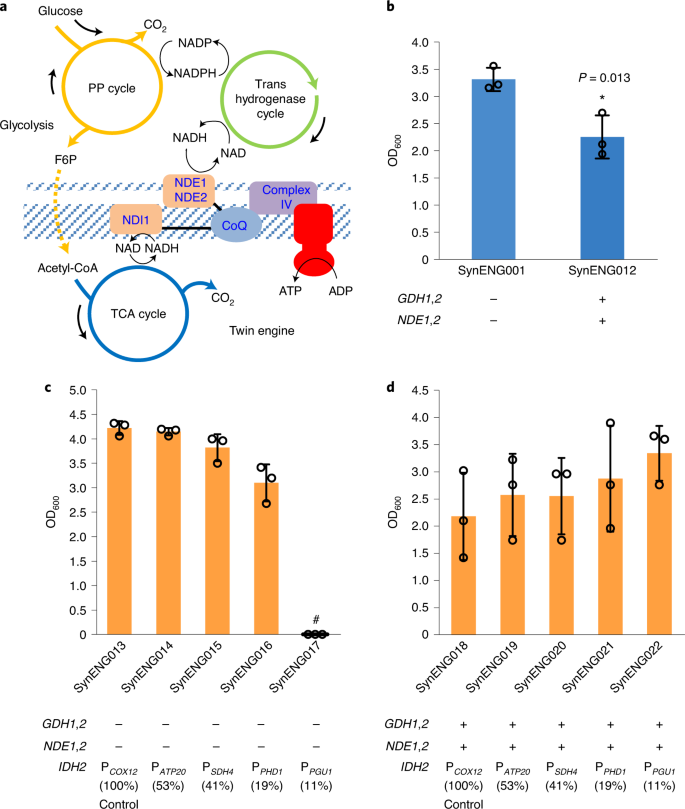
一个,双发设计原理图。b过度脱羧会降低细胞生长。c在缺乏合成能量系统的情况下,脱羧不足会降低细胞生长。TCA循环的微调是通过下调IDH2.IDH2由一系列启动子分别表达COX12(100%),ATP20(53%),SDH4(41%),PHD1(19%)和PGU1(11%)。#,没有幸存的殖民地。c,dPCOX12是指COX12的启动子,与PATP20、PSDH4、PPHD1、PPGU1相同。d合成能量系统取代TCA循环,为细胞生长提供能量。本地的IDH2由一系列启动子分别表达COX12(100%),ATP20(53%),SDH4(41%),PHD1(19%)和PGU1(11%)。菌株在摇瓶中以200转/分的速度培养120小时。30°C用葡萄糖喂料珠对应10 gl−1葡萄糖在SD培养基中。使用Student 's进行统计分析t-test(双尾,双样本不等方差,*P< 0.05, **P< 0.01, ***P< 0.001;样本大小,n= 3)。每次实验至少进行两次独立测量,平均±s.d。在三个生物重复中显示了一个有代表性的测量。所有细胞按照实验程序进行培养。
重复的脱酸
脱羧是细胞还原代谢的基础。在许多生物体中,三羧酸循环是产生能量的核心。在这一途径中,重复的脱羧导致NADH的产生,NADH随后被电子传递链再氧化,最终导致ATP的产生。因此,构建脱羧循环是构建新能源体系的第一步。为此,我们旨在将PP通路重新连接到具有重复脱羧功能的PP循环中。PP途径可以去除一个CO2从葡萄糖-6-磷酸生成核酮糖-5-磷酸供细胞生长。在这个过程中,两个NADPH +两个H+每摩尔碳释放产生的碳,这是氧化PP相。然后,由C5糖经过一系列分子重排生成C3、C4、C6和C7。最后,三个C5分子在非氧化PP相中可以形成两个果糖-6-磷酸分子和一个甘油醛-3-磷酸分子。甘油醛-3-磷酸和果糖-6-磷酸可通过糖异生作用转化回葡萄糖-6-磷酸,再进入氧化PP阶段。部分糖异生作用是PP的氧化和非氧化成分的结合,形成一个代谢循环12我们在这里称之为PP循环(图。1和扩展数据图。1).在这一途径中,每摩尔葡萄糖总共生成12摩尔NADPH。NADPH主要用作生物合成途径中的还原剂,而NADH主要用于能量代谢,它作为电子供体进入呼吸链以产生能量。将NADPH转化为NADH有三种可能的设计方案:(1)可溶性反式氢化酶UdhA的过表达大肠杆菌13,14;(2)甘油醛-3-磷酸脱氢酶(GAPDH)的过表达,该酶同时接受NADP+和NAD+15;(3) NAD过表达+依赖谷氨酸脱氢酶(GDH2)16,17.在这里,我们更倾向于通过过度表达原生基因来实现不可逆的反式氢化酶循环GDH1而且GDH2.Gdh1p,一个NADP+依赖谷氨酸脱氢酶,从氨和-酮戊二酸合成谷氨酸;Gdh2p, NAD+依赖谷氨酸脱氢酶,将谷氨酸降解为氨和-酮戊二酸。这些酶结合在一起,在氨的谷氨酸和-酮戊二酸之间形成一个循环。在这个循环中,一个NADPH被不可逆地转化为一个NADH(图2)。1而且2和扩展数据图。1).
为了产生足够的能量供细胞生长,PP循环应该能够促进相对较高的碳通量。为了测试氧化和非氧化PPP中碳通量的能力,我们删除了pgi1基因创造了葡萄糖代谢的“PP旁路”。如图所示。1 b,没有pgi1基因的菌株E1B (SynENG001),一种进化pdc-野生型酵母菌菌株18(SynENG064)不能以葡萄糖作为唯一的碳源生长,这可能是由于过量的NADPH生成所致。然而,在功能性反式氢化酶循环的背景下,细胞成功地生长到光密度OD600培养5天后= 10 (SynENG065)。通过在磷酸葡萄糖-异构酶节点上阻断糖酵解,所有葡萄糖都应该被迫通过PP途径。E1B菌株是进化而来的pdc-阴性菌株不能生产乙醇。随着发酵(主要来自底物水平磷酸化的能量供应)的取消,氧化磷酸化是细胞的主要能量来源。该菌株具有在细胞质中处理NADH而不将丙酮酸还原为乙醇的能力,即使在高糖培养基中也是如此18.在野生型酿酒酵母,pgi1无效突变体不能在葡萄糖上生长16,17.NAD生产过剩+‐依赖的谷氨酸脱氢酶(GDH2)可以抑制缺乏磷酸葡萄糖异构酶的细胞表型PGI1.与NADPH依赖的谷氨酸脱氢酶(GDH1),循环反式氢化酶系统一起,NADPH的消耗和NADH的生成发生19.这一结果与以往的研究一致19.有缺陷的生长Δpgi1菌株对葡萄糖也可通过表达恢复大肠杆菌反式氢化酶udhA或NADP-GAPDH。然而,并不是所有的酿酒酵母缺乏PGI1的菌株可以通过反式氢化酶的表达获救14.基于我们的研究结果,我们认为这种生长缺陷也可能是由于缺乏能够从NADPH中氧化额外NADH的功能呼吸系统。总之,这些结果证明了Δ的生长限制pgi1这可能是由于缺乏多余的NADPH的再氧化机制。
我们的研究结果清楚地表明,氧化和非氧化PP途径以及反式氢化酶循环的活性可以支持细胞生长,从而为构建合成能量系统提供了一个有前景的切入点。
高度减少化学品产量
产品和细胞底盘自然受到可用底物的化学计量限制,导致生物合成不平衡和次优产品产量。当葡萄糖产生高度还原的化学物质时,真核生物细胞质中还原力的提供通常由于NADH代谢的分隔而受到速率限制。
在TCA循环中,两个CO分子2被释放,电子以NADH的形式保存下来。与TCA循环相比,合成PP循环定位于细胞质中,递归地将葡萄糖氧化为碳,并释放出一个CO分子2同时将电子保存为NADPH。我们提出,通过PP循环的强制性NADPH合成可以进一步刺激碳减排。当与反式氢化酶循环结合时,强制性的NADH合成可以通过这种氧化PP途径的递归使用来实现。这种设计应该能够对真核生物细胞质中的NADH和NADPH供应进行简单的微调。
琥珀酸是一种四碳二羧酸,传统上被用作农业和食品工业的表面活性剂和添加剂20..还原琥珀酸途径有很高的产量,因为它固定一个二氧化碳20..在酿酒酵母NADH是由GAPDH将葡萄糖在细胞质中转化为丙酮酸而产生的。NADH的额外还原能力是由丙酮酸生成琥珀酸所必需的。我们同时过表达丙酮酸羧化酶(PYC2),重定向过氧化物酶体苹果酸脱氢酶(ScMDH3)△SKL)进入细胞质,表达一种延胡索酶大肠杆菌表达内源性富马酸还原酶(ScFRD1)21过度表达了粟酒裂殖酵母苹果酸转运蛋白基因SpMAE1在先前工程的E1B菌株(SynENG001)中,该菌株不能进行酒精发酵(图2)。2和扩展数据图。2).为了使碳通量进入合成PP循环,磷酸果糖激酶通过缺失的方式下调PFK2以及对PFK1.正如预期的那样,结合合成PP循环和反式氢化酶循环导致琥珀酸滴度显著增加,约为3.3 g l1(无花果。2 b).我们还观察到增加NADH会产生甘油(图2)。2摄氏度).甘油的生产酿酒酵母是细胞质NADH失衡的结果吗3..这些结果清楚地证明了额外的NADH被成功生成。
合成还原代谢使能量系统支持细胞生长
对于原生能量系统,NADH可以通过TCA循环在线粒体中反复生成。一个单亚基NADH-泛醌氧化还原酶将线粒体内NADH氧化偶联到呼吸链。酶Ndi1,被称为“内NADH脱氢酶”,催化两个电子从线粒体内NADH转移到呼吸链中的泛醌22,23.电子传递链包括复合物I-IV,它从电子流中提取能量,并利用它来驱逐穿过线粒体内膜的质子。通过合成PP和反式氢化酶循环,我们成功地在细胞质中实现了反复脱羧。为了从细胞质中产生的NADH获取能量,我们过表达了两种外部NADH脱氢酶同工酶,NDE1和NDE2(参考文献)。3.,24),可填补细胞质NADH与线粒体膜中电子传递链之间的空隙,生成ATP(图。3和扩展数据图。1).
为了验证这一假设,在进化中,反式氢化酶循环和线粒体外NADH脱氢酶同工酶过表达pdc-阴性,e1b衍生菌株(SynENG001)。非同义突变MTH1通过抑制几种己糖转运体基因的表达来缓解E1B菌株的葡萄糖抑制,这些己糖转运体基因限制了葡萄糖的转运,并根据葡萄糖的TCA循环为菌株提供了功能性氧化呼吸。随着发酵的取消(主要由底物水平磷酸化提供能量),氧化磷酸化成为该菌株的主要能量来源。使用这种合成能量设计,SynENG012的细胞生长甚至比对照菌株更弱(图2)。3 b).我们认为,这一发现表明过度脱羧/NADH生成或NADH和NADPH失衡对细胞是有毒的。为了进一步验证这一假设,原生TCA循环通过替换启动子来下调IDH2(线粒体NAD亚基2 (+)依赖异柠檬酸脱氢酶)与较弱的替代品,有或没有第二发动机设计(合成能源系统)25.没有合成能量系统,随着启动子减弱,细胞生长减弱,在平板上观察不到存活的菌落(图。3 c).我们认为这种细胞生长缺陷是由于缺乏能量造成的。然而,在合成能源系统的背景下,作为IDH2表达减弱,细胞生长改善(图;3 d;学生的t在菌株SynENG017和SynENG022之间进行-试验,P= 0.11)。比较菌株SynENG017和SynENG022PGU1启动子的IDH2,我们观察到合成能量系统可以取代TCA循环,为增强细胞生长提供能量。
通过合成还原代谢加速脂肪生成
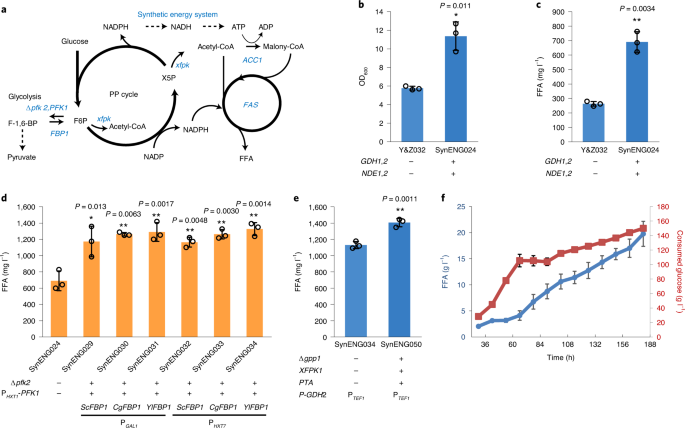
在产油真菌中,脂质过剩的启动是由线粒体NAD活性受损触发的(+)依赖异柠檬酸脱氢酶Idhp26,导致柠檬酸盐从线粒体输出到细胞质。在我们之前的研究中,为了模拟这种效应并将额外的碳通量引入自由脂肪酸(FFAs)的生产25我们通过删除的方式取消了Idhp活动IDH1(线粒体NAD亚单位1 (+)依赖异柠檬酸脱氢酶)和/或IDP1(线粒体nadp特异性异柠檬酸脱氢酶)。但是,删除IDH1(菌株Y&Z047)导致FFA滴度大大降低,生物量产量降低,并且增加了一倍IDH1- - - - - -IDP1缺失是致命的。动态控制异柠檬酸脱氢酶的表达IDH2促销品换成了HXT1该启动子被高浓度葡萄糖诱导,低浓度葡萄糖抑制,从而产生菌株Y&Z032。在菌株Y&Z032中,系统优化了FFA生物合成和基于atp -柠檬酸裂解酶的乙酰辅酶a通路。进一步的细节显示在扩展数据图中。3..我们使用葡萄糖缓释饲料珠在烧瓶中评估菌株的性能,这可以模拟葡萄糖限制发酵,以避免Crabtree效应。然后我们发现Y&Z032的细胞生长和FFA的产生都减少了。我们认为,由于动态TCA循环或动态TCA循环导致的能量供应不足导致了较低的FFA滴度和生物量产量减少IDH2表达式。为了验证这一假设,我们在菌株Y&Z032中引入了合成能量系统、反式氢化酶循环和线粒体外NADH脱氢酶同工酶。生物量产量随后提高了约100%(图。4 b),但更有趣的是,FFA滴度增加了约200%(图。4摄氏度)因为FFA的产生部分是与细胞生长耦合的。这些结果进一步证明,合成能量系统可以支持细胞生长和高度还原的化学物质的生产。
一个, FFA生产的双引擎示意图。b合成能量系统可以取代TCA循环来支持细胞生长。c合成能源系统可以取代TCA循环,支持FFA生产。d,增加脱羧有利于FFA的产生。eNOG途径与合成能量系统协同作用,增加了FFA的产量。一个- - - - - -e,使用Student 's进行统计分析t-test(双尾,双样本不等方差,*P< 0.05, **P< 0.01, ***P< 0.001;样本大小,n= 3)。每次实验至少进行两次独立测量,平均±s.d。在三个生物重复中显示了一个有代表性的测量。所有细胞按照实验程序进行培养。f,菌株SynENG058在限糖限氮条件下分批补料发酵。图中包括批数据和馈入批数据。中心和误差条代表平均值±s.e.m。(n= 3个生物独立的样本)。
然后,我们尝试通过过表达涉及以下途径的关键代谢基因来增强PP循环:(1)ZWF1编码葡萄糖-6-磷酸脱氢酶,该酶催化PP途径的不可逆和限速的第一步,主要负责NADP的NADPH再生+;(2)GND1,编码主要的磷酸葡萄糖酸脱氢酶,催化NADP的第二次氧化还原+NADPH;和(3)TKL1而且TAL1,分别编码转酮醇酶和转醛缩酶,两者都是PP循环的非氧化分支的一部分。结合PFK2删除和各种启动子的PFK1,这些酶的过表达大大提高了FFA的产量,如图扩展数据图所示。4.基于这些数据,NADPH和/或ATP可能仍然是FFA生物合成的限速步骤。
先前的研究表明,糖异生酶果糖-1,6-双磷酸酶的过表达可以增加NADPH的供应棒状杆菌属glutamicum通过糖酵解通量重定向到PP途径25.除了果糖-1,6-二磷酸酶编码基因的过表达,FBP1,我们还通过同时删除基因来下调磷酸果糖激酶的活性PFK2并实现动态控制PFK1基因表达(图;4).具体来说,我们测试了三种不同的FBP1同系物的酿酒酵母(ScFBP1),c . glutamicum(CgFBP1),Yarrowia lipolytica(YlFBP1).为了避免潜在的徒劳循环PFK1而且FBP1,采用不同的碳源响应启动子,如图所示。4 d.PFK1是由HXT1启动子,在高葡萄糖浓度下被诱导,在低葡萄糖浓度下被抑制。不同背景的表达FBP1基因是由GAL1p,这是由半乳糖的存在,或由HXT7p,在高葡萄糖浓度下被抑制,在低葡萄糖浓度下被诱导,或通过添加半乳糖。如图所示。4 d,通过优化菌株SynENG031和SynENG034将额外的碳通量分流到合成能量系统的PP循环中,FFA滴度进一步提高(约90%)。菌株SynENG034表现出较高的NADPH:NADP+比SynENG024(扩展数据图;5 b).NADPH是一种对自由基解毒和稳定细胞氧化还原状态必不可少的分子,因为它为抗氧化酶的循环提供了还原能力。SynENG034还显示出更强的抗氧化剂,如H2O2(扩展数据图。5 d).
脂肪生成是一个典型的还原代谢过程,由葡萄糖产生脂肪酸。它需要NADPH, ATP和前体乙酰辅酶a以2:1:1的比例平衡供应。我们证明了辅因子(NADPH, ATP)和前体乙酰辅酶a之间的比例可以通过优化FBP1和PFK1的表达水平来微调(图1)。4 d).此外,根据我们的设计并经过微调GDH2和反式氢化酶循环,我们可以调整NADPH和ATP的比例,进一步提高FFA滴度。为了验证这一假设,菌株SynENG034TEF1启动子的GDH2被一系列动态启动子所取代,包括来自HXT1,HXT3,HXT4,PFK27而且COX5B这是由高水平的葡萄糖诱导的,而低水平的葡萄糖则会抑制27.然而,我们没有观察到FFA滴度有任何实质性的改善(扩展数据图。6).然后我们在菌株SynENG028中评估了这一策略。在该菌株中,辅因子与前体乙酰辅酶a的比值低于SynENG034(扩展数据图4和图4)。4 d),结果没有增加FFA滴度(扩展数据图。6 b).我们预计,这一发现的原因可能是酵母细胞控制了NADPH和ATP生产之间的比例,使其与基于细胞生长的脂肪酸生产需求相匹配。考虑到我们减少了F6P到F1、6P的转化,碳通量到来自细胞质乙酸盐或线粒体柠檬酸盐的前体乙酰辅酶a可能限制了FFA的生物合成。因此,我们实现了异源磷酸酮酶途径28,由磷酸酮醇酶组成双歧杆菌谕令(Bbxfpk)和磷酸转乙酰化酶kluyveri梭状芽胞杆菌(Ckpta),并删除GPP1(参考文献。29,30.),以增加乙酰辅酶a的供应。磷酸酮糖能够将F6P和X5P裂解为乙酰-磷酸(图。4).通过这样做,PP循环中的部分碳通量可以直接转向乙酰辅酶a的生成。正如预期的那样,FFA滴度进一步提高了约30%(图。4 e).这个系统很好地说明了工程细胞代谢所涉及的挑战。具体来说,有必要将几种不同的策略结合起来以获得最佳结果,因为很少有单一的瓶颈与特定代谢物的过度生产相关。
工程菌株的分批补料发酵
摇瓶培养有利于微生物细胞工厂的建设和优化;然而,由于栽培控制有限,他们通常无法发现菌株的工业潜力。因此,我们确定了最佳的FFA生产者SynENG050在限糖和限氮补料批量培养中的特性。但是,由于菌株积累了高浓度的乙醇,使用了该方法HXT1基因启动子IDH2,高水平葡萄糖会诱导TCA周期关键基因的表达,低水平葡萄糖会抑制该基因的表达。换句话说,一旦血糖水平过高,酿酒酵母会由于克拉布特里效应而通过发酵积累乙醇。然而,当我们降低葡萄糖摄取率时HXT1启动子被抑制。没有IDH2, TCA循环受损的细胞无法完全消耗过量产生的乙醇。此外,如图扩展数据图所示。7醋酸盐的积累证实了以乙醇或醋酸盐为碳源的菌株SynENG034的细胞生长缺陷。为了解决这个问题并生成一个更健壮的应变,我们改为表达IDH2在SynENG050中获得一个全功能的TCA循环,从而得到SynENG055。然而,SynENG055的滴度从1405 mg l降低到9801(应变SynENG050)。我们假设一个过强的TCA循环竞争了脂肪酸合成的碳流。为了进一步加强FFA合成的碳流,引入了另一种硫酯酶TesA ',导致FFA滴度增加了约40%(菌株SynENG056;扩展数据图。8).SynENG056滴度恢复为1485 mg l1.然后,我们对分批补料培养的最佳菌株SynENG056进行了表征。然而,该菌株积累了大量的葡萄糖(扩展数据图。9).相应地,细胞也产生大量的甘油和琥珀酸(扩展数据图。9 b),其生物合成需要细胞质中充足的NADH供应。这些数据表明,糖酵解通量在F6P点被有效地降低,并进入PP循环,这意味着我们的合成能量系统在发酵罐条件下是有效的。我们认为葡萄糖和竞争性副产物的积累是由于FFA通路或/和FAA输出的薄弱,这可能消耗更多的NADPH,从而减少NADH的生成。为了验证这一假设,我们过度表达了全通路基因,包括FAS1,FAS2,Xfpk,家长会,德莎”而且ACC1S659A, S1157A,结果得到菌株SynENG058。我们在一个有十二烷层的发酵罐中评估了该菌株,这可能进一步增加FFAs的出口。用十二烷萃取,SynENG058产生了近20克升1远期运费协议(无花果。4 f),产率约为0.134 g FFA g1葡萄糖,其对应的最大理论产量的40%(扩展数据图。9 c, d).发酵后,含有FFAs的十二烷层在4°C下变为固体,如图扩展数据图所示。10.这一结果表明十二烷层中含有高浓度的FFAs。
讨论
为了确保适当提供关键的构建单元代谢物——以ATP形式的能量和以NADH/NADPH形式的生物合成还原能量,它们应该以适当的化学计量比合成——细胞已经进化到以高度协调的方式运作的几种途径。最大的生物技术挑战之一涉及基于代谢网络刚性改变这些化学计量比31.此外,不同的底物具有不同程度的约束,这将导致一些代谢中间体或ATP失去平衡而被浪费。
为了解决这一挑战,我们提出了一种合成还原代谢途径的潜力,作为细胞能量产生的一种可推广的方法,以及细胞产生还原性生物产物的能力。我们的合成还原代谢的关键成功之一包括提高了从输入的可变氧化态底物中合成更多还原化合物的效率。从葡萄糖(C6H12O6)转化为生物质(典型的酵母生物质化学成分是CH1.76N0.17O0.56,比葡萄糖的还原程度略高)3.,通过有效碳、能量和氧化还原辅因子的一个化学计量学约束,细胞代谢被优化为化学反应,导致生物合成失衡和更多还原化学物质的次优产物产量4.我们的设计可以改变这些化学计量学,并有可能通过微调碳(前体)、能量(ATP)和辅因子(NADH和NADPH)之间的比例来缓解还原代谢中的这种化学计量学限制。我们可以克服依赖ATP和nadph的生物减碳的局限性。
通过重新布线能量代谢,我们创造了一个人工能量系统。该系统依赖于通过PP途径的氧化成分产生胞质NADPH,该途径被设计为以循环方式重复脱羧操作。我们证明了这种合成的重复脱羧循环可以取代TCA循环产生能量。这种设计也有可能将TCA循环从其在能量生成中的独家作用中解放出来,并且它可以用于crabtree阴性或阳性的葡萄糖限制,补料分批发酵菌株。对于TCA中间衍生化学品的过度生产,也可以考虑完全断开的TCA循环,特别是当这种生产消耗大量ATP时。
酿酒酵母在过去的10年里,代谢已经系统地优化了FFA的生产32.使用这里开发的合成还原代谢,我们可以进一步提高我们的工程菌株的脂肪酸产量,据我们所知,它达到了FFA生产的最大产量酿酒酵母报道到目前为止。这种人工合成的能量系统可以为细胞提供额外的NADH、NADPH和ATP。然而,关于FFA生产过剩,至少有四个关键点:(1)前体乙酰辅酶a供应;(2)辅助因子NADPH和ATP的供应;(3)通过FAS1、FAS2、ACC1等多种因素放松通路;(4)分泌法,即十二烷萃取法。FFAs的产率较低,为0.11 g l1h1.这一低值归因于葡萄糖的摄入速度必须较低(图2)。4 f),这表明由于合成能量系统的适应度较低,效率较低(图。3 d).随着适应度的进一步提高,我们有信心提高FFAs的产量和生产率酿酒酵母可以进一步加强。静息法生产FFAs的异种微生物酿酒酵母细胞代表了这一领域的下一个里程碑。这一目标将需要脂肪酸生物合成与细胞生长完全分离,并深入了解细胞脂质代谢。异质FFA生产的另一个方向是降低材料成本,以碳中性或负性的方式最小化环境足迹,例如使用半光合作用或电化学固碳的化学物质33.
总之,我们的研究结果证明了一种合成的还原代谢/能量系统的建立,该系统能够在细胞质中提供额外的NADH。该途径可以通过替换TCA周期来支持细胞生长。此外,这种合成的还原代谢提高了FFA的生产酿酒酵母.相关的能量代谢重编程证明了这一点酿酒酵母新陈代谢是高度复杂的,但具有显著的可塑性。细胞的组织形式非常多样和灵活。生物工程使研究生命的一般组织原理成为可能。
方法
菌株、质粒和培养条件
所有密码子优化的异源基因均已合成(Genscript),列在补充表中1,所用菌株均列于补充表2.质粒构建使用DNA组装方法或Gibson组装克隆试剂盒(New England Biolabs)。所有菌株均来源于E1B (马塔,ura3-52,his3Δ1,pdc1Δ,pdc5Δ,pdc6Δ)或IMX581 (MATa ura3-52 can1Δ::cas9-natNT2 TRP1 LEU2 HIS3).采用LiAc/SS载体DNA/PEG法进行酵母转化。如前所述,crispr - cas9介导的基因组工程用于其他基于染色体的基因敲除、启动子替换和基因整合34.YPD培养基(10g l−1酵母提取物,20 g l−1蛋白胨20 g l−1葡萄糖;全部来自默克Millipore)用于常规培养酵母菌株。含200 mg l的YPD + G418培养基−1用G418 (Formedium)进行转化子的选择kanMX录音带。CSM-Ura培养基含20g l−1葡萄糖,6.7 gl−1酵母不含氨基酸的氮基(YNB;中)和0.77 g l−1不含尿嘧啶的完全补充混合物(CSM-Ura;Formedium)用于选择尿嘧啶原营养转化子。CSM + 5-FOA培养基,含6.7 g l−1YNB, 0.79 g l−1完全补充混合物(CSM;中)和0.8 g l−15-氟硼酸(5-FOA;Sigma-Aldrich),被用于回收URA3标记。接下来,20克l−1加入琼脂(Merck Millipore)制备固体培养基。需要时,100 mg l−1在培养基中加入组氨酸和/或尿嘧啶。如未指定,为代尔夫特介质357.5 g l−1(NH4)2所以4采用氮源,将3ml十二烷加入20ml液体介质中进行原位提取。
Shake-flask种植
摇瓶批量发酵生产FFAs是在最小介质中进行的35补充60 mg l−1如果需要尿嘧啶。3个独立的单菌落,进行相应的基因改造,接种到15 ml试管中,加入2 ml新鲜最低培养基。预培养24小时后,以初始外径接种600= 0.05,在15毫升最小培养基中,以200转/分的速度培养。30℃保温72 h。当摇瓶发酵进行模拟饲料批次条件,葡萄糖饲料珠(no。SMFB63361,库纳激振器),对应30g l−1以葡萄糖为唯一碳源,在30°C、200转/分的条件下培养96小时。搅动
馈料式发酵
在DasGip平行生物反应器系统(DasGip)的1.0 l生物反应器中进行FFA生产的分批和补料分批发酵。25.在整个发酵过程中,通过进一步添加十二烷,十二烷的百分比保持在15%左右。使用DasGip Control 4.0系统监测和控制温度、搅拌、曝气和pH值36.最初提供的曝气为36标准升每小时(sl h−1),并增加到最大48 sl h−1取决于溶解氧的含量。在分批喂食培养过程中,细胞被喂食400 g l−1葡萄糖溶液以指数增长的速度(米= 0.05 h−1)以维持恒定的生物量葡萄糖消耗率。最小培养基含1.8 g l−1(NH4)2所以4, 18克l−1KH2阿宝4, 3.0 g l−1MgSO4∙7 h2O, 360毫克一−1尿嘧啶、6×微量金属和6×维生素溶液。
代谢物量化
全细胞培养中的游离脂肪酸滴度(本研究仅测量FFAs)采用先前发表的方法定量。脂肪酸从无细胞水上清和十二烷相提取是按照以前发表的方法进行的36.用高效液相色谱法测定细胞外葡萄糖、甘油、乙醇和有机酸的浓度。
统计和再现性
每次量化至少进行了两个独立的实验,从培养三个开始。使用Student 's进行统计分析t-test(双尾,双样本不等方差,*P< 0.05, **P< 0.01, ***P< 0.001;样本大小,n= 3)。
报告总结
有关研究设计的进一步资料,请参阅自然研究报告摘要链接到这篇文章。
数据可用性
支持本研究结果的数据可在文章,补充信息文件和源数据链接到每个图形的文件。
代码的可用性
本文没有使用自定义代码。使用已发表的软件进行气相色谱-质谱和液相色谱-质谱数据分析,如方法.
参考文献
佩斯。生物化学的普遍性质。国家科学院学报美国98, 805-808(2001)。
尼尔森,J. & Keasling, J. D.工程细胞代谢。细胞164, 1185-1197(2016)。
巴克,b.m.等人。NADH代谢的化学计量学和区隔酿酒酵母.《。牧师。25, 15-37(2001)。
Park, J. O.等。协同底物共食刺激还原代谢。Nat,金属底座。1, 643-651(2019)。
于涛,达比里安,刘强,西维尔斯,V. &尼尔森,代谢重组的策略和挑战。咕咕叫。当今。系统。医学杂志。15, 30-38(2019)。
李丽娟,李志刚,李志刚,李志刚。干细胞内稳态与分化的代谢可塑性研究。细胞干细胞11, 596-606(2012)。
钱斯,B. &威廉姆斯,G.呼吸链和氧化磷酸化。放置Enzymol。遗传代数。Mol。Biol。17, 65-134(1956)。
Schwimmer, C.等。增加线粒体底物水平磷酸化可以挽救ATP合酶缺乏酵母的呼吸生长。生物。化学。280, 30751-30759(2005)。
庞格里等人。大肠杆菌作为代谢工程的宿主。金属底座。Eng。50, 16-46(2018)。
连俊,米希拉,赵慧。植物代谢工程研究进展酿酒酵母:新工具及其应用。金属底座。Eng。50, 85-108(2018)。
鲍戈拉德,林宗伟,林宗伟。廖建昌;合成非氧化糖酵解使碳完全保存。自然502, 693-697(2013)。
Park, J. O.等。协同底物共食刺激还原代谢。Nat,金属底座。1, 643-651(2019)。
马克思等人。磷酸葡萄糖异构酶突变体的代谢表型棒状杆菌属glutamicum.生物科技j .》。104, 185-197(2003)。
Heux, S., Cadiere, a . & Dequin, S.缺乏PGI1和表达一种转氢化酶的菌株对葡萄糖的利用表明,在磷酸五糖能力方面存在差异酿酒酵母菌株。FEMS酵母Res。8, 217-224(2008)。
Verho, R.等人。首株真菌NADP-GAPDH的鉴定克鲁维酵母菌属lactis.生物化学41, 13833-13838(2002)。
Ciriacy, M. & Breitenbach, I.糖酵解7个不同块的生理效应酿酒酵母.j . Bacteriol。139, 152-160(1979)。
基因突变抑制磷酸葡萄糖异构酶基因PGI1缺失的影响酿酒酵母.咕咕叫。麝猫。11, 429-434(1987)。
张杨,等。糖代谢的适应性突变恢复了丙酮酸脱羧酶阴性酵母菌对葡萄糖的生长。活细胞。细胞的事实。14, 116(2015)。
Boles, E., Lehnert, W. & Zimmermann, F. K. nad依赖的谷氨酸脱氢酶在恢复葡萄糖生长中的作用酿酒酵母磷酸葡萄糖异构酶突变体。欧元。学生物化学j。217, 469-477(1993)。
张晓林等。琥珀酸生产节能途径的代谢进化大肠杆菌.国家科学院学报美国106, 20180-20185(2009)。
严,D. J.等。还原途径的构建酿酒酵母在低pH值下进行有效琥珀酸发酵。Bioresour。抛光工艺。156, 232-239(2014)。
从鱼藤酮不敏感的线粒体中纯化和鉴定Nadh - Q6氧化还原酶酿酒酵母.欧元。学生物化学j。176, 377-384(1988)。
Marres, C. A. M., Devries, S. & Grivell . L. A.编码鱼藤酮不敏感的内部NADH的核基因的分离和失活:线粒体的泛醌氧化还原酶酿酒酵母.欧元。学生物化学j。195, 857-862(1991)。
卢提克,m.a.h.等人。的酿酒酵母NDE1和NDE2基因编码独立的线粒体NADH脱氢酶,催化细胞质NADH的氧化。生物。化学。273, 24529-24534(1998)。
于,T.等。从酒精发酵到脂肪生成的酵母代谢重编程。细胞174, 1549-1558(2018)。
Beopoulos, A, Chardot, T. & Nicaud, J. M。Yarrowia lipolytica:一个模型和工具,以了解涉及脂质积累的机制。Biochimie91, 692-696(2009)。
凯伦,L.等人。启动子在不同生长条件下保持其相对活性水平。摩尔。系统。医学杂志。9, 1-17(2013)。
林铁生,廖建昌。人工合成的非氧化糖酵解能实现完全的碳保存。自然502, 693-697(2013)。
梅多斯,a.l.等人。改写酵母中心碳代谢的工业类异戊二烯生产。自然537, 694-697(2016)。
刘庆林等。重组酵母中的碳代谢,以高水平生产芳香族化学品。新译本:10:4976(2019)
陈志伟,陈志伟,陈志伟。代谢物过度生产中的网络刚性和代谢工程。科学252, 1675-1681(1991)。
阮古芬,W. & Keasling, J. D.代谢工程酿酒酵母用于生产脂肪酸衍生的生物燃料和化学品。金属底座。Eng。21, 103-113(2014)。
刘永哲等。生物燃料为可持续的未来。细胞184, 1636-1647(2021)。
于,T.等。代谢工程酿酒酵母用于生产长链脂肪酸衍生化学品。Commun Nat。8, 15587(2017)。
Verduyn, C., Postma, E., Scheffers, W. a . & Van Dijken, J. P.苯甲酸对酵母代谢通量的影响:对呼吸和酒精发酵调节的连续培养研究。酵母8, 501-517(1992)。
朱,Z.等。多维工程酿酒酵母用于中链脂肪酸的高效合成。Catal Nat。3., 64-74(2020)。
确认
J.N.感谢诺和诺德基金会(no。NNF10CC1016517)、克努特和爱丽丝·瓦伦堡基金会以及瑞典战略研究基金会。感谢国家重点研发计划项目(no. 2020YFA0907800和2021YFA0911000)、国家自然科学基金项目(no. 2020yfa0911000);国家自然科学基金(NSFC 32071416),深圳合成生物研究所科研项目(批准号:;深圳市微生物制剂智能制造重点实验室(JCHZ20200003);ZDSYS20210623091810032)。我们感谢Y. J. Zhou, D. Florian和Z. Zhu的重要讨论,以及Chalmers质谱基础设施对代谢物分析的帮助。
资金
查尔姆斯理工大学提供的开放获取资金。
作者信息
作者及隶属关系
贡献
T.Y.和J.N.构思了这项研究。T.Y.设计并执行了大部分实验,分析了数据并起草了手稿。q.l工程琥珀酸生产,并协助代谢产物分析和发酵。X.L.和X.W.进行细胞生长试验和NADPH测定。Y.C.协助数据分析和解释。Y.C.和J.N.修改了手稿。所有作者对稿件进行了修改和批准。
相应的作者
道德声明
相互竞争的利益
J.N.是Biopetrolia AB的股东。T.Y.是CHO Biosynthesis的股东。所有其他作者都声明没有利益冲突。
同行评审
同行评审信息
自然的新陈代谢感谢匿名审稿人对本工作的同行评议所作的贡献。主要处理编辑:Alfredo Giménez-Cassina,与自然的新陈代谢团队。
额外的信息
出版商的注意施普林格自然对出版的地图和机构从属关系中的管辖权主张保持中立。
扩展数据
扩展数据图1综合能源系统示意图。
合成能源系统包含三个模块。首先,通过下调酶的表达,将PP通路转化为PP循环PFK1/2,这使得重复脱羧。H +以NADPH的形式携带。其次,引入一个转氢化酶循环,将NADPH转化为NADH。最后,细胞质中的NADH被转移到线粒体膜中的呼吸链上产生能量。
扩展数据图2图中菌株的遗传修饰2.
一个,本研究相关酵母菌株的流程图。详情见补充表2.b琥珀酸生产菌株的构建。E1B菌株作为背景菌株,这是一种进化菌株pdc负面压力。本机PYC2而且FRDS1过表达。本机MDH3通过删除c端信号重新定位到细胞质中。一个FumC将来自大肠杆菌的基因导入到菌株中,而原生菌株FUM1被删除。
图3菌株Y&Z032的遗传修饰。
的IDH2Y&Z032中线粒体NAD(+)依赖异柠檬酸脱氢酶基因亚基2表达HXT1启动子,在高葡萄糖浓度下被诱导,在低葡萄糖浓度下被抑制。其他修改也如图所示。
图4合成能源系统支持FFAs生产。
增加脱羧有利于FFAs生产。糖酵解的微调是通过下调磷酸果糖激酶PFK1和删除PFK2来实现的。本机PFK1启动子(100%)被较弱的启动子取代VMA6p(47%),CDC24(25%),SET3(12%),IDP1(6%),分别。细胞生长和脂肪酸水平如图所示一个和图b.统计分析是使用学生的t以及(单侧;双样本不等方差;*P< 0.05, **P< 0.01, ***P< 0.001;样本大小,n= 3)。每次实验至少进行两次独立测量,平均±s.d。在三个生物重复中显示了一个有代表性的测量。所有细胞按照实验程序进行培养。
图5合成还原代谢增加NADPH/NADP +比值。
一个,在1%+0.5%葡萄糖环境中生长的SynENG024和SynENG034中NADPH/NADP +的细胞内比率的测量。b,在1%+0.5%半乳糖中生长的SynENG024和SynENG034中NADPH/NADP +的细胞内比率的测量。结果显示三个独立实验的平均值,误差条表示标准偏差。c酵母细胞SynENG024在胁迫剂(H2O2)在SD/-Ura基础培养基上加1%乙醇和0.5%葡萄糖。d酵母细胞SynENG034在胁迫剂(H2O2)在SD/-Ura基础培养基上加1%乙醇和0.5%葡萄糖。e酵母细胞SynENG024在胁迫剂(H2O2)在SD/-Ura基础培养基上加1%乙醇和0.5%半乳糖。f酵母细胞SynENG034在胁迫剂(H2O2)在SD/-Ura基础培养基上加1%乙醇和0.5%半乳糖。与无花果有关。4.
图6转氢化酶循环的动态调控。
一个动态调节转氢化酶循环对高NADPH供给的FFAs产量无影响。通过微调GDH2表达实现了转氢酶循环的动态调控。碳源依赖启动子,如HXT1, HXT3, HXT4, PFK27和COX5B,被使用。这些启动子被高水平的葡萄糖诱导,并被低水平的葡萄糖抑制。TDH3启动子作为第二个对照。如图所示,背景菌株SynENG034具有较高的NADPH供给水平。4 d.b动态调节转氢化酶循环对低NADPH供给的FFAs产量无影响。通过微调GDH2表达实现了转氢酶循环的动态调控。碳源依赖启动子,如HXT1, HXT3, HXT4, PFK27和COX5B,被使用。这些启动子被高水平的葡萄糖诱导,并被低水平的葡萄糖抑制。TDH3启动子作为第二个对照。背景菌株SynENG034具有高水平的NADPH供应,如图扩展数据图所示。3..统计分析是使用学生的t以及(单侧;双样本不等方差;*P< 0.05, **P< 0.01, ***P< 0.001;样本大小,n= 3)。每次实验至少进行两次独立测量,平均±s.d。在三个生物重复中显示了一个有代表性的测量。所有细胞按照实验程序进行培养。
图7菌株SynENG050在限糖限氮条件下分批补料发酵
一个菌株SynENG050的基因修饰。b,显示发酵过程中乙醇(红色符号)、乙酸(绿色符号)和甘油(浅蓝色符号)的时间过程。
图9葡萄糖限制和氮限制条件下的分批补料发酵。
一个、菌株SynENG056发酵过程中残留葡萄糖的时间进程。b,显示了菌株SynENG056发酵过程中乙醇(红色符号)、甘油(绿色符号)和琥珀酸盐(浅蓝色符号)的时间过程。c、菌株SynENG058发酵过程中干细胞质量的时间变化规律。d,显示了菌株SynENG058发酵过程中琥珀酸(蓝色符号)、甘油(红色符号)、乙酸(绿色符号)和乙醇(紫色符号)的时间过程。
扩展数据图10十二烷萃取。
一个,纯十二烷。b十二烷与FFAs发酵后。c,十二烷与FFAs发酵后可支持1毫升吸管尖的重量。d,十二烷发酵后分层。(发酵后约120毫升培养基1瓶,4°C保存12小时)。
源数据
图1 .来源数据
统计源数据。
图2 .来源数据
统计源数据。
图3 .源数据
统计源数据。
图4 .来源数据
统计源数据。
图4 .扩展数据
统计源数据。
图5 .源数据扩展数据
统计源数据。
图6 .源数据扩展数据
统计源数据。
图7 .源数据扩展数据
统计源数据。
图8 .源数据扩展数据
统计源数据。
图9 .源数据扩展数据
统计源数据。
图10 .源数据扩展数据
统计源数据。
权利和权限
开放获取本文遵循知识共享署名4.0国际许可协议(Creative Commons Attribution 4.0 International License),允许以任何媒介或格式使用、分享、改编、分发和复制,只要您对原作者和来源给予适当的署名,提供知识共享许可协议的链接,并注明是否有更改。本文中的图像或其他第三方材料包含在文章的创作共用许可中,除非在材料的信用额度中另有说明。如果内容未包含在文章的创作共用许可协议中,并且您的预期使用不被法定法规所允许或超出了允许的使用范围,您将需要直接获得版权所有者的许可。要查看此许可证的副本,请访问http://creativecommons.org/licenses/by/4.0/.
关于本文
引用本文
于涛,刘强,王鑫,刘强。et al。代谢重构使酵母中的合成还原代谢成为可能。Nat金属底座4, 1551-1559(2022)。https://doi.org/10.1038/s42255-022-00654-1
收到了:
接受:
发表:
发行日期:
DOI:https://doi.org/10.1038/s42255-022-00654-1
这篇文章被引用
无TCA循环的合成代谢
自然的新陈代谢(2022)