新出现的临床分析表明,COVID-19后新发糖尿病的风险增加,但因果关系和潜在机制尚未确定。疾病消退后的持续高血糖和非胰腺组织的潜在感染使COVID-19与糖尿病之间的关系又增加了一层复杂性。
糖尿病(DM)是COVID-19严重疾病和死亡的公认危险因素,但感染后代谢失调的临床和实验室证据越来越多,这提出了一个问题,即SARS-CoV-2本身是否会引发或加速DM的发展。
临床和流行病学证据
在大流行早期阶段新发高血糖与感染同时出现的初步报告后,几项大型队列研究现在表明,两种1型糖尿病(T1D)的新发糖尿病(DM)风险总体增加。1,22型糖尿病(T2D)3.,4,5,6COVID-19感染后。然而,对于T1D,流行病学数据是有争议的2和苏格兰1登记处注意到,在SARS-CoV-2感染人数达到峰值后不久,儿童和青少年的T1D诊断有所增加,而来自加拿大的一项更大规模的基于人群的重复横断面研究7没有。大流行间接导致的自然发生的T1D延迟诊断可能会使这些结果混淆,而在新发糖尿病儿童中验证过去COVID-19感染的挑战进一步使关联研究复杂化。
与此同时,COVID-19与新发T2D相关的证据似乎更加有力。对患者电子记录的调查显示,感染后12周内新发DM的风险总体上增加3.在COVID-19诊断后91天内接受胰岛素处方的可能性增加3.以及12个月随访时发生糖尿病和高血糖的过度负担(其中> 77%分层为T2D)4.这些患者从COVID-19恢复后,是否以及何时恢复血糖控制仍不清楚。在一些队列中,63-79%的患者在康复6个月后血糖控制有所改善5,841-79%的患者在康复10个月后得到改善5,6.高达56%的患者仍然高血糖6.另一组在急性感染期间患有血糖异常的COVID-19住院患者在7个月的随访中显示急性后期恢复到生理性血糖控制9.
尽管不确定患病率和持久性,但血糖异常可能是SARS-CoV-2急性后后遗症(PASC)的一个潜在方面,通常也被称为“长COVID”(或“LC”)。然而,这些发现也不一定意味着SARS-CoV-2感染有直接的糖尿病诱发作用,因为在非covid急性呼吸窘迫综合征后也会观察到高血糖,这可能是全身炎症的结果10.尽管如此,新发T2D的发生率3.,4,5,6以及胰岛素抵抗8covid后表明,SARS-CoV-2感染可能会促进高危人群的β细胞衰竭。
值得注意的是,与未接种疫苗的个体感染相比,接种疫苗后的突破性感染与PASC背景下DM发病率的显著降低无关。然而,胰岛素使用风险的降低表明,先前存在的免疫可以改善代谢失调的严重程度11.此外,最近的预印本表明,新发DM伴多次再感染的风险不断累积12.由于伦理原因,人类胰岛素和葡萄糖水平与β细胞感染程度的相关时间分辨数据总是缺乏的,这将限制我们的实验知识局限于动物模型,包括非人类灵长类动物。总的来说,COVID-19后任何类型的新发糖尿病的长期风险和负担,特别是考虑到新出现的免疫逃避变异和多种后续感染,只能通过在未来几年提供长期随访数据和综合数据集的人群水平研究来澄清。
SARS-CoV-2感染胰腺β细胞的研究
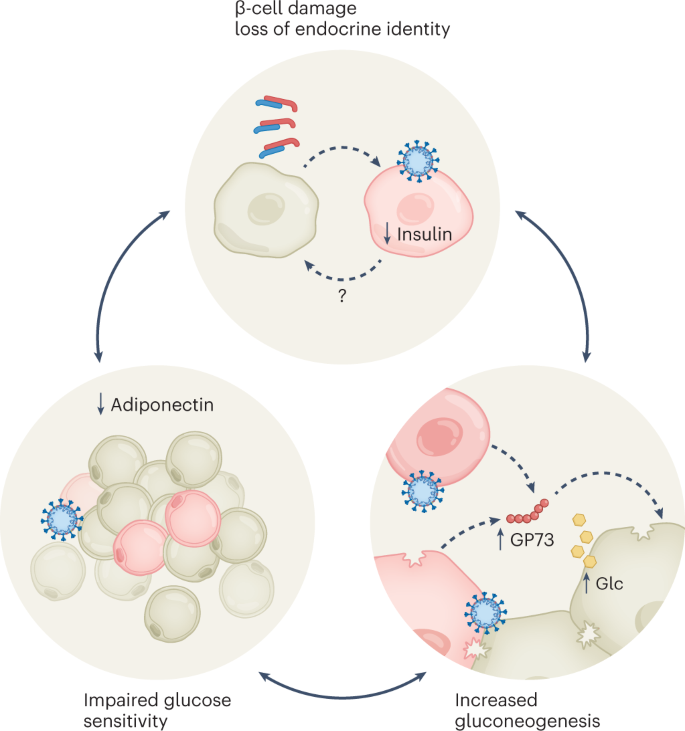
SARS-CoV-2进入受体ACE2是否在胰腺组织,特别是β细胞中表达,一直存在广泛争议13,14,15.这种“ACE2争论”是由供体可变性、使用的不同样本类型(原发性胰岛、干细胞来源的内分泌细胞和自溶程度不同的尸检样本)和抗体的可变特异性共同促成的,抗体可以与ACE2的短或长亚型相互作用,也可以与两者相互作用13,15.然而,多项研究,在某些情况下,甚至是最初怀疑两种经典入口因子存在的小组发表的研究,清楚地显示了ACE2和TMPRSS2在β细胞中的表达16,17.此外,ace2增强因子Neuropilin-1的表达表明胰腺β细胞中存在额外的病毒进入途径,这表明β细胞对SARS-CoV-2感染具有易感性13,14,18.外分泌胰腺细胞和胰腺微血管对病毒感染的易感性可能有助于传播到胰腺的内分泌细胞,但它也可能导致胰腺炎症本身的代谢变化19.越来越多的证据表明,β细胞可以在体外感染,也可以在死于COVID-19或因COVID-19而死亡的患者体内感染13,14,18.β细胞感染已被证明与内分泌特性的丧失有关,导致与胰岛素产生和释放相关的基因表达减少,从而改变形态和功能。具体地说,感染与脱颗粒有关13,葡萄糖刺激的胰岛素分泌受损13,18去分化或转分化13,20.,或细胞死亡14,18(无花果。1).虽然β细胞转分化在T2D中的发生和相关性在人类中仍然存在争议21在一项使用人类胰岛和尸检的优雅研究中,报告了SARS-CoV-2感染后β细胞可塑性获得α细胞和腺泡细胞命运。值得注意的是,真核起始因子2 (eIF2)信号通路在这里被确定为一种“可用药”机制,以防止转分化20..与这一观察结果一致,最近的一项研究显示,在T2D进展过程中,一定比例的胰岛细胞转化为外分泌样细胞,这表明病理性的胰岛可塑性可能也是T2D β细胞衰竭的潜在原因22.因此,在感染SARS-CoV-2的非人类灵长类动物中,观察到SARS-CoV-2胰腺感染,动物出现t2d样表型,伴随β细胞萎缩和颗粒度降低23.与患者一样,并非所有动物都出现高血糖(50%出现高血糖)或血清胰岛素水平升高(37.5%出现高血糖)。23;这种变异的潜在原因尚不清楚,尽管上述病毒进入蛋白表达的个体间变异可能提供了部分解释13.
胰腺以外糖代谢失调的机制
β细胞感染程度17,再加上人体内固有的高胰岛素储备,不能单独解释COVID-19后新发糖尿病,这表明存在其他机制。鉴于SARS-CoV-2具有广泛的组织嗜性,感染其他(内分泌)器官并导致代谢失调并不令人惊讶。最近阐明的脂肪细胞和肝脏SARS-CoV-2感染机制提供了与T2D发病率增加及其对肥胖依赖的潜在联系(图2)。1):首先,成熟的脂肪细胞被证明支持病毒复制,56%死于COVID-19的男性的脂肪组织中发现了SARS-CoV-2蛋白。值得注意的是,脂肪细胞中的病毒物质只在超重或肥胖的男性中检测到24这与大队列研究中男性占主导地位的情况一致,报告了糖尿病发病风险增加4.在女性中,该研究没有发现BMI和病毒RNA水平之间的明确联系,并不是所有的研究都证实了男性的这种关系10,24.一旦在体外感染SARS-CoV-2,脂肪细胞分泌的脂联素减少10.脂联素具有胰岛素增敏特性,因此,正如在显示低脂联素和高c肽浓度的COVID-19患者中所显示的那样,脂联素的缺乏可能导致全身性胰岛素抵抗10.
肝感染可能会进一步加剧胰岛素抵抗——肝细胞和各种其他组织中的细胞感染SARS-CoV-2会增强应激诱导的糖生成因子GP73的分泌,从而促进肝细胞的糖异生25.因此,COVID-19患者的血清GP73水平升高,这与血糖水平相关25.总之,这些发现为某些患者队列中新发T2D (bmi依赖)发病率的机制解释4.此外,这些与非胰腺组织感染相关的后果可能解释了在covid -19后患者的分泌组中观察到的过度炎症,随后导致胰岛素抵抗和β细胞的过度刺激8.
尽管性别和肥胖特异性差异还需要进一步研究,但SARS-CoV-2对健康葡萄糖代谢至关重要的细胞和器官的感染可能会引发糖尿病的新发作。糖尿病前期患者可能特别脆弱,因为感染通过胰岛素敏感性降低、糖异生增加以及随后胰岛素需求增加的恶性循环,最终推动β细胞衰竭。而病毒对β细胞的直接损伤导致其病理可塑性和功能进一步减弱。反之亦然,正如在covid后患者中观察到的那样,胰岛素释放失控和过量也可能是由于感染和全身炎症进一步加速了β细胞衰竭。
我们要去哪里?
考虑到COVID-19和糖尿病之间的双向关系,糖尿病是一种与更严重后果相关的共病,但也可能是感染本身的结果,因此,彻底了解潜在机制,以实现有针对性的干预,并减少正在发生的大流行中可能上升的高医疗负担将至关重要。一些重要的问题仍然悬而未决或只得到了部分答案(表1).找到这些问题的答案将是代谢研究界在不久的将来的一项关键任务。
这些问题只能通过结合具有长期和全面随访数据的人群水平临床队列研究,以及体外研究和动物模型的详细机制研究来解决。目前的研究受到队列异质性的限制,主要集中在住院患者,忽视了绝大多数仍面临PASC的“轻度”COVID-19病例。不完整的数据集,例如缺乏感染证据或缺乏自身抗体检测或DM亚型分层,进一步阻碍了我们建立COVID-19/DM联系因果关系的能力。
由于临床研究中的随机化在伦理上是不可能的,而且目前的啮齿动物模型仅能不完全概括COVID-19,因此,具有时间分辨率的大型动物模型可以获得各种dm相关组织,包括胰腺和体液(例如,血液和粪便,以研究微生物组),因此非常有必要填补目前在理解SARS-CoV-2病理生理学方面存在的机制差距。由于与新变异相关的死亡率较低和免疫接种率高,公共卫生措施放松,提高了警惕,因此感染率仍然居高不下,再次感染的风险也有所增加,但澄清新发糖尿病和PACS的其他方面的发病率和负担将至关重要。
糖尿病已经是全世界最常见的非传染性疾病之一。即使假设发病率和短暂性较低,目前全球6亿例COVID-19病例也可能使糖尿病诊断人数大幅增加,进一步危及世卫组织和联合国制定的减少非传染性疾病造成的疾病负担上升的目标,这些目标是《2030年可持续发展议程》的一部分。因此,政策制定者可能需要重新考虑他们的战略,即主要根据死亡率和医院占用率来制定公共卫生措施的严格程度,以防止对人口、经济和本已紧张的医疗系统造成过度负担。
参考文献
McKeigue, p.m.等人。糖尿病护理https://doi.org/10.2337/dc22-0385(2022)。
Kamrath, C.等人。糖尿病护理45, 1762-1771(2022)。
Rezel-Potts, E.等人。科学硕士。19, e1004052(2022)。
谢艳&阿尔-阿里,Z。《柳叶刀糖尿病内分泌》。10, 311-321(2022)。
达斯古普塔,R.等人。J.糖尿病并发症36, 108100(2022)。
克罗默,S. J.等。J.糖尿病并发症36, 108145(2022)。
舒尔曼,R.,科恩,E.,斯图克尔,T. A., Diong, C. & Guttmann, A.。JAMA Netw。开放5, e2223394(2022)。
蒙特弗斯科,L.等。Nat,金属底座。3., 774-785(2021)。
劳伦兹,A.等人。j .中国。性。金属底座。107, e1009-e1019(2022)。
韦勒等人。细胞金属底座。33, 2174 - 2188。e5(2021)。
Al-Aly, Z., bowwe, B. & Xie, Y.。Nat,地中海。28, 1461-1467(2022)。
Al-Aly, Z. & bowwe, B。预印在https://doi.org/10.21203/rs.3.rs-1749502/v1(2022)。
Müller, J. A.等。Nat,金属底座。3., 149-165(2021)。
Steenblock, C.等人。Commun Nat。12, 3534(2021)。
Fignani, D.等人。前面。性。(洛桑)11, 596898(2020)。
Kusmartseva, I.等人。细胞金属底座。32, 1041 - 1051。e6(2020)。
van der Heide, V.等。细胞的代表。38, 110508(2022)。
吴,C.-T。et al。细胞金属底座。33, 1565 - 1576。e5(2021)。
Pandanaboyana, S.等。肠道70, 1061-1069(2021)。
唐,等。细胞金属底座。33, 1577 - 1591。e7(2021)。
巴特勒,A. E.等。j .中国。性。金属底座。101, 523-532(2016)。
Amo-Shiinoki, K.等。江森自控的洞察力6, e143791(2011)。
米莱特,K.等。预印在https://doi.org/10.21203/rs.3.rs-592374/v1(2021)。
齐克勒,等人。细胞金属底座。34, 1-2(2022)。
Wan, L.等。Nat,金属底座。4, 29-43(2022)。
确认
我们感谢乌尔姆大学医学中心内科I系Martin Heni教授提供的有益讨论。
作者信息
作者及隶属关系
相应的作者
道德声明
相互竞争的利益
作者声明没有利益竞争。
同行评审
同行评审信息
自然的新陈代谢感谢Ziyad Al-Aly和其他匿名审稿人对这项工作的同行评议所作的贡献。
权利和权限
关于本文
引用本文
Groß, R, Kleger, A. COVID-19和糖尿病-我们现在在哪里?Nat金属底座4, 1611-1613(2022)。https://doi.org/10.1038/s42255-022-00691-w
发表:
发行日期:
DOI:https://doi.org/10.1038/s42255-022-00691-w