癌症疫苗可以引发肿瘤特异性T细胞,但通过免疫检查点疗法(ICT)维持其功能可能需要强大的抗肿瘤免疫。一项新的研究表明,在临床前模型中,新抗原癌症疫苗与抗pd - l1 ICT协同作用,并提供了这种协同作用的机制见解。
抗体阻断免疫检查点(例如CTLA-4和PD-1或PD-L1)可以释放T细胞破坏肿瘤,但并非所有患者都受益于ICT1.尽管ICT阻断了“检查点”的功能以减轻T细胞的抑制,但通过接种疫苗增加效应T细胞的数量一直是一种有吸引力的癌症治疗策略。由于T细胞通过其T细胞受体(TCR)主要识别主要组织相容性复合体(MHC)上呈现的外源或非自身肽,因此识别来自病原体的MHC结合肽的T细胞可以很容易地通过疫苗诱导。癌症疫苗的原理是,源自身体自身细胞出现问题的癌细胞可以产生抗原,这些抗原可以被T细胞识别为“外来”2.因此,癌症疫苗通常由肿瘤蛋白或多肽,或用于产生这些肿瘤抗原的分子模板(如基于病毒载体和DNA或rna的疫苗)和免疫佐剂组成。
与信息和通信技术相比,过去几十年进行的治疗性癌症疫苗临床试验基本上产生了负面结果,并导致癌症疫苗开发普遍放弃3..这些令人失望的结果可能至少部分归因于免疫检查点对T细胞反应起到了“刹车”的作用,在进行许多癌症疫苗试验时,这一概念尚不为人所知1.此外,大多数癌症疫苗靶向肿瘤相关抗原,这些抗原来源于癌细胞异常表达的自身蛋白,由于对非突变的自身肽的免疫耐受,这种抗原本身可能不是最佳的2,3..免疫基因组学方法的出现促进了基于源自体细胞改变(例如,点突变、插入或缺失、基因融合)的肿瘤特异性新抗原的癌症疫苗的开发。4,5.治疗性新抗原疫苗可以在临床前模型中诱导强大的抗肿瘤免疫4,6,7早期个体化新抗原疫苗临床试验表明它们可能具有临床疗效3.,8,9,10,11,12.尽管这些发现令人鼓舞,但疫苗诱导的肿瘤特异性T细胞可能遵循与非疫苗诱导的T细胞相同的途径,后者经常失去抗肿瘤效应功能并变得功能失调或耗尽,部分原因是免疫检查点受体PD-1与其主要配体PD-L1之间的相互作用13.事实上,早期临床试验的数据表明,新抗原疫苗与抗pd -1或抗pd - l1联合使用可能会提高疗效9.在本期的自然癌症Liu等人提供的证据表明,与单一治疗相比,联合新抗原疫苗接种和抗pd - l1 ICT提供了更好的抗肿瘤免疫,并进一步定义了联合治疗诱导的T细胞促进肿瘤细胞破坏的特征14.
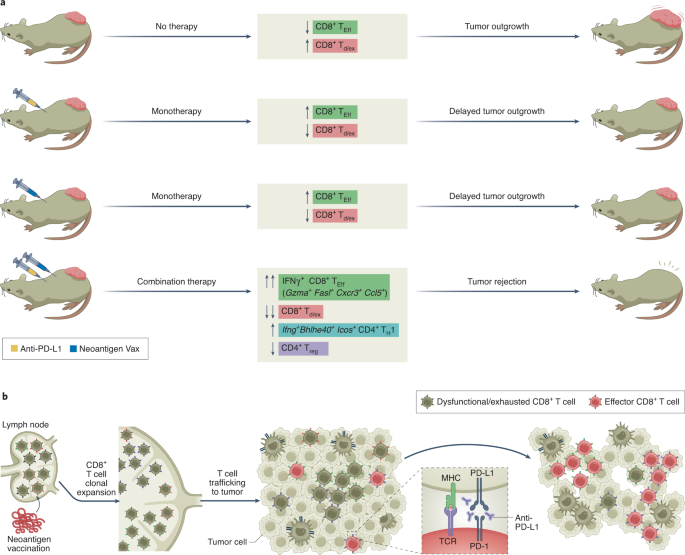
作者首先使用小鼠MC-38结肠腺癌肿瘤模型和一种由9-mer突变Adpgk (mAdpgk)肽组成的新抗原疫苗,该疫苗由两种佐剂(poly-IC和CpG 1826)组成。14.9-mer mAdpgk新抗原由MC-38肿瘤中ADPGK蛋白的点突变形成,作为MHC I类(MHC-I)结合表位,被CD8识别+T细胞7.在患有MC-38肿瘤的小鼠中,当mAdpgk新抗原疫苗作为单一疗法给予时,观察到肿瘤生长的适度延迟。进一步分析显示肿瘤内新抗原特异性CD8+T细胞表达T细胞功能的负调节因子,包括PD-1和转录因子TOX。这些特征与CD8有关+缺乏效应功能的T细胞被指定为功能失调或耗竭的T细胞d /交货)13.同时,肿瘤微环境(TME)内的其他免疫细胞表达高水平的PD-L1。因此,Liu等。14评估ICT抗体阻断TME中PD-1-PD-L1相互作用是否能提高新抗原疫苗的疗效。虽然通过新抗原接种或抗pd - l1治疗的单一治疗减缓了肿瘤的生长,但新抗原接种和抗pd - l1联合治疗提供了更好的疗效,并导致了完全的肿瘤排斥反应(图2)。1).
为了深入了解新抗原疫苗接种和抗pd - l1的协同作用,作者利用多种方法来仔细检查联合治疗期间的T细胞动力学。他们对接受不同治疗的小鼠的肿瘤、肿瘤引流淋巴结和脾脏中分离的总T细胞进行了单细胞RNA测序和靶向TCR捕获(scTCR-seq),以及流式细胞术。在未治疗且肿瘤逐渐生长的小鼠中,CD8+Td /交货TME中的细胞随着时间的推移而增加,而新抗原疫苗接种和抗pd - l1单药治疗均增加了肿瘤内CD8的比例+T细胞具有效应表型(TEff)相对于Td /交货细胞。联合治疗产生了最有利的结果,其特点是CD8扩增最显著+TEff细胞,同时CD8的比例也在减少+Td /交货细胞。这些CD8+TEff联合治疗后出现的细胞表达较低水平的抑制受体基因(Lag3和Havcr2),以及与细胞毒性有关的基因(Gzma和Fasl)和趋化因子信号传导(Cxcr3和Ccl5),它们还产生IFNγ,这是一种参与免疫介导的肿瘤排斥反应的关键细胞因子。尽管mAdpgk疫苗抗原是CD8识别的mhc - 1新抗原+T细胞,联合治疗也影响CD4+调节T (T)注册)细胞和CD4+辅助T (TH)细胞,识别MHC II类(MHC-II)上呈递的肽的T细胞群。具体来说,用联合疗法治疗的荷瘤小鼠显示出肿瘤内CD4的比例缩小+T注册细胞和T的增加H1 CD4+T细胞表达Bhlhe40,国际安全和发展理事会和Ifng编码IFNγ的基因。
为了深入了解联合免疫治疗是否重新激活了肿瘤内已有的T细胞,或者来自淋巴组织的T细胞克隆替代是否有助于联合治疗的治疗效果,Liu等人。14接下来通过TCR测序追踪肿瘤和外周淋巴器官中的克隆T细胞。作者得出结论,这种治疗刺激了克隆CD8+TEff分化、扩张和迁移到肿瘤部位(图2)。1 b).FTY720是一种抑制淋巴细胞从淋巴结排出的S1P受体激动剂,使用FTY720治疗可消除联合治疗的治疗效果。这些发现支持在该模型中,联合免疫治疗诱导持久的、功能性的肿瘤内CD8的假设+TEff通过从淋巴组织迁移的T细胞克隆替代,而不是在治疗前重新激活填充TME的T细胞。
值得注意的是,肽- mhc - i四聚体染色显示,联合治疗不仅增加了肿瘤内新抗原特异性CD8的百分比+T细胞识别作为疫苗靶点的mAdpgk抗原,以及肿瘤内的CD8+p15E是一种在MC-38细胞中表达的内源性逆转录病毒MHC-I抗原。在人类中,新抗原疫苗已被证明不仅能增强治疗前被T细胞识别的针对新抗原的T细胞数量,而且还能诱导针对以前未观察到的其他新抗原的新生T细胞反应,包括未被所用疫苗特异性靶向的不同新抗原——这种现象被称为表位扩散8,12.在接受个体化新抗原疫苗和纳沃单抗(抗pd -1抗体)治疗的癌症患者中,表位扩散与无进展生存期相关11.
Liu等人使用临床前模型和针对MC-38肿瘤中单一新抗原的疫苗策略,促进了对T细胞动力学的研究,包括对CD8的监测+T细胞在不同的处理条件下识别相同的新抗原14.虽然在这种情况下使用针对单一新抗原的疫苗是有利的,但人类患者肿瘤可能比小鼠MC-38肿瘤细胞系更具异质性,因此可能有必要针对多种肿瘤抗原来减少可能出现抗原丢失肿瘤变异的可能性。为此,大多数癌症疫苗临床试验都是针对多种肿瘤抗原设计的3..此外,新抗原疫苗应用于Liu等人。14该研究由一个9聚肽组成,该肽与CD8呈递的最小MHC-I新抗原表位相对应+T细胞。然而,大多数新抗原疫苗临床试验使用合成长肽(SLPs)或编码长肽的基于rna的癌症疫苗,最小的mhc - 1表位被额外的氨基酸包围3.,9,10,11,12.这是因为mhc - ii结合的CD4+T细胞表位通常比mhc - i结合的CD8更长+T细胞表位,所以一个较长的肽产物使得CD4+和CD8+T细胞表位会出现在疫苗中。在涉及slp和RNA疫苗策略的临床前模型和试验中,CD4+针对MHC-II新抗原的T细胞反应经常被激发,即使在疫苗被设计为诱导CD8的情况下也是如此+基于MHC-I新抗原预测的T细胞9,15.在未来的研究中,扩展Liu等人的研究结果将是值得关注的。14通过修改疫苗方案,包括包含MHC-I新抗原的多个slp,从而引发CD8+T细胞应答和CD4识别的MHC-II新抗原+T细胞,单独使用或与ICT结合使用。
最后,Liu等人将mAdpgk新抗原疫苗接种于未感染肿瘤的小鼠,获得了流动分类的新抗原特异性CD8的TCR序列+T细胞从scTCR-seq数据中推断出CD8+T细胞可能是mAdpgk新抗原特异性的14.这种方法使作者能够表征这些新抗原特异性T细胞的分子表型,并鉴定出与这些细胞相关的TCR克隆型密切相关的基因转录特征。对人类患者数据的分析表明,这一特征与CD8有关+T细胞具有效应表型,并且与ICT在“热”肿瘤(即具有强免疫浸润的肿瘤)中的结果相关。作者认为,这种转录特征和鉴定的细胞亚群可以用来区分肿瘤抗原特异性与旁观者TEff细胞,从而指导开发有效的新抗原疫苗和改进的生物标志物,用于临床对免疫治疗的反应。总的来说,这些发现为抗原特异性效应T细胞的出现、维持和表型特征提供了重要见解,这些效应T细胞对肿瘤根除至关重要,并进一步支持将新抗原疫苗与ICT结合的联合免疫疗法的基本原理。
参考文献
夏尔马,P.和艾利森,J. P.。Nat, Rev. immuno1。20., 75-76(2020)。
舒马赫,t.n.和施赖伯,r.d.。科学348, 69-74(2015)。
布拉斯,E.和奥特,p.a.。奈特,克林牧师。肿瘤防治杂志。18, 215-229(2021)。
卡塞尔,j.c.等人。癌症Res。72, 1081-1091(2012)。
Matsushita, h。自然482, 400-404(2012)。
古宾,M. M.等。自然515, 577-581(2014)。
Yadav, M.等。自然515, 572-576(2014)。
卡雷诺,b.m.等。科学348, 803-808(2015)。
奥特,p.a.等人。自然547中文信息学报,217-221(2017)。
沙欣,U.等。自然547, 222-226(2017)。
奥特,p.a.等人。细胞183[j] .中文信息学报,2014(5):559 - 567。
Hu, Z.等。Nat,地中海。27, 515-525(2021)。
Philip, M. & Schietinger, A。Nat, Rev. immuno1。https://doi.org/10.1038/s41577-021-00574-3(2021)。
刘磊等。Nat。癌症https://doi.org/10.1038/s43018-022-00352-7(2022)。
克里特,S.等。自然520, 692-696(2015)。
作者信息
作者及单位
相应的作者
道德声明
相互竞争的利益
M.M.G.每年从施普林格自然有限公司获得1000美元的个人酬金,担任该杂志的副编辑自然-精密肿瘤学.
权利和权限
关于本文
引用本文
Shavkunov, a.s., Gubin, M.M.免疫治疗二人组的动力学。Nat癌症3., 376-378(2022)。https://doi.org/10.1038/s43018-022-00362-5
发表:
发行日期:
DOI:https://doi.org/10.1038/s43018-022-00362-5